As complicações biliares pós-transplante hepático podem ocorrer em 6-40% dos pacientes, sendo mais frequentes após o transplante intervivos.
Elas podem ser precoces, ocorrendo nas primeiras 4 a 6 semanas (fístulas, biloma, estenoses e deiscência por necrose da anastomose biliar); ou tardias (fístulas, estenoses, colangite, coledocolitíase, cálculos, cast syndrome, disfunção do esfíncter de Oddi, mucocele, doença biliar recidivante).
As estenoses biliares pós-transplante hepático podem ainda ser classificadas em anastomóticas (Figura 1) e não anastomóticas (Figura 2). Suas características estão descritas na Tabela 1.
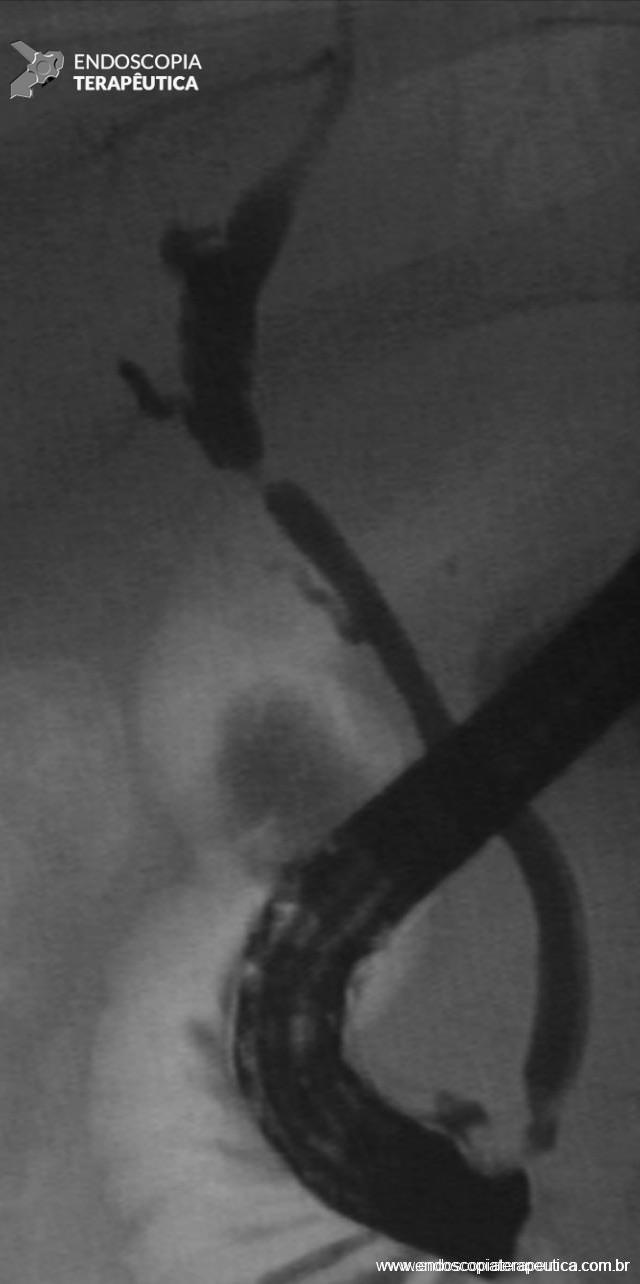
Figura 1 – Aspecto colangiográfico de estenose anastomótica após transplante hepático de doador cadáver.
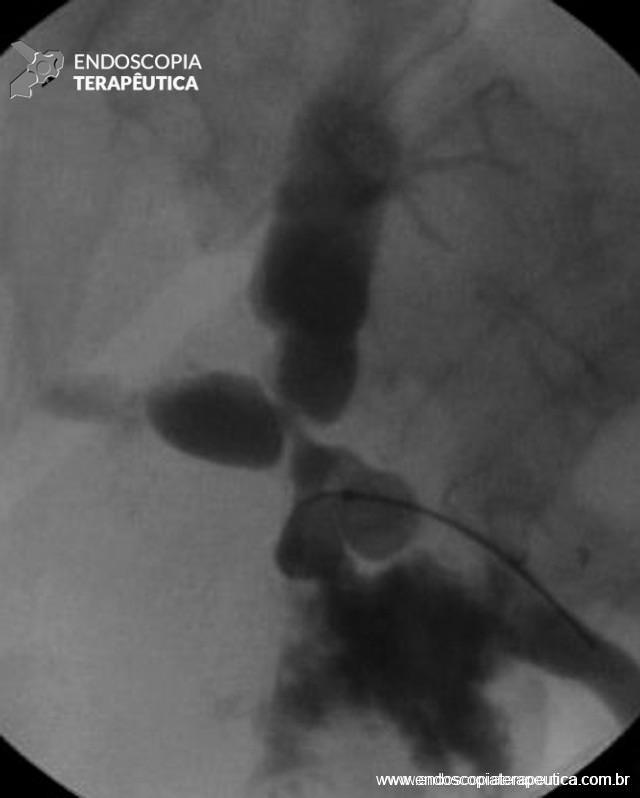
Figura 2 – Aspecto fluoroscópico de estenose não anastomótica (doador cadáver), acometendo o hilo hepático, associada à fístula biliar
Tabela 1: Características das estenoses biliares anastomóticas e não anastomóticas pós transplante hepático.
| Estenoses anastomóticas | Estenoses não anastomóticas | |
| Incidência
|
Doador cadáver: 5 – 15%
Intervivos (Figura 3): 19 – 40% |
5 -15% |
| Característica | Isoladas
Curtas em extensão |
Múltiplas, longas
Ductos intra-hepáticos Ducto do doador |
| Apresentação | 1o ano após transplante
(5 a 8 meses) |
Etiologia isquêmica: 3-6 meses
Etiologia imunológica: > 1 ano |
| Fatores de risco | Questões técnicas
Fístula biliar |
Lesões isquêmicas: trombose da artéria hepática, parada cardíaca, isquemia (quente ou fria), condições de preservação ou lesão de reperfusão
Lesões imunológicas: rejeição ductopênica, incompatibilidade ABO, polimorfismo de genes, doenças imunomediadas pré-existentes no receptor
Outros: infecção CMV e recidiva viral (HBV ou HCV) |
| Quadro clínico | Assintomáticos (alterações laboratoriais)
Sintomas inespecíficos: prurido, anorexia, icterícia e febre
Dor ausente (imunossupressão e denervação hepática) |
Assintomáticos (alterações laboratoriais)
Sintomas inespecíficos: prurido, anorexia, icterícia e febre
Dor ausente
Maior acúmulo de barro biliar: episódios recorrentes de colangite e formação de casts* |
| Diagnóstico | Exames laboratoriais: AST, ALT, bilirrubinas, FAL e δGT | Exames laboratoriais: AST, ALT, bilirrubinas, FAL e δGT |
| USG abdominal com Doppler: exame inicial (sensibilidade 38 a 66%) | USG abdominal com Doppler: exame inicial (sensibilidade 38 a 66%) | |
| CPRM: acurácia de 95% | CPRM: acurácia de 95%
Aspecto radiológico remete à colangite esclerosante primária devido à presença de estenoses múltiplas e extensas |
|
| Biópsia hepática | Excluir rejeição se alterações dos exames de bioquímica, sem dilatação comprovada da via biliar | |
* casts: descamação epitelial em molde, CPRM: colangiopancreato ressonância magnética
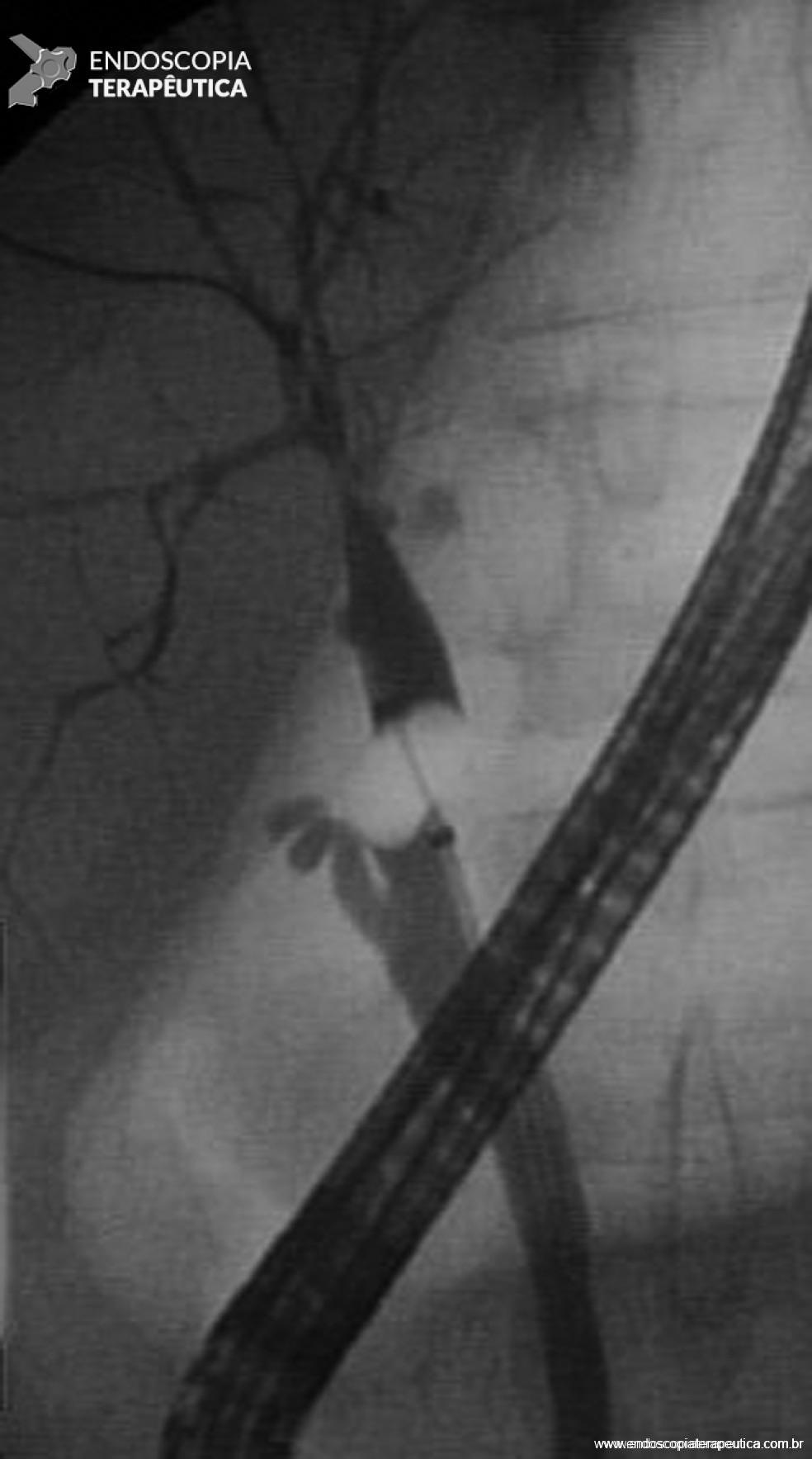
Figura 3 – Paciente transplantado hepático (doador vivo), com estenose complexa, anastomótica e não anastomótica, com lesões acometendo difusamente a via biliar intra-hepática.
A estenose biliar também é descrita no doador vivo, com incidência de 0,4% e 6%. É mais frequente quando o lobo hepático direito é utilizado. Os fatores de risco incluem a fístula biliar, idade avançada e o calibre do ducto biliar (< 4 mm). O quadro clínico é inespecífico, podendo haver colestase.
TRATAMENTO
Na última década, medidas não operatórias se tornaram a opção terapêutica de primeira linha para as complicações biliares pós transplante hepático. Nos pacientes com anastomose ducto-ducto a colangiografia retrógrada endoscópica (CRE) é a escolha inicial.
O tratamento endoscópico pode ser realizado por meio da dilatação com balão hidrostático ou dilatadores de passagem, seguida da colocação de uma ou mais próteses plásticas, ou ainda, mais recentemente, da prótese metálica autoexpansível totalmente coberta (PMAEC). Na presença de lesões da artéria hepática (insuficiência ou obstrução), estas devem ser abordadas durante o curso do tratamento.
A terapêutica com próteses plásticas múltiplas consiste na dilatação hidrostática da estenose seguida da colocação do maior número de próteses plásticas possível. Os pacientes devem ser submetidos à sessões repetidas, no prazo médio de três meses, para prevenção da oclusão, colangite e formação de cálculos. Todas as próteses devem ser retiradas, a estenose deve ser dilatada e um número progressivamente maior de próteses (Figura 4A e B) deve ser utilizado a cada troca, com objetivo de alcançar o maior diâmetro possível. O tratamento é completado em um ano e a maioria dos pacientes deve precisar de quatro a cinco procedimentos nesse período.
A terapia com prótese metálica totalmente coberta consiste na colocação de uma única PMAEC (Figura 5) após esfincterotomia biliar, sem necessidade de dilatação na maioria das vezes. O tempo de permanência ideal da prótese metálica ainda não está completamente definido. Os resultados do tratamento são favoráveis quando ela é mantida por período superior à 3 meses, não havendo comprovação à respeito do benefício da sua permanência por mais de 6 meses.
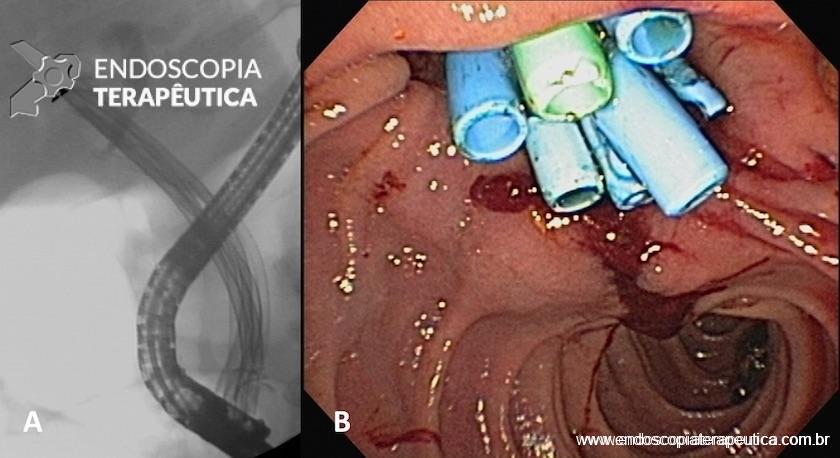
Figura 4 – Aspecto radiológico (A) e endoscópico (B) da estenose anastomótica (doador cadáver) tratada com dilatação hidrostática e colocação de próteses plásticas múltiplas.
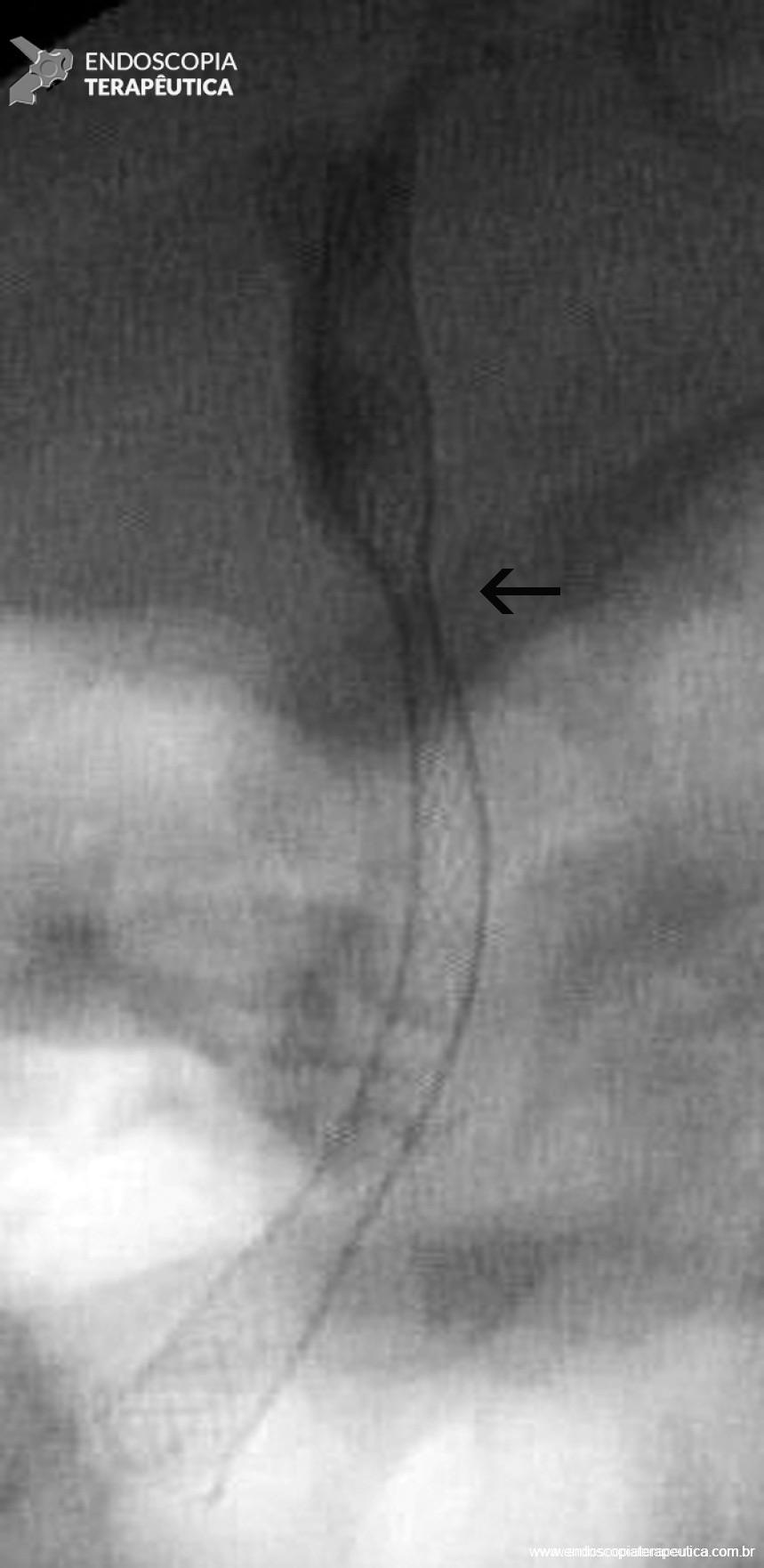
Figura 5 – Aspecto colangiográfico da PMAE totalmente coberta liberada evidenciando discreta compressão (seta), que corresponde ao ponto da estenose anastomótica.
Tabela 2: Comparação do tratamento com próteses plásticas múltiplas e prótese metálica auto-expansível totalmente coberta no tratamento das estenoses biliares pós transplante hepático.
| Próteses plásticas múltiplas | PMAEC | |
| Tempo de tratamento | 12 meses | ± 6 meses |
| Número de procedimentos | 4 a 5 | 2 |
| Taxa de sucesso
Estenose anastomótica
|
Doador cadáver: 82 a 98%
Doador vivo: 60 a 75%
|
87,5 a 100% |
| Taxa de sucesso
Estenose não anastomótica
|
Doador cadáver: 50 a 75%
Doador vivo: 25 a 33%
|
Não está indicada. |
| Taxa de complicações | 4 a 16% | 14,5 a 18% |
| Migração | 5 a 33,3% | 4 a 46,7% |
| Recidiva | 0 a 34% | 4,5 47,4% |
| Custo (6) | US$ 16.095 | US$ 6.903 |
PMAEC: prótese metálica auto-expansível totalmente coberta
Nos pacientes com estenose grave da anastomose direta ducto-ducto e falha no acesso profundo retrógrado à via biliar é possível a realização do procedimento combinado, com punção biliar percutânea ou guiada por EUS, seguida da terapia endoscópica rendez-vous. A colangioscopia direta também é uma ferramenta disponível para a transposição da estenose em caso de insucesso, com custo inferior ao das duas opções citadas anteriormente (Figura 6).
O tratamento cirúrgico fica reservado para os casos de insucesso da intervenção endoscópica ou radiológica e consiste na conversão da reconstrução para derivação biliar ou em casos extremos, o re-transplante.
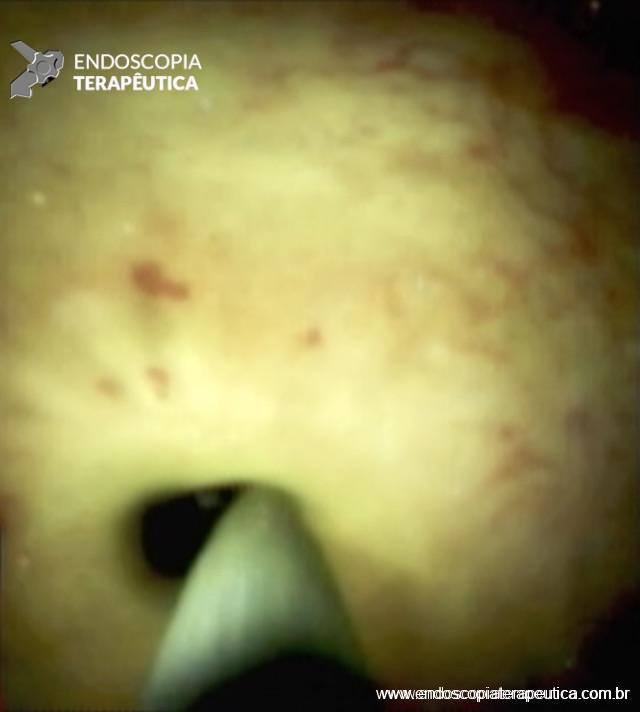
Figura 6 – Aspecto colangioscópico da passagem do fio guia pelo orifício da estenose da anastomose biliar.
Referências Bibliográficas
- Costamagna G, Tringali A, Mutignani M, Perri V, Spada C, Pandolfi M et al. Endotherapy of postoperative biliary strictures with multiple stents: results after more than 10 years of follow-up. Gastrointest Endosc. 2010;72:551-557.10.1016/j.gie.2010.04.052.20630514.
- Akamatsu N, Sugawara Y, Hashimoto D. Biliary reconstruction, its complications and management of biliary complications after adult liver transplantation: a systematic review of the incidence, risk factors and outcome. Transpl Int. 2011;24:379-392.10.1111/j.1432-2277.2010.01202.x.21143651.
- Chaput U, Vienne A, Audureau E, Bauret P, Bichard P, Coumaros D et al. Temporary placement of fully covered self-expandable metal stents for the treatment of benign biliary strictures. United European Gastroenterol J. 2016;4:403-412.10.1177/2050640615606550.27403307.
- Coté GA, Slivka A, Tarnasky P, Mullady DK, Elmunzer BJ, Elta G et al. Effect of Covered Metallic Stents Compared With Plastic Stents on Benign Biliary Stricture Resolution: A Randomized Clinical Trial. JAMA. 2016;315:1250-1257.10.1001/jama.2016.2619.27002446.
- Martins FP, Ferrari AP. Cholangioscopy-assisted guidewire placement in post-liver transplant anastomotic biliary stricture. Endoscopy 2018;49:E283-E284. 10.1055/s-0043-117940
- Martins FP, De Paulo GA, Contini MLC, Ferrari AP. Metal versus plastic stents for anastomotic biliary strictures after liver transplantation: a randomized controlled trial. Gastrointest Endosc. 2018;87:131e1-131e13. 10.1016/j.gie.2017.04.013.
…………………………………………………………………………………………………………..
Como citar esse artigo:
Martins FP. Estenose biliar pós transplante hepático. Endoscopia Terapêutica; 2018. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/estenose-biliar-transplante-hepatico/
Médica do Serviço de Endoscopia do Hospital Israelita Albert Einstein, São Paulo
Médica do Serviço de Endoscopia da Unidade Itaim do Hospital Sírio Libanês, São Paulo
Doutora em Gastroenterologia pela Universidade Federal de São Paulo (UNIFESP/EPM)
Pós-doutorado pela Universidade Federal de São Paulo (UNIFESP/EPM) - Brigham and Women's Hospital/Harvard Medical School

3 Comentários
Fernanda, parabéns pelo post, bem explicativo e com bonitas imagens.
Já existem alguns estudos comparando o uso de próteses plásticas vs PMAEC no tratamento da estenose biliar pós-Tx (ducto-ducto) , inclusive um estudo de sua autoria publicado recentemente. Parabéns. Cosiderando o menor número de procedimentos e menor custo, a PMAEC parece ser a melhor opção quando disponível?
Analisando tb a taxa de recorrência da estenose após a PMAE, qual seria o tempo mais apropriado para deixar a prótese in loco? Existe algum trabalho comparando a taxa de recorrência da estenose após 3 meses vs 6 meses de uso da PMAEC? Abraços.
Matheus, obrigada pelo comentário e ótimas perguntas!
Em resposta à sua primeira pergunta: sim, a PMAEC parece ser, no momento, a melhor opção para o tratamento inicial das estenoses biliares anastomóticas pós transplante hepático. A despeito do seu alto custo inicial, o número reduzido de procedimentos acarreta em menor custo total do tratamento. Ademais, na eventualidade de uma recidiva, o paciente pode ser tratado novamente por via endoscópica.
A sua segunda pergunta é bastante intrigante! O período mais apropriado de manutenção da PMAEC ainda não está claramente definido. Atualmente, estamos realizando uma extensão do nosso trabalho publicado recentemente, com a inclusão de um terceiro grupo, no qual a prótese metálica é mantida por 1 ano. O racional para a extensão do tempo de permanência da prótese foi justamente a menor taxa de recidiva que observamos no grupo próteses plásticas múltiplas tratados durante o período de 1 ano. Infelizmente, temos observado uma alta taxa de migração da PMAEC no momento da sua retirada ao 12o mês. Dessa forma, o tempo de permanência ideal talvez seja algo em torno de 6 a 12 meses.
Em relação à sua última pergunta: sim, existe evidência na literatura de que a permanência da prótese por mais de 3 meses está relacionada à maior taxa de resolução da estenose (Kahaleh et al, J Clin Gastro, 2016) e menor taxa de recidiva (Jimenez-Perez et al, Trans Proc, 2016)
Abraços.
Correção da referência: (Kahaleh et al, J Clin Gastro, 2013)