O H pylori
O Helicobacter pylori é uma bactéria gram-negativa que induz reações celulares e químicas no estômago, sendo considerada carcinógeno humano. Seu diagnóstico e tratamento têm importante papel na prevenção de doenças associadas, como câncer gástrico, úlceras, linfoma MALT e pólipos hiperplásicos. (Para saber mais sobre H. PYLORI, acesse esse post 1 e esse post 2)
Sabemos que existem vários testes diagnósticos, desde não invasivos (sorologia, teste respiratório e antígeno fecal) até os invasivos (urease, cultura e histologia). Os métodos não invasivos possuem alta acurácia, porém não avaliam as alterações da mucosa gástrica. Para saber mais sobre os testes diagnósticos acesse esse post.
Devido ao caráter focal da colonização bacteriana, a acurácia dos métodos invasivos, por sua vez, depende do local, número e tamanho das biópsias. Estas, quando mal direcionadas, podem resultar em falsos-negativos. Dessa forma, é importante avaliarmos os preditores endoscópicos da presença ou ausência do H. pylori a fim de direcionar biópsias para áreas de maior probabilidade de infecção, assim como até evitá-las quando o valor preditivo positivo for alto.
Estudos demonstraram que, apesar de não serem patognomônicos, alguns achados endoscópicos estão associados à presença do H. pylori. Recentemente, novas tecnologias de cromoscopia e magnificação permitiram a análise da microestrutura da mucosa gástrica e, consequentemente, maior acurácia na determinação do status de infecção (ausência, infecção ativa e pós-erradicação).
O objetivo deste artigo é auxiliar os endoscopistas na avaliação dos achados endoscópicos relacionados ao H. pylori tanto à luz branca, quanto à cromoscopia e magnificação.
Então vamos lá!
2. Achados do estômago não infectado
2.1 À luz branca
O estômago normal apresenta coloração rósea-avermelhada e brilhante e o pregueado mucoso está presente de maneira uniforme. O muco deve ser hialino e frequentemente formando pequeno lago. No corpo e fundo, as pregas estão mais concentradas na grande curvatura, em forma de tenda e que tendem a desaparecer com a insuflação. Já o antro é plano, com tonalidade clara.
2.2 À cromoscopia e magnificação
Para entendermos as alterações visualizadas na magnificação endoscópica, precisamos primeiro saber a histomorfologia da mucosa normal do estômago.
Para saber mais sobre a histologia normal do estômago Clique aqui
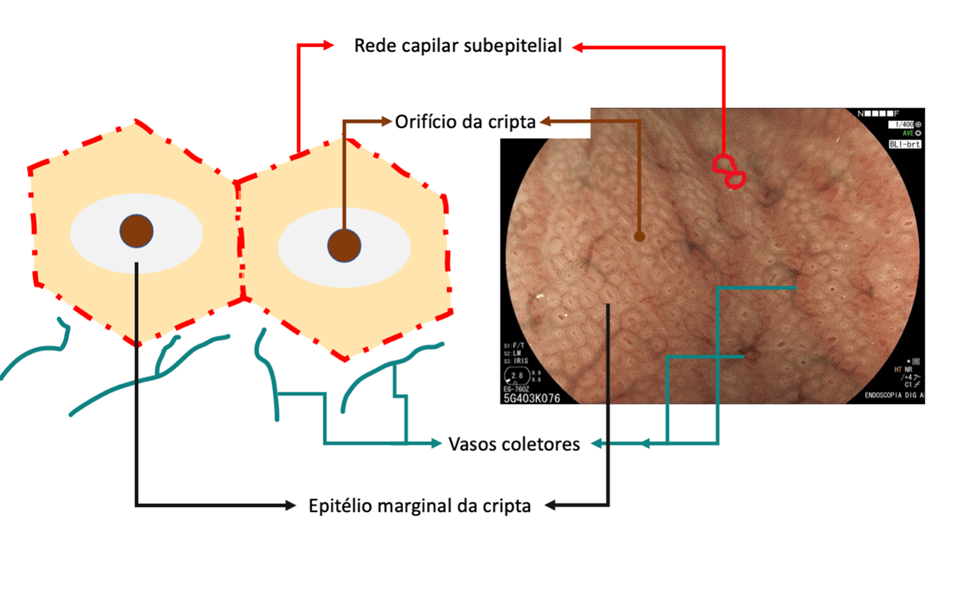
Resumidamente, a mucosa do corpo gástrico é composta por orifício críptico (OC), epitélio marginal da cripta (MCE), rede de capilar subepitelial (SECN), vasos coletores e espaços intervenientes (entre as criptas), conforme esquema a seguir:
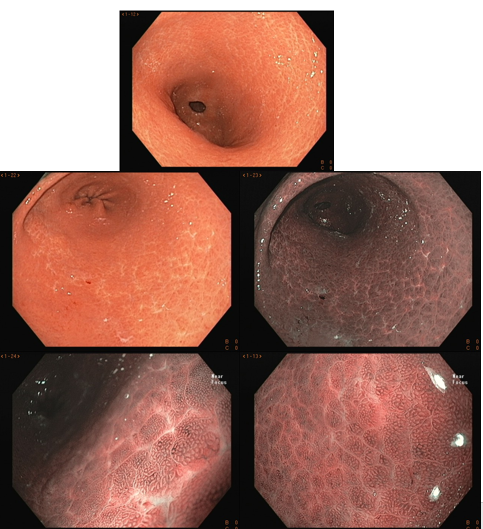
No estômago não infectado pelo H. pylori, a rede capilar subepitelial está presente, de forma regular em todo o corpo, denominada de RAC (regular arrangement of collecting venules). O valor preditivo-negativo deste achado é maior que 90%, o que significa que sua presença na pequena curvatura de corpo distal e incisura está fortemente associada à condição de não infecção pelo H. pylori.
Podemos observar, também, que tanto o orifício da cripta quanto o epitélio marginal são ovais, regulares e simétricos. A rede capilar subepitelial (SECN) é regular e fina, em formato de favo de mel.
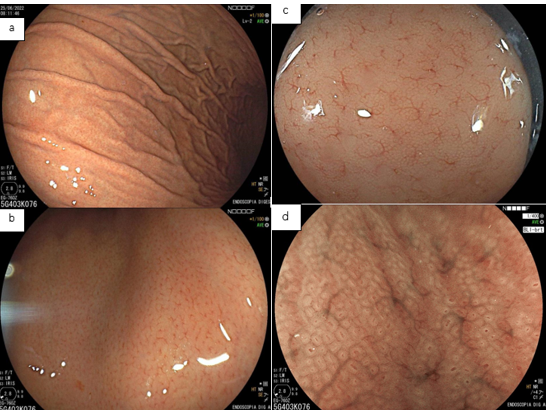
3. Achados do estômago infectado
3.1- À luz branca
À luz branca, os achados endoscópicos mais associados à infecção pelo H. pylori são: hiperemia difusa, enantema petequial (“salpicado”) de fundo e corpo proximal, pregas espessadas e tortuosas, edema da mucosa, exsudato fibrinoso no corpo e nodularidade antral. Com a persistência da infecção, ocorre diminuição das pregas e os vasos submucosos ficam mais visíveis, achados da gastrite atrófica.
Em estudo prospectivo multicêntrico, a sensibilidade e especificidade dos achados endoscópicos descritos acima foram de 94,3% e 62,8% (KATO,2013). A hiperemia difusa foi considerado característica mais confiável pelos endoscopistas experientes.
Sabemos que essa infecção se inicia no antro e progride para o corpo. Todavia, no antro, a acurácia diagnóstica é menor, pois os vasos estão localizados mais profundamente, prejudicando sua visualização. Portanto, devemos primeiro avaliar a presença ou ausência da hiperemia no corpo. Quando essa avaliação é difícil, devemos prestar atenção no enantema petequial, no edema, nas pregas e no exsudato fibrinoso.
Como descrito anteriormente, a ausência do padrão regular das vênulas coletoras (RAC negativo) pode estar associado à infecção ativa pelo H. pylori, mas a especificidade deste achado é baixa. Em estudo brasileiro (Fiuza F, Martins BC, 2021), a ausência de RAC esteve associada apenas a 50,6% de positividade do H. pylori. Em outras palavras, a ausência de RAC tem alta acurácia para presença da bactéria, mas nem sempre a infecção é que causa sua perda.
Importante lembrar que, na infecção pelo H. pylori, o RAC desaparece inicialmente na pequena curvatura de corpo distal e incisura, sendo esses locais os mais específicos para serem analisados. Entretanto, nas gastrites crônicas, quando a atrofia antral se estende justamente pela incisura e pequena curvatura de corpo distal, pode ocorrer desaparecimento ou deformidade do RAC, mesmo em pacientes erradicados, dificultando sua análise. Nesses casos, precisamos procurar o RAC na mucosa de corpo distal longe da atrofia.
Outro dado importante é que a última região em que o RAC fica preservado é no corpo proximal e fundo gástrico, locais que não são recomendados para avaliação da infecção bacteriana.
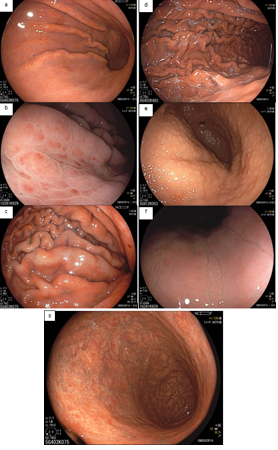
3.2- À magnificação
Histomorfologicamente, com a infecção pelo H. pylori, as criptas tornam-se maiores e irregulares, envoltas por eritema e sulcos. Já não conseguimos ver a rede de capilares subepiteliais, pois células inflamatórias, edema, epitélio degenerado, e rompimento da rede microvascular impedem sua adequada visualização. Os orifícios das criptas ficam assimétricos e brancos devido ao depósito de conteúdo inflamatório no seu interior das glândulas. Conforme a atrofia vai se expandindo, o epitélio marginal das criptas fica aumentado e possui forma irregular e alongada/curva. É o que chamamos de “antralização” do corpo gástrico.
Em estudo brasileiro (Fiuza F, Martins BC, 2021), verificou-se que é possível identificar essas alterações da mucosa gástrica (especialmente a presença ou ausência de RAC) utilizando a tecnologia de near focus, visto que os gastroscópios com magnificação ainda não são amplamente disponíveis em nosso meio.
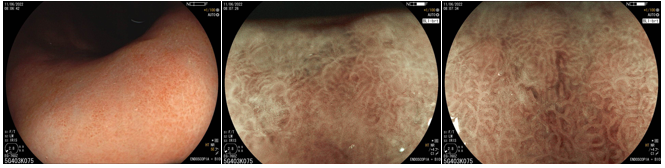
4. Achados do estômago tratado (pós-erradicação)
Ainda permanece controverso se o tratamento do H. pylori pode reverter a gastrite atrófica e a metaplasia intestinal. Além disso, pode levar até 10-15 anos para a mucosa se recuperar e voltar ao normal.
Após a erradicação, as áreas não atróficas dissipam a inflamação e as áreas atróficas tornam-se relativamente avermelhadas quando comparadas à mucosa adjacente. Isso confere o padrão em “mapa”. Esse padrão pode estar associado ao desenvolvimento de câncer gástrico tanto primário quando metacrônico mesmo após tratamento efetivo do H. pylori.
Outra característica descrita é o padrão “rachado” (cracked pattern, em inglês), onde aparecem sulcos na mucosa antral, indicando mucosa reparativa.
Estudos demonstraram que a terapia de erradicação pode alterar as características do estômago reparado, causando dificuldade no diagnóstico de câncer gástrico precoce. Por isso que o status pós-erradicação deve ser distinguido da negatividade do H. pylori.
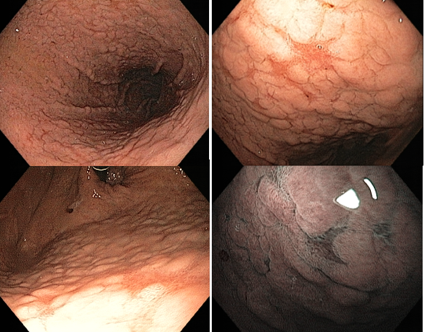
Referências
Anagnostopoulos GK, Yao K, Kaye P, Fogden E, Fortun P, Shonde A, Foley S, Sunil S, Atherton JJ, Hawkey C, Ragunath K. High-resolution magnification endoscopy can reliably identify normal gastric mucosa, Helicobacter pylori-associated gastritis, and gastric atrophy. Endoscopy. 2007 Mar;39(3):202-7.
Yao K. The endoscopic diagnosis of early gastric cancer. Ann Gastroenterol. 2013;26(1):11-22.
Yagi K, Nakamura A, Sekine A. Comparison between magnifying endoscopy and histological, culture and urease test findings from the gastric mucosa of the corpus. Endoscopy. 2002 May;34(5):376-81.
Yuan C, Lin XM, Ou Y, Cai L, Cheng Q, Zhou P, Liao J. Association between regular arrangement of collecting venules and Helicobacter pylori status in routine endoscopy. BMC Gastroenterol. 2021 Oct 20;21(1):389.
Glover B, Teare J, Patel N. A systematic review of the role of non-magnified endoscopy for the assessment of H. pylori infection. Endosc Int Open. 2020 Feb;8(2):E105-E114.
Qi Q, Guo C, Ji R, Li Z, Zuo X, Li Y. Diagnostic Performance of Magnifying Endoscopy for Helicobacter pylori Infection: A Meta-Analysis. PLoS One. 2016 Dec 19;11(12):e0168201.
Weng CY, Xu JL, Sun SP, Wang KJ, Lv B. Helicobacter pylori eradication: Exploring its impacts on the gastric mucosa. World J Gastroenterol. 2021 Aug 21;27(31):5152-5170.
Nishikawa Y, Ikeda Y, Murakami H, et al. Classification of atrophic mucosal patterns on Blue LASER Imaging for endoscopic diagnosis of Helicobacter pylori-related gastritis: A retrospective, observational study. PLoS One. 2018;13(3):e0193197.
Toyoshima O, Nishizawa T, Koike K. Endoscopic Kyoto classification of Helicobacter pylori infection and gastric cancer risk diagnosis. World J Gastroenterol. 2020 Feb 7;26(5):466-477.
Ono S, Dohi O, Yagi N, Sanomura Y, Tanaka S, Naito Y, Sakamoto N, Kato M. Accuracies of Endoscopic Diagnosis of Helicobacter pylori-Gastritis: Multicenter Prospective Study Using White Light Imaging and Linked Color Imaging. Digestion. 2020;101(5):624-630.
Kato T, Yagi N, Kamada T, Shimbo T, Watanabe H, Ida K; Study Group for Establishing Endoscopic Diagnosis of Chronic Gastritis. Diagnosis of Helicobacter pylori infection in gastric mucosa by endoscopic features: a multicenter prospective study. Dig Endosc. 2013 Sep;25(5):508-18.
Fiuza F, Maluf-Filho F, Ide E, Furuya CK Jr, Fylyk SN, Ruas JN, Stabach L, Araujo GA, Matuguma SE, Uemura RS, Sakai CM, Yamazaki K, Ueda SS, Sakai P, Martins BC. Association between mucosal surface pattern under near focus technology and Helicobacter pylori infection. World J Gastrointest Endosc. 2021 Oct 16;13(10):518-528.
Como citar este artigo
Nobre R, Baba E, Achados endoscópicos relacionados à infecção pelo H. Pylori, Endoscopia Terapêutica; 2022. Dísponivel em: https://endoscopiaterapeutica.net/pt/assuntosgerais/achados-endoscopicos-relacionados-a-infeccao-pelo-h-pylori


2 Comentários
Parabéns pela excelente revisão. Imagens fantásticas. Tudo muito claro e prático.
Parabéns pela excelente revisão, pela didática e pelo show de imagens Renata e Elisa!
Gostaria de deixar minha opinião quanto ao local de exame aproximado da mucosa.
Minha preferência é justamente pela parede posterior de corpo médio. Fácil de examinar e com alta sensibilidade. Maioria dos casos a infecção já é crônica e já acomete o corpo. Usamos esse método no artigo publicado na WJGE em 2021 e nos baseamos no artigo de Yagi K, et al. Endoscopy. 2002;34:376–381.
Abs