Paciente do sexo feminino, 51 anos, com antecedente de transplante hepático em outubro de 2023 devido a cirrose hepática de etiologia alcóolica. A partir de dezembro de 2023, passa a apresentar colestase bioquímica persistente e assintomática, a despeito de níveis adequados de imunossupressão: BT 2,52; BD 1,83; GGT 544,31 (VR<38); FAL 373 (VR<116).
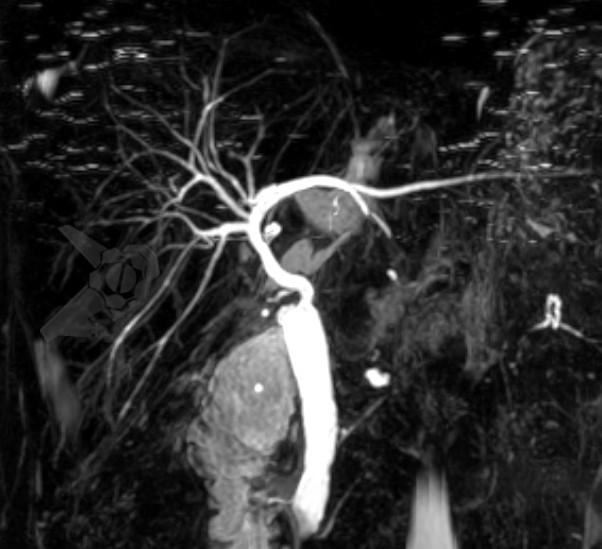
Foi submetida a ressonância magnética de abdome (RNM) com colangiorressonância (colangioRNM), que não evidenciou alteração vascular da artéria hepática, apenas desproporção entre as vias biliares do doador e receptor, sem estenose definida, porém com discreta dilatação de vias intra-hepáticas.
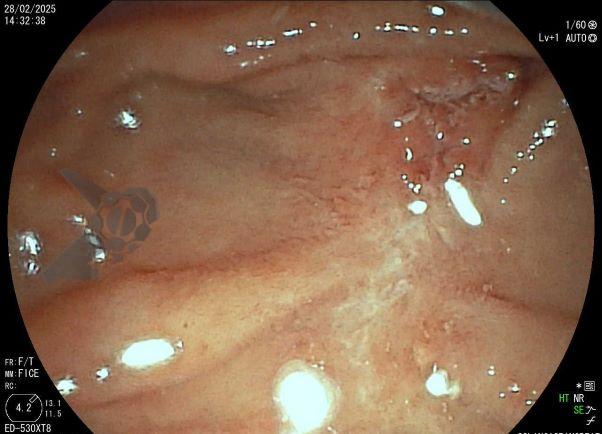
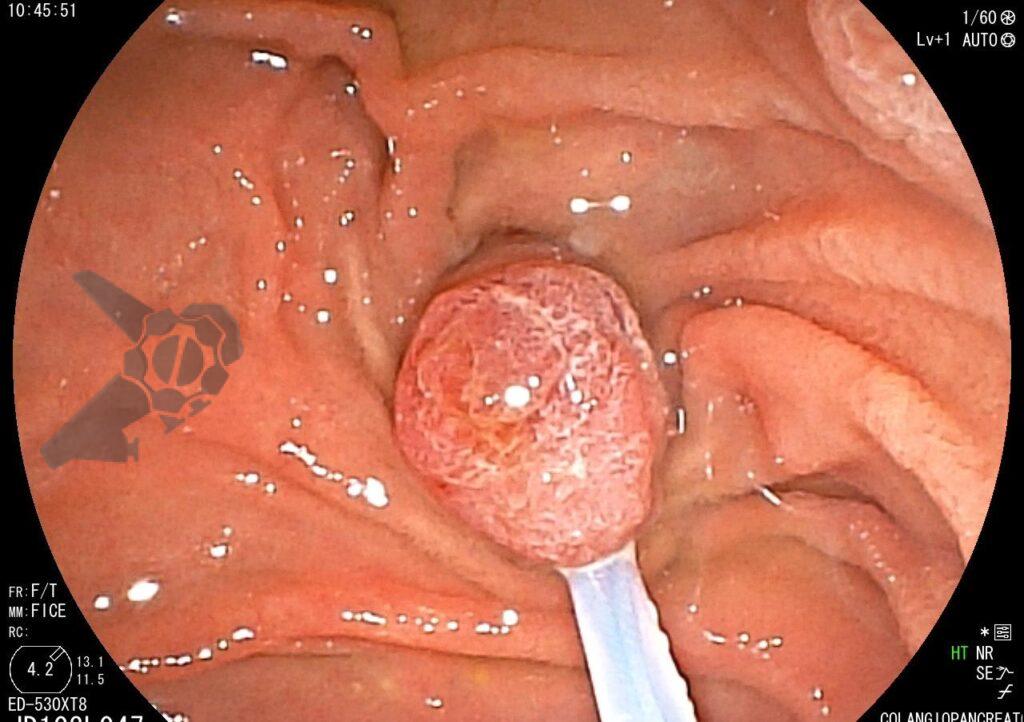
Tendo em vista quadro clínico associado a dilatação de vias biliares, foi indicada colangiopancreatografia endoscópica retrógrada (CPRE) para tratamento de possível estenose da anastomose biliar. Ao se posicionar o duodenoscópio na segunda porção duodenal, identificada lesão polipóide suspeita para adenoma de papila duodenal maior, sendo realizadas biópsias.
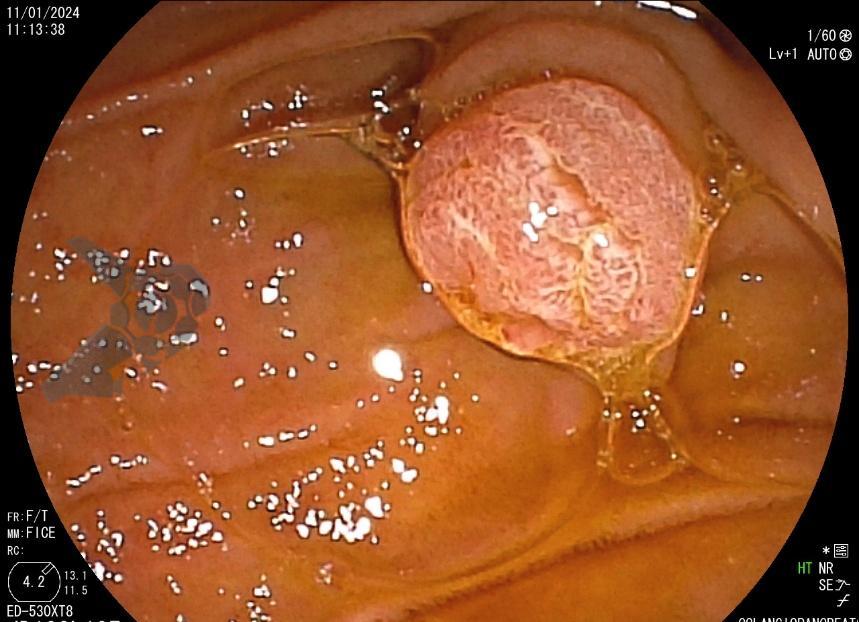
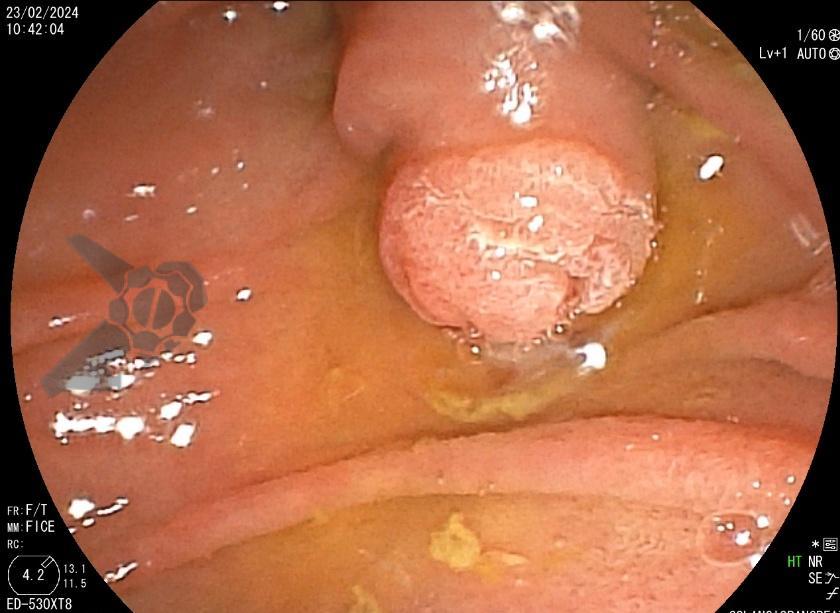
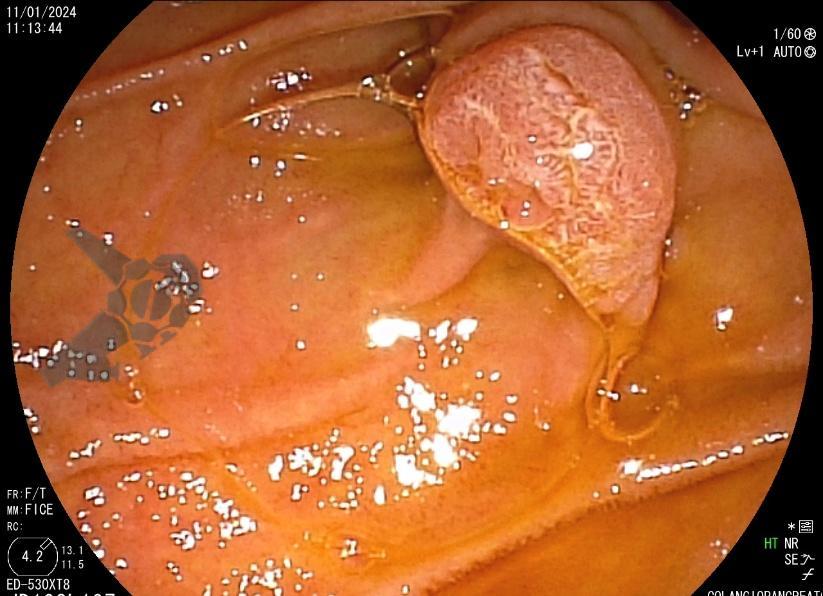
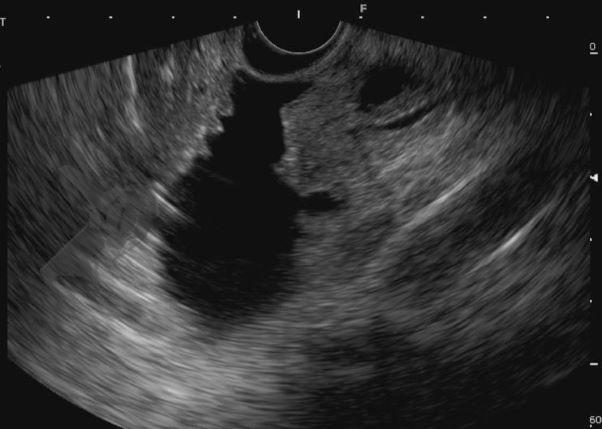
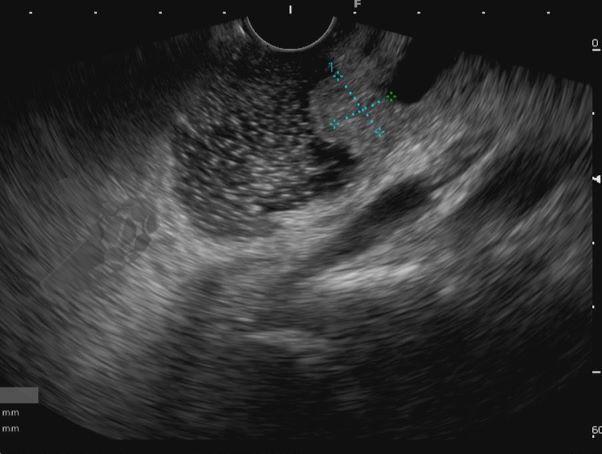
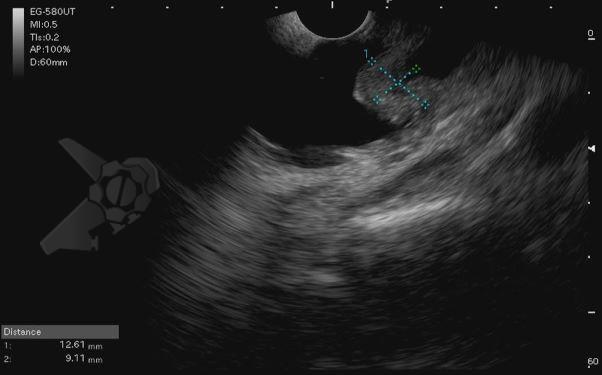
Diante da confirmação histológica de adenoma tubular com displasia de baixo grau, optado pelo estadiamento local através de ultrassom endoscópico (EUS), evidenciando lesão restrita a mucosa (sem sinais de acometimento de camada muscular) medindo 12×9 mm, com dilatação de colédoco até 9 mm e ausência de extensão intraductal.
Dessa forma, indicada papilectomia endoscópica e realizada ressecção em monobloco, em modo endocut Q, sem injeção de submucosa. Não foi realizada esfincterotomia ou passagem de prótese biliar ou pancreática. Observou-se pequeno sangramento imediato no leito de ressecção, controlado com injeção de adrenalina. Não há lesão residual no leito. Paciente evoluiu bem, assintomática e sem intercorrências após o procedimento.
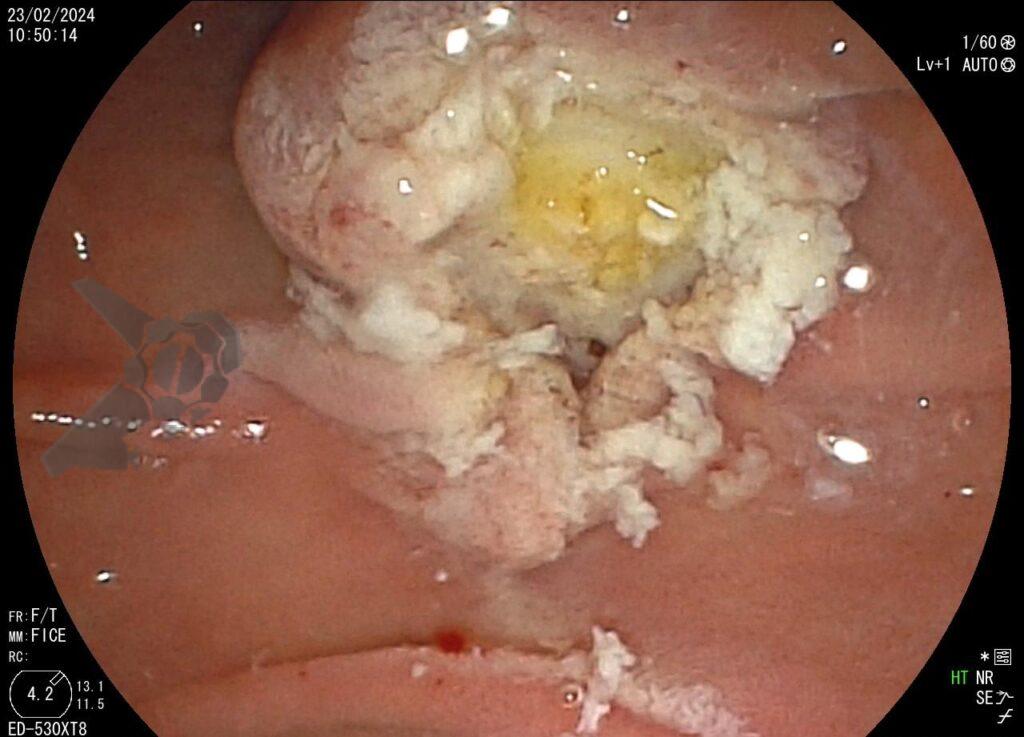
O anatomopatológico confirma biópsia prévia, com margens laterais e profundas livres de lesão (R0). Houve resolução da colestase após o procedimento: BT 0,98; BD 0,42; GGT 105; FAL 153. Paciente permaneceu sem lesões suspeitas no leito nos exames de seguimento, com biópsia após 1 ano exibindo apenas processo infamatório reacional.
Revisão
A neoplasia da ampola de Vater é uma entidade rara, mais comum em homens e idosos, embora o diagnóstico abaixo dos 45 anos venha em ascensão nos últimos anos. Diante do diagnóstico em pacientes jovens, deve-se suspeitar de síndrome genética sobrejacente, sendo a PAF (Polipose Adenomatosa Familiar) a principal envolvida1,2. Seguindo a cadeia de carcinogênese adenoma-carcinoma, as lesões podem se originar da mucosa duodenal ou pancreatobiliar e os tipos mais diagnosticados são o adenoma, displasia intraepitelial e adenocarcinoma, sendo que o adenoma do tipo intestinal corresponde a mas de 95% das lesões benignas3.
A maioria das lesões é assintomática e costuma ser identificada incidentalmente durante exames endoscópicos por outras indicações. É possível, no entanto, se apresentarem com icterícia (16.6%), dor abdominal (14.4%), pancreatite (4.1%) e colangite (1%)4.
Tendo em vista a visão parcial da papila duodenal maior obtida através do endoscópio de visão frontal, sugere-se que a adequada avaliação seja realizada com o duodenoscópio ou endoscópio convencional associado ao uso de cap. Embora não exista uma classificação validada para avaliação das lesões de papila, deve-se avaliar o tamanho, se há extensão da lesão para além da papila, como as lesões de crescimento lateral (LSTp). Além disso, alguns aspectos identificados correlacionam-se com maior risco de invasão da muscular como endurecimento, ulceração, friabilidade, sangramento, depressão e “nonlifting sign”4,5. O diagnóstico histológico deve ser realizado idealmente pela biopsia endoscópica; em caso de falha diagnóstica, são alternativas a biópsia por EUS ou biópsia endoscópica após esfincterotomia, de preferência com intervalo de 10 dias entre os procedimentos4. Vale ressaltar que a presença de adenoma nas biópsias endoscópicas não exclui a presença de adenocarcinoma, devido as altas taxas de falsos negativos e variável concordância entre as biópsias endoscópicas e as peças de ressecção5.
O estadiamento deve seguir a classificação TNM e pode ser realizado por tomografia computadorizada (TC), colangioRNM, EUS e ultrassom intraductal. Nota-se a superioridade do EUS na avaliação do T (principalmente em lesões maiores do que 2 cm e T1) e da colangioRNM na avaliação do N. Ademais, a avaliação da extensão intraductal da lesão se faz necessária para definição do tratamento4.
Segundo a recomendação da ESGE, está indicada a papilectomia endoscópica nas lesões até 4 cm, com extensão intraductal de até 2cm e nas lesões malignas Tis/T1aN0M0 (idealmente restritos a mucosa). Nos casos tecnicamente difíceis, como tamanho superior a 4 cm, divertículo duodenal ou extensão intraductal>2cm pode ser considerado e discutido de forma individualizada a ampulectomia cirúrgica no caso de lesões superficiais ou duodenopancreatectomia nos casos de T≥1 ou N+/M+4. Existem trabalhos que mostram bons resultados na ressecção endoscópica de neoplasias precoces (adenocarcinoma bem diferenciado até T1aN0M0), embora as taxas de acometimento linfonodal no T1 podem chegar a 45%4,6,7.
Embora muitas técnicas tenham sido descritas até o momento e não haja consenso em alguns aspectos, a ESGE sugere a ressecção com alça sem injeção de submucosa, utilizando-se modo Endocut de forma reduzir o risco de sangramento durante e após o procedimento. Nos casos de LSTp, deve ser feita injeção de submucosa e ressecção por mucosectomia, apresentando um maior risco de sangramento associado. Nos casos de extensão intraductal há maior risco de não obtenção de R0 e necessidade de complementação com tratamento cirúrgico, principalmente nas lesões com maior grau de displasia. Nestes casos, há possibilidade de abordagem da extensão intraductal no momento da papilectomia através da ablação com cistótomo guiada por fio guia ou ablação por radiofrequência (RFA)4.
A esfincterotomia com passagem de prótese biliar é considerada quando há esvaziamento lentificado, sangramento ou quando realizado tratamento de lesão intraductal. É recomendada profilaxia de pancreatite com administração de indometacina via retal e colocação de prótese pancreática4. Embora exista tal recomendação, alguns trabalhos recentes não demonstram redução significativa na incidência de pancreatite pós-papilectomia endoscópica com o uso da prótese pancreática8,9. Outras técnicas descritas incluem a colangiopancreatografia com esfincterotomia biliar e alocação de fio guia no ducto pancreático precedendo a papilectomia com posterior colocação de próteses10.
A ressecção é considerada bem sucedida diante da ausência de lesão residual no leito após o procedimento, sendo a ressecção em monobloco é o principal fator associado a obtenção do R04,11. Os principais efeitos adversos da papilectomia endoscópica são: pancreatite (11.9 %), sangramento (10.6 %), perfuração (3,1%) e colangite (2,7%)4,12. A taxa de mortalidade é baixa (0,3%) e a estenose tardia pode ocorrer em 2,4% dos casos4.
O seguimento deve ser realizado por duodenoscopia com biópsias do leito e de áreas suspeitas em 3, 6 e 12 meses e anualmente por 3 a 5 anos. A presença de lesão residual benigna, que ocorre em cerca de 11%, ou recorrente pode ser tratada com eletrocoagulação por plasma de argônio ou mucosectomia, com bons resultados4. Em se tratando de adenomas esporádicos, a taxa de recorrência da lesão a longo prazo é semelhante entre a papilectomia endoscópica e a ampulectomia cirúrgica (15,7%x17,6%, com menores taxas de eventos adversos e maior segurança na primeira modalidade13.
Veja mais sobre o assunto: PAPILA DUODENAL MAIOR: Precisamos inspecionar na rotina? • Endoscopia Terapeutica.
Referências
- Ramai D, Ofosu A, Singh J, John F, Reddy M, Adler DG. Demographics, tumor characteristics, treatment, and clinical outcomes of patients with ampullary cancer: A Surveillance, epidemiology, and end results (SEER) cohort study. Minerva Gastroenterologica e Dietologica. 2019 May;65(2). doi:10.23736/s1121-421x.18.02543-6
- Rostain F. Trends in incidence and management of cancer of the ampulla of Vater. World Journal of Gastroenterology. 2014;20(29):10144. doi:10.3748/wjg.v20.i29.10144
- Fischer H-P, Zhou H. Pathogenesis of carcinoma of the papilla of Vater. Journal of Hepato-Biliary-Pancreatic Surgery. 2004 Oct;11(5):301–9. doi:10.1007/s00534-004-0898-3
- Vanbiervliet G, Strijker M, Arvanitakis M, Aelvoet A, Arnelo U, Beyna T, et al. Endoscopic management of AMPULLARY TUMORS: European Society of Gastrointestinal Endoscopy (ESGE) guideline. Endoscopy. 2021 Mar 16;53(04):429–48. doi:10.1055/a-1397-3198
- Li S-L, Li W, Yin J, Wang Z-K. Endoscopic papillectomy for ampullary adenomatous lesions: A literature review. World Journal of Gastrointestinal Oncology. 2021 Oct 15;13(10):1466–74. doi:10.4251/wjgo.v13.i10.1466
- Lee S, Hwang J, Ko S, So H, Oh D, Song T, et al. Long-term outcomes of endoscopic papillectomy for early-stage cancer in duodenal ampullary adenoma: Comparison with surgical treatment. Endoscopy. 2020 Apr; doi:10.1055/s-0040-1704412
- Napoleon B, Gincul R, Ponchon T, Berthiller J, Escourrou J, Canard J-M, et al. Endoscopic papillectomy for early ampullary tumors: Long-term results from a large multicenter prospective study. Endoscopy. 2014 Jan 29;46(02):127–34. doi:10.1055/s-0034-1364875
- Chandan S, Canakis A, Deliwala S, Frohlinger M, Khan SR, Mohan BP, et al. Prophylactic pancreatic duct stenting to reduce the risk of post-ampullectomy pancreatitis: A comprehensive review and meta-analysis of 1858 patients. Surgical Endoscopy. 2024 Jul 19;38(9):4798–813. doi:10.1007/s00464-024-11019-y
- Jiang J, Lv F, Chen C, Jiang W. Effectiveness of endoscopic papillectomy with stent placement in pancreatic and bile ducts for treating duodenal papillary adenoma: A retrospective study. BMC Gastroenterology. 2024 Oct 24;24(1). doi:10.1186/s12876-024-03466-7
- Kim GE, Siddiqui UD. Endoscopic resection techniques for duodenal and ampullary adenomas. VideoGIE. 2023 Aug;8(8):330–5. doi:10.1016/j.vgie.2023.05.006
- Choi SJ, Lee HS, Kim J, Choe JW, Lee JM, Hyun JJ, et al. Clinical outcomes of Endoscopic Papillectomy of Ampullary Adenoma: A multi-center study. World Journal of Gastroenterology. 2022 May 7;28(17):1845–59. doi:10.3748/wjg.v28.i17.1845
- Sahar N, Krishnamoorthi R, Kozarek RA, Gluck M, Larsen M, Ross AS, et al. Long-term outcomes of endoscopic papillectomy for ampullary adenomas. Digestive Diseases and Sciences. 2019 Aug 28;65(1):260–8. doi:10.1007/s10620-019-05812-2
- Garg R, Thind K, Bhalla J, Simonson MT, Simons-Linares CR, Singh A, et al. Long-term recurrence after endoscopic versus surgical ampullectomy of sporadic ampullary adenomas: A systematic review and meta-analysis. Surgical Endoscopy. 2023 May 23;37(7):5022–44. doi:10.1007/s00464-023-10083-0
Como citar este artigo
Mateus I. Papilectomia endoscópica pós transplante hepático Endoscopia Terapeutica, 2025 Vol II. Disponível em: https://endoscopiaterapeutica.net/pt/casosclinicos/papilectomia-endoscopica-pos-transplante-hepatico/
Médica Gastroenterologista e Endoscopista pelo Hospital das Clínicas da Faculdade de Medicina USP Ribeirão Preto.
Membro Titular SOBED. Médica assistente do Serviço de Endoscopia do Departamento de Cirurgia Digestiva - HCFMUSP Ribeirão Preto.