O complexo da esclerose tuberosa (CET) é uma doença genética autossômica dominante, que acomete 1 a cada 6.000-10.000 nascidos vivos (1). Ela acomete igualmente ambos os sexos e todas as raças e ocorre devido a mutações nos genes supressores tumorais TSC 1 ou TSC 2 (1). No entanto, embora seja uma doença autossômica dominante, cerca de 80% dos casos são por variantes “de novo”, sendo a mutação no gene TSC2 a mais comum (2).
O CET é caracterizado pelo desenvolvimento de uma variedade de tumores benignos envolvendo múltiplos órgãos, incluindo a pele, cérebro, rim, olhos, entre outros. O risco de tumores malignos também está aumentado nesse grupo de pacientes (3). No entanto a apresentação clínica é muito variável, mesmo dentro da mesma família (4). As lesões cutâneas são as mais comuns, estando presente em mais de 90% dos pacientes, incluindo máculas hipopigmentadas, angiofibromas faciais, placa de Shagreen, entre outras (1). As manifestações neuropsiquiátricas estão presentes na maioria dos pacientes também e são responsáveis por importante morbidade. Elas incluem epilepsia, déficit cognitivo e de aprendizado, autismo e alterações do comportamento, hamartomas glioneurais, nódulos subependimários e astrocitoma subependimário de células gigantes (5). A presença de angiomiolipomas e cistos renais é comum e podem levar ao desenvolvimento de insuficiência renal (1). Outros órgãos acometidos com menos frequência são os olhos, pulmão e coração.
Diagnóstico
O diagnóstico pode ser baseado em critérios clínicos e no teste genético. Para o diagnóstico clínico são necessários a presença de dois critérios maiores ou um maior e dois ou mais menores (tabela 1). Já o teste genético se baseia na pesquisa da mutação dos genes TSC1 e TSC2. Embora a presença da mutação confirme o diagnóstico, ela não presente na totalidade dos casos, sendo positiva em 75% a 90% dos pacientes (1).
| CRITÉRIOS MAIORES | CRITÉRIOS MENORES |
Placas hipomelanóticas (≥3, 5mm ou maior de diâmetro) | Lesões na pele “em confete” |
Angiofibromas (≥3) ou placa fibrosa cefálica | Defeitos puntiformes no esmalte dentário |
Fibroma ungueal (≥2) | Fibromas orais (≥2) |
Placa de Shagreen | Manchas acrômicas na retina |
Múltiplos hamartomas de retina | Múltiplos cistos renais |
Túberes corticais (SNC) | Hamartomas não-renais |
Nódulos subependimários (≥2) | |
Astrocitoma subependimário de células gigantes | |
Rabdomioma cardíaco | |
Linfangioleiomiomatose | |
Angiomiolipomas (≥2) |
Tabela 1: Critérios diagnósticos para o complexo de esclerose tuberosa
As lesões pancreáticas não são comuns e não estão incluídas nos critérios diagnósticos do complexo de esclerose tuberosa. No entanto, devido ao aumento na realização de exames de imagem abdominal, principalmente para seguimento das lesões renais, tem se observado um aumento no diagnóstico incidental das lesões pancreáticas, em especial os tumores neuroendócrinos (6).
Caso clínico
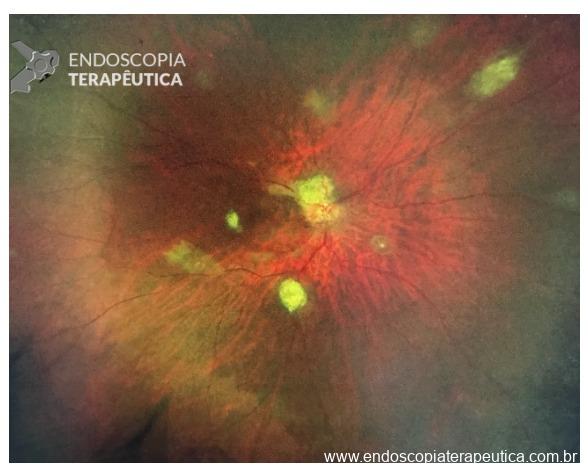
Paciente masculino, 35 anos, já com diagnóstico de esclerose tuberosa e teste genético positivo, com mutação no gene TSC 2, veio encaminhado para realização de ecoendoscopia devido ao achado de lesões císticas pancreáticas em ressonância de abdome durante seguimento de cistos renais. Além dos achados pancreáticos, o paciente possuía angiofibromas nasais, hamartomas na retina (imagem 1) e múltiplos cistos renais (imagem 2). Não era portador de distúrbios neuropsiquiátricos.
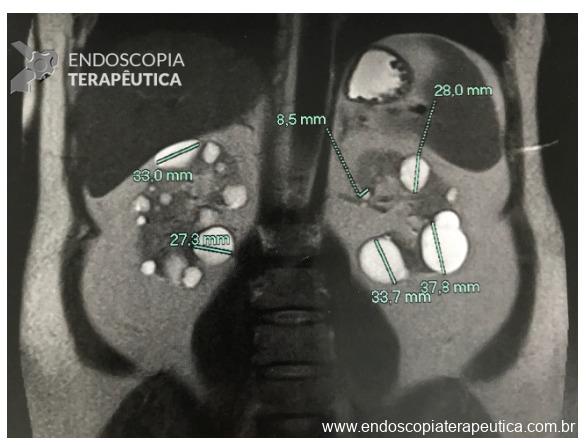
Ressonância de abdome mostrando cistos renais
RNM
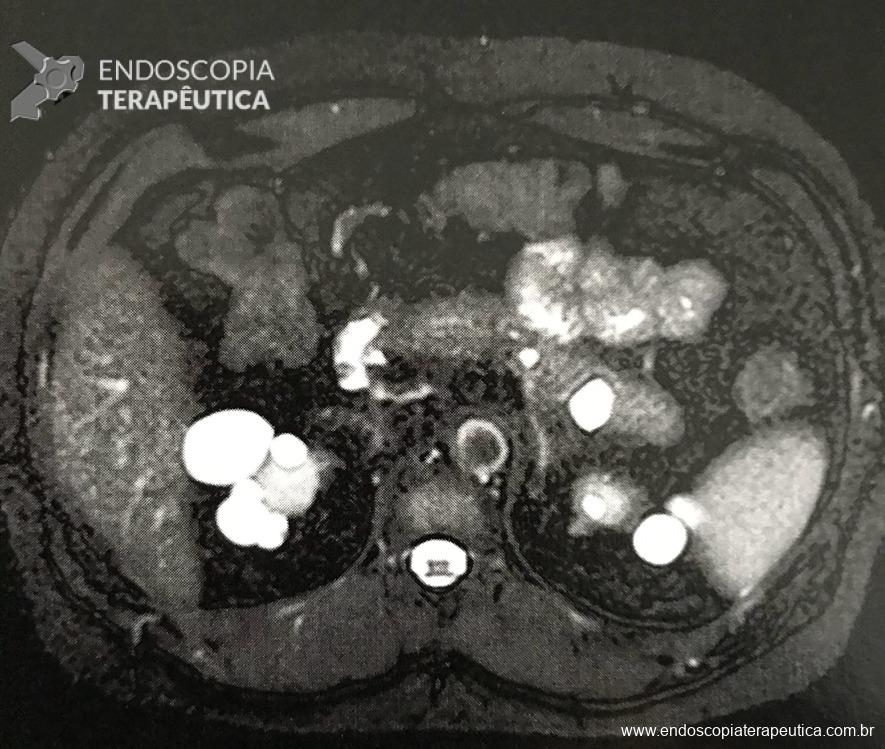
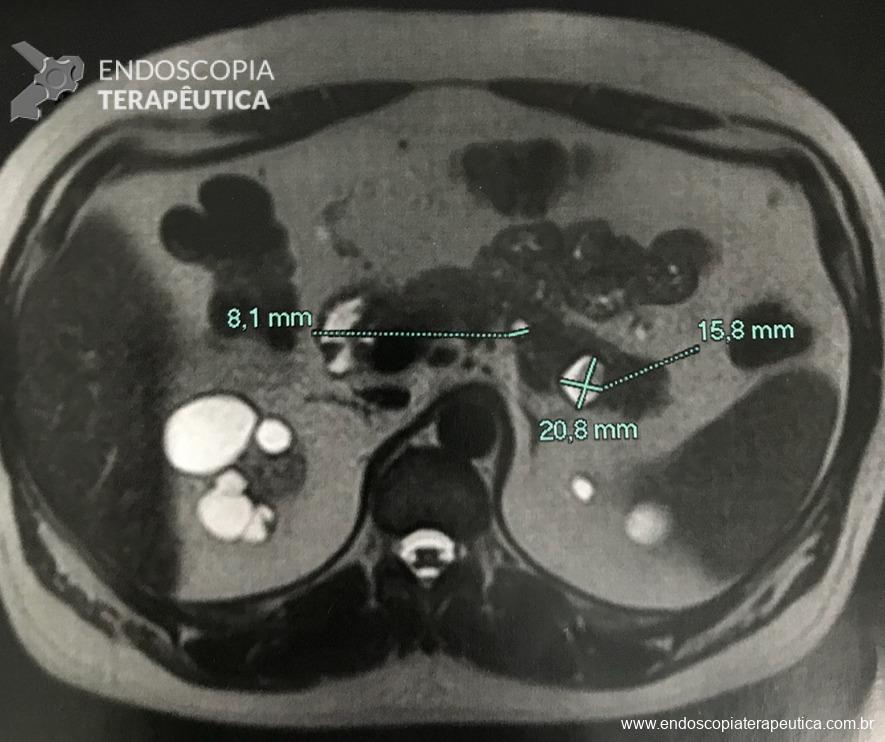
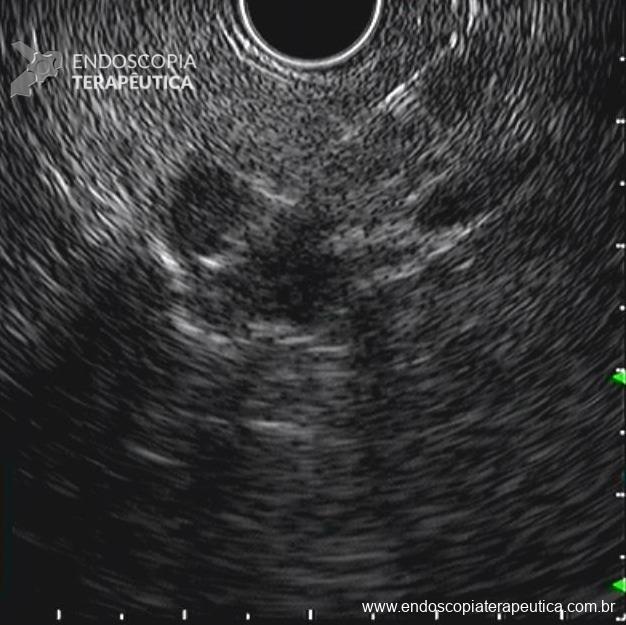
- presença de formação nodular heterogênea, predominantemente cística, com área de hipossinal em T2 de permeio, contornos lisos, localizada no aspecto posterior da cauda pancreática, medindo 20,8 x 15,8 mm.
- Outra pequena formação cística homogênea na face posterior do corpo pancreático, de contornos lisos, medindo 8 mm. Não se observa comunicação com o ducto pancreático principal (imagens 3 e 4).
Ecoendoscopia:
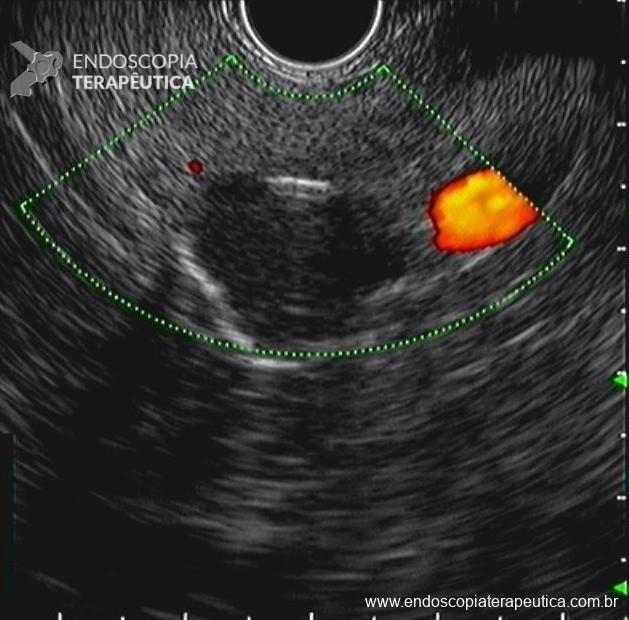
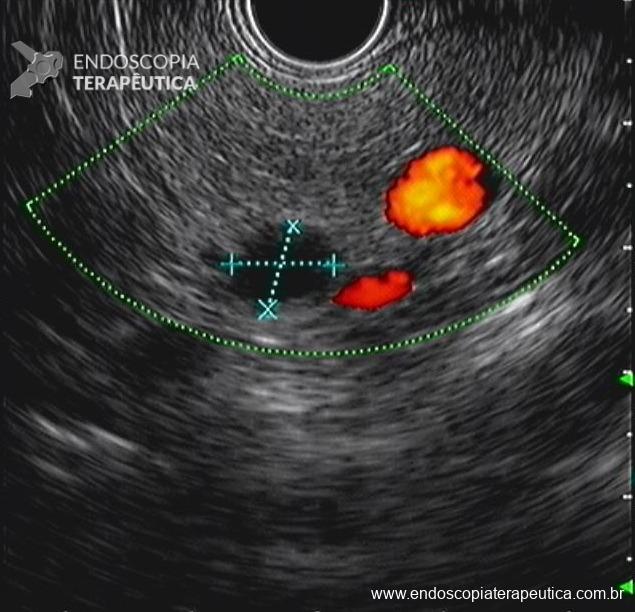
- Presença de lesão cística, com conteúdo hipoecoico e heterogêneo, sem componente sólido evidente e sem comunicação com o ducto pancreático principal, medindo 15,7 x 13,2 mm, localizada em cauda do pâncreas. Realizada punção ecoguiada com agulha FNA de 22G, não sendo possível aspirar todo o conteúdo do cisto (imagem 5, 6 e 7).
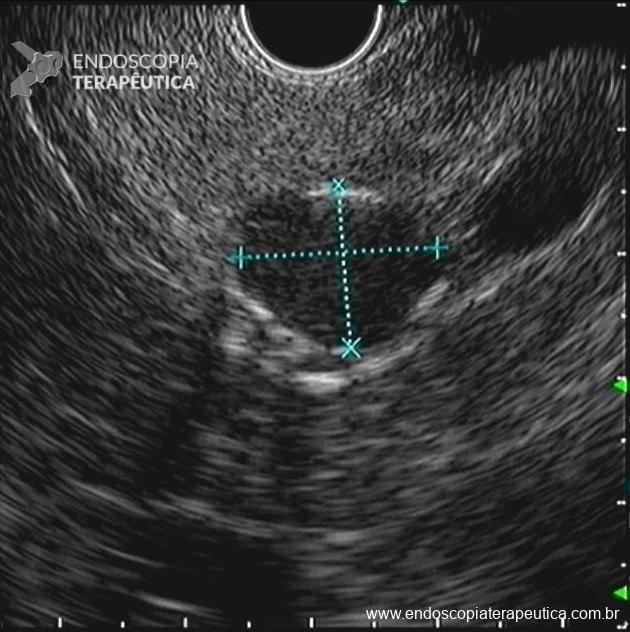
- Presença de outra pequena lesão cística, com conteúdo anecoico e homogêneo, sem componente sólido e sem comunicação com o ducto pancreático principal, medindo 8,1 x 7,0 mm, localizada em corpo (imagem 8). Não realizada punção ecoguiada.
Estudo anatomopatológico:
- Proliferação de células pequenas e monótonas, formando arranjos sólidos, em a meio grande quantidade de hemácias, apresentando discretíssimas atipias nucleares, índice mitótico muito baixo e citoplasma predominantemente eosinofílico com regiões de células claras.
- Os achados histopatológicos são sugestivos do diagnóstico de um processo neoplásico (neoplasia neuroendócrina? Carcinoma de célular acinares? Outros?). Sugere-se estudo imunohistoquímico na tentativa de maior detalhamento da lesão.
Imuno-histoquímica:
- Citoqueratina – Positivo
- Sinaptofisina – Positivo forte e difuso
- CD-56 – Positivo
- Ki-67 – Positivo (<2%)
O perfil imunohistoquímico é sugestivo de uma neoplasia neuroendócrina bem diferenciada de baixo grau.
Paciente foi encaminhado para avaliação cirúrgica, mas, devido ao tamanho da lesão, por se tratar de tumor não funcionante e por estar assintomático, foi optado pelo tratamento conservador, com seguimento por ressonância magnética.
Discussão:
Os tumores neuroendócrinos do pâncreas são raros e correspondem a 1%-3% de todas as neoplasias pancreáticas (6). A maioria deles ocorre de forma esporádica, entretanto cerca de 10% estão associados a síndromes genéticas, como neoplasia neuroendócrina múltipla do tipo 1 (mais comum), von Hippel Lindau, neurofibromatose tipo 1 e complexo de esclerose tuberosa (7).
A incidência dos tumores neuroendócrinos em pacientes com CET é de 1,8% – 9%, bem maior que na população em geral, que é de cerca de 0,003% (7,8). No entanto, algumas semelhanças entre as duas populações podem ser observadas, sendo a localização mais comum no corpo e cauda do pâncreas e a presença de tumores não funcionantes (7). Por outro lado, os pacientes com CET são mais jovens ao diagnóstico (26 anos x 56 anos) e apresentam uma maior proporção de lesões císticas (7). A mutação no gene TSC2 parece ser a mais associada à presença de tumores neuroendócrinos (8).
Embora os tumores neuroendócrinos pancreáticos não estejam entre os critérios diagnósticos do complexo da esclerose tuberosa e não exista indicação para o seu rastreamento nesse grupo de pacientes, deve-se estar atento para o seu diagnóstico na presença de lesão sólida ou cística, uma vez que ele representa o tumor pancreático mais comum em pacientes com CET (7).
Referências
- Portocarreo LKL, Quental KN, Samorano LP, et al. Tuberous Sclerosis Complex: review based on new diagnostic criteria. An Bras Dermatol. 2018;93:323-331.
- Au KS, Williams AT, Roach ES, et al. Genotype/phenotype correlation in 325 individuals referred for a diagnosis of tuberous sclerosis complex in the United States. Genet Med 2007; 9:88.
- Curatolo P, Bombardieri R, Jozwiak S. Tuberous sclerosis. Lancet 2008; 372:657.
- Lyczkowski DA, Conant KD, Pulsifer MB, et al. Intrafamilial phenotypic variability in tuberous sclerosis complex. J Child Neurol 2007; 22:1348.
- Mizuguchi M, Takashima S. Neuropathology of tuberous sclerosis. Brain Dev 2001; 23:508.
- Kopadze S, Shoshiashvili I, Dumbadze A, et al. Neuroendocrine pancreatic tumor in a patient with dual diagnosis of tuberous sclerosis complex and basement membrane disease: A case report and review of the literature. Radiol Case Rep 2021;16:3581-3588.
- Larson AM, Hedgire SS, Deshpande V, et al. Pancreatic neuroendocrine tumors in patients with tuberous sclerosis complex. Clin Genet 2012;82:558-563.
- Mowrey K, Northrup H, Rougeau P, et al. Frequency, Progression, and Current Management: Report of 16 New Cases of Nonfunctional Pancreatic Tumor in Tuberous Sclerosis Complex and Comparison with Previous Reports. Front Neurol 2021;12:627672
Como citar este artigo
Retes FA. Alteração pancreática em paciente portador de complexo da esclerose tuberosa Endoscopia Terapeutica 2023 Vol 2. Disponível em: endoscopiaterapeutica.net/pt/alteracao-pancreatica-em-paciente-portador-de-complexo-da-esclerose-tuberosa/
Membro Titular da SOBED; Especialização em Endoscopia Gastrointestinal HC-FMUSP; Mestre pelo Departamento de Gastroenterologia – FMUSP; Médico Endoscopista do Instituto Alfa de Gastroenterologia HC-UFMG;