El H pylori
El Helicobacter pylori es una bacteria gram-negativa que induce reacciones celulares y químicas en el estómago, siendo considerada un carcinógeno humano. Su diagnóstico y tratamiento tienen un papel importante en la prevención de enfermedades asociadas, como cáncer gástrico, úlceras, linfoma MALT y pólipos hiperplásicos.
Sabemos que existen varios tests diagnósticos, desde no invasivos (serología, test respiratorio y antígeno fecal) hasta los invasivos (ureasa, cultivo e histología). Los métodos no invasivos poseen alta precisión, pero no evalúan las alteraciones de la mucosa gástrica.
Debido al carácter focal de la colonización bacteriana, la precisión de los métodos invasivos, a su vez, depende del lugar, número y tamaño de las biopsias. Estas, cuando están mal dirigidas, pueden resultar en falsos negativos. De esta forma, es importante evaluar los predictores endoscópicos de la presencia o ausencia del H. pylori con el fin de dirigir biopsias hacia áreas de mayor probabilidad de infección, así como hasta evitarlas cuando el valor predictivo positivo sea alto.
Estudios demostraron que, aunque no son patognomónicos, algunos hallazgos endoscópicos están asociados a la presencia del H. pylori. Recientemente, nuevas tecnologías de cromoscopía y magnificación permitieron el análisis de la microestructura de la mucosa gástrica y, consecuentemente, mayor precisión en la determinación del status de infección (ausencia, infección activa y post-erradicación).
El objetivo de este artículo es ayudar a los endoscopistas en la evaluación de los hallazgos endoscópicos relacionados al H. pylori tanto a la luz blanca, como a la cromoscopía y magnificación.
2. Hallazgos del estómago no infectado
2.1 A la luz blanca
El estómago normal presenta coloración rosa-rojiza y brillante y el plegamiento mucoso está presente de manera uniforme. El moco debe ser hialino y frecuentemente formando pequeño lago. En el cuerpo y fondo, los pliegues están más concentrados en la gran curvatura, en forma de tienda y que tienden a desaparecer con la insuflación. Ya el antro es plano, con tonalidad clara.
2.2 A la cromoscopía y magnificación
Para entender las alteraciones visualizadas en la magnificación endoscópica, necesitamos primero saber la histomorfología de la mucosa normal del estómago.
Resumidamente, la mucosa del cuerpo gástrico está compuesta por orificio críptico (OC), epitelio marginal de la cripta (MCE), red de capilar subepitelial (SECN), vasos colectores y espacios intervinientes (entre las criptas), conforme esquema a continuación:

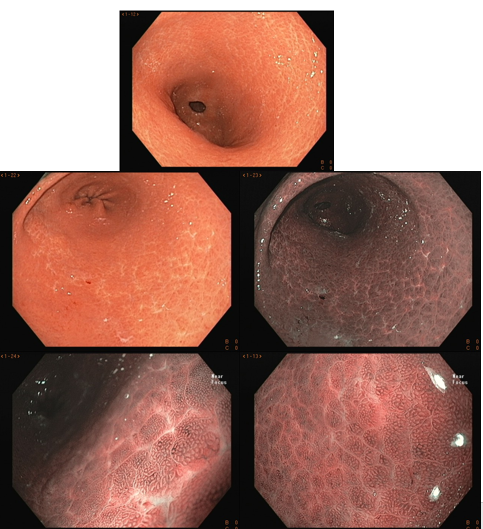
En el estómago no infectado por el H. pylori, la red capilar subepitelial está presente, de forma regular en todo el cuerpo, denominada de RAC (regular arrangement of collecting venules). El valor predictivo negativo de este hallazgo es mayor que el 90%, lo que significa que su presencia en la pequeña curvatura de cuerpo distal e incisura está fuertemente asociada a la condición de no infección por el H. pylori.
Podemos observar, también, que tanto el orificio de la cripta como el epitelio marginal son ovales, regulares y simétricos. La red capilar subepitelial (SECN) es regular y fina, en formato de panal de abeja.

Figura 1: Hallazgos endoscópicos de un estómago no infectado por H. pylori. (a) La mucosa es lisa, brillante, con pliegues uniformemente distribuidos. (b) Vénulas colectoras (RAC) distribuidas regularmente. (c) RAC en detalle bajo luz blanca y sin aumento. (d) El aumento muestra un patrón vascular en panal de abejas de los capilares subepiteliales, orificios crípticos redondos (marrones) y epitelio marginal críptico de forma ovalada regular. Las RAC son de color azulado (cian).
3. Hallazgos del estómago infectado
3.1- A la luz blanca
A la luz blanca, los hallazgos endoscópicos más asociados a la infección por el H. pylori son: hiperemia difusa, enantema petequial (“salpicado”) de fondo y cuerpo proximal, pliegues engrosados y tortuosos, edema de la mucosa, exudado fibrinoso en el cuerpo y nodularidad antral. Con la persistencia de la infección, ocurre disminución de los pliegues y los vasos submucosos se hacen más visibles, hallazgos de la gastritis atrófica.
En un estudio prospectivo multicéntrico, la sensibilidad y especificidad de los hallazgos endoscópicos descritos arriba fueron del 94,3% y 62,8% (Kato,2013). La hiperemia difusa fue considerada la característica más confiable por los endoscopistas experimentados.
Sabemos que esta infección se inicia en el antro y progresa hacia el cuerpo. Sin embargo, en el antro, la precisión diagnóstica es menor, ya que los vasos están localizados más profundamente, perjudicando su visualización. Por lo tanto, debemos primero evaluar la presencia o ausencia de la hiperemia en el cuerpo. Cuando esta evaluación es difícil, debemos prestar atención en el enantema petequial, en el edema, en los pliegues y en el exudado fibrinoso.
Como se describió anteriormente, la ausencia del patrón regular de las vénulas colectoras (RAC negativo) puede estar asociado a la infección activa por el H. pylori, pero la especificidad de este hallazgo es baja. En un estudio brasileño (Fiuza F, Martins BC, 2021), la ausencia de RAC estuvo asociada solo a un 50,6% de positividad del H. pylori. En otras palabras, la ausencia de RAC tiene alta precisión para la presencia de la bacteria, pero no siempre la infección es la que causa su pérdida.
Es importante recordar que, en la infección por el H. pylori, el RAC desaparece inicialmente en la pequeña curvatura de cuerpo distal e incisura, siendo estos lugares los más específicos para ser analizados. Sin embargo, en las gastritis crónicas, cuando la atrofia antral se extiende justamente por la incisura y pequeña curvatura de cuerpo distal, puede ocurrir desaparición o deformidad del RAC, incluso en pacientes erradicados, dificultando su análisis. En estos casos, necesitamos buscar el RAC en la mucosa de cuerpo distal lejos de la atrofia.
Otro dato importante es que la última región en que el RAC se mantiene preservado es en el cuerpo proximal y fondo gástrico, lugares que no son recomendados para la evaluación de la infección bacteriana.
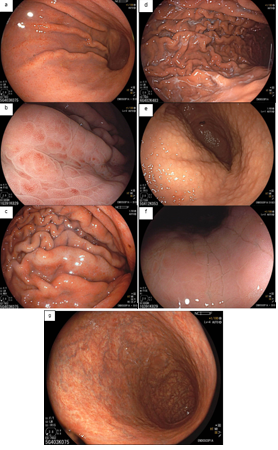
Figura 2: Hallazgos endoscópicos de un estómago infectado por H. pylori. (a) enantema difuso, (b) enantema petequial y edema, (c) congestión de pliegues, (d) exudado fibrinoso en el cuerpo, (e) nodularidad antral, (f) edema mucoso y ausencia del RAC, (g) atrofia.
3.2- A la magnificación
Histomorfológicamente, con la infección por el H. pylori, las criptas se hacen más grandes e irregulares, rodeadas por eritema y surcos. Ya no conseguimos ver la red de capilares subepiteliales, pues células inflamatorias, edema, epitelio degenerado y ruptura de la red microvascular impiden su adecuada visualización. Los orificios de las criptas se vuelven asimétricos y blancos debido al depósito de contenido inflamatorio en su interior de las glándulas. Conforme la atrofia se va expandiendo, el epitelio marginal de las criptas se hace más grande y posee forma irregular y alargada/curva. Es lo que llamamos “antralización” del cuerpo gástrico.
En un estudio brasileño (Fiuza F, Martins BC, 2021), se verificó que es posible identificar estas alteraciones de la mucosa gástrica (especialmente la presencia o ausencia de RAC) utilizando la tecnología de near focus, ya que los gastroscopios con magnificación aún no son ampliamente disponibles en nuestro medio.
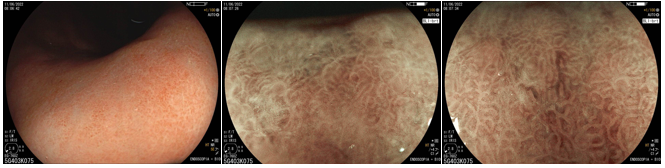
Figura 3: Magnificación endoscópica de un estómago infectado con H. pylori: mucosa edematosa, con enantema y disminución del plegamiento mucoso. Se observó pérdida de la red capilar subepitelial normal y de las vénulas colectoras. Las criptas se alargaron y presentaron una apariencia reticular (antralización), con eritema y dilatación de los vasos subepiteliales.
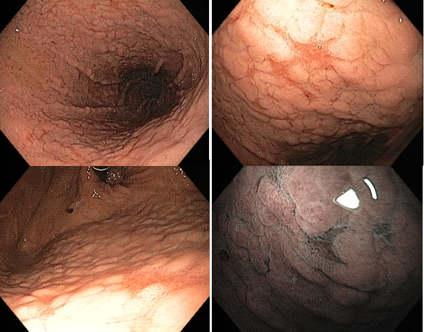
4. Hallazgos del estómago tratado (post-erradicación)
Sigue siendo controvertido si el tratamiento contra H. pylori puede revertir la gastritis atrófica y la metaplasia intestinal. Además, la mucosa puede tardar hasta 10-15 años en recuperarse y volver a la normalidad.
Tras la erradicación, las zonas no atróficas disipan la inflamación y las zonas atróficas se tornan relativamente rojizas en comparación con la mucosa adyacente. Esto da lugar al patrón “mapa”. Este patrón puede estar asociado con el desarrollo de cáncer gástrico tanto primario como metacrónico, incluso después de un tratamiento eficaz contra H. pylori.
Otra característica descrita es el patrón “agrietado”, donde aparecen surcos en la mucosa antral, lo que indica mucosa reparadora.
Los estudios han demostrado que la terapia de erradicación puede alterar las características del estómago reparado, lo que dificulta el diagnóstico temprano de cáncer gástrico. Por lo tanto, el estado posterior a la erradicación debe distinguirse de la negatividad de H. pylori.
Referências
Anagnostopoulos GK, Yao K, Kaye P, Fogden E, Fortun P, Shonde A, Foley S, Sunil S, Atherton JJ, Hawkey C, Ragunath K. High-resolution magnification endoscopy can reliably identify normal gastric mucosa, Helicobacter pylori-associated gastritis, and gastric atrophy. Endoscopy. 2007 Mar;39(3):202-7.
Yao K. The endoscopic diagnosis of early gastric cancer. Ann Gastroenterol. 2013;26(1):11-22.
Yagi K, Nakamura A, Sekine A. Comparison between magnifying endoscopy and histological, culture and urease test findings from the gastric mucosa of the corpus. Endoscopy. 2002 May;34(5):376-81.
Yuan C, Lin XM, Ou Y, Cai L, Cheng Q, Zhou P, Liao J. Association between regular arrangement of collecting venules and Helicobacter pylori status in routine endoscopy. BMC Gastroenterol. 2021 Oct 20;21(1):389.
Glover B, Teare J, Patel N. A systematic review of the role of non-magnified endoscopy for the assessment of H. pylori infection. Endosc Int Open. 2020 Feb;8(2):E105-E114.
Qi Q, Guo C, Ji R, Li Z, Zuo X, Li Y. Diagnostic Performance of Magnifying Endoscopy for Helicobacter pylori Infection: A Meta-Analysis. PLoS One. 2016 Dec 19;11(12):e0168201.
Weng CY, Xu JL, Sun SP, Wang KJ, Lv B. Helicobacter pylori eradication: Exploring its impacts on the gastric mucosa. World J Gastroenterol. 2021 Aug 21;27(31):5152-5170.
Nishikawa Y, Ikeda Y, Murakami H, et al. Classification of atrophic mucosal patterns on Blue LASER Imaging for endoscopic diagnosis of Helicobacter pylori-related gastritis: A retrospective, observational study. PLoS One. 2018;13(3):e0193197.
Toyoshima O, Nishizawa T, Koike K. Endoscopic Kyoto classification of Helicobacter pylori infection and gastric cancer risk diagnosis. World J Gastroenterol. 2020 Feb 7;26(5):466-477.
Ono S, Dohi O, Yagi N, Sanomura Y, Tanaka S, Naito Y, Sakamoto N, Kato M. Accuracies of Endoscopic Diagnosis of Helicobacter pylori-Gastritis: Multicenter Prospective Study Using White Light Imaging and Linked Color Imaging. Digestion. 2020;101(5):624-630.
Kato T, Yagi N, Kamada T, Shimbo T, Watanabe H, Ida K; Study Group for Establishing Endoscopic Diagnosis of Chronic Gastritis. Diagnosis of Helicobacter pylori infection in gastric mucosa by endoscopic features: a multicenter prospective study. Dig Endosc. 2013 Sep;25(5):508-18.
Fiuza F, Maluf-Filho F, Ide E, Furuya CK Jr, Fylyk SN, Ruas JN, Stabach L, Araujo GA, Matuguma SE, Uemura RS, Sakai CM, Yamazaki K, Ueda SS, Sakai P, Martins BC. Association between mucosal surface pattern under near focus technology and Helicobacter pylori infection. World J Gastrointest Endosc. 2021 Oct 16;13(10):518-528.
Como citar este artigo
Nobre R, Baba E, Penaloza CSQ. Achados endoscópicos relacionados à infecção pelo H. Pylori, Endoscopia Terapêutica; 2022. Dísponivel em:
https://endoscopiaterapeutica.net/es/temas-generales/hallazgos-endoscopicos-relacionados-com-infeccion-por-h-pylori/
