O câncer colorretal (CCR) é o quarto tumor mais frequente e a segunda causa de morte por câncer nos EUA. Estima-se para o ano de 2016 mais de 140 mil novos casos de câncer de cólon e reto nos EUA com aproximadamente 50 mil mortes, correspondendo a aproximadamente 9% das causas de morte por câncer. No Brasil, segundo os dados do INCA, estima-se mais de 34 mil novos casos de CCR para 2016. Apesar dos elevados números a incidência e a mortalidade nos pacientes acima de 50 anos vem diminuindo desde a década de 90 devido aos programas de rastreamento e melhora da assistência oncológica clínica e cirúrgica.
Entretanto, o diagnóstico de CCR nos pacientes abaixo de 50 anos tem aumentado por fatores ainda não esclarecidos. Segundo a OMS, estima-se que nos pacientes abaixo de 34 anos a incidência deve aumentar em até 125% até 2030.
O câncer colorretal é uma doença heterogênea no que se refere ao desenvolvimento e ao comportamento biológico e causada pela interação entre fatores genéticos herdados ou não e ambientais. A doença pode se apresentar de forma esporádica, herdada ou familiar.
Forma esporádica: a apresentação esporádica, sem história familiar, corresponde a aproximadamente 70% dos casos. A idade acima de 50 anos é o fator de risco mais importante além da dieta e de outros fatores ambientais.
Herdada: uma pequena proporção dos casos se deve às formas herdadas, relacionadas à mutações germinativas específicas, divididas pela presença ou não de polipose associada.
- O CCR com polipose inclui a Polipose Adenomatosa Familiar (PAF) em 1% dos casos, a Polipose associada ao gene MYH em menos de 1% e as síndromes de poliposes hamartomatosas como Peutz-Jeghers e a Polipose Juvenil.
- As formas não relacionadas à polipose correspondem a 2 a 5% dos casos e se referem ao HNPCC e a Síndrome de Lynch. Todas estas condições apresentam um risco muito significativo de transformação maligna e na maioria das vezes a mutação genética pode ser identificada.
Familiar: Aproximadamente 20 a 25% dos casos se relacionam a um componente hereditário não tão bem estabelecido como as formas descritas acima e são denominados “câncer colorretal familiar”. As alterações genéticas são até o momento menos conhecidas que as das formas herdadas e o risco de desenvolvimento de câncer em um indivíduo deste grupo é 1,7 vezes maior que o da população geral quando existe um parente de primeiro com CCR.
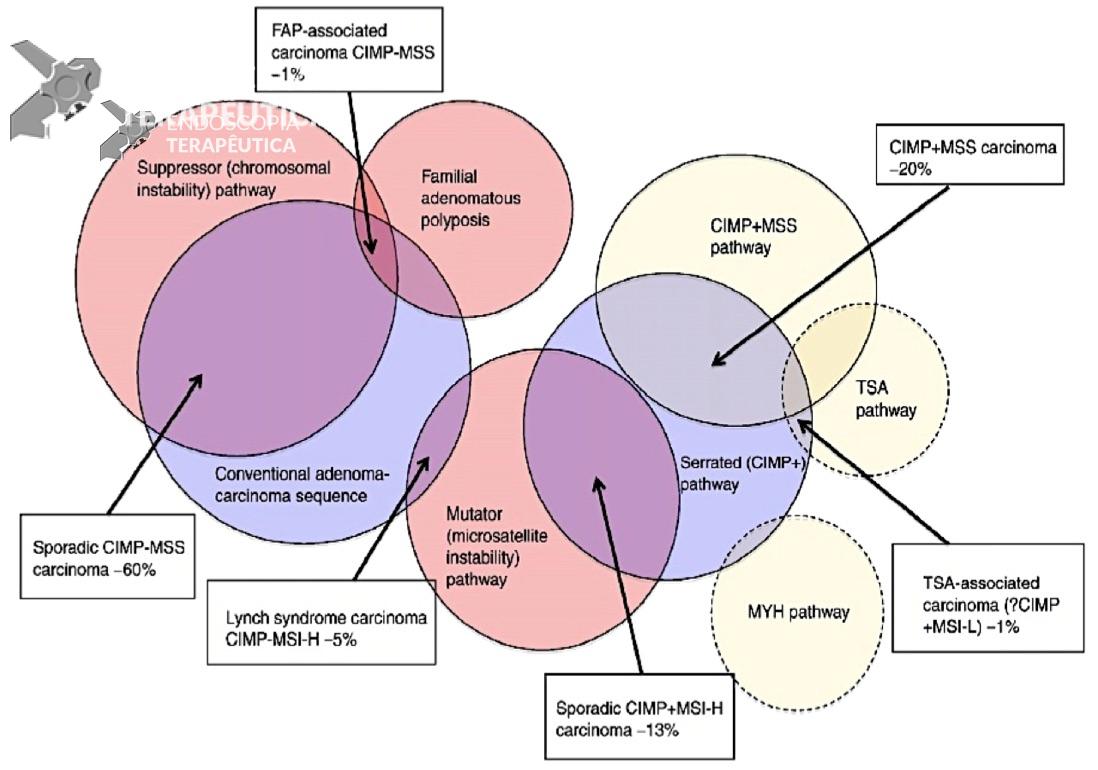
A carcinogênese pode ser entendida como um desequilíbrio entre o desenvolvimento de mutações e os mecanismos de controle do ciclo celular. As vias mais estabelecidas para o câncer colorretal são a via supressora ou instabilidade cromossômica (CIN), a via de instabilidade de microssatélites (MSI) e a via do fenótipo metilador da ilhas CPG (CIMP). A figura 1 demonstra de forma esquemática a sobreposição das vias de carcinogênese colorretal.
Figura 1. Representação esquemática e interação entre as diferentes vias de carcinogênese colorretal.
Referência: Snover DC. Human Pathology 2011;42:1-10.
1. CIN – Via Supressora ou Instabilidade Cromossômica.
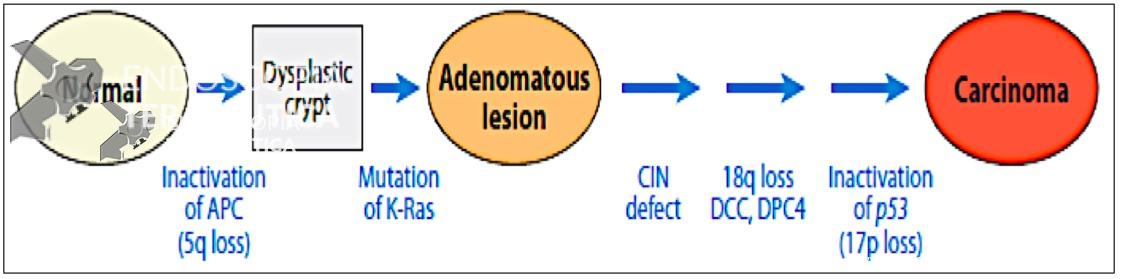
A via denominada supressora contempla a via adenoma-carcinoma descrita em 1990 por Fearon e Vogelstein e se caracteriza por um acumulo gradual de mutações que levam a ativação de oncogenes (KRAS) e inativação de genes supressores de tumor (DCC, APC, SMAD4 e TP53). CIN se refere a alterações das estruturas cromossômicas com ganhos e perdas parciais ou totais que resultam em variabilidade do cariótipo, aneuploidia e perda da heterozigoze (LOH). Trata-se da via mais bem estudada de carcinogênese colorretal e se relaciona à PAF e aos tumores esporádicos, correspondendo a aproximadamente 70% dos casos de CCR. As lesões precursoras da via supressora (CIN) são os adenomas. Os tumores são mais frequentemente encontrados no cólon distal e são sensíveis ao 5-FU, droga chave no tratamento sistêmico, quando indicado antes ou depois do tratamento cirúrgico. A figura 2 ilustra de uma forma simplificada os passos principais do desenvolvimento do carcinoma colorretal de acordo com a via CIN.
Figura 2. Via adenoma carcinoma (CIN).
Referência: Fearon ER. Annu. Rev. Pathol. Mech. Dis 2011; 6:479-507.
2. MSI – Instabilidade de Microssatélites.
A segunda via de carcinogênese colorretal é denominada Instabilidade de Microssatélites ou MSI. Descrita inicialmente em 1993, envolve o acumulo de erros durante a replicação do DNA devido a presença de mutações herdadas ou adquiridas em genes responsáveis pelo seu reparo (MMR). Estes erros se acumulam predominantemente em fragmentos de DNA com padrão de repetições de 1 a 5 nucleotídeos denominados Microssatélites. Os cinco genes que têm particular interesse por sua relação com o câncer hereditário não polipóide (HNPCC/Síndrome de Lynch) e suas respectivas frequências de mutação são: MLH1 (49%), MSH2 (38%), MSH6 (9%), PSM2 (2%) e PMS1 (0,3%). Os tumores colorretais podem ser divididos em MSI alto se dois ou mais genes MMR estiverem mutados, MSI baixo se apenas uma mutação for encontrada ou MSS (estáveis). MSI é encontrado na Síndrome de Lynch (MSI alto) e em aproximadamente 15% dos CCR esporádicos.
Pelo menos dois mecanismos resultam num defeito das proteínas de reparo (MMR). Uma mutação germinativa de um gene MMR (MLH1, MSH2, MSH6 e PMS2) resultando no funcionamento inadequado da proteína de reparo como acontece no HNPCC/Síndrome de Lynch ou um silenciamento do gene MMR por hipermetilação, usualmente MLH1, mais frequentemente observado no câncer esporádico (evento epigenético).
A lesão precursora da via MSI também é o adenoma e velocidade de transformação para o cancer invasivo é mais rápida quando comparada à via CIN e estimada em aproximadamente 5 anos. Os tumores esporádicos relacionados à Instabilidade de Microssatélites são mais frequentemente encontrados em mulheres, localizados no cólon proximal, com padrão mucinoso pouco diferenciado e acentuada infiltração linfocítica. Apesar da resistência ao 5-FU, os tumores MSI altos têm melhor prognóstico, menor probabilidade de metástases à distância e maior sobrevida quando comparados aos tumores MSI estáveis.
3. CIMP – Fenótipo Metilador das Ilhas CPGs.
Historicamente os pólipos do cólon eram classificados em adenomas neoplásicos e pólipos hiperplásicos não neoplásicos. Em 1990, Longacre e Fenoglio-Preiser descreveram o primeiro caso de “serrated adenoma”. Em 1996, Torlakovic e Snover publicaram uma série de casos de polipose hiperplásica sugerindo que os até então benignos pólipos hiperplásicos poderiam se transformar. Outras estudos vieram até que na edição de 2010 a OMS publicou a nova classificação das lesões serrilhadas que foram divididas em pólipos hiperplásicos (PH, 75%), com seus subtipos microvesicular (PHMV), pobre em mucina (PHPM) e células caliciformes (PHCC), pólipo ou adenoma sessil serrilhado (ASS, 15-25%) com ou sem displasia e pólipo ou adenoma serrilhado tradicional (AST, 1%) com ou sem displasia.
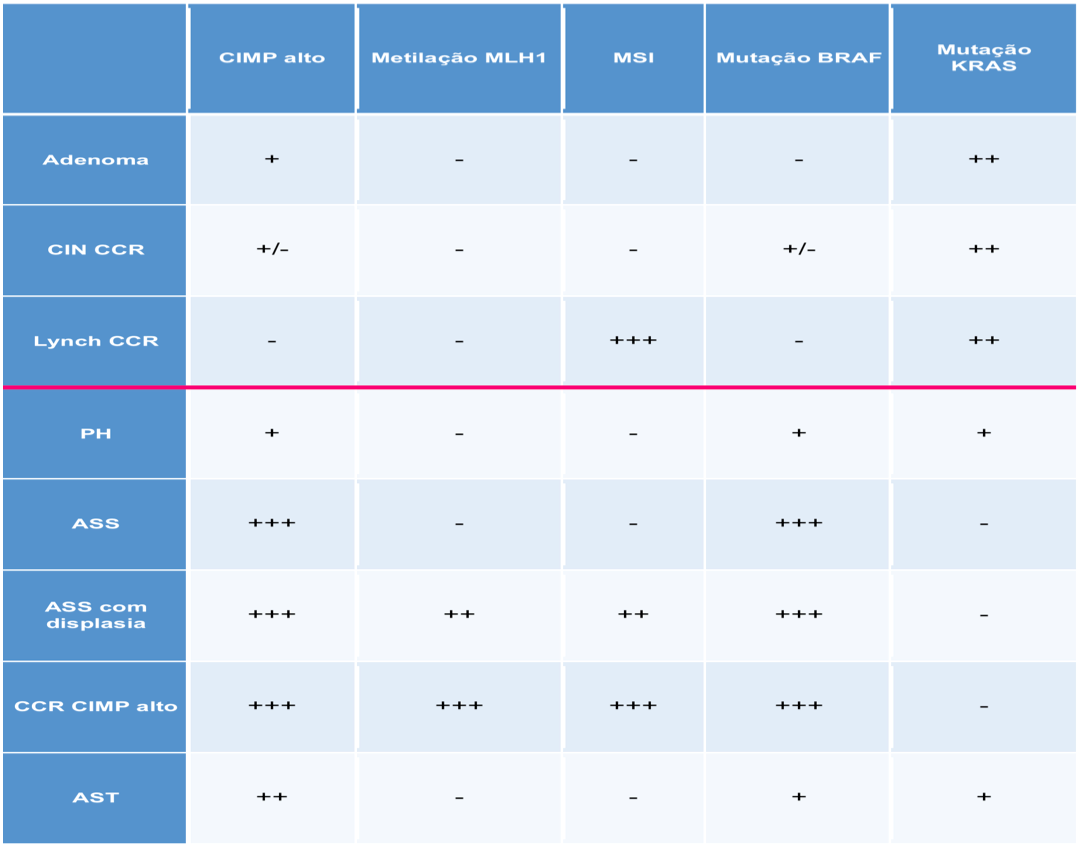
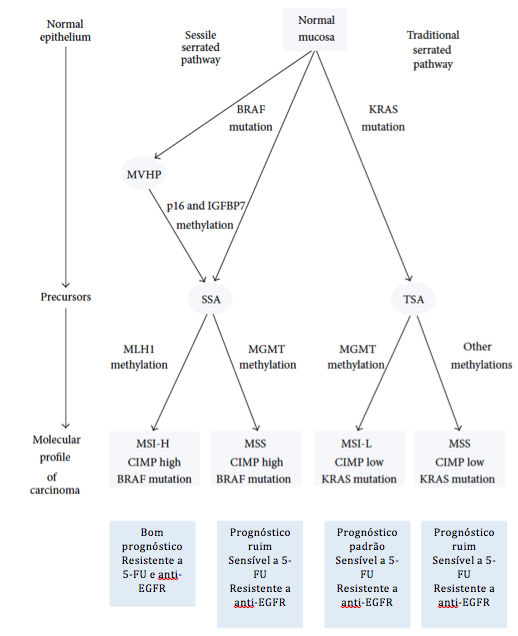
A chamada via alternativa de carcinogênese colorretal ou via serrilhada, responsável por aproximadamente 20 a 30% dos casos de CCR, foi descrita há pouco mais de 15 anos e é caracterizada pela hipermetilação das chamadas ilhas CpG (regiões do genoma ricas em CpG ou Citosina – Phosfato – Guanina) nas regiões promotoras de genes supressores de tumor (CIMP) com consequente silenciamento dos genes envolvidos e mutação do oncogene BRAF. CIMP pode ser expresso em alto, baixo ou ausente. O fenótipo de CIMP alto pode ser encontrado em até 25% dos PH, 65% dos ASS e menos de 1% dos adenomas. Assim, a via serrilhada é também conhecida como via CIMP. O tempo de progressão das lesões serrilhadas para o cancer invasivo é controverso e parece ser de aproximadamente 15 anos, podendo se tornar significativamente mais rápido quando a lesão exibe displasia e fenômenos de metilação. As lesões serrilhadas possuem uma íntima relação com o câncer de intervalo. Os tumores desta via se encontram mais frequentemente no cólon proximal e em geral apresentam um prognóstico ruim com exceção dos MSI altos. As características moleculares dos pólipos e do CCR e as outras variações moleculares da via serrilhada são descritas respectivamente na tabela 1 e na figura 3 abaixo.
Tabela 1. Características moleculares dos pólipos e do câncer colorretal.
Referência: Rex et al. Am J Gastroenterol 2012; 107:1315-1329.
Figura 3: Via de carcinogênese serrilhada.
Referência: Szylberg L et al. Gastroenterol Res Pract 2015; 2015:573814.
Implicações clínicas e considerações finais
- O CCR é uma doença comum e heterogênea envolvendo diversos aspectos moleculares e manifestações clinicopatológicas.
- A colonoscopia associada à polipectomia se relaciona à uma redução significativa da incidência e da mortalidade do CCR. O aperfeiçoamento no diagnostico endoscópico, o melhor tratamento e o adequado seguimento dos pacientes portadores de lesões precursoras do CCR deve ser o objetivo do endoscopista nos programas de rastreamento.
- Recomenda-se a ressecção de todos os adenomas e pólipos serrilhados proximais ao sigmoide além daqueles maiores que 5 mm no cólon distal e no reto.
- Os avanços na biologia molecular e na classificação genética do CCR são essenciais para o tratamento sistêmico mais personalizado e efetivo dos pacientes com doença metastática.
Referências Bibliográficas
- IJspeert JEG, Medema JP, Dekker E. Colorectal Neoplasia Pathways: State of the Art. Gastrointest Endoscopy Clin N AM. 2015; 25: 169-182.
- Kanthan R, Senger JL, Kanthan SC. Molecular Events in Primary and Metastatic Colorectal Carcinoma: A Review. Patholog Res Int. 2012; 2012:597497.
- Snover DC. Update on the serrated pathway to colorectal carcinoma. Human Pathology 2011;42:1-10.
- Bettington M, Walker N, Clouston A, Brown I, Leggett B, Whitehall V. The serrated pathway to colorectal carcinoma: current concepts and challenges. Histopathology 2013; 62: 67-386.
- Rex DK, Ahnen DJ, Baron JA, Batts KP, Burke CA, Burt RW, Goldblum JR, Guillem JG, Kahi CJ, Kalady MF, O’Brien MJ, Odze RD, Ogino S, Parry S, Snover DC, Torlakovic EE, Wise PE, Young J, Church J. Serrated lesions of the colorectum: review and recommendations from an expert panel. Am J Gastroenterol 2012; 107:1315-1329.
- Szylberg L, Janiczek M, Popiel A, Marszalek A. Serrated polyps and Their Alternative Pathway to the Colorectal Cancer: A Systematic Review. Gastroenterol Res Pract 2015; 2015:573814.
- Raskov H, Pommergaard HC, Burcharth J, Rosenberg J. Colorectal carcinogenesis-update and perspectives. World J Gastroenterol. 2014; 48: 18151-18164.
Membro Titular da Sociedade Brasileira de Coloproctologia;
Cirurgião e Colonoscopista do Hospital Sírio Libanês e do Hospital Alemão Oswaldo Cruz

2 Comentários
Pedro, não conhecia a polipose ligada ao gene MYH. Existe alguma diferença na manifestação clínica desta polipose comparada à PAF?
Pedro, parabéns por ter conseguido resumir de uma forma tão didática este tema tão complexo e de extrema importância. Gostaria de perguntar como você faz na prática a pesquisa genética dos pacientes e seus familiares.