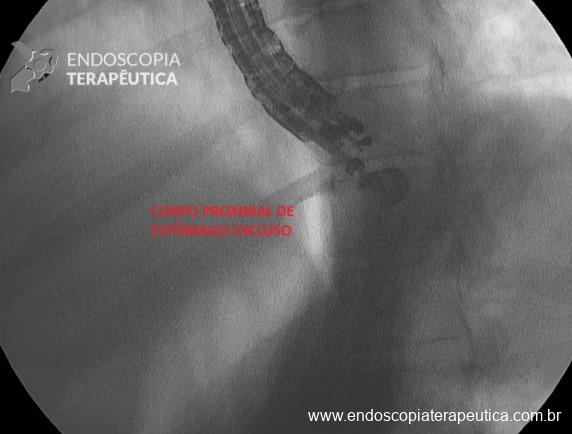
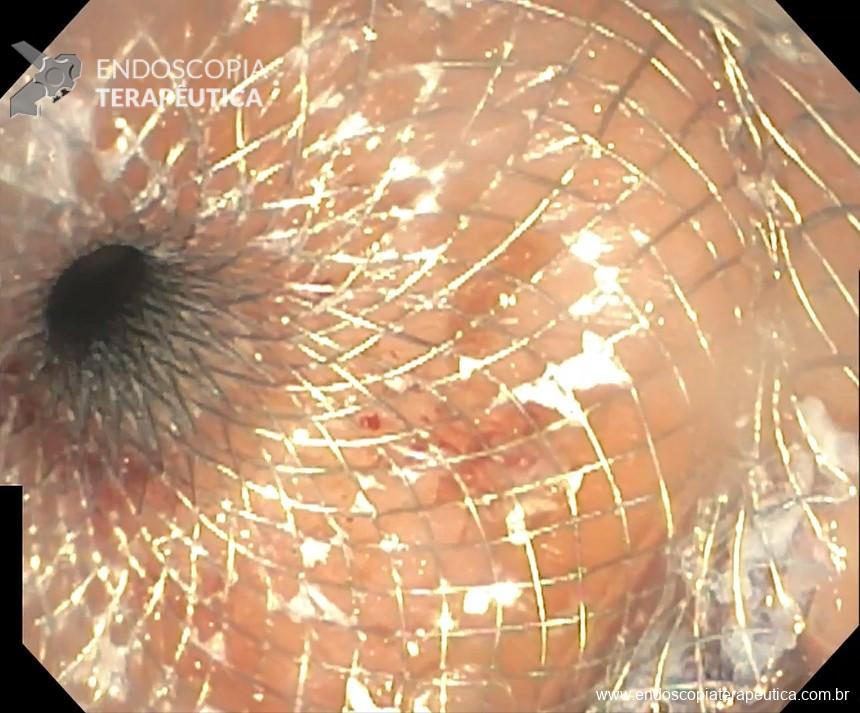
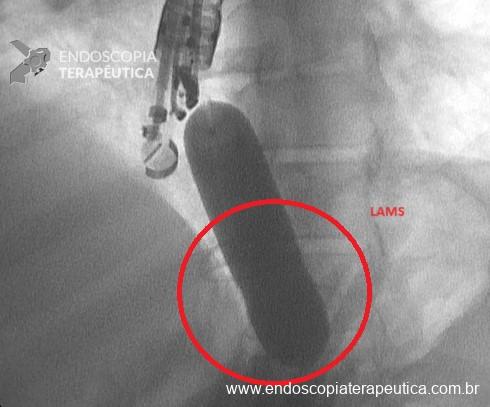
Stents de aposição de lúmen nas drenagens de coleções fluidas pancreáticas e risco de sangramento – onde estamos?
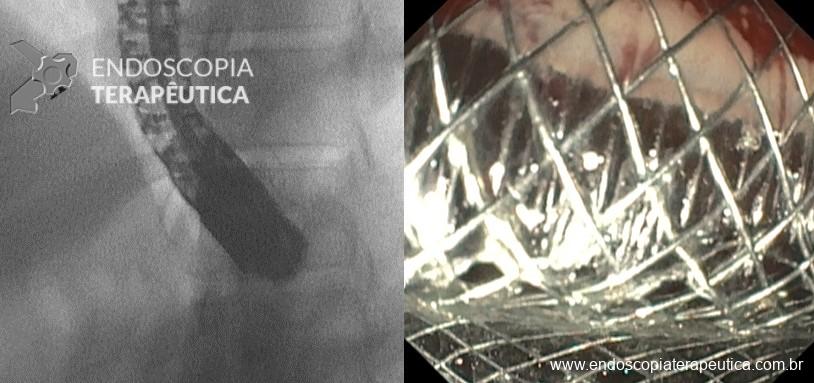
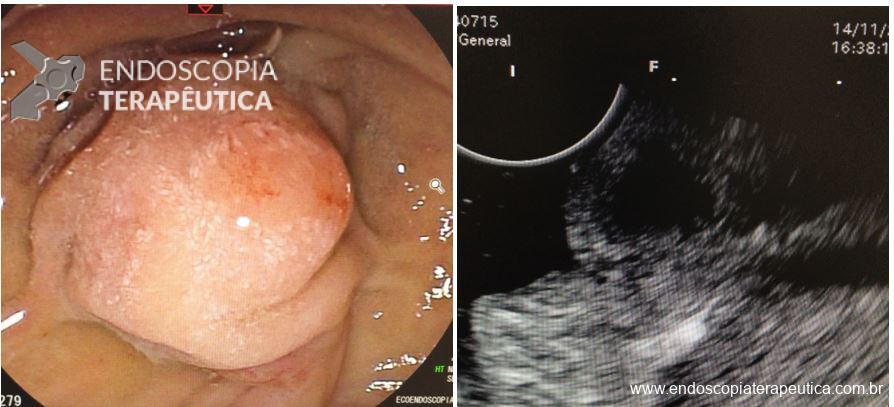
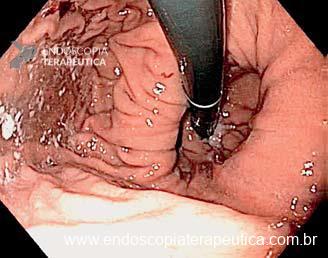
Desde a introdução dos stents metálicos de aposição de lúmen (LAMS) em 2012, as aplicações e usos desses dispositivos têm crescido constantemente. Eles têm sido empregados em uma ampla variedade de procedimentos, incluindo o tratamento de estenoses gastrointestinais luminais, para cistogastrostomia e necrosectomia endoscópica direta, para drenagem da vesícula biliar e para gastrojejunostomia.
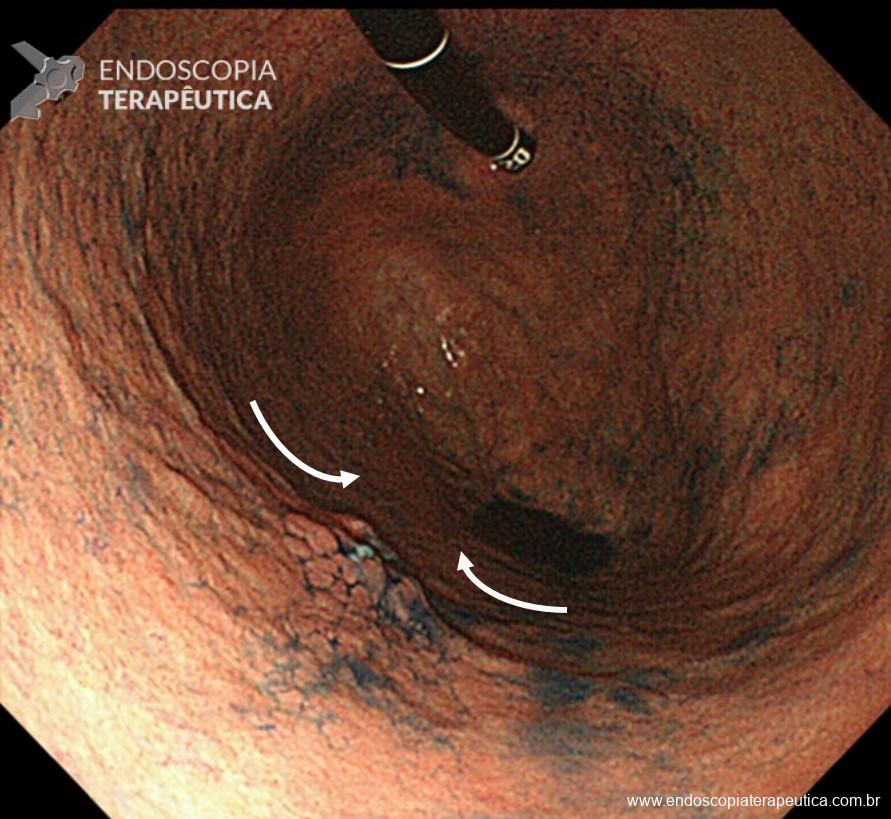
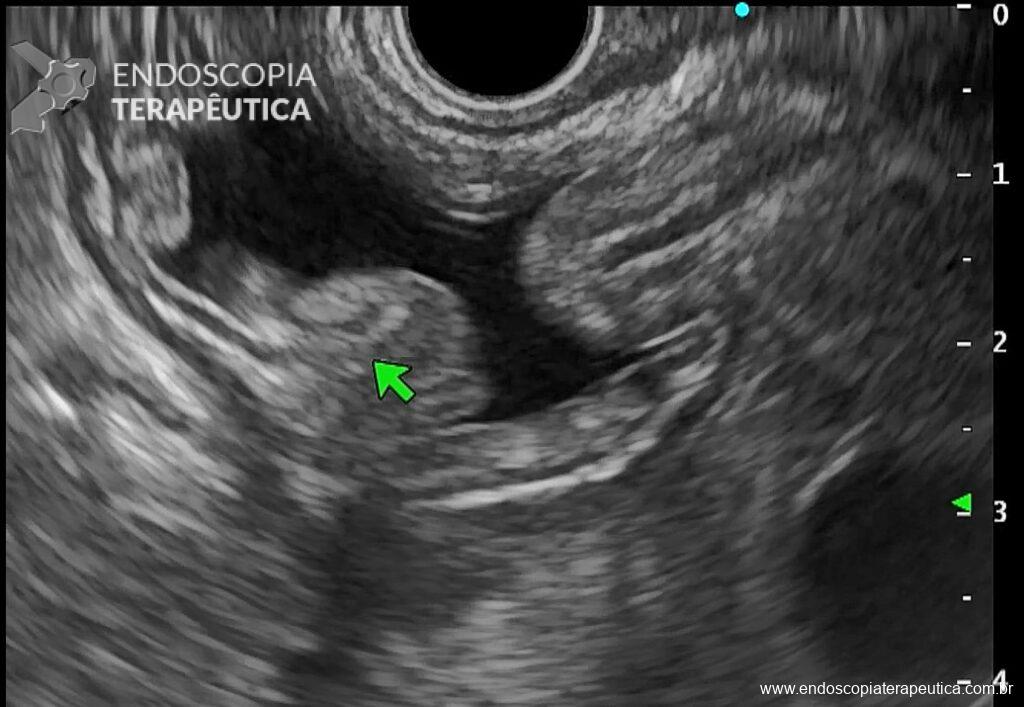
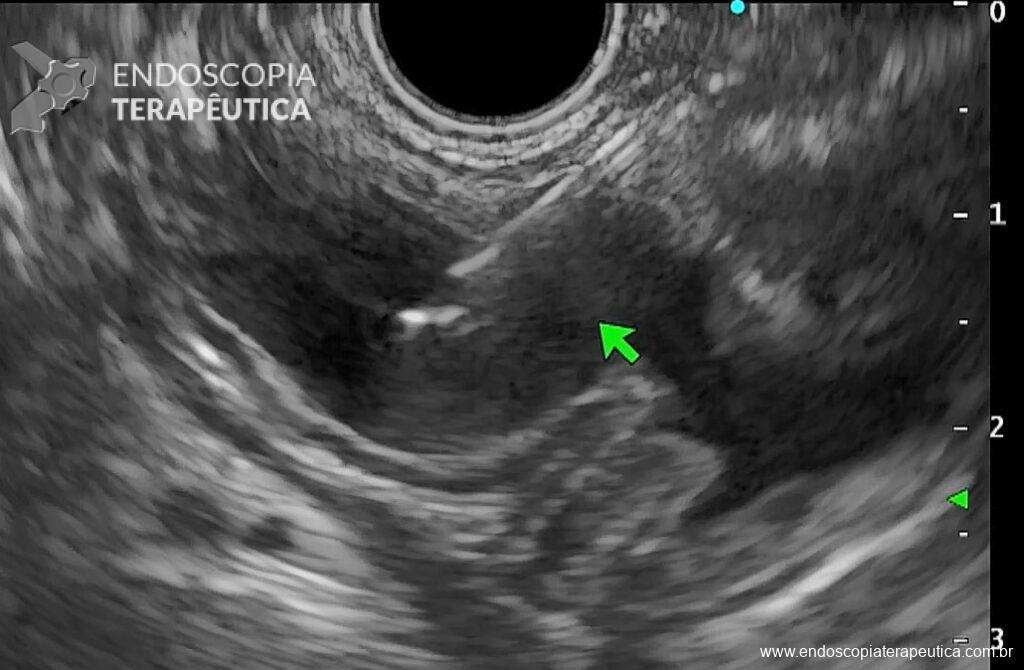
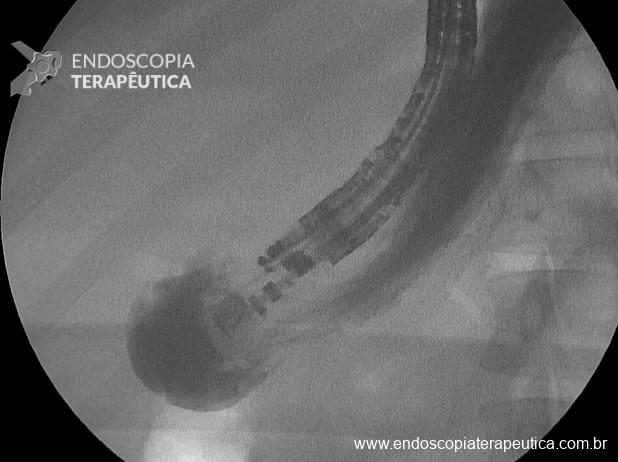
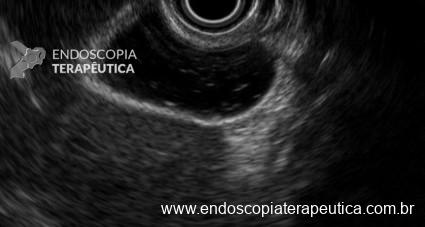
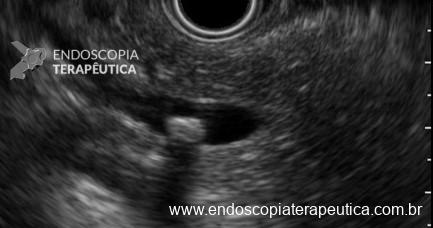
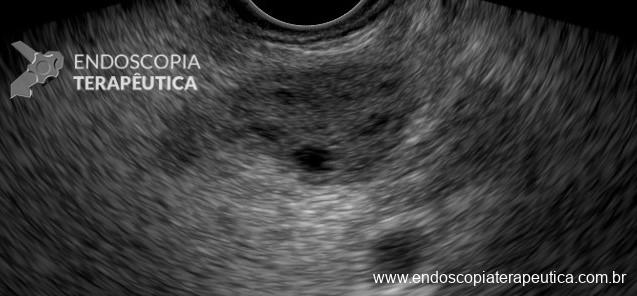
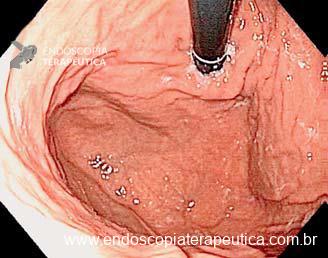
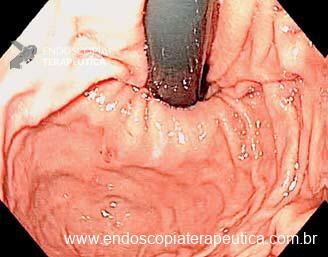
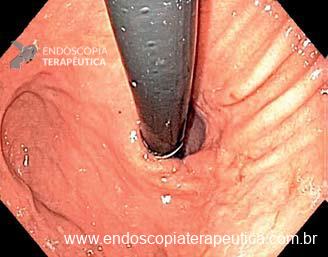
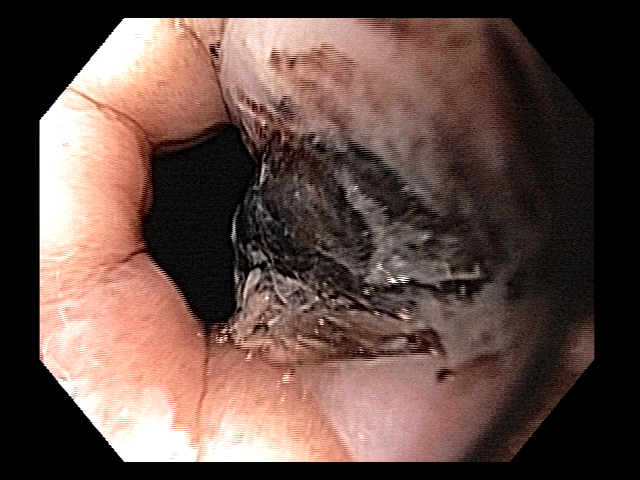
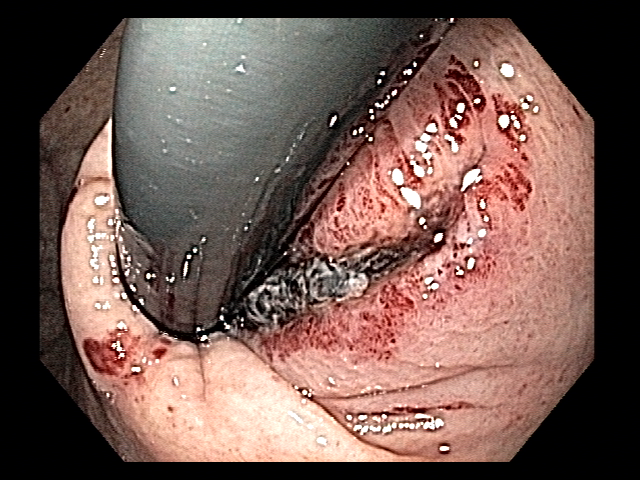
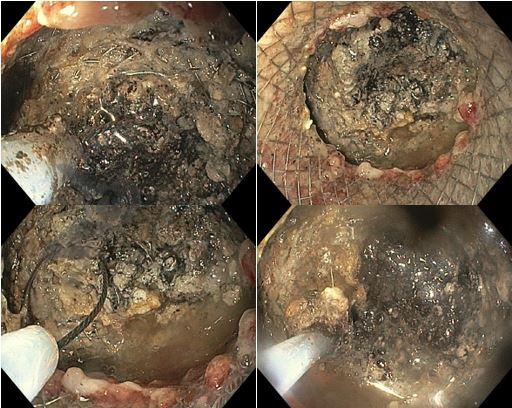
Os LAMS estão sendo cada vez mais preferidos em relação aos stents plásticos (duplo pigtail) para pacientes submetidos à drenagem ecoguiada de coleções fluidas pancreáticas (PFC) por possuírem implantação tecnicamente fácil e amplo lúmen que facilita o rápido escoamento do conteúdo do cisto, no entanto, foram relatados eventos adversos tardios, como sangramento, migração e sepultamento do stent. A maioria dos estudos que descreve tais complicações não foi prospectiva e as definições utilizadas não foram uniformes, o que limita a padronização dos eventos adversos relacionados aos LAMS. Clique aqui para rever a Classificação de Atlanta para coleções fluidas peripancreáticas.
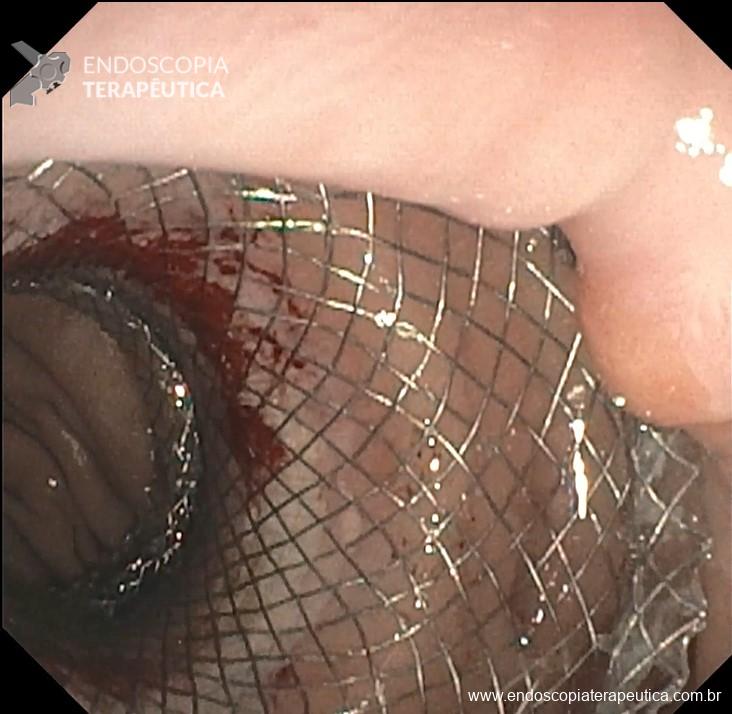
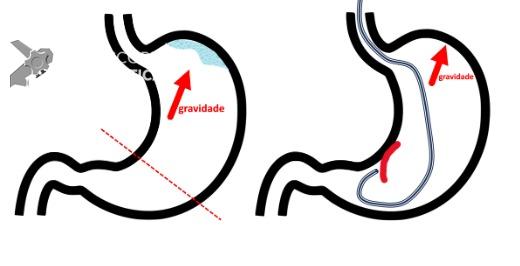
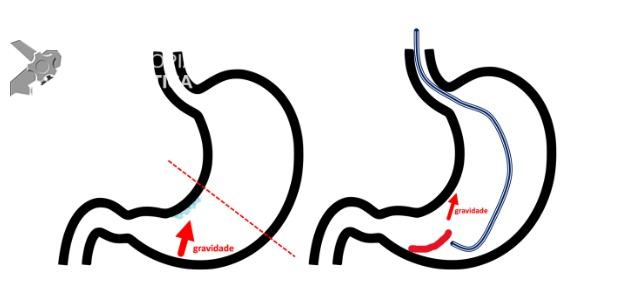
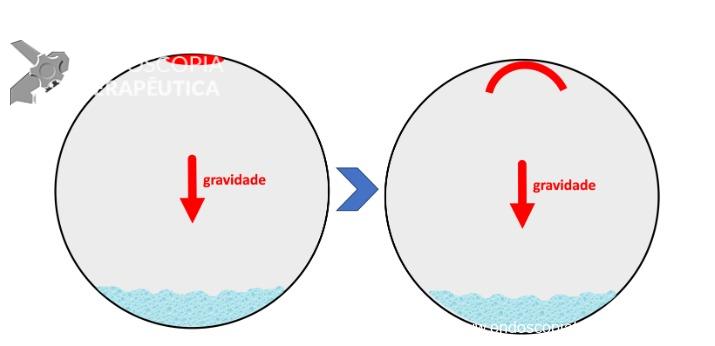
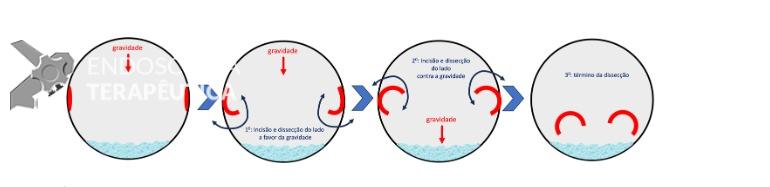
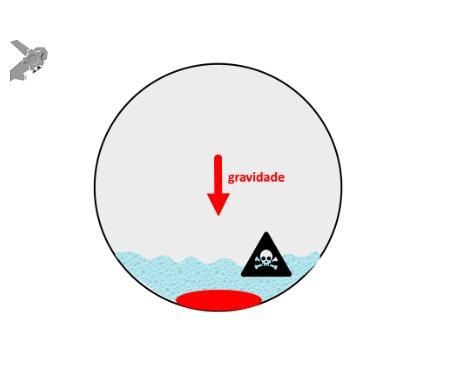
Uma auditoria de um ensaio clínico randomizado comparando a eficácia dos LAMS com stents plásticos de duplo pigtail relatou uma taxa inesperadamente alta de sangramento grave. O estudo observou que 10 de 31 pacientes (32,2%) no braço de tratamento LAMS tiveram complicações, incluindo três episódios de sangramento tardio começando três semanas após a colocação do stent. 1 O protocolo do estudo foi alterado e foi postulado que os stents plásticos tendem a gravitar em direção ao lúmen paulatinamente enquanto os LAMS poderiam ocasionar um rápido colapso da cavidade, resultando no risco de contato entre os vasos retroperitoneais e a flange distal do stent. O atrito prolongado poderia gerar erosão e ruptura dos vasos, causando sangramento agudo grave. Considerando essa hipótese, o tempo de permanência do stent além de 4 semanas foi relatado como um preditor de sangramento tardio e formou-se consenso para remoção do mesmo antes deste prazo na prática clínica. Todavia, essa recomendação é baseada principalmente em dados de uma coorte de centro único, limitando a generalização dos resultados. 1, 2
Um estudo de coorte prospectivo com revisão sistemática sobre eventos hemorrágicos após a colocação de LAMS compilou 21 estudos envolvendo 1.378 pacientes com uma taxa de sangramento de 3,8% (52/1378), dos quais 46,2% (24/52) ocorreram na primeira semana após a colocação de LAMS. A conclusão após análise dos casos publicados foi de que o risco de sangramento estaria relacionado a fatores inerentes ao próprio procedimento ao invés do tempo de permanência do stent, inferindo que um protocolo de remoção precoce dos LAMS para PFC é eficaz em prevenir tal desfecho. 3
Em 2022 foi publicada a análise retrospectiva do maior banco de dados multicêntrico (1.018 pacientes) existente sobre o uso de LAMS para drenagem de PFC (18 unidades do Reino Unido e Irlanda), aumentando o conhecimento neste cenário. Nenhum dos fatores analisados, como tipo (WON versus pseudocisto), tamanho da coleção (≤10 cm versus >10 cm) ou tempo de remoção do stent (≤4 semanas versus 4–8 semanas versus >8 semanas), mostrou correlação com eventos adversos tardios. Esses resultados fornecem mais evidências indiretas para manutenção da LAMS in situ além de 4 semanas, caso necessário clinicamente. 4
Para mais informações de manejo pós-drenagem ecoguiada de coleções peripancreáticas: clique aqui.
O uso de LAMS para o manejo das PFC tem excelentes taxas de sucesso técnico e clínico, no entanto, o índice de eventos adversos não é desprezível e deve ser cuidadosamente considerado antes das drenagens, em particular para WON. A prorrogação da sua permanência às vezes é necessária em pacientes com necrose pancreática extensa que obtém melhora clínica discreta ao cabo de 4 semanas. Até que haja mais estudos prospectivos para elucidarem este dilema, as descobertas de um grande conjunto de dados da vida real (banco de dados multicêntrico) acrescentam-se à literatura existente sobre o manejo dos LAMS para a drenagem de PFC e apoiam seu uso estendido em pacientes onde clinicamente indicado, desde que haja supervisão estreita.
Referências
- Bang JY, Navaneethan U, Hasan MK, et al. Non-superiority of lumen-apposing metal stents over plastic stents for drainage of walled-off necrosis in a randomised trial. Gut. 2018;68:1200–1209.
- Bang JY, Hasan M, Navaneethan U, et al. Lumen-apposing metal stents (LAMS) for pancreatic fluid collection (PFC) drainage: may not be business as usual. Gut. 2017;66(12):2054–2056.
- Waseem Ahmad, Syed A. Fehmi, Thomas J. Savides, Gobind Anand, Michael A. Chang, Wilson T. Kwong. Protocol of early lumen apposing metal stent removal for pseudocysts and walled off necrosis avoids bleeding complications. Scand J Gastroenterol. 2020 Feb;55(2):242-247.
- Manu Nayar , John S Leeds , UK & Ireland LAMS Colloborative, Kofi Oppong. Lumen-apposing metal stents for drainage of pancreatic fluid collections: does timing of removal matter? Gut 2022;71:850–853.
Como citar este artigo
Ribeiro MSL. Stents de aposição de lúmen nas drenagens de coleções fluidas pancreáticas e risco de sangramento – onde estamos? Endoscopia Terapeutica 2024 vol II. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/stents-de-aposicao-de-lumen-nas-drenagens-de-colecoes-fluidas-pancreaticas-e-risco-de-sangramento-onde-estamos/