Deparamo-nos frequentemente com essa situação. Será que você acerta essa questão?
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
Paciente 18 anos previamente hígido com quadro de dor epigástrica intensa há 2 meses associado à dor para engolir, náuseas e 3 episódios de vômitos na última semana. Em uso de omeprazol 40 mg/d, bromoprida 30 mg/d com pouca melhora. Nega uso de AINEs. Relata ainda diarreia com cerca de 8 episódios ao dia com muco, sem sangue. Refere perda de 8 kg em 2 meses.
Exames laboratoriais: Hb: 9,3/Hto:36%/ PCR: 29,8/Ferro:34/ Sat ferro:14%
Tomografia de abdome com contraste: normal.
Solicitadas EDA e colonoscopia que seguem abaixo.
EDA: Notam-se úlceras ovaladas a 30 cm da ADS, algumas confluentes, medindo até 20 mm, bordas pouco delimitadas, localizadas em parede lateral direita. Estômago e duodeno sem alterações.
Anatomopatológico: Esofagite crônica ulcerada. Imunohistoquimica negativa para herpes e CMV.
Colonoscopia: Íleo terminal normal. Presença de úlceras longitudinais e serpiginosas em todo o cólon, intercaladas por segmentos de mucosa normal. Aspecto sugestivo de doença de Crohn em atividade – SES CD : 25.
Anatomopatológico: Colite crônica intensa ulcerada. Imunohistoquímica negativa para CMV e herpes.
Diante dos tais achados, a hipótese diagnóstica mais provável é Doença de Crohn com acometimento colônico e do trato gastrintestinal superior.
Realizado tratamento medicamentoso com azatioprina 100 mg/d e infliximabe com boa resposta. Após 6 meses, apresentou remissão clínica e endoscópica.
A doença de Crohn é uma doença inflamatória crônica que pode afetar qualquer parte do trato gastrintestinal. O envolvimento esofágico da doença de Crohn é raro, com prevalência de 6,8% no adulto e até 16% na população pediátrica.
Os sintomas são leves e inespecíficos. O envolvimento do trato gastrointestinal superior confere um fenótipo da doença mais grave com maior chance de complicações, tais como obstrução ou perfuração.
O diagnóstico se dá pela endoscopia digestiva alta (EDA), com realização de biópsias. As lesões são mais frequentes no terço distal do esôfago. Podemos observar enantema, erosões, úlceras aftoides, enquanto os quadros mais avançados podem evidenciar aparência de cobblestone, estenoses e até fístulas.
A presença de granuloma pode ser vista em até 40% dos casos. A histologia pode evidenciar as “squiggle cells” (células em rabisco), que são adensamentos de linfócitos intraepiteliais e que podem ser vistas em outras condições, tais como doença celíaca e DRGE.
Deve-se fazer diagnóstico diferencial, principalmente com etiologia péptica, medicamentosa, virais (CMV e herpes) e até neoplásicas.
Alguns pesquisadores propõem critérios diagnósticos para acometimento proximal da doença de Crohn:
OU
O tratamento clínico consiste no uso de imunossupressores e/ou terapia biológica. O tratamento endoscópico (dilatação ou próteses) se restringe às formas complicadas ou falhadas ao tratamento medicamentoso. A dilatação esofágica endoscópica com balão é efetiva nas estenoses fibróticas em até 80% dos casos, apesar de riscos de perfuração (0,1 a 0,4%). O tratamento cirúrgico é indicado para correção de fístulas e estenoses longas.
Carlos A. Doença de Crohn com acometimento esofágico. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/casosclinicos/doenca-de-crohn-com-acometimento-esofagico/
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
O teste de urease ou teste rápido de urease (RUT) é um teste rápido, barato e simples, muito usado no exame de endoscopia para verificar a presença da bactéria Helicobacter pylori. Na verdade, o uteste detecta a presença da enzima urease na amostra da mucosa gástrica. Portanto, o teste da urease é um teste indireto da presença de H. pylori (HP).
Apesar de ser um teste simples, e o mais popular para fazer o diagnóstico da infecção pelo HP, não deixa de ser um teste invasivo, visto que requer exame de endoscopia para obtenção de um fragmento da mucosa gástrica.
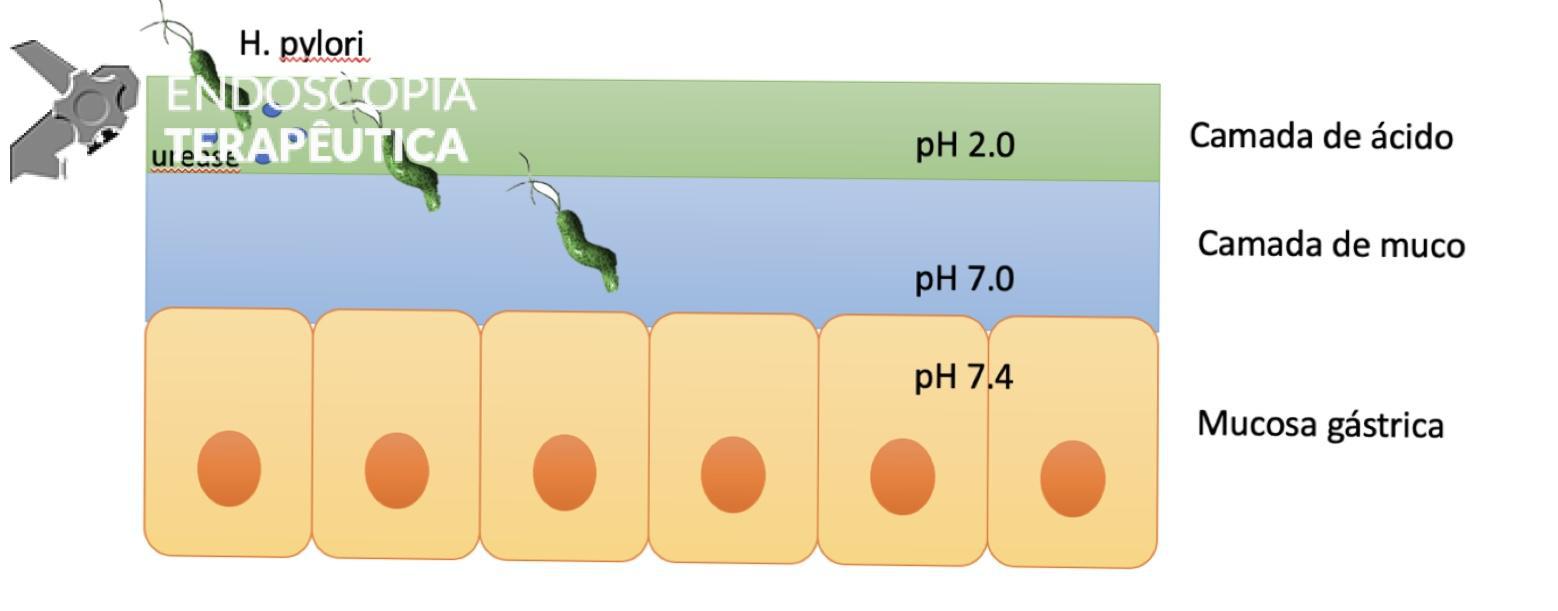
Figura 2: urease produzida pelo H pylori provoca hidrolise da ureia em amônia e CO2, alcalinizando a camada de ácido do estômago e permitindo que o HP sobreviva e atinja o epitélio da mucosa gástrica
O fragmento de mucosa gástrica é colocado em um tubo ou gel contendo ureia e um indicador de pH (vermelho de fenol). O pH desta solução é de 5,9.
Se a urease produzida pelo Helicobacter pylori estiver presente no fragmento, ocorrerá hidrólise da ureia formando amônia. A amônia alcaliniza o meio, promovendo a mudança de cor do amarelo para o rosa.
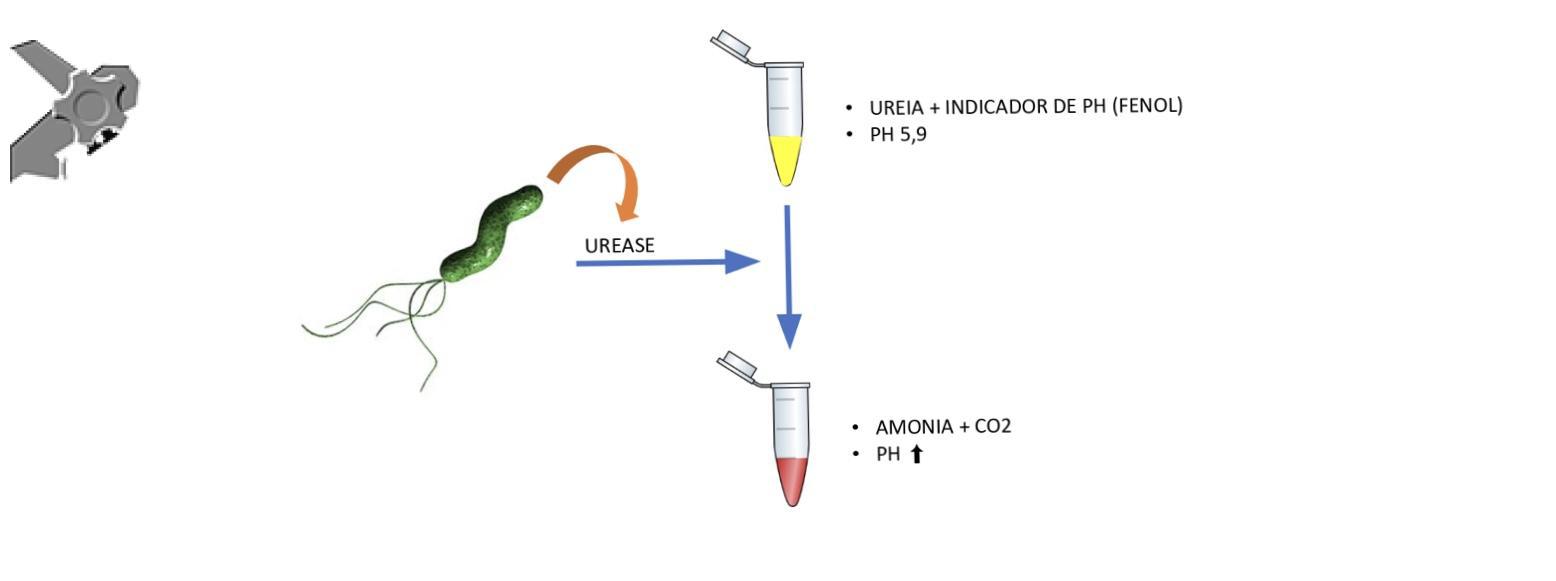
Figura 3: esquema sumarizando como funciona o teste de urease
Obs.: outros testes usaram indicadores diferentes, cada um com uma vantagem potencial. Como exemplo, alguns testes iniciam a reação com um pH mais baixo (pH 5,4), visto que a atividade da urease do H. pylori é mais eficiente nesse pH mais baixo em comparação com outras bactérias, o que poderia diminuir o falso positivo (que, no entanto, é bem raro).
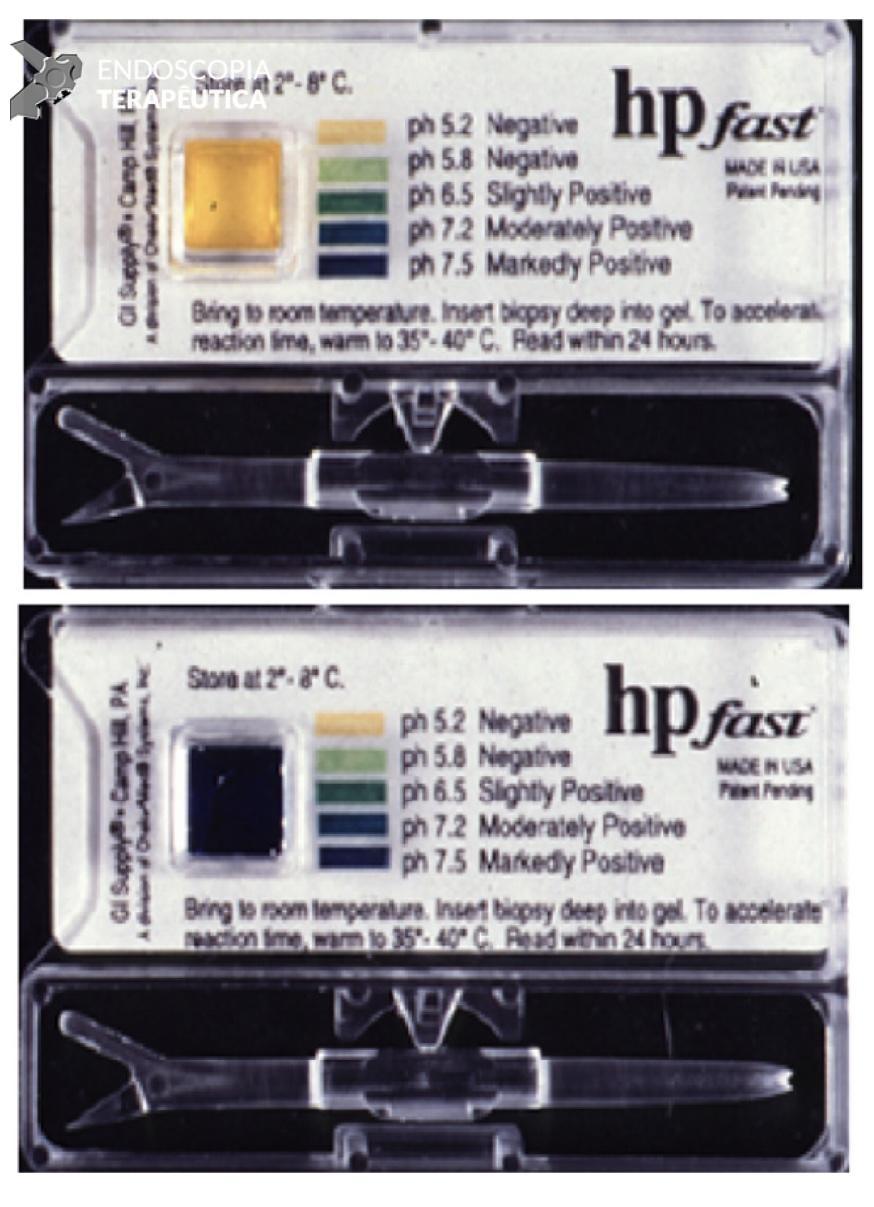
Figura 5: O teste hpfast inicia a reação em um pH mais baixo, diminuindo o falso positivo da urease produzia por outras bactérias como Proteus ou Pseudomonas.
O tempo em que o teste fica positivo depende da concentração de bactérias e da temperatura.
A maioria dos testes ficará positivo dentro de 2-3 horas, mas recomenda-se guardar os testes negativos por 24 horas para a tomada de decisão.
Resultados positivos após 24 horas são, na maioria das vezes, falsos positivos e não deveriam ser usados para decisões de tratamento.
A sensibilidade do teste de urease varia entre 80% e 100% e especificidade entre 97% e 99%.
Estima-se que seja necessário aproximadamente 105 H. pylori na amostra de biópsia para alterar a cor do teste, o que geralmente não é um problema, pois a concentração de H. pylori normalmente excede esse mínimo.
Importante ressaltar que a biópsia deve ser coletada de um local onde os organismos estão presentes:
Um estudo comparou os resultados de uma biópsia realizada na incisura angularis, uma na região pré-pilórica e uma no corpo, apresentando sensibilidade de 100%, 87% e 84,4%, respectivamente, e nenhum falso positivo, ou seja, especificidade de 100% (Woo, 1996).
| No geral, para melhores resultados, recomenda-se a obtenção de dois fragmentos:
· um do antro (evitando áreas de ulceração e metaplasia intestinal óbvia) · um do corpo |
Além da atrofia gástrica, a sensibilidade do teste também pode diminuir em:
Alguns autores advogam que a contaminação da pinça de biópsia por formalina poderia diminuir a sensibilidade do teste. No entanto, um estudo comparou os resultados de 253 pacientes submetidos a duas coletas de teste: uma antes e uma após a imersão da pinça em formalina. No total, houve discordância em apenas 8 casos (3%) e os autores concluem que a pré-imersão da pinça em formalina não interfere com a sensibilidade do teste (Castelotte J, 2001).
Falsos positivos são raros e, quando presentes, podem ser devido à presença de outros organismos contendo urease, como Proteus mirabilis, Citrobactor freundii, Klebsiella pneumonia, Enterobactor cloacae e Staphylococcus aureus.
Contudo, a menos que o paciente tenha acloridria ou hipocloridria, a presença desses organismos em concentração suficiente para produzir um resultado positivo é pouco provável.
Após 24 horas, aumenta-se a chance de falso positivo pela presença de outros organismos contendo urease.
Obs: UREIA é uma paroxítona com ditongo aberto e, portanto, não é acentuada.Para saber mais sobre a nova ortografia aplicada aos termos endoscópicos, confiraclicando aqui !
Martins B. Teste de urease. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/teste-de-urease/
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
As primeiras diretrizes diagnósticas sobre Esofagite Eosinofílica (EEo) foram publicadas em 2007 e atualizadas em 2011. Ela foi definida como uma condição clínico-patológica imuno-mediada, caracterizada por:
Nessa época, EEo e DRGE eram consideradas mutuamente excludentes, e havia um consenso entre especialistas determinando que a melhor abordagem para descartar inflamação relacionada à doença do refluxo gastroesofágico (DRGE) seria com uso de inibidor de bomba de prótons (IBP) em altas doses por 8 semanas ou através do monitoramento de pH (pHmetria).
Durante a década seguinte, experiências clínicas adicionais e pesquisas forneceram novos insights sobre a resposta aos IBP’s. Vários investigadores observaram que uma grande proporção de pacientes com sintomas e eosinofilia esofágica (≥15 eos/cga) respondeu ao tratamento com IBP em alta dose, mas não tinha apresentação clínica consistente com DRGE. Por causa disso, as diretrizes diagnósticas publicadas em 2011, 2013 e 2014 definiram uma nova condição denominada Eosinofilia Esofágica Responsiva ao IBP (PPI-REE). Pacientes com PPI-REE tinham sintomas de disfunção esofágica e ≥15 eos/cga na biópsia, mas obtiveram melhora ou resolução dos sintomas e da eosinofilia após um ciclo de IBP em altas doses. Nessas diretrizes, a PPI-REE não foi bem compreendida, mas EEo e DRGE ainda eram consideradas duas condições distintas.
No entanto, uma gama de pesquisas em andamento sugeriu que EEo e DRGE não eram necessariamente condições excludentes e, em vez disso, compartilhavam uma relação complexa (elas podem coexistir):
Além disso, uma série de estudos examinou as características clínicas, endoscópicas e histológicas iniciais (antes do ciclo de IBP) da EEo e PPI-REE, não encontrando fatores conclusivos que pudessem distinguir as duas.
Condições atópicas concomitantes eram comuns em EEo e PPI-REE, fatores alérgicos e inflamatórios foram encontrados elevados em ambos, e os perfis de expressão de RNA foram muito semelhantes entre as duas condições (e distintas da DRGE), com normalização após tratamento com esteróides tópicos ou restrição dietética, embora existissem algumas diferenças. Finalmente, vários mecanismos não-ácido mediados potenciais foram descritos que poderiam explicar a resposta ao IBP na PPI-REE.
Assim, PPI-REE emergiu como um subtipo de EEo em alguns pacientes, e uma controvérsia se desenvolveu sobre se EEo e PPI-REE eram de fato a mesma condição; se PPI-REE era uma doença associada a alergia alimentar; se os IBP’s devem ser considerados tratamento na EEo; e se o ciclo de IBP deve ser removido da diretriz de diagnóstico. No entanto, tomados em conjunto, esses novos avanços de pesquisa forneceram uma forte justificativa para a consideração da remoção do ciclo de IBP do algoritmo de diagnóstico da EEo.
A favor da manutenção do ciclo de IBP nos critérios diagnósticos pesavam o potencial em reduzir o número de endoscopias necessárias, a ajuda em tratar a DRGE concomitante e fornecer uma abordagem em etapas para o diagnóstico de EEo. A favor da eliminação do ciclo de IBP pesavam permitir a capacidade de discutir uma gama de terapias (por exemplo, algumas usadas para EEo clássica) sem comprometer os pacientes com um IBP desde o início, ajudar a conseguir um recrutamento mais amplo em ensaios clínicos e permitir o tratamento da eosinofilia esofágica com IBP independentemente da causa subjacente, removendo a resposta à medicação como critério diagnóstico.
Uma nova diretriz europeia sobre EEo publicada em 2017 sugeriu que PPI-REE e EEo estavam no mesmo espectro, e que os IBP’s poderiam ser considerados um tratamento primário.
| Critérios Diagnósticos de Esofagite Eosinofílica |
Sintomas de disfunção esofágica
|
EoE
|
Brasil G. Esofagite Eosinofílica: Critérios Diagnósticos. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/esofagite-eosinofilica-criterios-diagnosticos/
Fístula gastropancreática secundária a neoplasia intraductal mucinosa papilar pancreática – achados de endoscopia digestiva alta e de ultrassom endoscópico.
A neoplasia intraductal mucinosa papilar (NIMP) pancreática é uma neoplasia epitelial, que se caracteriza por proliferação papilar e dilatação do ducto pancreático principal, com consequente formação de cisto[i]. As NIMPs são classificadas como tipo ducto pancreático principal (DP), tipo ducto pancreático secundário (DS), ou misto com base no envolvimento topográfico ductal do tumor. Sua identificação usualmente é feita por colangiopancreatoressonância magnética (ColangioRM), podendo ser confirmada pelo ultrassom endoscópico (USE) com ou sem punção ecoguiada, cujo principal achado é a confirmação de comunicação ductal, corroborado pela presença de células mucinosas. Seu tratamento baseia-se nos fatores de risco (sintomas clínicos, achados de imagem) pelo fato da NIMP progredir para carcinoma de forma infrequente e muitos pacientes serem assintomáticos. Atualmente, as recomendações de sociedade sugerem acompanhamento de 2 a 3 anos para cistos < 1 cm; anual de cistos (1 e 2 cm) por um período total de 2 anos e de 3-6 meses para cistos > 2 cm. Qualquer paciente ictérico ou com história de pancreatite aguda é candidato à cirurgia com base na localização do cisto e na extensão do envolvimento do DP[ii]. A NIMP pode apresentar-se como uma variável fistulizante, usualmente para o duodeno. Os autores apresentam um caso de formação espontânea de fístula gastropancreática secundária a uma NMIP tipo misto detectada e avaliada por endoscopia digestiva alta e ecoendoscopia.
Paciente do sexo feminino, 68 anos, procurou o serviço de gastroenterologia do CHC-UFPR em maio 2018 com queixa de plenitude pós-prandial e desconforto abdominal. Solicitados exames diagnósticos de rotina, em que um US mostrou lesão solido-cística pancreática a esclarecer. Um exame de ColangioRM mostrou dilatação e irregularidade ductal a esclarecer, tendo como hipóteses diagnósticas NMIP do tipo misto ou pancreatite crônica calcificante (FIGURA 1). Foi submetida a ecoendoscopia e endoscopia digestiva alta o qual evidenciou NIMP com fistulização para o estômago e acentuada dilatação ductal pancreática com vegetações em seu interior (FIGURAS 2, 3 e 4). Foi possível adentrarmos no trajeto fistuloso para obteção de biópsias das vegetações.
A biópsia endoscópica confirmou NIMP do tipo misto padrão intestinal (FIGURA 5) e, conforme os critérios de Fukuoka 2016 (sintomas, acentuada dilatação ductal) acometimento de toda a glândula pancreática e o elevado risco de malignidade, foi decidido por pancreatectomia total como opção para tratamento curativo. Durante o ato cirúrgico, não foi possível a dissecção da cabeça pancreática devido a aderências em grandes vasos. Foi optado então por pancreatectomia corpo-caudal, cuja congelação de margem evidenciou lesão papilar ductal sem displasia. O procedimento foi associado a gastrectomia parcial e esplenectomia. A paciente apresentou evolução pós-operatória favorável, recebendo alta 10 dias pós-procedimento. O anatomopatológico evidenciou neoplasia mucinosa intraductal papilífera com displasia de alto grau, sem foco de neoplasia invasora, com acometimento ductal extenso e margem proximal positiva para presença de epitélio papilar sem displasia. Seis meses após o procedimento, a paciente retorna ao hospital por diarreia e desnutrição, a qual foi manejada com orientações dietéticas e revisão da reposição de enzimas pancreáticas. Um mês após, a paciente é reinternada com quadro de sepse sem origem determinada, evoluindo a óbito em 3 dias a despeito de medidas suportivas e uso de antibiótico de largo espectro.
FIGURA 1 – Colangioressonância – acentuada dilatação e tortuosidade do ducto pancreático principal (flechas verdes) com sinais de comunicação fistulosa com o estômago ao nível do corpo pancreático (flecha azul).
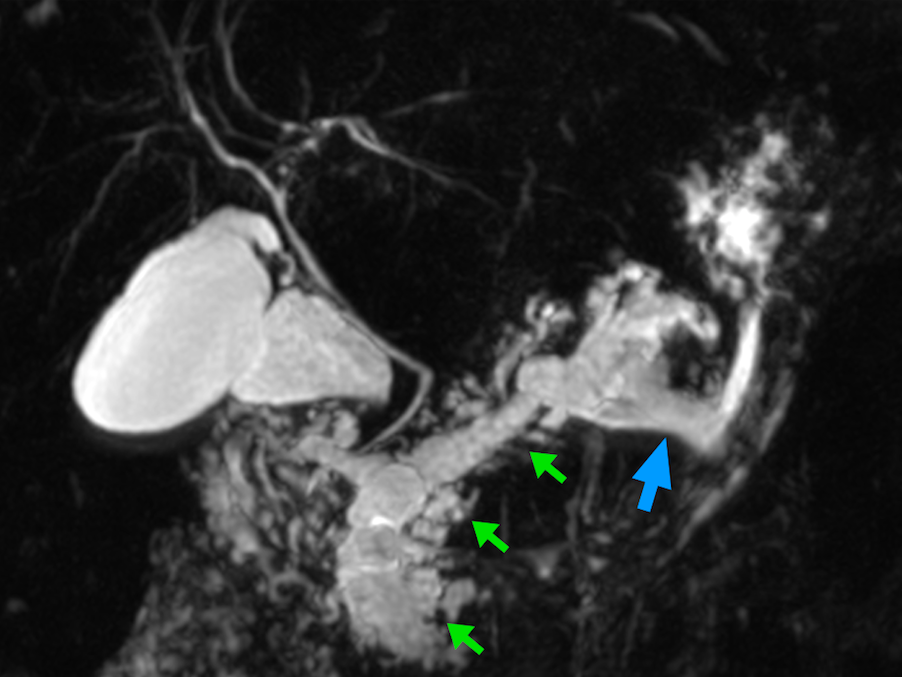
FIGURA 2 – Achado ecoendoscópico – presença de vegetação intraductal doppler-positivo dentro do ducto pancreático principal (este dilatado), confirmando tratar-se de NIMP tipo misto.
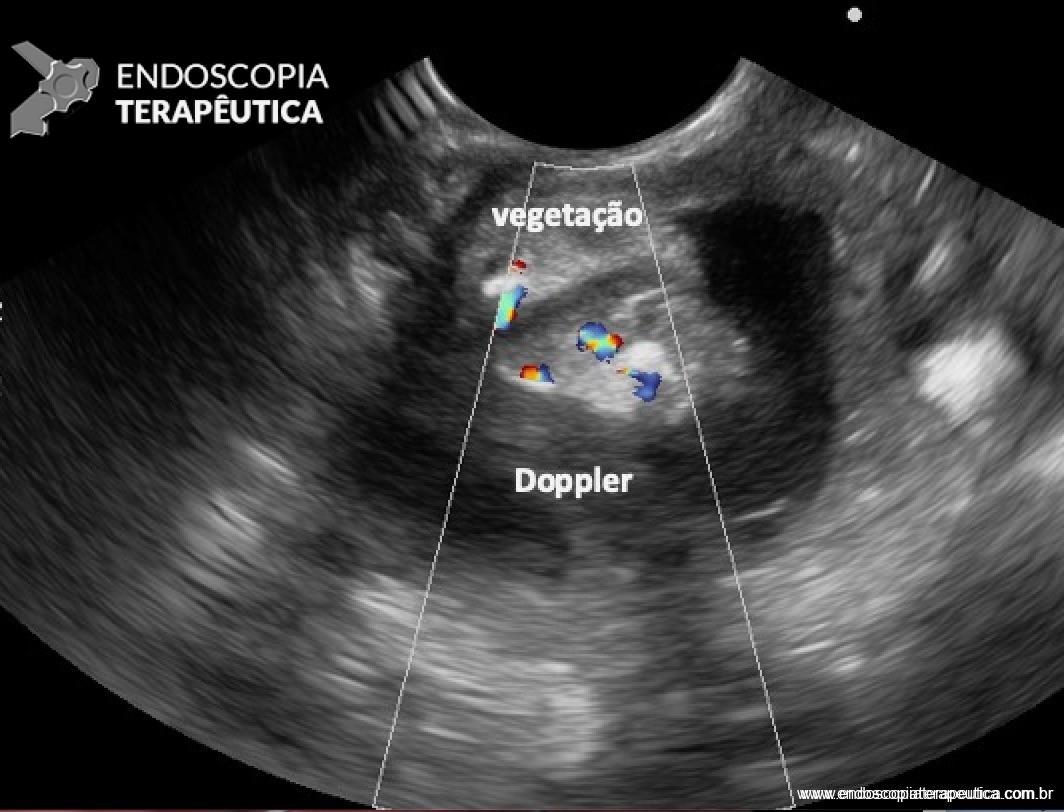
FIGURA 3 – Achado endoscópico – presença de uma gota de muco junto à parede posterior do estômago, confirmando tratar-se de uma neoplasia mucinosa.
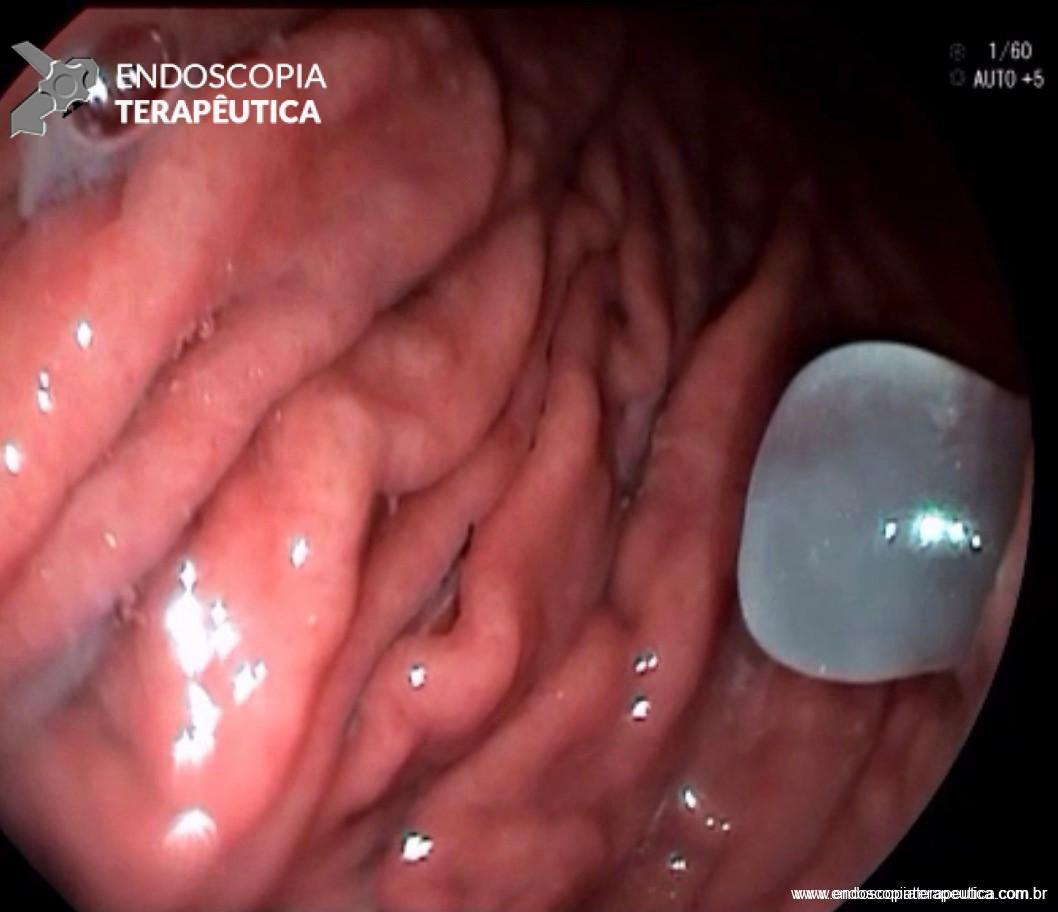
FIGURA 4 – Achado endoscópico – após adentrado no orifício fistuloso, nota-se a parede do ducto pancreático principal (ao fundo) e uma vegetação (à direita).
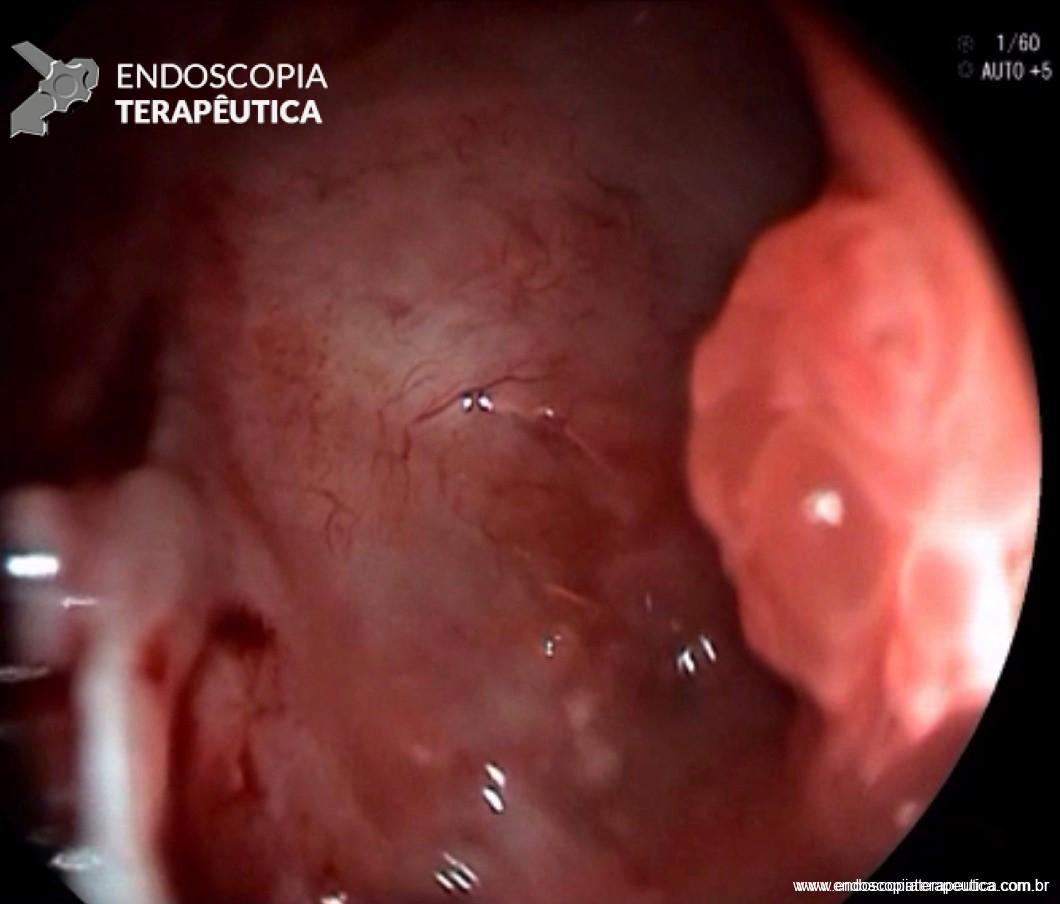
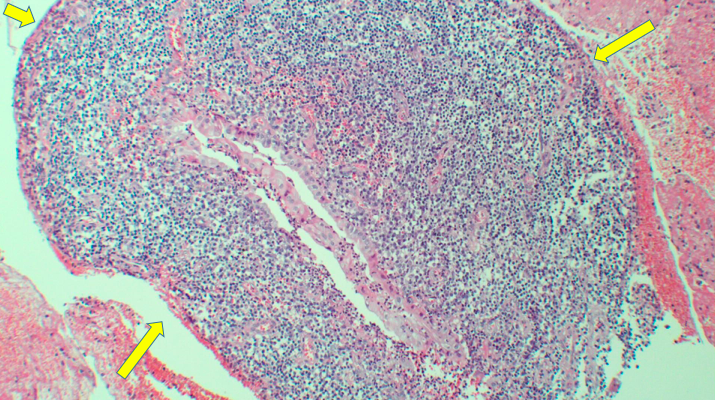
FIGURA 5 – Fotomicrografia demonstrando projeção papilar e epitélio tipo intestinal (flechas amarelas). Hematoxilina-eosina 40x.
A NIMP pode apresentar como complicação durante seu seguimento a formação de fístula espontânea em órgãos adjacentes em até 6% dos casos[i], ou mesmo, muito raramente, ruptura em peritônio livre[ii]. A presença de uma fístula é usualmente identificada por exames de imagem não invasivos, tais como a TC de abdômen e a ColangioRM, pois permitem a identificação anatômica da fístula. Tais achados podem ser confirmados por ultrassom endoscópico.
As fístulas podem ser múltiplas, ocorrendo em qualquer dos tipos de NIMP (DP, DS ou misto) [iii]. O tipo de fístula pode variar em comportamento como sendo invasor (tipo penetrante) devido à infiltração por neoplasia avançada ou por compressão local e isquemia da parede do tubo digestivo (tipo mecânico), este usualmente não associado à malignidade e responsável por até cerca de 2/3 dos casos de NIMP fistulizante (4). Dentre os sítios descritos, a NIMP pode fistulizar para o duodeno (65%), seguido de colédoco (11%), estômago (19%) e cólon (3%)[iv]. Dentre as fístulas para o estômago, identificamos na literatura um total de 5 casos publicados e 2 séries de casos.
Embora o achado de fístula sugira agressividade, nos casos em que ocorre compressão (tipo mecânico), a sua presença não está necessariamente associada à neoplasia invasiva. De fato, o tipo histológico usual nas fístulas é o intestinal6, considerado de baixa agressividade dentre os quatro tipos histológicos de NIMP descritos na literatura. No presente caso, a paciente apresentava tipo histológico intestinal com foco de displasia de alto grau, sem sinais de neoplasia invasora. Entretanto, o acometimento ductal desses pacientes tende a ser difuso por toda a extensão do pâncreas. Isso determina um dilema terapêutico para pacientes com alto risco cirúrgico e idosos, uma vez que a cirurgia com potencial de cura seria a pancreatectomia total, um procedimento de elevado risco e morbidade pré e pós-operatória. Clinicamente, a presença de fístula em si não representa uma situação de risco para o paciente. A fistulização, em verdade, pode promover descompressão ductal pancreática[v] e melhora dos sintomas[vi], restando apenas o componente secretor da doença, que teoricamente poderia espoliar o paciente por perda proteica. No presente estudo, a paciente referia-se à dor abdominal crônica, provavelmente decorrente de pancreatite crônica adjacente.
Em relação à conduta, no presente caso, optou-se, inicialmente, por pancreatectomia total, mas foi tecnicamente possível somente a realização de pancreatectomia corpo-caudal (aderências ao nível da cabeça pancreática) e gastrectomia parcial com remoção do componente fistuloso. A despeito de ter sido realizada uma cirurgia que poupou tecido pancreático, a paciente desenvolveu desnutrição grave em curto espaço de tempo de pós-operatório.
A fístula gastropancreática é considerada rara na literatura e suas consequências, a longo prazo; risco de neoplasia e o intervalo de seguimento não estão definidos7. No presente caso, o exame endoscópico e endossonográfico foram cruciais para o diagnóstico e, quanto ao tratamento, faz-se necessária uma avaliação do risco, ponderando-se as ressecções pancreáticas extensas, principalmente em pacientes idosos e de alto risco.
Eduardo Aimore Bonin1, Raquel Canzi Almada de Souza1, Renata Pereira Mueller1, Sergio Ossamu Ioshii1, José Celso Ardengh 2.
1- Complexo Hospital de Clínicas, Universidade Federal do Paraná, Curitiba, Brasil.
2- Hospital 9 de Julho, Setor de Endoscopia, São Paulo, SP, Brasil, Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (HCFMRP-USP). Endoscopia, Ribeirão Preto, SP, Brasil.
Aimore E., Canzi R., Pereira R., Ossamu S. e Celso J. Casos Clínicos: Fístula gastropancreática secundária a neoplasia intraductal mucinosa papilar pancreática. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/casosclinicos/fistula-gastropancreatica-secundaria-neoplasia-intraductal-mucinosa-papilar-pancreatica-achados-de-endoscopia-digestiva-alta-e-de-ultrassom-endoscopico/
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
[i] Kobayashi G., Fujita N., Noda Y., Ito K., Horaguchi J., Obana T. Intraductal papillary mucinous neoplasms of the pancreas showing fistula formation into other organs. J Gastroenterol. 2010;45(October, 10):1080–1089.
[ii] Mizuta Y, Akazawa Y, Shiozawa K, Ohara H, Ohba K, Ohnita K, Isomoto H, Takeshima F, Omagari K, Tanaka K, Yasutake T, Nakagoe T, Shirono K, Kohno S. Pseudomyxoma peritonei accompanied by intraductal papillary mucinous neoplasm of the pancreas. Pancreatology. 2005; 5(4-5):470-4.
[iii] Ravaud S., Laurent V., Jausset F., Cannard L., Mandry D., Oliver A. CT and MR imaging features of fistulas from intraductal papillary mucinous neoplasm of the pancreas to adjacent organs: a retrospective study of 423 patients. Eur J Radiol. 2015;84(November, 11):2080–2088.
[iv] Ravaud S., Laurent V., Jausset F., Cannard L., Mandry D., Oliver A. CT and MR imaging features of fistulas from intraductal papillary mucinous neoplasm of the pancreas to adjacent organs: a retrospective study of 423 patients. Eur J Radiol. 2015;84(November, 11):2080–2088.
[v] Patel A,Allen A, Kuwahara J, Tracy Wadsworth T, Loeffler DM,Xie KL. Intraductal papillary mucinous neoplasm complicated by a gastropancreatic fistula Radiol Case Rep. 2019 Mar; 14(3): 320–323.
[vi] Gebran Khneizer,a,d Kavya M. Reddy,b Muhammad B. Hammami,c and Samer Alkaadeb Formation of Pancreatoduodenal Fistula in Intraductal Papillary Mucinous Neoplasm of the Pancreas Decreased the Frequency of Recurrent Pancreatitis. Gastroenterology Res. 2019 Feb; 12(1): 43–47.
VEJA TAMBÉM !
A coagulação por plasma de argônio (APC) é um procedimento eletrocirúrgico que combina uma corrente monopolar com o gás argônio para obter a coagulação. O gás é ionizado por meio de uma faísca de alta voltagem liberada na extremidade do cateter, aplicando, desse modo, o plasma de energia no tecido adjacente.
Após o efeito térmico, a superfície do tecido perde sua condutividade elétrica, e o feixe de plasma muda sua direção para um tecido condutor adjacente (não coagulado). Isso resulta em uma profundidade limitada de trauma local.
Quando a distância não é suficiente, não há transmissão elétrica pelo gás, pois a resistência ao fluxo de corrente elétrica é muito alta, e a ativação do pedal resulta apenas no fluxo de gás argônio inerte. Em geral, a distância ideal entre a sonda e o tecido varia de 2 a 8 mm.
O sistema para APC consiste em um gerador eletrocirúrgico, um pedal de ativação, um medidor de fluxo de gás de argônio preso ao cilindro de gás, sondas de distribuição flexíveis (cateter) e uma placa de aterramento.
Figura 1. Estação de trabalho VIO 300 D – ERBE (cortesia de Erbe do Brasil Ltda. – Barueri, SP, Brasil)
Os cateteres de APC são instrumentos flexíveis, capazes de fornecer, simultaneamente, o gás argônio e a corrente elétrica com a ativação de um único pedal. Essas sondas diferem de acordo com o seu diâmetro, comprimento e desenho da ponta.
Figura 2. Direção do fluxo de gás argônio (setas) depende da posição do desenho da ponta da sonda (A); efeitos das diferentes sondas (B) (cortesia de Erbe do Brasil Ltda. – Barueri, SP, Brasil)
Forced APC: energia elevada no tecido alvo, resultando em coagulação profunda e desvitalização efetiva. Apresenta uma potência fixa, forte efeito hemostático e aplicação contínua de energia.
Video 1. APC modo Forced (cortesia de Erbe do Brasil Ltda. – Barueri, SP, Brasil)
Pulsed APC: esse modo é baseado em ativação pulsada. Utilizado no tratamento de lesões superficiais grandes, situadas, principalmente, em estruturas de paredes finas e termossensíveis. Devido à saída de energia intermitente, o risco de perfuração é reduzido em comparação com aquele que utiliza um feixe de APC contínuo.
Utiliza duas frequências diferentes:
Efeito 1: 1 pulso/seg. Alta energia de saída por pulso.
Efeito 2: 16 pulsos/seg. Baixa energia de saída por pulso.
Aplicações:
Video 2. APC modo Pulsed (cortesia de Erbe do Brasil Ltda. – Barueri, SP, Brasil)
Precise APC: efeito de coagulação superficial por meio de uma saída de baixa energia por unidade de tempo, adequado em tecidos delicados. Possui controle de ajuste automático do plasma de argônio, ou seja, o efeito tissular é independente da distância (em até 5 mm).
Aplicações:
Video 3. APC modo Precise (cortesia de Erbe do Brasil Ltda. – Barueri, SP, Brasil)
Na Figura 3, demonstramos os diferentes efeitos tissulares e, na Figura 4, a sensibilidade térmica nos diferentes tecidos.
Figura 3. Efeitos dos diferentes modos de APC (cortesia de Erbe do Brasil Ltda. – Barueri, SP, Brasil)

Figura 4. Sensibilidade térmica nos diferentes tecidos

Fernandez J. Usos do Plasma de Argônio em endoscopia. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/plasma-de-argonio/
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
A terapia com vácuo endoscópico é uma opção para tratamento de fístulas pós-operatórias. Apresentamos, neste caso, uma alternativa de manejo para fístula de coto jejunal.
Paciente feminina, 42 anos, com gastrectomia total prévia por adenocarcinoma gástrico, com abdômen agudo obstrutivo devido à recidiva neoplásica. Submetida à colectomia esquerda de urgência. Evoluiu com sepse, necessitando reabordagem no terceiro dia pós-operatório, sendo visualizada fístula de coto jejunal (provável trauma por sonda nasogástrica).
Realizada rafia do coto, teste com azul de metileno e drenagem local para tratamento da fístula. Evoluiu com resposta inflamatória prolongada, sendo manejada com nutrição parenteral total até extubação. Após melhora clínica, reiniciada dieta, evidenciando-se persistência da fístula. Mantido jejum oral e suporte parenteral sem melhora aos testes sequenciais com azul de metileno oral. Após 35 dias de pós-operatório, sem melhora com tratamento cirúrgico e clínico, foi optado por confecção de curativo de pressão negativa para tratamento endoscópico.
Na endoscopia, observa-se coto jejunal terminal aberto, medindo, aproximadamente, 2 cm de diâmetro, com deiscência completa da rafia, processo inflamatório e fibrina em grande quantidade com dreno abdominal junto ao local da fístula.
Confeccionado curativo com sonda tipo trilumina, adaptando a sonda de aspiração com gases e adesivos, formando um “Y” para encaixar no coto jejunal e a sonda alimentar para seguir na via digestiva, mantendo alimentação enteral pós-fístula.
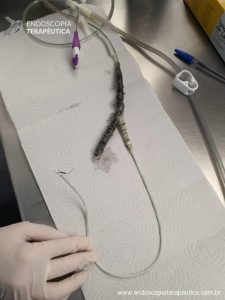
Sonda trilumina confeccionada.
Colocada sonda via nasal e posicionado o braço de aspiração, encaixado no coto jejunal, guiado por visão direta endoscópica, e mantido em aspiração contínua por dispositivo de pressão negativa VAC, com média de pressão de sucção de 125 mmHg.
Sonda posicionada no jejuno com dispositivo de sucção VAC, fotos abaixo:
Houve necessidade de troca da sonda no terceiro dia por falha de vácuo e posicionamento.
Realizada revisão endoscópica após 10 dias de sucção contínua. Observada redução significativa do orifício fistuloso e redução do processo inflamatório e fibrinopurulento local.
Devido à dificuldade de autorização de material pela saúde suplementar, e obstrução da sonda trilumina na via alimentar, adaptamos uma sonda de aspiração a vácuo confeccionada com sonda nasogástrica revestida com esponja e adesivo multiperfurado externo, sendo posicionada via nasal por visão endoscópica no coto jejunal e passagem de sonda enteral na outra narina, mantendo alimentação enteral pela alça alimentar.
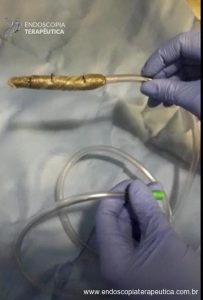
Sonda confeccionada manualmente.
Realizada nova revisão endoscópica 27 dias após início da terapia com vácuo endoscópico, com evidência de fechamento do lúmen fistuloso, realizado novo teste com azul de metileno sem extravasamento.
Após teste com azul de metileno negativo por 24 horas, foi retirado dreno abdominal, e paciente retomou alimentação oral, normalizando textura alimentar em 7 dias.
Neste caso, observamos que a sonda trilumina tem maior tolerabilidade pelo paciente, por ficar adaptada apenas em uma narina que realiza alimentação e sucção. Porém, o longo trajeto da sonda alimentar favorece obstrução e dobras no trato digestivo especialmente na região da anastomose, além dos entraves de custo e disponibilidade do material. Enquanto a sonda nasogástrica é de baixo custo, a confecção do curativo é facilmente executável e efetiva, porém causando maior desconforto no paciente pela necessidade de uso de ambas as narinas para sucção e alimentação simultâneas.
Durante o tratamento com vácuo endoscópico, observamos que, clinicamente, é bem tolerável, com pouca dor, porém houve sensação de engasgo e náuseas intensas nos primeiros dias da terapia, necessitando uso de amplictil para controle dos sintomas, além do trauma nasal pelo tempo prolongado e várias passagens de sonda via nasal.
A terapia com vácuo endoscópico pode ser eficaz por ser minimamente invasiva, permitindo a recuperação em menor tempo, podendo evitar reabordagem cirúrgica e até permitir tratamento a nível ambulatorial.
Wercka J. Tratamento a vácuo de fístula digestiva pós-operatória. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/casosclinicos/tratamento-vacuo-de-fistula-digestiva-pos-operatoria/
A técnica de Gastroplastia Endoscópica (ESG – Endoscopic Sleeve Gastroplasty) consiste na utilização de um dispositivo de sutura endoscópica (Apollo Overstitch) acoplado na extremidade de endoscópio de duplo canal para confecção de plicaturas na parede gástrica, tornando-o com aspecto tubulizado e, portanto, reduzindo seu volume.
As suturas podem ser realizadas em padrões distintos, iniciando-se em corpo distal, podendo ser restritas a corpo ou incluir parte do fórnix gástrico. A realização de suturas em antro não está indicada.
Imagem esquemática evidenciando o padrão de sutura em quadrado/retângulo (A) e padrão em “U” (B) para facilitar a compreensão, embora, na prática, as suturas sejam realizadas com uma distância maior entre si.
A população-alvo do procedimento é composta por pacientes que, apesar de serem obesos, não são candidatos à cirurgia bariátrica ou recusam o procedimento cirúrgico.
A perda de peso associada a ESG varia entre 16 e 19% do peso total e de 47 a 55% do excesso de peso após um ano do procedimento, de acordo com as maiores séries publicadas.
As principais complicações do procedimento estão associadas à dor ou vômitos que necessitem de prolongamento do internamento hospitalar, sangramento e coleções perigástricas (relato de tratamento conservador e laparoscopia).
Revisão sistemática e meta-análise publicada no ano passado abrangeu oito estudos, no período entre 2016 e 2019, envolvendo 1772 pacientes submetidos a ESG:
Estudo prospectivo realizado no Brasil envolvendo 233 casos de ESG, todos utilizando mesmo padrão de sutura (em U), encontrou valores semelhantes em relação à perda de peso total após 6 meses (17,1%) e um ano (19,7%).
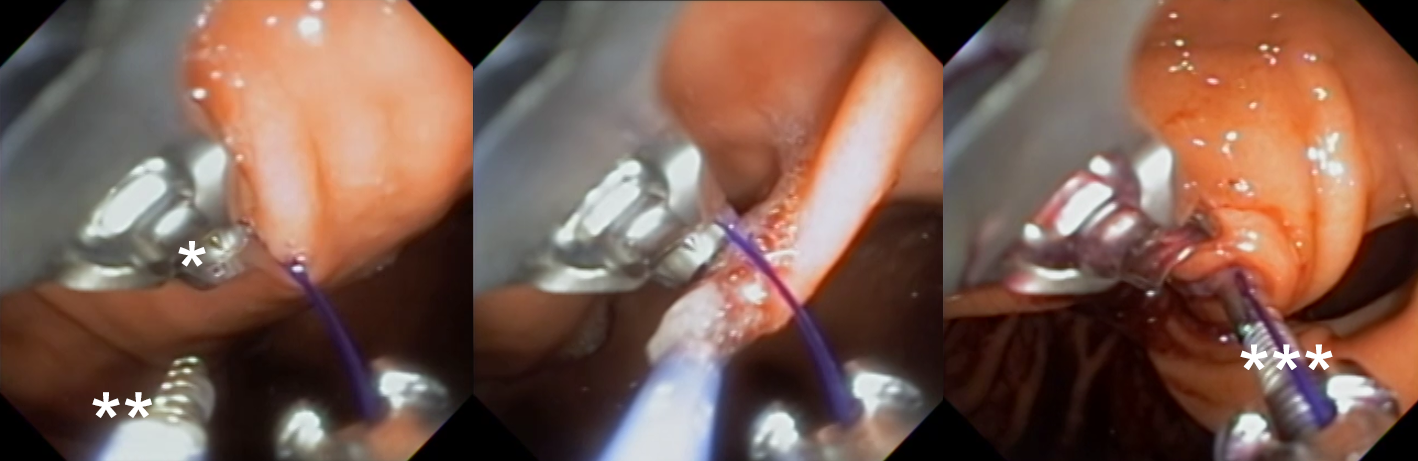
Etapas para realização da sutura: Com o fio já posicionado no porta agulha(*), é realizado o posicionamento da hélice/helix (**) na região desejada. Tração da helix trazendo o tecido para dentro do dispositivo de sutura. Na última imagem, liberação do fio(***).
O Brasil é um dos principais expoentes no campo da cirurgia e endoscopia bariátrica e, recentemente, publicou o Consenso Brasileiro sobre ESG, envolvendo 1828 procedimentos realizados por 47 endoscopistas.
Foi relatado pelo grupo taxa de eventos adversos maiores de 0,8% (15 casos), principalmente por sangramento manejados por tratamento conservador ou endoscópico. Dentre as outras causas de eventos adversos foram citados dor abdominal por persistência de pneumoperitônio (3 casos), vômitos persistentes (1 caso), insuficiência respiratória sem necessidade de ventilação mecânica, no pós-operatório imediato (1 caso, paciente com DPOC), e três casos que necessitaram de intervenção cirúrgica por laparoscopia: dois abscessos retrogástricos e uma perfuração de vesícula biliar. Houve um caso de óbito por tromboembolismo pulmonar no 5º DPO em paciente hipertenso, com sequela de AVC e IMC de 31 Kg/m2.
Dentre os principais pontos de consenso (concordância de 70% ou mais dos participantes), cita-se:
A técnica é bastante promissora, segura, com bons resultados nos primeiros dois anos após o procedimento, obedecendo aos critérios determinados pela ASGE e ASMBS. Uma das principais limitações do método está relacionada ao custo ainda muito elevado do procedimento, tanto pelo custo do próprio dispositivo e do treinamento em manejá-lo quanto pela necessidade de dispor de aparelho de duplo canal, overtube e insuflador de CO2.
Embora já seja realizada há certo tempo, muitos cirurgiões e endoscopistas ainda desconhecem a técnica ou não conhecem bem as diversas publicações sobre o tema, o que acaba gerando comparações entre a técnica de ESG e a cirurgia de sleeve, sem levar em consideração que tanto seus resultados como suas indicações são distintas.
A seguir, teste seus conhecimentos e responda o nosso QUIZ!
Ferreira F. Gastroplastia Endoscópica. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/gastroplastia-endoscopica/
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
A endoscopia digestiva é uma especialidade médica jovem e em franco desenvolvimento. Nas últimas quatro ou cinco décadas, evoluímos de meros espectadores do trato digestivo através de fibroscópios para endoscopistas intervencionistas munidos de videoendoscópios de alta definição com uma ampla gama de acessórios. Alguns marcos históricos dessa evolução foram as primeiras: polipectomia (1969); papilotomia com retirada de cálculo (1974); gastrostomia endoscópica (1979); ligadura elástica (1990) (SIVAK, 2006).
A terapêutica na superfície luminal do aparelho digestivo, também chamada de “primeiro espaço” teve um grande marco histórico nos anos 2000. O desenvolvimento da dissecção submucosa (ESD) permitiu ressecções em monobloco de grandes lesões, assim como ressecções curativas de neoplasias precoces. Os acessórios criados para atender às necessidades desta técnica foram importantes na criação e aprimoramentos de diversos outros procedimentos (SIVAK, 2006).
O conceito de cirurgia endoscópica transluminal por orifícios naturais (NOTES) surgiu em 2004 com a proposta de peritonioscopia transgástrica (KALLOO, 2004). Acessar a cavidade peritoneal com o endoscópico, o dito “segundo espaço”, encontrou impasses técnicos que impediram seu crescimento. O NOTES, contudo, deixou de herança um grande avanço para a endoscopia terapêutica com o surgimento do conceito de túnel submucoso com “flap” de mucosa formando uma válvula de segurança (SUMIYAMA, 2007).
Essa técnica abriu as portas para a exploração do “terceiro espaço” e o surgimento de novas possibilidades com a endoscopia submucosa. Em 2008, Inoue tratou a primeira acalasia através de uma miotomia endoscópica da cárdia por um túnel submucoso. Surgia o POEM, abrindo um universo de novas possibilidades terapêuticas por endoscopia.
Por um longo período, a muscular própria foi considerada uma fronteira onde o endoscopista não deveria intervir diante do risco de perfuração. Com o desenvolvimento da técnica de tunelização submucosa, este limite deixou de existir. Patologias de abordagem exclusivamente cirúrgica passaram a contar com a opção de tratamento endoscópico eficaz, seguro e com o mínimo de invasão no organismo.
Nesta sessão do site Endoscopia Terapêutica, faremos uma breve revisão das aplicações da endoscopia no terceiro espaço: POEM e suas variantes Z-POEM, D-POEM, G-POEM, assim como o STER.
Em 2010, Inoue publicou a primeira série de casos de miotomia endoscópica peroral (POEM) para o tratamento da acalasia da cárdia, lançando para o mundo uma nova opção terapêutica. Nos anos subsequentes, um grande número de publicações comprovou sua segurança e eficácia, elevando rapidamente o POEM para uma opção terapêutica ao lado da tradicional cardiomiotomia a Heller e da dilatação pneumática.
O grande atrativo do POEM é a possibilidade de oferecer uma miotomia precisa sem a necessidade de incisão cirúrgica. A técnica consiste na injeção de solução cristaloide ou, de preferência, coloide na submucosa, confeccionando um coxim para a incisão mucosa que permite o acesso do endoscópio ao terceiro espaço. Esta mucosectomia deve ser feita no mínimo 2,0 cm acima do início da miotomia para garantir a formação de uma válvula pelo flap de mucosa e submucosa. A confecção do túnel entre a submucosa e a muscular própria através de dissecção eletrocirúrgica tem sua extensão definida pelo endoscopista a depender do comprimento da miotomia necessária. A secção da musculatura pode ser dirigida à camada circular da muscular própria ou envolver também a longitudinal – não há evidência da superioridade de uma ou outra técnica (LIU, 2020).
A precisa separação entre a submucosa e a muscular própria permite um controle da extensão e da profundidade da miotomia que normalmente não é possível na cirurgia. Essa versatilidade tornou o POEM a primeira escolha terapêutica nos distúrbios espásticos do esôfago como a acalasia do tipo Chicago III ou o esôfago em quebra-nozes. Nos subtipos Chicago I e II de acalasia, o POEM possui eficácia equivalente a Heller (Kahrilas AGA), mas com o tempo cirúrgico significativamente menor no POEM (MOURA; WERNER).
Contudo, o refluxo gastroesofágico (DRGE) continua sendo um ponto a ser melhorado na técnica, com incidências que variam de 10 a 70%, dependendo do conceito usado para a definição de DRGE e do continente do estudo (LIU, 2020). Na prática, a maior parte destes pacientes são assintomáticos ou portadores de erosões classe “A” ou “B” de Los Angeles. Sintomas relevantes ou graus mais severos de DRGE na endoscopia ocorrem em uma minoria dos pacientes. Mesmo assim, a supressão ácida e o acompanhamento endoscópico faz parte do seguimento pós-operatório.
A tunelização da submucosa permitiu uma abordagem mais precisa do septo dos divertículos esofágicos. A dissecção rente à muscular própria permite a precisa secção do septo até sua base, local que frequentemente não é abordado na septotomia tradicional, pelo risco de perfuração ou surgimento de fístula com risco de mediastinite (para saber mais sobre Z-POEM, confira o post clicando neste link).
A maior série publicada de pacientes com divertículo de Zenker tratados por Z-POEM envolveu 75 pacientes com controle sintomático em 92% dos pacientes e sem complicações tardias (Yang, 2020).
O tratamento dos divertículos de esôfago médio e epifrênicos (D-POEM) segue o mesmo princípio com a vantagem de ser possível estender a miotomia o quanto for necessário para o tratamento dos distúrbios espásticos frequentemente presentes nesses casos. A abordagem cirúrgica, classicamente indicada, possui uma precisão limitada para a extensão e profundidade da miotomia do corpo esofágico, com maior risco de lesão transmural. Tal evento é raro no D-POEM, conferindo à técnica um perfil eficaz e seguro (MAYDEO, 2019).
Fístula esofagopleural com formação de abscesso torácico no pós-operatório de diverticulectomia epifrênica videotoracoscópica. O esôfago distal apresentava distúrbio espástico associado. Procedido com a passagem de duas próteses plásticas do tipo duplo pig-tail de 7F na fístula seguida de POEM com miotomia longa da camada circular do esôfago na face contralateral.
A gastroparesia é produto de uma peristalse não coordenada do antro com o momento de relaxamento pilórico. Esta patologia pode ser idiopática, diabética ou iatrogênica. Quando medidas clínicas falham, o tratamento cirúrgico tradicional é a piloroplastia, visando facilitar o esvaziamento gástrico.
O mesmo princípio é obtido pela endoscopia do terceiro espaço com secção da musculatura pilórica sob visão direta e preservando as demais camadas do trato digestivo. A piloromiotomia endoscópica através de tunelização submucosa é referida genericamente na literatura como G-POEM.
Mohan e colaboradores conduziram uma metanálise que comparou os resultados de G-POEM em 332 pacientes versus a piloroplastia cirúrgica em 375 pacientes, identificando taxa de sucesso clínico equivalentes (75,8% x 77,3%) (MOHAN, 2019). Tal achado posiciona a endoscopia como uma boa opção terapêutica nos casos de gastroparesia refratária (saiba mais sobre G-POEM clicando neste link).
A presença de sintomas como disfagia, vômitos, intolerância alimentar, perda de peso acelerada e doença do refluxo gastroesofágico no pós-operatório de gastrectomia vertical deve levantar a suspeita clínica de estenose. Esse evento adverso ocorre entre 0,1 e 4% das cirurgias.
Apesar de não haver consenso na literatura sobre seu manejo, habitualmente iniciamos com sessões de dilatação pneumática. Nos casos de falência terapêutica, as próximas etapas que seguem são o uso de prótese e finalmente cirurgia de conversão para by-pass.
Contudo, a estenotomia gástrica através da tunelização submucosa, genericamente incluída na categoria G-POEM, tem mostrado resultados promissores na resolução dos casos refratários. O racional consiste na secção da musculatura gástrica sob visão direta. A estenose é tratada seguindo o mesmo princípio da seromiotomia cirúrgica, mas com maior precisão, minimizando o risco de perfuração transmural (DE MOURA, 2019). Tais características não são oferecidas por nenhuma outra modalidade terapêutica.
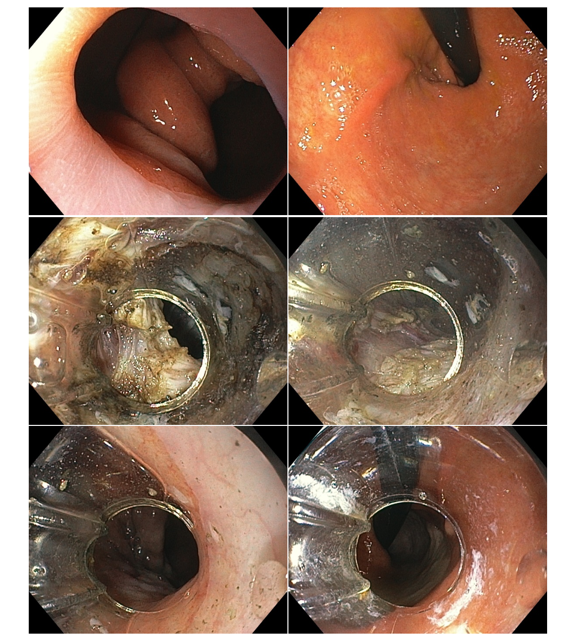 Imagens de uma estenostomia de “twist” gástrico por túnel submucoso. Esta paciente também, além da
Imagens de uma estenostomia de “twist” gástrico por túnel submucoso. Esta paciente também, além da