Deparamo-nos frequentemente com essa situação. Será que você acerta essa questão?
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
O teste de urease ou teste rápido de urease (RUT) é um teste rápido, barato e simples, muito usado no exame de endoscopia para verificar a presença da bactéria Helicobacter pylori. Na verdade, o uteste detecta a presença da enzima urease na amostra da mucosa gástrica. Portanto, o teste da urease é um teste indireto da presença de H. pylori (HP).
Apesar de ser um teste simples, e o mais popular para fazer o diagnóstico da infecção pelo HP, não deixa de ser um teste invasivo, visto que requer exame de endoscopia para obtenção de um fragmento da mucosa gástrica.
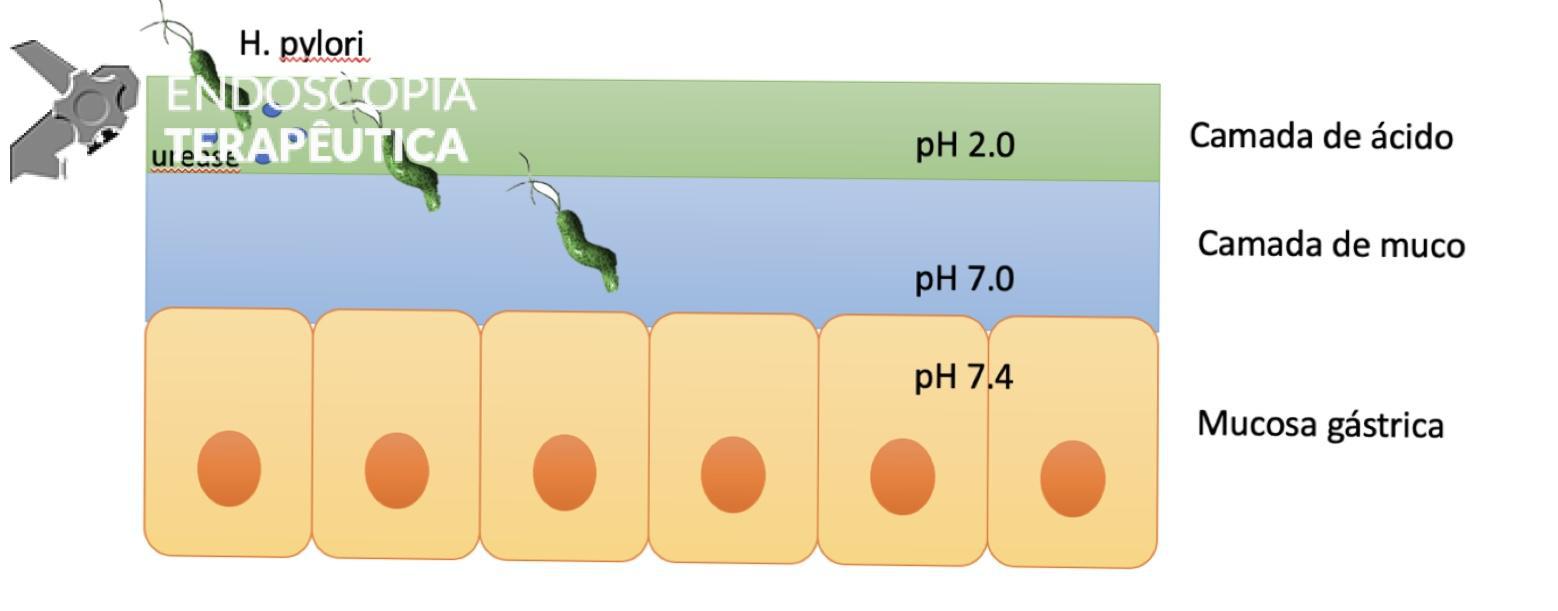
Figura 2: urease produzida pelo H pylori provoca hidrolise da ureia em amônia e CO2, alcalinizando a camada de ácido do estômago e permitindo que o HP sobreviva e atinja o epitélio da mucosa gástrica
O fragmento de mucosa gástrica é colocado em um tubo ou gel contendo ureia e um indicador de pH (vermelho de fenol). O pH desta solução é de 5,9.
Se a urease produzida pelo Helicobacter pylori estiver presente no fragmento, ocorrerá hidrólise da ureia formando amônia. A amônia alcaliniza o meio, promovendo a mudança de cor do amarelo para o rosa.
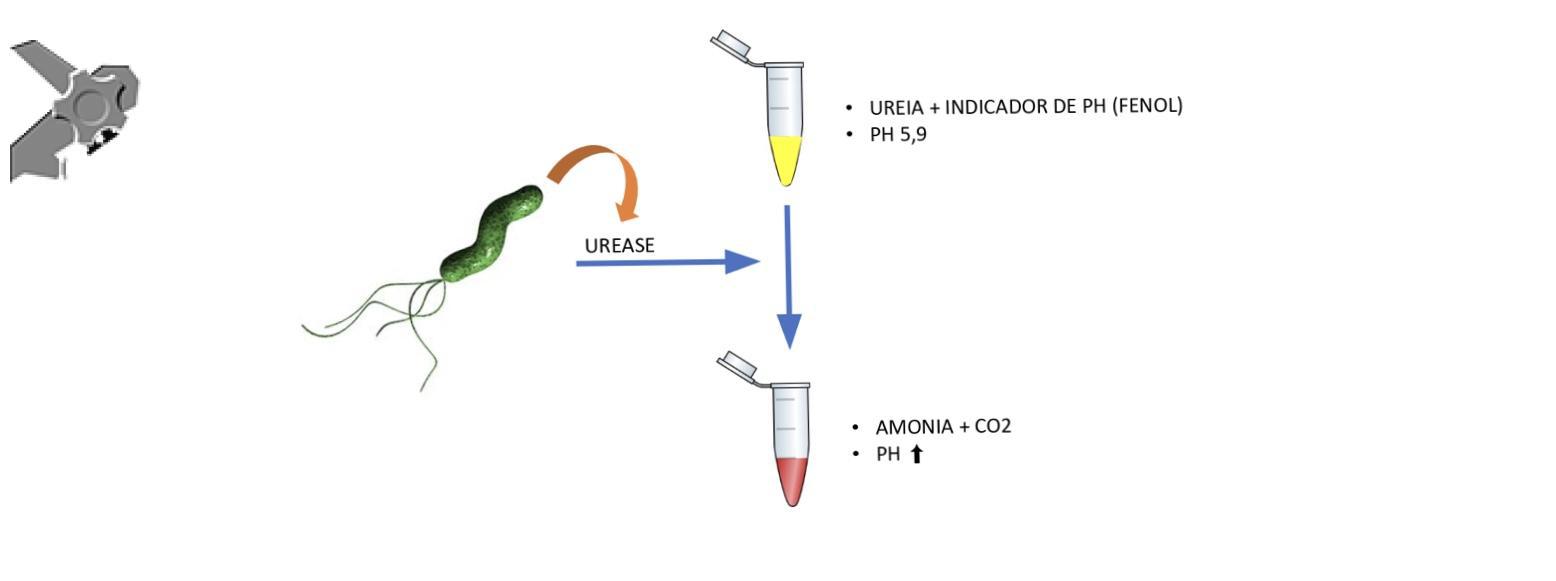
Figura 3: esquema sumarizando como funciona o teste de urease
Obs.: outros testes usaram indicadores diferentes, cada um com uma vantagem potencial. Como exemplo, alguns testes iniciam a reação com um pH mais baixo (pH 5,4), visto que a atividade da urease do H. pylori é mais eficiente nesse pH mais baixo em comparação com outras bactérias, o que poderia diminuir o falso positivo (que, no entanto, é bem raro).
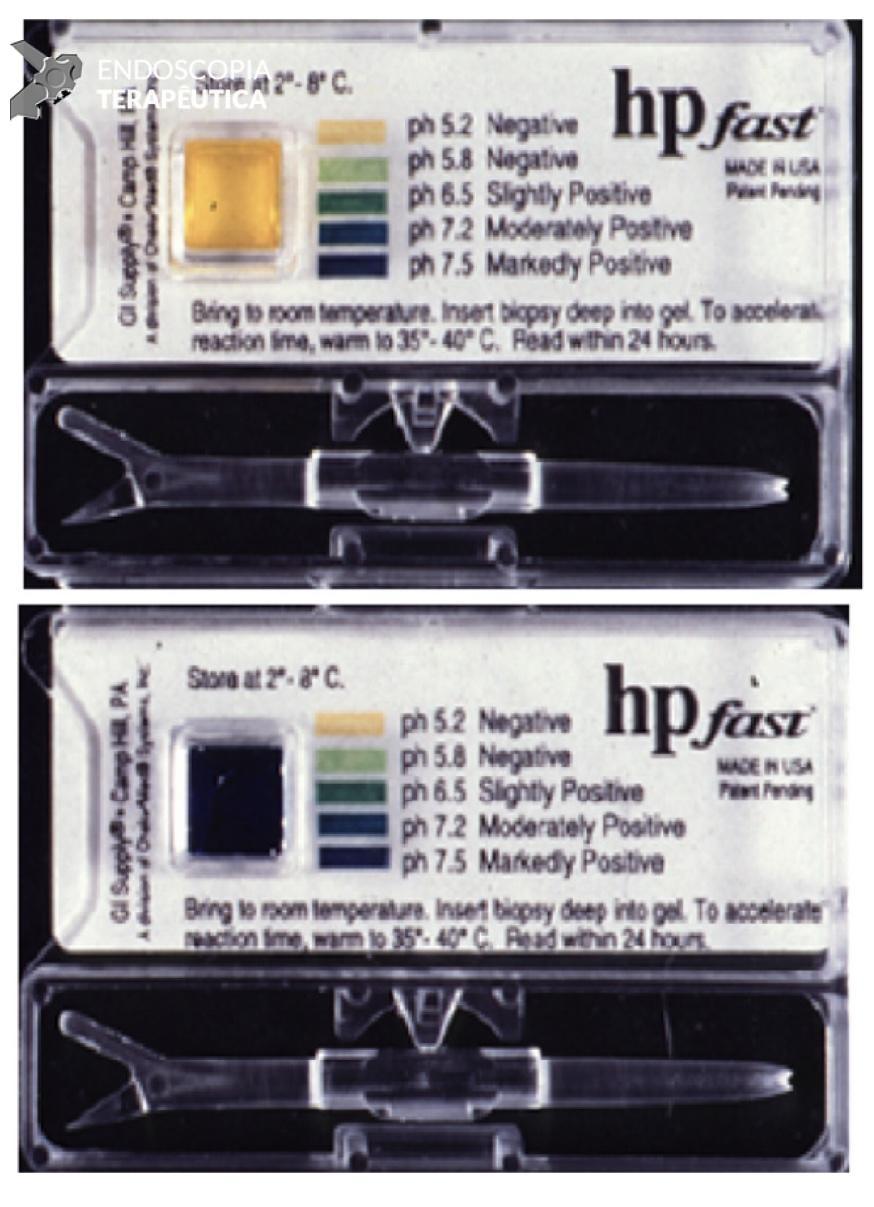
Figura 5: O teste hpfast inicia a reação em um pH mais baixo, diminuindo o falso positivo da urease produzia por outras bactérias como Proteus ou Pseudomonas.
O tempo em que o teste fica positivo depende da concentração de bactérias e da temperatura.
A maioria dos testes ficará positivo dentro de 2-3 horas, mas recomenda-se guardar os testes negativos por 24 horas para a tomada de decisão.
Resultados positivos após 24 horas são, na maioria das vezes, falsos positivos e não deveriam ser usados para decisões de tratamento.
A sensibilidade do teste de urease varia entre 80% e 100% e especificidade entre 97% e 99%.
Estima-se que seja necessário aproximadamente 105 H. pylori na amostra de biópsia para alterar a cor do teste, o que geralmente não é um problema, pois a concentração de H. pylori normalmente excede esse mínimo.
Importante ressaltar que a biópsia deve ser coletada de um local onde os organismos estão presentes:
Um estudo comparou os resultados de uma biópsia realizada na incisura angularis, uma na região pré-pilórica e uma no corpo, apresentando sensibilidade de 100%, 87% e 84,4%, respectivamente, e nenhum falso positivo, ou seja, especificidade de 100% (Woo, 1996).
| No geral, para melhores resultados, recomenda-se a obtenção de dois fragmentos:
· um do antro (evitando áreas de ulceração e metaplasia intestinal óbvia) · um do corpo |
Além da atrofia gástrica, a sensibilidade do teste também pode diminuir em:
Alguns autores advogam que a contaminação da pinça de biópsia por formalina poderia diminuir a sensibilidade do teste. No entanto, um estudo comparou os resultados de 253 pacientes submetidos a duas coletas de teste: uma antes e uma após a imersão da pinça em formalina. No total, houve discordância em apenas 8 casos (3%) e os autores concluem que a pré-imersão da pinça em formalina não interfere com a sensibilidade do teste (Castelotte J, 2001).
Falsos positivos são raros e, quando presentes, podem ser devido à presença de outros organismos contendo urease, como Proteus mirabilis, Citrobactor freundii, Klebsiella pneumonia, Enterobactor cloacae e Staphylococcus aureus.
Contudo, a menos que o paciente tenha acloridria ou hipocloridria, a presença desses organismos em concentração suficiente para produzir um resultado positivo é pouco provável.
Após 24 horas, aumenta-se a chance de falso positivo pela presença de outros organismos contendo urease.
Obs: UREIA é uma paroxítona com ditongo aberto e, portanto, não é acentuada.Para saber mais sobre a nova ortografia aplicada aos termos endoscópicos, confiraclicando aqui !
Martins B. Teste de urease. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/teste-de-urease/
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
As primeiras diretrizes diagnósticas sobre Esofagite Eosinofílica (EEo) foram publicadas em 2007 e atualizadas em 2011. Ela foi definida como uma condição clínico-patológica imuno-mediada, caracterizada por:
Nessa época, EEo e DRGE eram consideradas mutuamente excludentes, e havia um consenso entre especialistas determinando que a melhor abordagem para descartar inflamação relacionada à doença do refluxo gastroesofágico (DRGE) seria com uso de inibidor de bomba de prótons (IBP) em altas doses por 8 semanas ou através do monitoramento de pH (pHmetria).
Durante a década seguinte, experiências clínicas adicionais e pesquisas forneceram novos insights sobre a resposta aos IBP’s. Vários investigadores observaram que uma grande proporção de pacientes com sintomas e eosinofilia esofágica (≥15 eos/cga) respondeu ao tratamento com IBP em alta dose, mas não tinha apresentação clínica consistente com DRGE. Por causa disso, as diretrizes diagnósticas publicadas em 2011, 2013 e 2014 definiram uma nova condição denominada Eosinofilia Esofágica Responsiva ao IBP (PPI-REE). Pacientes com PPI-REE tinham sintomas de disfunção esofágica e ≥15 eos/cga na biópsia, mas obtiveram melhora ou resolução dos sintomas e da eosinofilia após um ciclo de IBP em altas doses. Nessas diretrizes, a PPI-REE não foi bem compreendida, mas EEo e DRGE ainda eram consideradas duas condições distintas.
No entanto, uma gama de pesquisas em andamento sugeriu que EEo e DRGE não eram necessariamente condições excludentes e, em vez disso, compartilhavam uma relação complexa (elas podem coexistir):
Além disso, uma série de estudos examinou as características clínicas, endoscópicas e histológicas iniciais (antes do ciclo de IBP) da EEo e PPI-REE, não encontrando fatores conclusivos que pudessem distinguir as duas.
Condições atópicas concomitantes eram comuns em EEo e PPI-REE, fatores alérgicos e inflamatórios foram encontrados elevados em ambos, e os perfis de expressão de RNA foram muito semelhantes entre as duas condições (e distintas da DRGE), com normalização após tratamento com esteróides tópicos ou restrição dietética, embora existissem algumas diferenças. Finalmente, vários mecanismos não-ácido mediados potenciais foram descritos que poderiam explicar a resposta ao IBP na PPI-REE.
Assim, PPI-REE emergiu como um subtipo de EEo em alguns pacientes, e uma controvérsia se desenvolveu sobre se EEo e PPI-REE eram de fato a mesma condição; se PPI-REE era uma doença associada a alergia alimentar; se os IBP’s devem ser considerados tratamento na EEo; e se o ciclo de IBP deve ser removido da diretriz de diagnóstico. No entanto, tomados em conjunto, esses novos avanços de pesquisa forneceram uma forte justificativa para a consideração da remoção do ciclo de IBP do algoritmo de diagnóstico da EEo.
A favor da manutenção do ciclo de IBP nos critérios diagnósticos pesavam o potencial em reduzir o número de endoscopias necessárias, a ajuda em tratar a DRGE concomitante e fornecer uma abordagem em etapas para o diagnóstico de EEo. A favor da eliminação do ciclo de IBP pesavam permitir a capacidade de discutir uma gama de terapias (por exemplo, algumas usadas para EEo clássica) sem comprometer os pacientes com um IBP desde o início, ajudar a conseguir um recrutamento mais amplo em ensaios clínicos e permitir o tratamento da eosinofilia esofágica com IBP independentemente da causa subjacente, removendo a resposta à medicação como critério diagnóstico.
Uma nova diretriz europeia sobre EEo publicada em 2017 sugeriu que PPI-REE e EEo estavam no mesmo espectro, e que os IBP’s poderiam ser considerados um tratamento primário.
| Critérios Diagnósticos de Esofagite Eosinofílica |
Sintomas de disfunção esofágica
|
EoE
|
Brasil G. Esofagite Eosinofílica: Critérios Diagnósticos. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/esofagite-eosinofilica-criterios-diagnosticos/
A terapia com vácuo endoscópico é uma opção para tratamento de fístulas pós-operatórias. Apresentamos, neste caso, uma alternativa de manejo para fístula de coto jejunal.
Paciente feminina, 42 anos, com gastrectomia total prévia por adenocarcinoma gástrico, com abdômen agudo obstrutivo devido à recidiva neoplásica. Submetida à colectomia esquerda de urgência. Evoluiu com sepse, necessitando reabordagem no terceiro dia pós-operatório, sendo visualizada fístula de coto jejunal (provável trauma por sonda nasogástrica).
Realizada rafia do coto, teste com azul de metileno e drenagem local para tratamento da fístula. Evoluiu com resposta inflamatória prolongada, sendo manejada com nutrição parenteral total até extubação. Após melhora clínica, reiniciada dieta, evidenciando-se persistência da fístula. Mantido jejum oral e suporte parenteral sem melhora aos testes sequenciais com azul de metileno oral. Após 35 dias de pós-operatório, sem melhora com tratamento cirúrgico e clínico, foi optado por confecção de curativo de pressão negativa para tratamento endoscópico.
Na endoscopia, observa-se coto jejunal terminal aberto, medindo, aproximadamente, 2 cm de diâmetro, com deiscência completa da rafia, processo inflamatório e fibrina em grande quantidade com dreno abdominal junto ao local da fístula.
Confeccionado curativo com sonda tipo trilumina, adaptando a sonda de aspiração com gases e adesivos, formando um “Y” para encaixar no coto jejunal e a sonda alimentar para seguir na via digestiva, mantendo alimentação enteral pós-fístula.
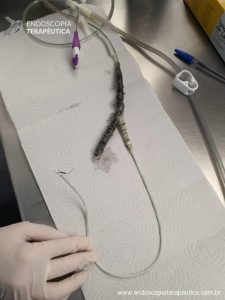
Sonda trilumina confeccionada.
Colocada sonda via nasal e posicionado o braço de aspiração, encaixado no coto jejunal, guiado por visão direta endoscópica, e mantido em aspiração contínua por dispositivo de pressão negativa VAC, com média de pressão de sucção de 125 mmHg.
Sonda posicionada no jejuno com dispositivo de sucção VAC, fotos abaixo:
Houve necessidade de troca da sonda no terceiro dia por falha de vácuo e posicionamento.
Realizada revisão endoscópica após 10 dias de sucção contínua. Observada redução significativa do orifício fistuloso e redução do processo inflamatório e fibrinopurulento local.
Devido à dificuldade de autorização de material pela saúde suplementar, e obstrução da sonda trilumina na via alimentar, adaptamos uma sonda de aspiração a vácuo confeccionada com sonda nasogástrica revestida com esponja e adesivo multiperfurado externo, sendo posicionada via nasal por visão endoscópica no coto jejunal e passagem de sonda enteral na outra narina, mantendo alimentação enteral pela alça alimentar.
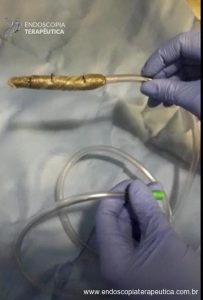
Sonda confeccionada manualmente.
Realizada nova revisão endoscópica 27 dias após início da terapia com vácuo endoscópico, com evidência de fechamento do lúmen fistuloso, realizado novo teste com azul de metileno sem extravasamento.
Após teste com azul de metileno negativo por 24 horas, foi retirado dreno abdominal, e paciente retomou alimentação oral, normalizando textura alimentar em 7 dias.
Neste caso, observamos que a sonda trilumina tem maior tolerabilidade pelo paciente, por ficar adaptada apenas em uma narina que realiza alimentação e sucção. Porém, o longo trajeto da sonda alimentar favorece obstrução e dobras no trato digestivo especialmente na região da anastomose, além dos entraves de custo e disponibilidade do material. Enquanto a sonda nasogástrica é de baixo custo, a confecção do curativo é facilmente executável e efetiva, porém causando maior desconforto no paciente pela necessidade de uso de ambas as narinas para sucção e alimentação simultâneas.
Durante o tratamento com vácuo endoscópico, observamos que, clinicamente, é bem tolerável, com pouca dor, porém houve sensação de engasgo e náuseas intensas nos primeiros dias da terapia, necessitando uso de amplictil para controle dos sintomas, além do trauma nasal pelo tempo prolongado e várias passagens de sonda via nasal.
A terapia com vácuo endoscópico pode ser eficaz por ser minimamente invasiva, permitindo a recuperação em menor tempo, podendo evitar reabordagem cirúrgica e até permitir tratamento a nível ambulatorial.
Wercka J. Tratamento a vácuo de fístula digestiva pós-operatória. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/casosclinicos/tratamento-vacuo-de-fistula-digestiva-pos-operatoria/
A endoscopia digestiva é uma especialidade médica jovem e em franco desenvolvimento. Nas últimas quatro ou cinco décadas, evoluímos de meros espectadores do trato digestivo através de fibroscópios para endoscopistas intervencionistas munidos de videoendoscópios de alta definição com uma ampla gama de acessórios. Alguns marcos históricos dessa evolução foram as primeiras: polipectomia (1969); papilotomia com retirada de cálculo (1974); gastrostomia endoscópica (1979); ligadura elástica (1990) (SIVAK, 2006).
A terapêutica na superfície luminal do aparelho digestivo, também chamada de “primeiro espaço” teve um grande marco histórico nos anos 2000. O desenvolvimento da dissecção submucosa (ESD) permitiu ressecções em monobloco de grandes lesões, assim como ressecções curativas de neoplasias precoces. Os acessórios criados para atender às necessidades desta técnica foram importantes na criação e aprimoramentos de diversos outros procedimentos (SIVAK, 2006).
O conceito de cirurgia endoscópica transluminal por orifícios naturais (NOTES) surgiu em 2004 com a proposta de peritonioscopia transgástrica (KALLOO, 2004). Acessar a cavidade peritoneal com o endoscópico, o dito “segundo espaço”, encontrou impasses técnicos que impediram seu crescimento. O NOTES, contudo, deixou de herança um grande avanço para a endoscopia terapêutica com o surgimento do conceito de túnel submucoso com “flap” de mucosa formando uma válvula de segurança (SUMIYAMA, 2007).
Essa técnica abriu as portas para a exploração do “terceiro espaço” e o surgimento de novas possibilidades com a endoscopia submucosa. Em 2008, Inoue tratou a primeira acalasia através de uma miotomia endoscópica da cárdia por um túnel submucoso. Surgia o POEM, abrindo um universo de novas possibilidades terapêuticas por endoscopia.
Por um longo período, a muscular própria foi considerada uma fronteira onde o endoscopista não deveria intervir diante do risco de perfuração. Com o desenvolvimento da técnica de tunelização submucosa, este limite deixou de existir. Patologias de abordagem exclusivamente cirúrgica passaram a contar com a opção de tratamento endoscópico eficaz, seguro e com o mínimo de invasão no organismo.
Nesta sessão do site Endoscopia Terapêutica, faremos uma breve revisão das aplicações da endoscopia no terceiro espaço: POEM e suas variantes Z-POEM, D-POEM, G-POEM, assim como o STER.
Em 2010, Inoue publicou a primeira série de casos de miotomia endoscópica peroral (POEM) para o tratamento da acalasia da cárdia, lançando para o mundo uma nova opção terapêutica. Nos anos subsequentes, um grande número de publicações comprovou sua segurança e eficácia, elevando rapidamente o POEM para uma opção terapêutica ao lado da tradicional cardiomiotomia a Heller e da dilatação pneumática.
O grande atrativo do POEM é a possibilidade de oferecer uma miotomia precisa sem a necessidade de incisão cirúrgica. A técnica consiste na injeção de solução cristaloide ou, de preferência, coloide na submucosa, confeccionando um coxim para a incisão mucosa que permite o acesso do endoscópio ao terceiro espaço. Esta mucosectomia deve ser feita no mínimo 2,0 cm acima do início da miotomia para garantir a formação de uma válvula pelo flap de mucosa e submucosa. A confecção do túnel entre a submucosa e a muscular própria através de dissecção eletrocirúrgica tem sua extensão definida pelo endoscopista a depender do comprimento da miotomia necessária. A secção da musculatura pode ser dirigida à camada circular da muscular própria ou envolver também a longitudinal – não há evidência da superioridade de uma ou outra técnica (LIU, 2020).
A precisa separação entre a submucosa e a muscular própria permite um controle da extensão e da profundidade da miotomia que normalmente não é possível na cirurgia. Essa versatilidade tornou o POEM a primeira escolha terapêutica nos distúrbios espásticos do esôfago como a acalasia do tipo Chicago III ou o esôfago em quebra-nozes. Nos subtipos Chicago I e II de acalasia, o POEM possui eficácia equivalente a Heller (Kahrilas AGA), mas com o tempo cirúrgico significativamente menor no POEM (MOURA; WERNER).
Contudo, o refluxo gastroesofágico (DRGE) continua sendo um ponto a ser melhorado na técnica, com incidências que variam de 10 a 70%, dependendo do conceito usado para a definição de DRGE e do continente do estudo (LIU, 2020). Na prática, a maior parte destes pacientes são assintomáticos ou portadores de erosões classe “A” ou “B” de Los Angeles. Sintomas relevantes ou graus mais severos de DRGE na endoscopia ocorrem em uma minoria dos pacientes. Mesmo assim, a supressão ácida e o acompanhamento endoscópico faz parte do seguimento pós-operatório.
A tunelização da submucosa permitiu uma abordagem mais precisa do septo dos divertículos esofágicos. A dissecção rente à muscular própria permite a precisa secção do septo até sua base, local que frequentemente não é abordado na septotomia tradicional, pelo risco de perfuração ou surgimento de fístula com risco de mediastinite (para saber mais sobre Z-POEM, confira o post clicando neste link).
A maior série publicada de pacientes com divertículo de Zenker tratados por Z-POEM envolveu 75 pacientes com controle sintomático em 92% dos pacientes e sem complicações tardias (Yang, 2020).
O tratamento dos divertículos de esôfago médio e epifrênicos (D-POEM) segue o mesmo princípio com a vantagem de ser possível estender a miotomia o quanto for necessário para o tratamento dos distúrbios espásticos frequentemente presentes nesses casos. A abordagem cirúrgica, classicamente indicada, possui uma precisão limitada para a extensão e profundidade da miotomia do corpo esofágico, com maior risco de lesão transmural. Tal evento é raro no D-POEM, conferindo à técnica um perfil eficaz e seguro (MAYDEO, 2019).
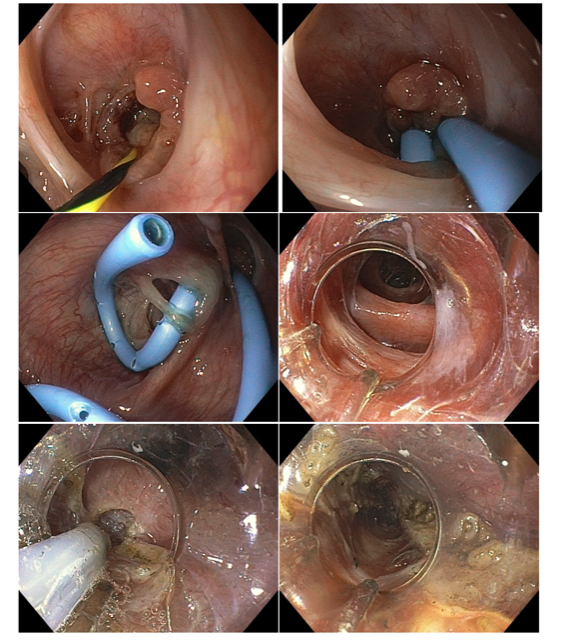
Fístula esofagopleural com formação de abscesso torácico no pós-operatório de diverticulectomia epifrênica videotoracoscópica. O esôfago distal apresentava distúrbio espástico associado. Procedido com a passagem de duas próteses plásticas do tipo duplo pig-tail de 7F na fístula seguida de POEM com miotomia longa da camada circular do esôfago na face contralateral.
A gastroparesia é produto de uma peristalse não coordenada do antro com o momento de relaxamento pilórico. Esta patologia pode ser idiopática, diabética ou iatrogênica. Quando medidas clínicas falham, o tratamento cirúrgico tradicional é a piloroplastia, visando facilitar o esvaziamento gástrico.
O mesmo princípio é obtido pela endoscopia do terceiro espaço com secção da musculatura pilórica sob visão direta e preservando as demais camadas do trato digestivo. A piloromiotomia endoscópica através de tunelização submucosa é referida genericamente na literatura como G-POEM.
Mohan e colaboradores conduziram uma metanálise que comparou os resultados de G-POEM em 332 pacientes versus a piloroplastia cirúrgica em 375 pacientes, identificando taxa de sucesso clínico equivalentes (75,8% x 77,3%) (MOHAN, 2019). Tal achado posiciona a endoscopia como uma boa opção terapêutica nos casos de gastroparesia refratária (saiba mais sobre G-POEM clicando neste link).
A presença de sintomas como disfagia, vômitos, intolerância alimentar, perda de peso acelerada e doença do refluxo gastroesofágico no pós-operatório de gastrectomia vertical deve levantar a suspeita clínica de estenose. Esse evento adverso ocorre entre 0,1 e 4% das cirurgias.
Apesar de não haver consenso na literatura sobre seu manejo, habitualmente iniciamos com sessões de dilatação pneumática. Nos casos de falência terapêutica, as próximas etapas que seguem são o uso de prótese e finalmente cirurgia de conversão para by-pass.
Contudo, a estenotomia gástrica através da tunelização submucosa, genericamente incluída na categoria G-POEM, tem mostrado resultados promissores na resolução dos casos refratários. O racional consiste na secção da musculatura gástrica sob visão direta. A estenose é tratada seguindo o mesmo princípio da seromiotomia cirúrgica, mas com maior precisão, minimizando o risco de perfuração transmural (DE MOURA, 2019). Tais características não são oferecidas por nenhuma outra modalidade terapêutica.
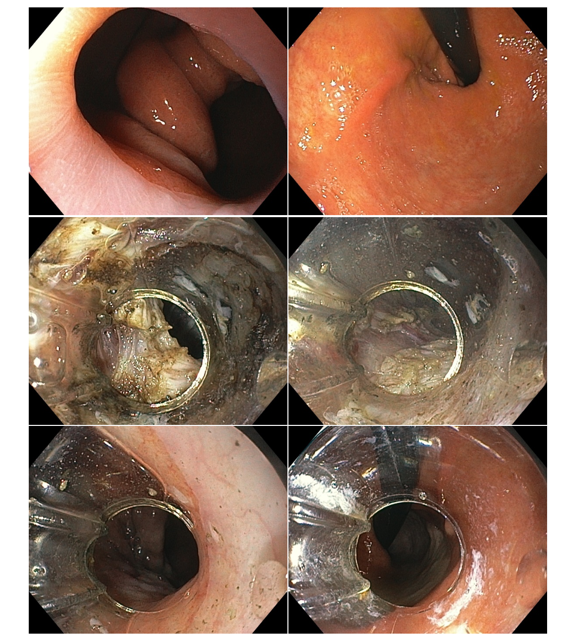 Imagens de uma estenostomia de “twist” gástrico por túnel submucoso. Esta paciente também, além da
Imagens de uma estenostomia de “twist” gástrico por túnel submucoso. Esta paciente também, além da
Paciente de 21 anos, com quadro de DRGE, submetida a EDA, sendo vista em esôfago cervical a imagem abaixo.
Desde março de 2020, quando a OMS definiu que estávamos diante de uma pandemia de consequências desconhecidas, uma grande mobilização da comunidade científica mundial buscou acúmulo de conhecimento sobre o novo vírus, porém, por meses à frente, ainda agiríamos no escuro em muitas situações, contando com muito menos informação de qualidade do que gostaríamos.
No quesito transmissibilidade, por exemplo, muito se assumiu como verdade a partir do comportamento de outros coronavírus, dada a semelhança estrutural do SARS-CoV-2 com seus predecessores.
Ainda em março, aqui no site, alguns artigos trouxeram uma parte importante do que já era conhecido e relevante (links abaixo).
Infelizmente, quase nada tratava especificamente do comportamento viral no ambiente da endoscopia. Na verdade, até recentemente a endoscopia digestiva estava fora da lista de procedimentos geradores de aerossóis, havendo apenas a evidência de disseminação bacteriana demonstrada por culturas de amostras de face shields usadas por endoscopistas. Apesar disso, medidas para a redução da transmissão por aerossóis foram e seguem recomendadas. E muitas perguntas seguiram sem respostas. Endoscopia de fato produz aerossol? O vírus em suspensão é capaz de infectar alguém durante ou após o exame?
Recentemente, uma revisão buscou tratar do assunto com olhar voltado à prática endoscópica. Nessa revisão, intitulada “Extent of infectious SARS-CoV-2 aerosolisation as a result of oesophagogastroduodenoscopy or colonoscopy”, os autores selecionaram 26 artigos dentre 3745 inicialmente localizados.
Foram incluídos estudos que relatassem riscos por aerossol em pacientes com COVID-19, tendo sido excluídos os não relacionados à COVID-19, com metodologia considerada fraca, não escritos em inglês, e aqueles não indexados à PubMed.
Figura 1 – Flow chart com elegibilidade, inclusão e exclusão de artigos.
Os autores relatam que os estudos selecionados na revisão sugerem alta infectividade por contato e por gotículas, no entanto, afirmam não haver em sua amostra nenhum estudo clínico que demonstre carga viral presente no aerossol, não sendo possível a definição de uma “dose” infectante, mas afirma que isso pode corresponder a algumas centenas de partículas virais. Entenda-se por “dose” a menor quantidade de partículas virais necessárias para iniciar uma infecção.
Abaixo, estão listadas algumas afirmações colocadas pelos autores em sua discussão:
Figura 2 – Agregado das amostras e dias de início dos sintomas.
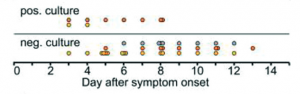
Figura 3 – Resultados agregados de sucesso de isolamento viral em diferentes dias desde o início dos sintomas.
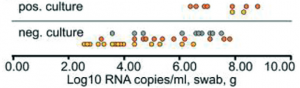
Figura 4 – Sucesso de isolamento viral e carga viral da amostra.
A revisão apresenta dificuldades para trazer, de fato, luz ao assunto, seja por limitações em seu desenho, seja pela escassez de informações na literatura.
Em resumo, as evidências que sustentam o papel da aerossolização como via de transmissão de COVID-19 na prática endoscópica são limitadas até o momento e o assunto ainda carece de melhor entendimento.
Rodrigues R. Aerossóis e transmissibilidade na prática endoscópica: a dúvida que paira no ar. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/artigoscomentados/aerossois-e-transmissibilidade-na-pratica-endoscopica-a-duvida-que-paira-no-ar/
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quiz, classificações e mais!
Mulher, 42 anos, sem comorbidades conhecidas, em investigação de doenças autoimunes, submete-se à EDA por queixas dispépticas.
Laudo endoscópico:
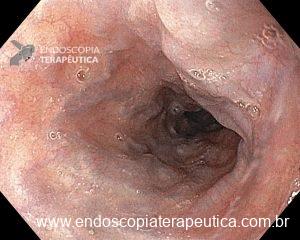
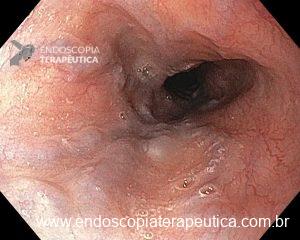
Tais achados estavam restritos ao terço superior do esôfago, se estendendo da região logo abaixo do cricofaríngeo até 20 cm da ADS.
Paciente sexo feminino, 54 anos, com antecedentes de transtorno depressivo e dislipidemia, iniciou em novembro de 2019 quadro de icterícia, colúria e hipocolia fecal, sem dor abdominal, febre ou perda de peso. Etilista de 5 doses/semana e tabagista com baixa carga tabágica (2 anos/maço). Fazia uso de sertralina há 2 anos e havia iniciado o uso de sinvastatina em outubro de 2019, tendo interrompido o uso quando ficou ictérica.
Feita hipótese de lesão hepática induzida por sinvastatina e optado por seguimento clínico-laboratorial.
Houve persistência do quadro, sendo realizada ecoendoscopia em julho de 2020 para afastar causas obstrutivas, com achado de região hipoecogênica, heterogênea, limites irregulares, medindo 2,5 x 1,5 cm na cabeça pancreática (Figura 1), sem dilatação de colédoco à montante (5,8 mm).
Realizada punção com agulha de biópsia (FNB) de 20G da lesão pancreática e, no mesmo procedimento, biópsia de lobo esquerdo hepático (Figura 2). Para a biópsia hepática, foi utilizada também uma agulha de FNB de 20G, 2 passagens, com 3 oscilações lentas em cada, sem uso de vácuo. Obtida quantidade satisfatória de material (Figura 3). Não houve intercorrências durante ou após o procedimento.
Anatomopatológico da lesão pancreática revelou tecido acinar pancreático sem atipias e do fígado hepatopatia crônica colestática padrão biliar, com fibrose grau 2 e colestase moderada/acentuada, compatível com ação medicamentosa.
Iniciado uso de ácido ursodesoxicólico, com melhora inicial do quadro clínico-laboratorial.
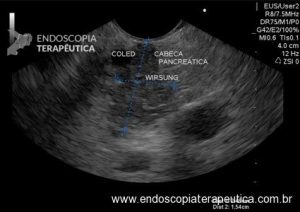
Figura 1. Região hipoecogênica, heterogênea, limites irregulares, medindo 2,5 x 1,5 cm, localizada na cabeça pancreática.
Discussão
A biópsia hepática é ferramenta útil no diagnóstico e estadiamento de doenças do fígado como hepatites virais, doença hepática gordurosa associada a disfunção metabólica e hepatopatias autoimunes. Apesar do avanço de técnicas não invasivas como a elastografia hepática, estas permitem o estadiamento apenas do grau de fibrose, não fornecendo dados importantes para confirmação etiológica a avaliação do grau de atividade inflamatória, por exemplo.
As vias mais utilizadas para biópsia hepática são a percutânea, cirúrgica e transjugular. Cada uma delas possui limitações e riscos importantes como dor abdominal, sangramento, complicações da anestesia geral (biópsia cirúrgica) e alto custo (biópsia transjugular).
A biópsia hepática por ecoendoscopia vem ganhando espaço nos últimos anos, com publicações recentes de séries de casos com mais de 200 pacientes e metanálises incluindo mais de 400 pacientes. Tem como potenciais vantagens:
A eficácia em se obter material adequado para análise histológica na biópsia hepática por ecoendoscopia é de 93,9 a 100%. O comprimento médio total dos fragmentos obtidos nos diferentes estudos é de 2,4 a 5,5 cm (com fragmentos únicos de 0,4 a 1,1 cm) e o número médio de espaços porta obtidos de 21 a 42. A biópsia dos dois lobos hepáticos está associada a maior comprimento da amostra e maior número de espaços porta.
Em relação às complicações
A biópsia hepática por ecoendoscopia pode ser feita com agulhas de punção aspirativa (FNA) de 19G, bem como agulhas de FNB de 19G e 22G, com índice de sucesso semelhante. A punção pode ser feita no lobo hepático esquerdo (via transgástrica) e/ou direito (via transduodenal) geralmente sem vácuo, 1 a 3 passagens, 3 a 4 oscilações, utilizando-se o Doppler para evitar vasos no trajeto. A retirada do fragmento da agulha pode ser feita com estilete ou flush com heparina, com cuidado para não curvar a agulha e fragmentar a amostra, que deve ser colocada em formalina 10%.
A principal limitação para a maior utilização da biópsia hepática por ecoendoscopia no Brasil é seu maior custo comparado à via mais utilizada (percutânea). Porém, em casos em que a ecoendoscopia está indicada por outros motivos (como o caso em questão) ou quando outras vias não são possíveis (obesidade grau 3, por exemplo), esta via parece ser factível e segura.
Referências
O câncer de esôfago (CE) é a oitava neoplasia maligna mais frequente em todo o mundo, ocupando também a sexta posição em causa de mortes entre todos os tipos de câncer. No Brasil, de acordo com dados do Instituto Nacional de Câncer (INCA), o CE está entre as dez neoplasias mais incidentes, sendo a sexta neoplasia mais frequente entre pessoas do sexo masculino e a décima terceira entre as do sexo feminino.
Os dois tipos histológicos principais do CE são o carcinoma epidermóide e o adenocarcinoma. Em nosso meio, o primeiro representa cerca de 96% das neoplasias esofágicas diagnosticadas. No entanto, a incidência do último vem aumentando progressivamente.
O diagnóstico definitivo do CE se dá através do exame de endoscopia digestiva alta com obtenção de biópsias da lesão e, muito frequentemente, é realizado já em fase avançada da doença, após o aparecimento dos primeiros sintomas disfágicos. Cerca de 50% dos pacientes apresentam doença locorregional avançada ou metastática ao momento do diagnóstico, com grave comprometimento nutricional e queda do estado geral, reduzindo a possibilidade de um tratamento curativo. Nestes, a paliação dos sintomas e o manejo das complicações ainda é a melhor opção, sendo a colocação de prótese metálica autoexpansível (PMAE) o método mais rápido com este propósito.
A fístula esofagorrespiratória (FER) é a temida complicação do câncer de esôfago. É definida como uma comunicação patológica entre o esôfago e a árvore respiratória, estando presente entre 5 a 15% dos indivíduos com neoplasia esofágica e em menos de 1% dos indivíduos com carcinoma broncogênico. Os sintomas típicos do paciente portador de FER são quadros de tosse associados à ingesta alimentar e pneumonias aspirativas de repetição, presentes em até 95% dos casos. Em média, a fístula se desenvolve cerca de oito meses após o diagnóstico do CE e, uma vez estabelecida sua presença, o tratamento deve ser prontamente instituído para evitar a contaminação contínua da via aérea e o óbito por sepse de foco pulmonar. Desta forma, o fechamento da FER e o restabelecimento da capacidade de ingesta alimentar por via oral são considerados tão importantes quanto o tratamento da doença subjacente.
A taxa de sucesso no fechamento da fístula com PMAE varia entre 70% a 100% e pode promover melhora instantânea da disfagia através da restauração da patência esofágica, evitando alimentação pelo uso de sonda nasoenteral ou por gastrostomia percutânea, além de melhorar a qualidade de vida e reduzir o número de intervenções adicionais.
O CE complicado por FER leva à rápida deterioração do estado geral do paciente, seguida de morte num curto período de tempo, secundária às infecções respiratórias e à má nutrição. Não existem muitas opções terapêuticas disponíveis para o manejo da fístula maligna, haja vista a inoperabilidade da quase totalidade dos pacientes, sendo a PMAE método amplamente empregado nesses casos. No entanto, reconhece-se que existem eventos adversos relacionados ao método e, mais importante que isso, observa-se que parcela significativa dos pacientes que são submetidos à passagem da PMAE evoluem de forma desfavorável, com piora súbita do quadro clínico e pulmonar.
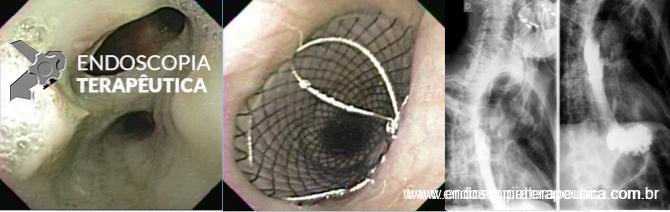
A: VISÃO ENDOSCÓPICA DA FÍSTULA ESOFÁGICA (SETA); B: VISÃO ENDOSCÓPICA DA PRÓTESE METÁLICA EXPANDIDA EM ESÔFAGO; C: INJEÇÃO DE MEIO DE CONTRASTE CONFIRMANDO A OCLUSÃO DA FÍSTULA PELA PRÓTESE (IMAGEM RADIOLÓGICA)
Quanto aos eventos adversos, a taxa total varia de 30% a 43%, sendo que a maior parte destes ocorrem tardiamente, ou seja, após 7 dias do procedimento. Os eventos adversos mais frequentes são, em ordem decrescente de prevalência: a migração, a obstrução da prótese por crescimento tumoral nas suas extremidades, a hematêmese e impactação alimentar.
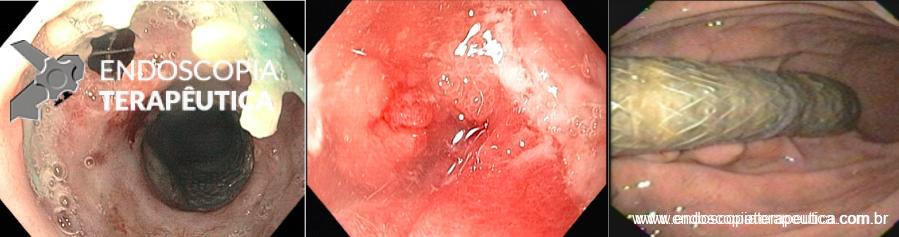
VISÃO ENDOSCÓPICA DE EVENTOS ADVERSOS DAS PRÓTESES METÁLICAS: A: FÍSTULA ESOFÁGICA (SETA); B: OBSTRUÇÃO DA PRÓTESE POR CRESCIMENTO TUMORAL NA EXTREMIDADE PROXIMAL DA PRÓTESE; C: MIGRAÇÃO DISTAL DA PRÓTESE PARA O ESTÔMAGO
O ideal seria haver uma base mais racional na qual se possa identificar quais pacientes se beneficiariam da utilização da prótese e quais não teriam benefício ou até mesmo teriam piora clínica com o tratamento. Se isso for possível, outros métodos paliativos podem ser indicados, evitando procedimento algo invasivo e oneroso ao sistema de saúde.
É evidente a escassez de estudos que se dedicaram à essa questão e não se sabe qual a vantagem da prótese na sobrevida do paciente. A maioria das publicações são pequenos estudos de coorte, com curto tempo de seguimento e índices variáveis de sucesso e complicações. Recentemente houve uma importante publicação que avaliou os fatores preditivos associados à falha clínica do uso de PMAE para o tratamento da FER, com as seguintes conclusões:
– Pacientes com ECOG (Eastern Cooperative Oncology Group) 3 e 4, desenvolvimento da fístula durante o tratamento do câncer esofágico e diâmetro da fístula igual ou superior a 1 cm foram fatores preditivos de insucesso clínico do tratamento das fístulas esofagorrespiratórias com prótese metálica autoexpansível em pacientes com câncer esofágico.
– Pacientes com ECOG (Eastern Cooperative Oncology Group) 3 e 4, tratamento oncológico prévio com radioterapia, isolada ou associada à quimioterapia e doença pulmonar infecciosa em atividade no momento da passagem da prótese foram fatores que impactaram negativamente a sobrevida dos pacientes.
Referência Bibliográfica:
Ribeiro MSI et al. Self-expandable metal stent for malignant esophagorespiratory fistula: predictive factors associated with clinical failure. GIE. 2018 Feb;87(2):390-396. PMID: 2896474. DOI: 10.1016/j.gie.2017.09.020.