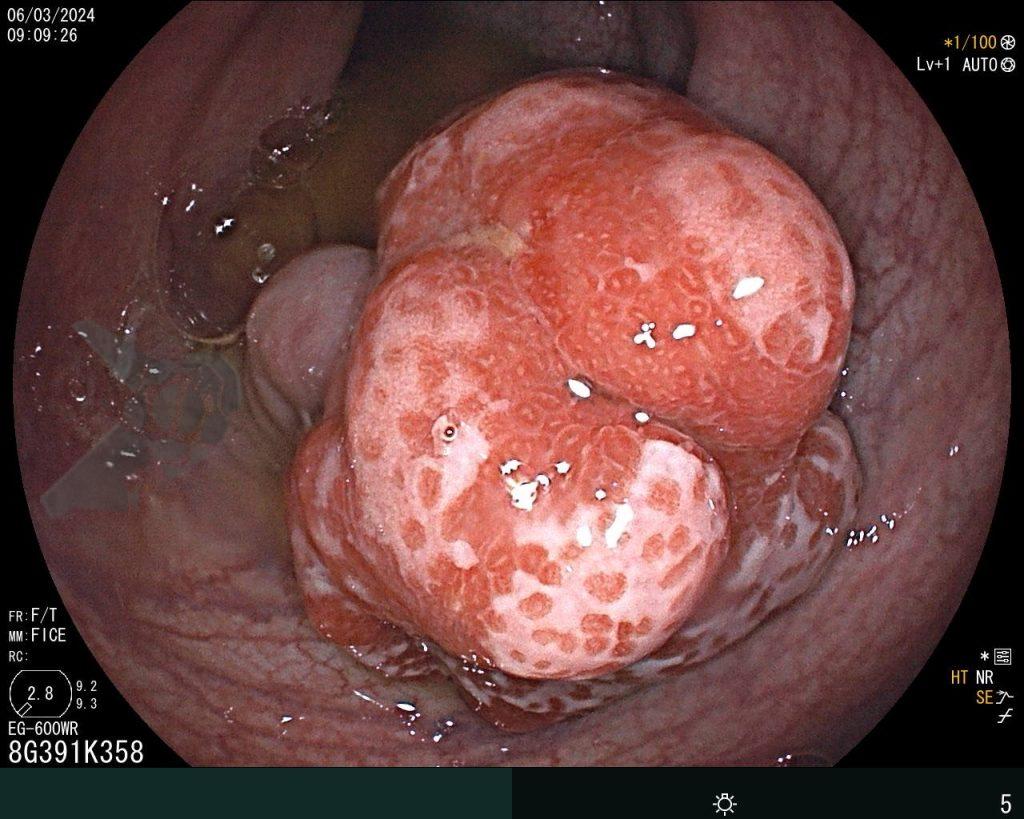
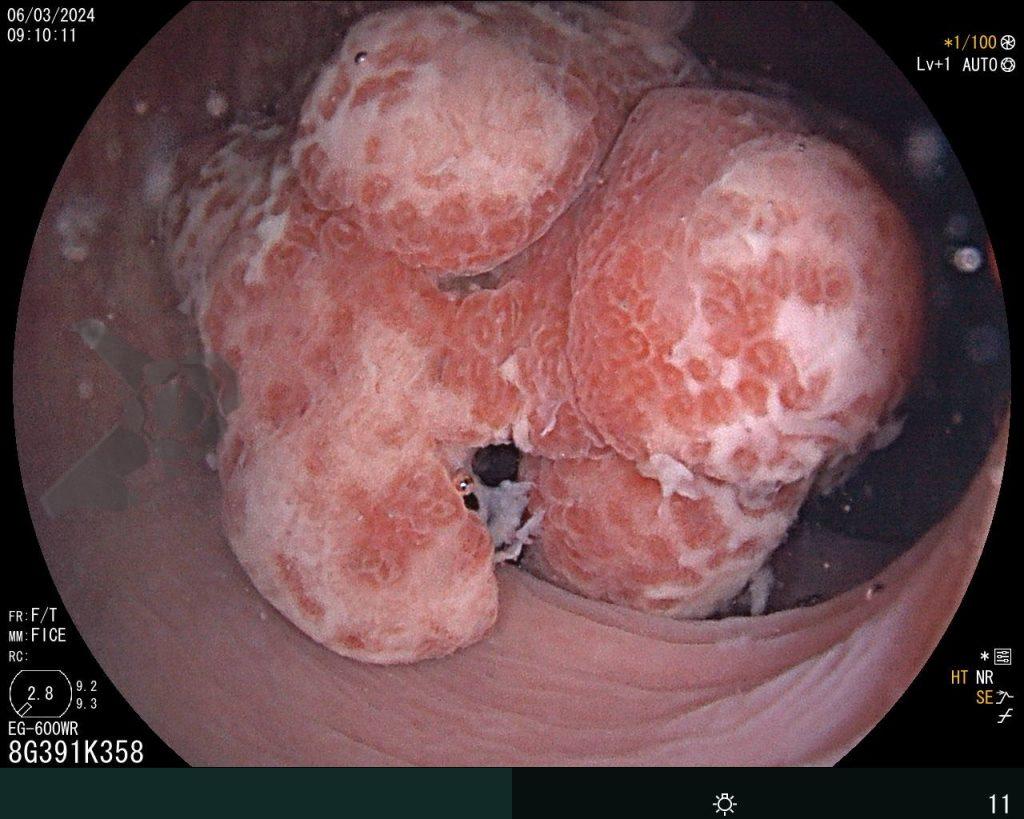
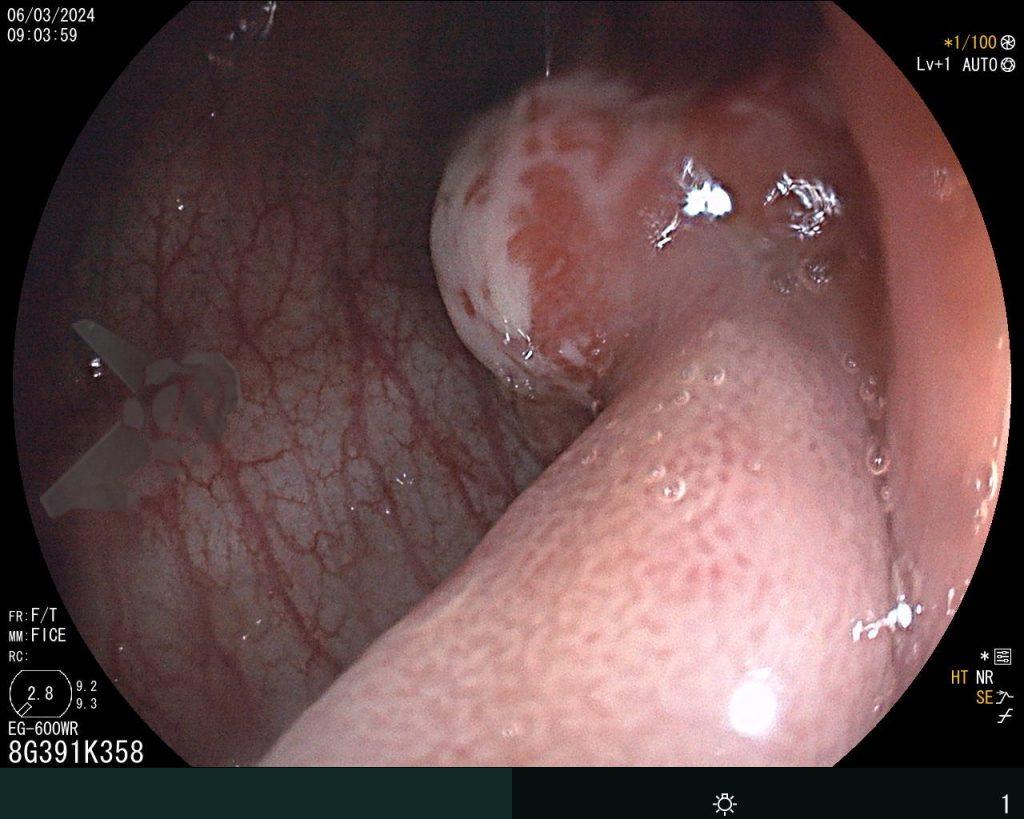
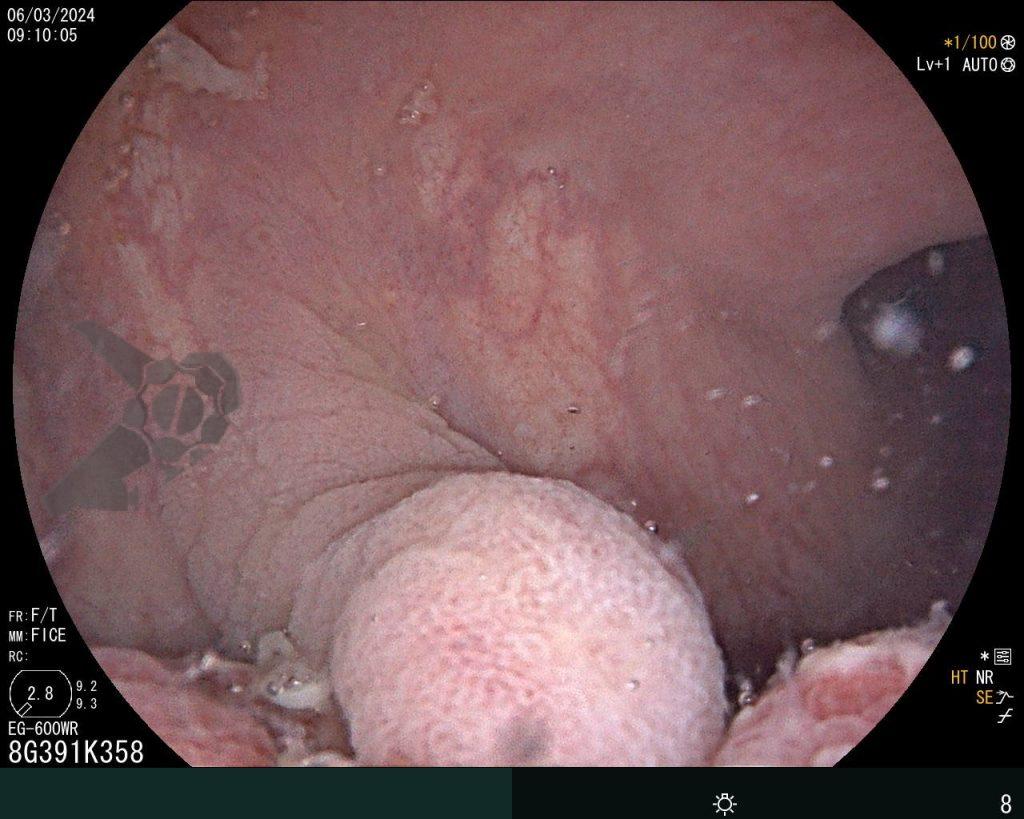
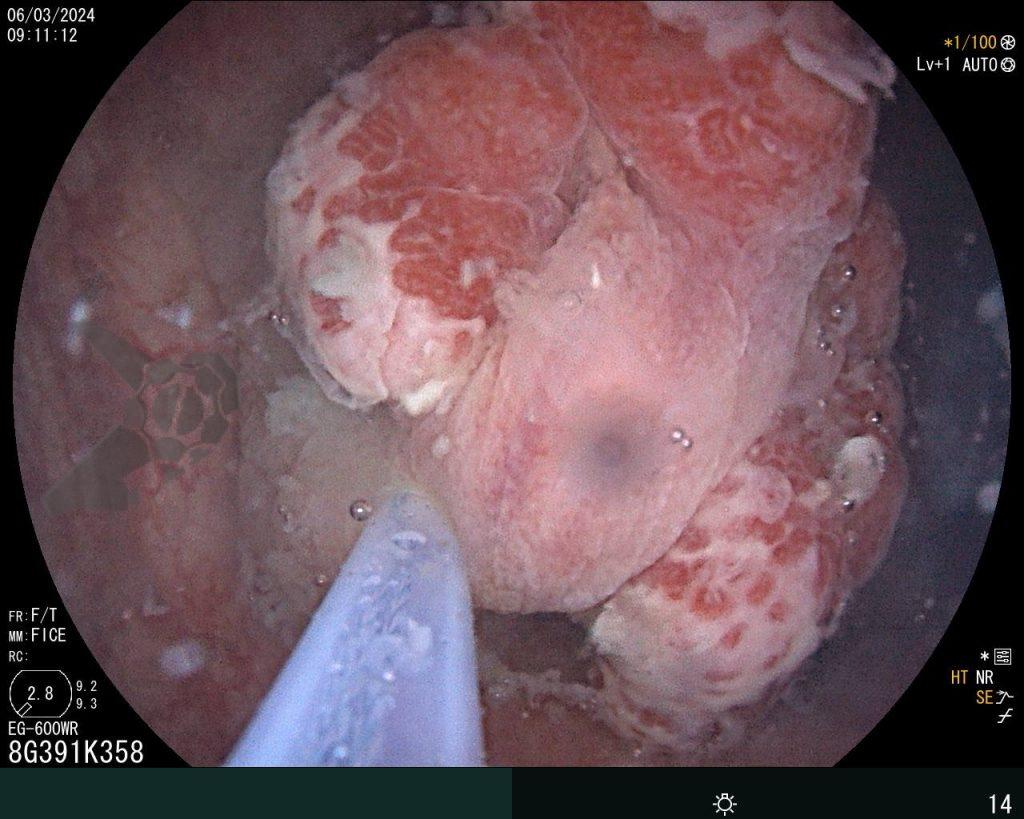
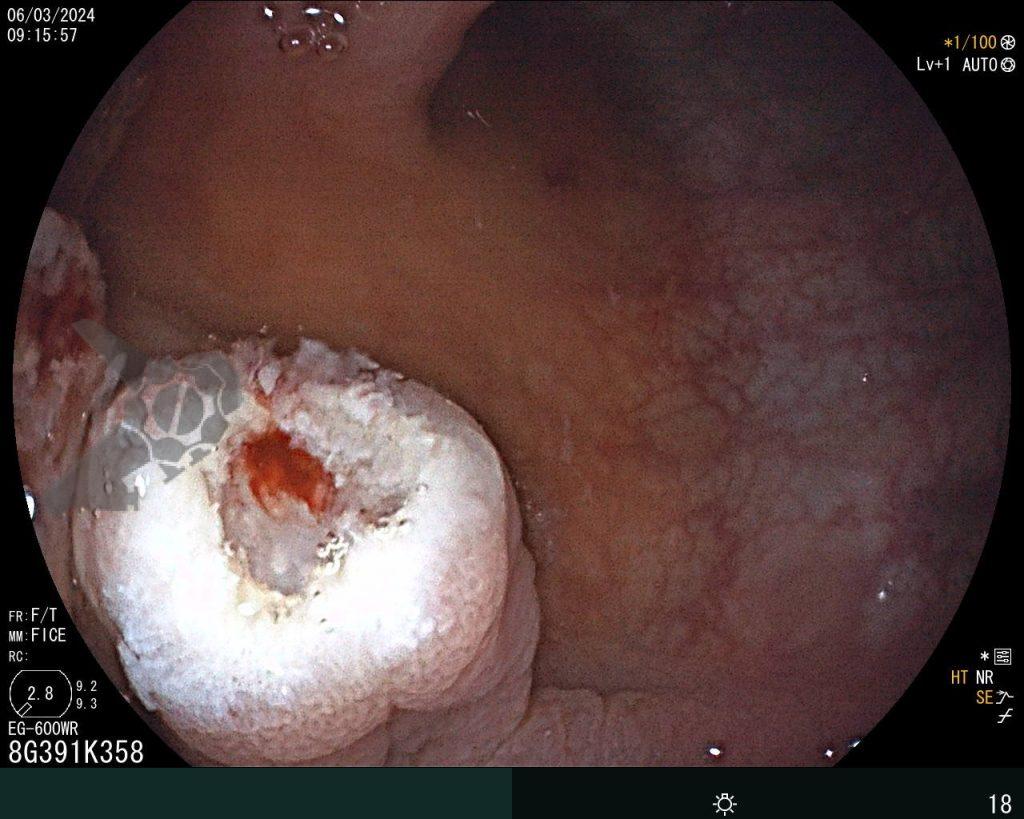
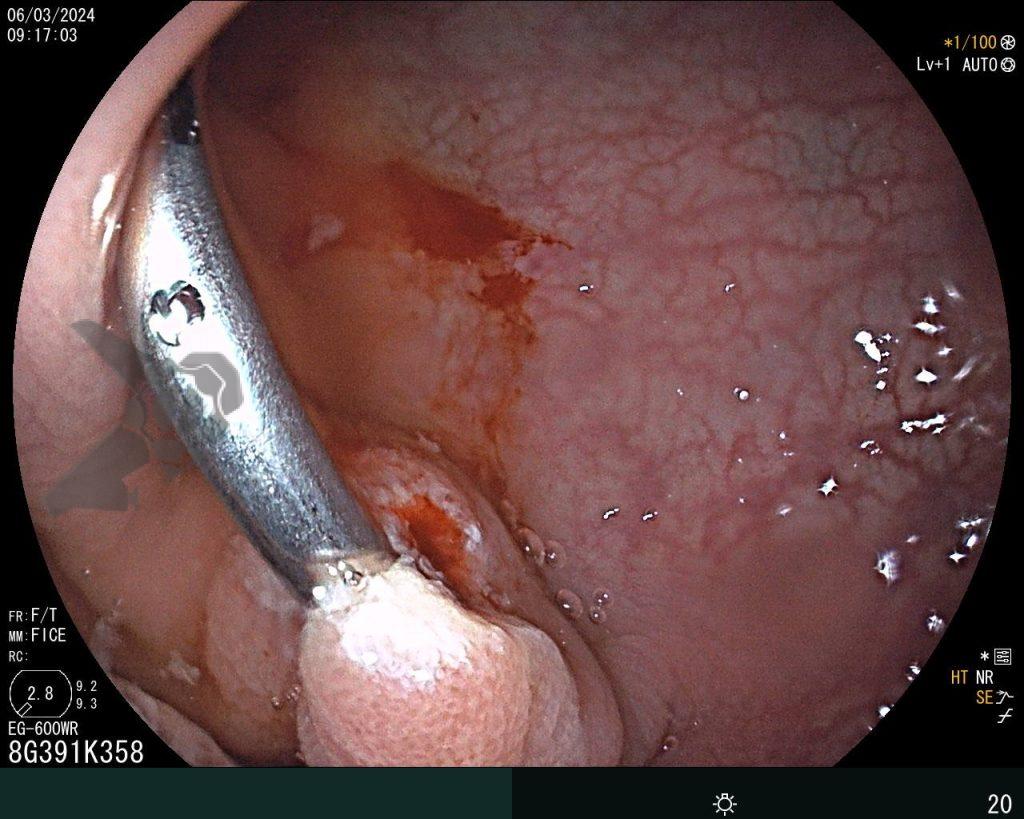
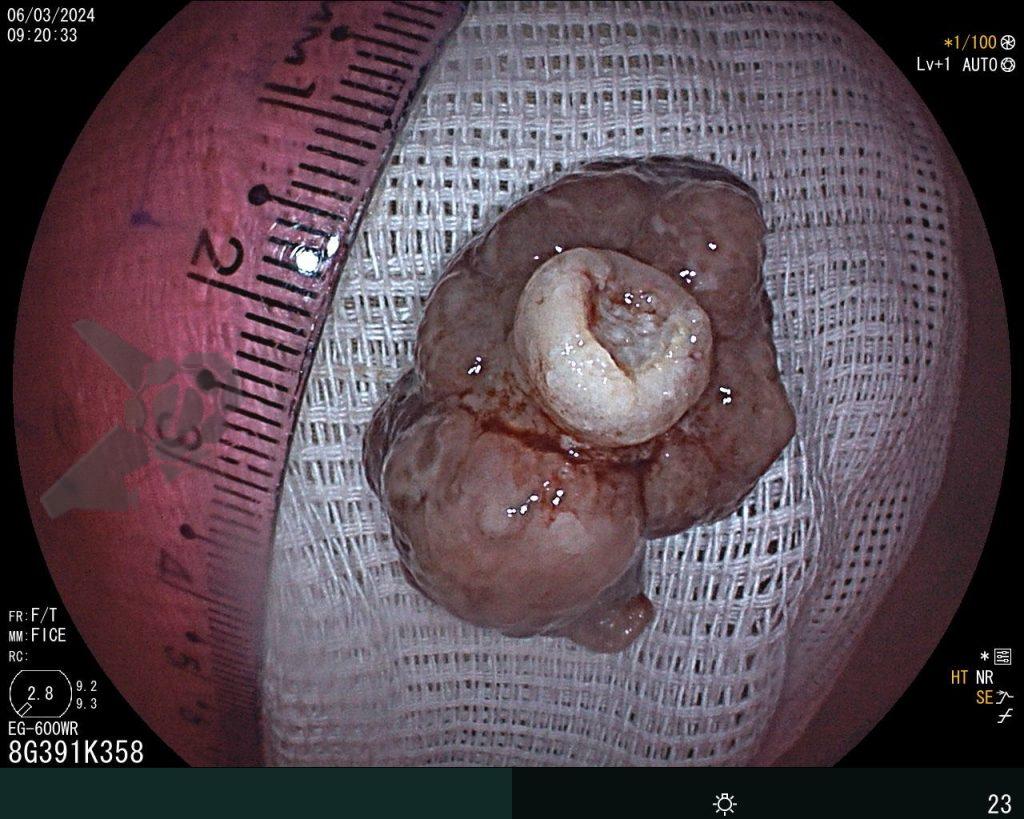
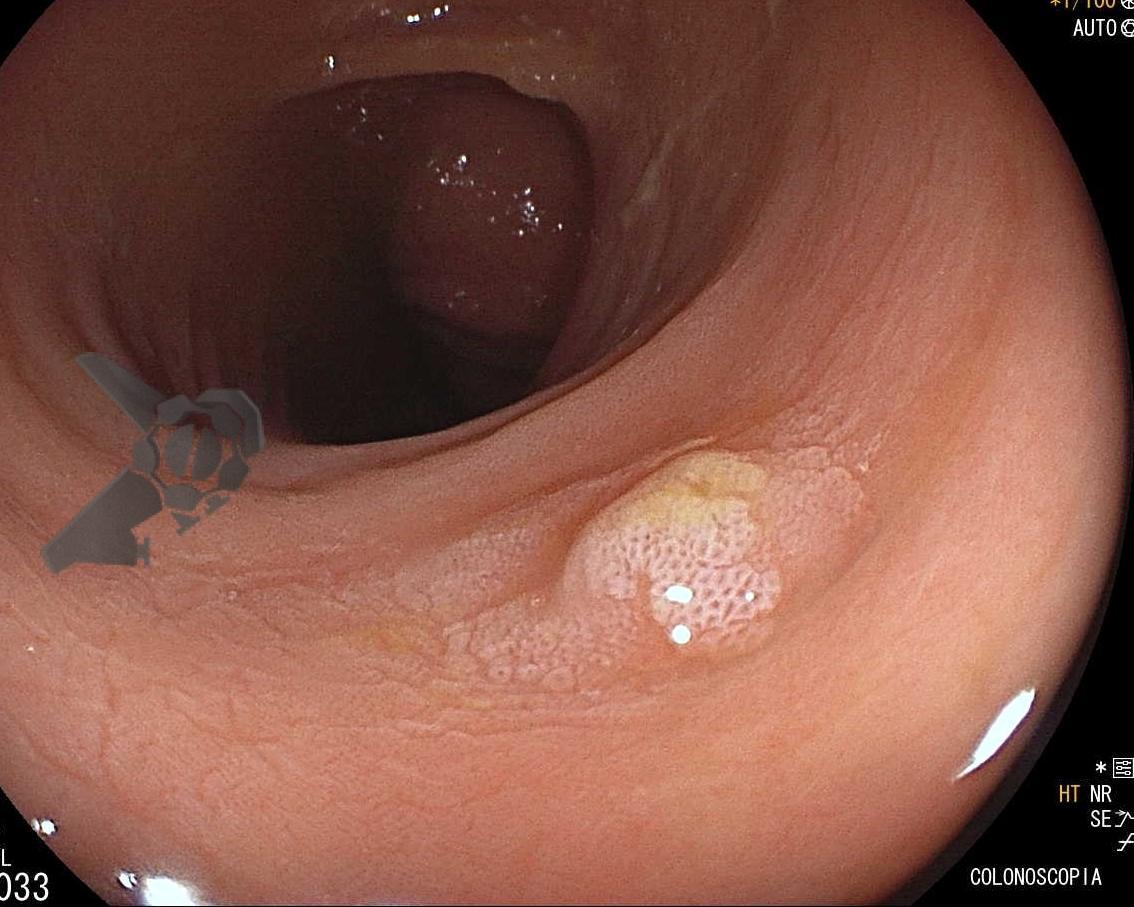
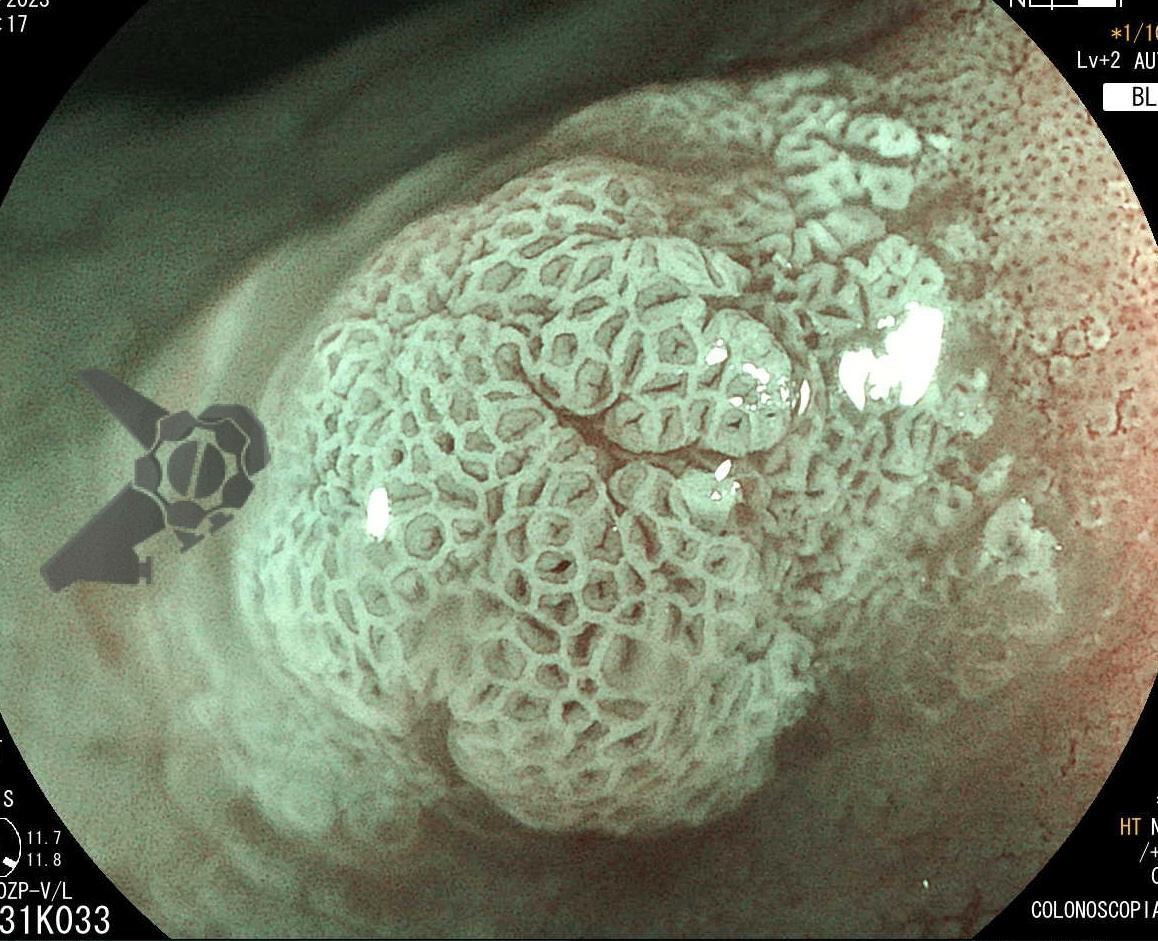
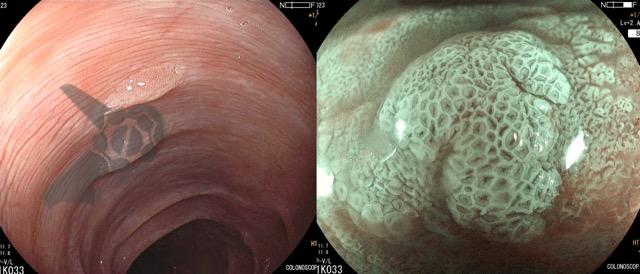
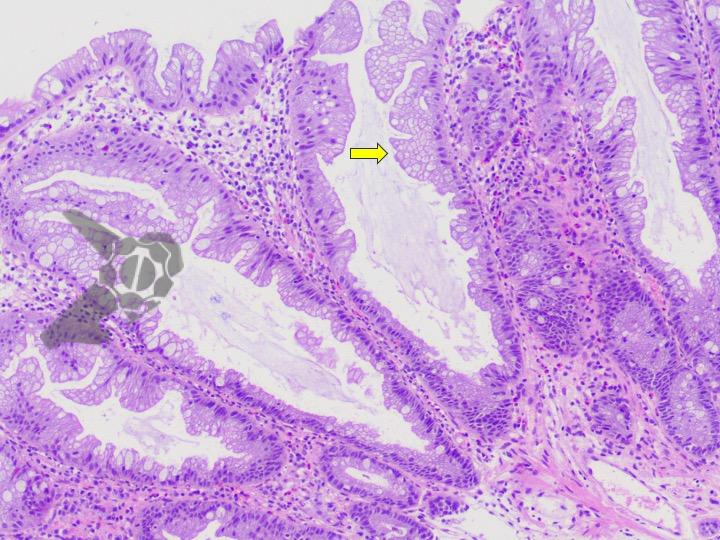
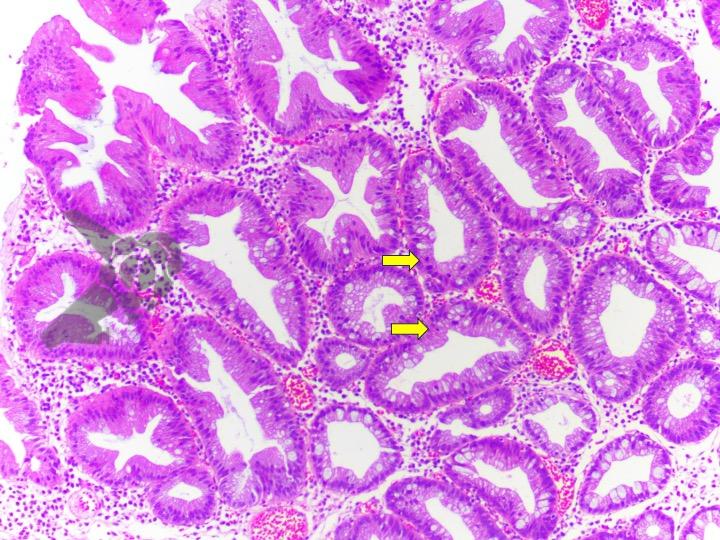
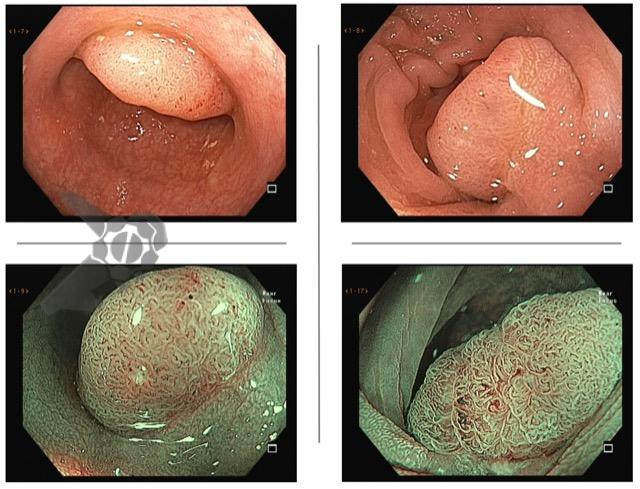
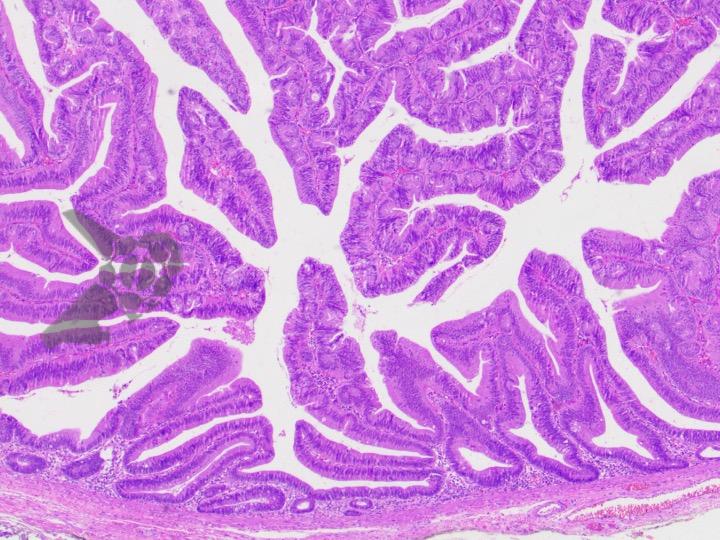
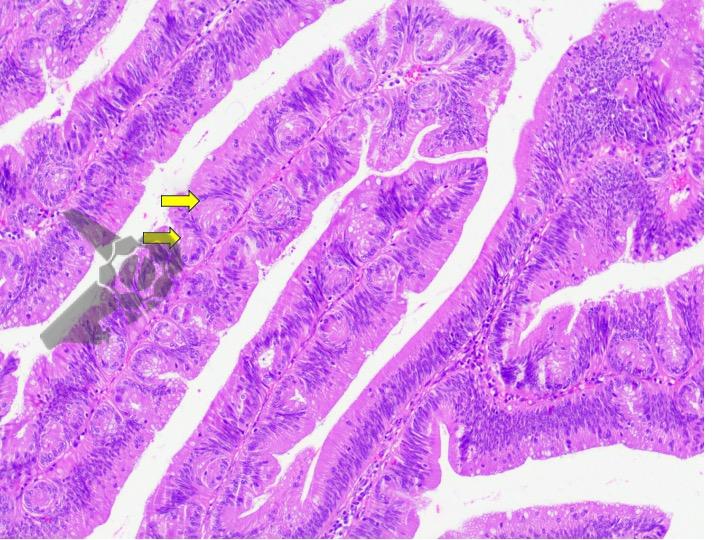
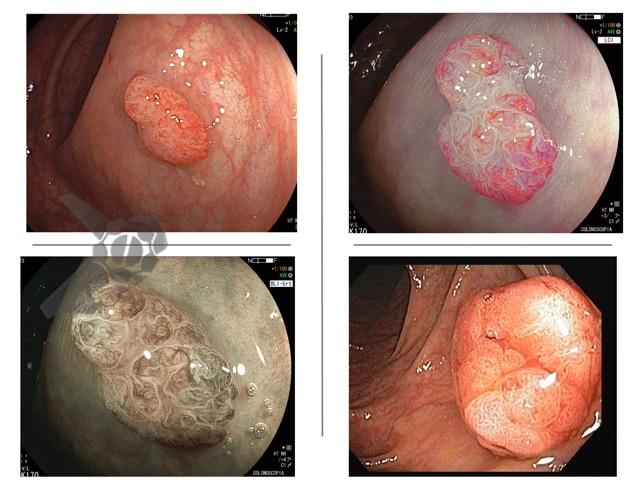
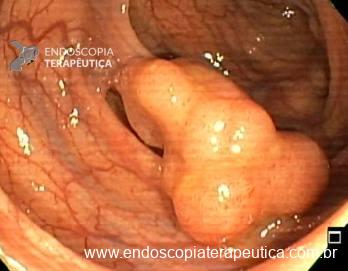
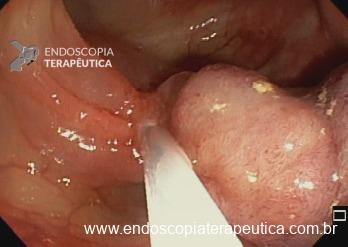
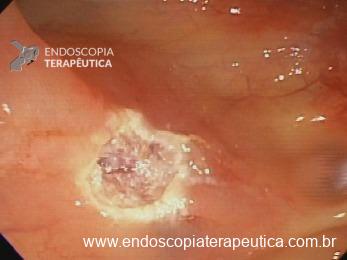
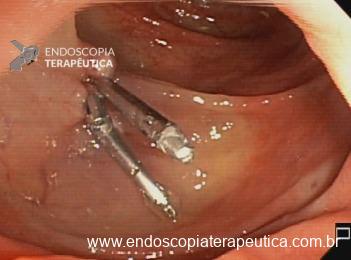
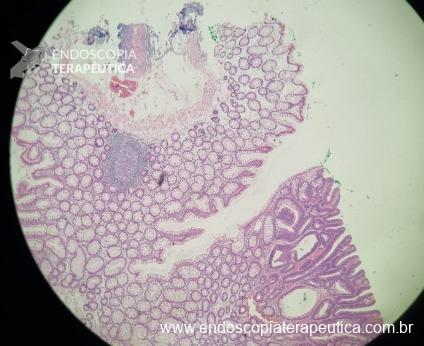
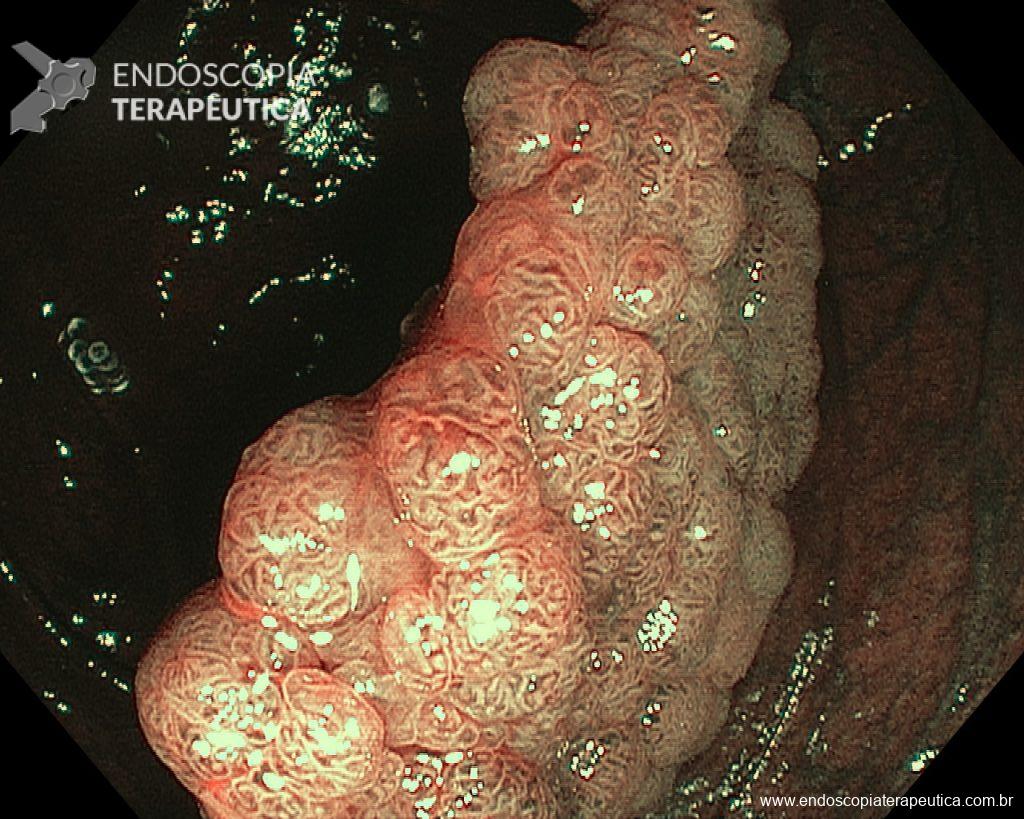
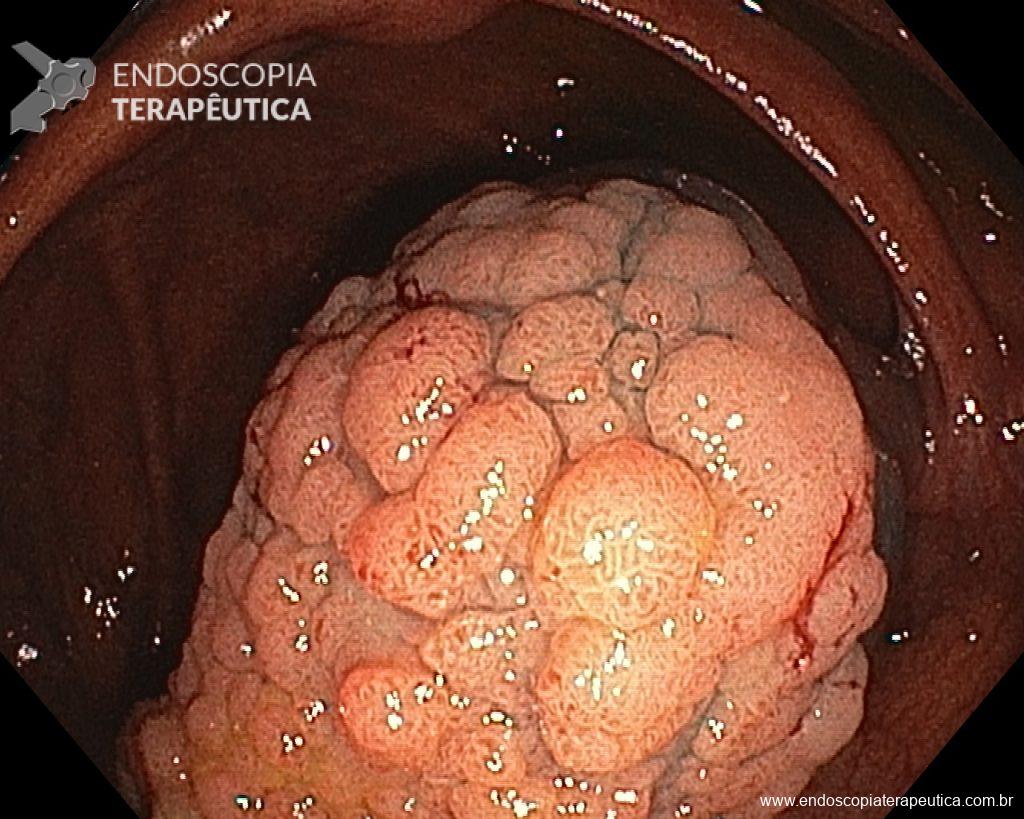
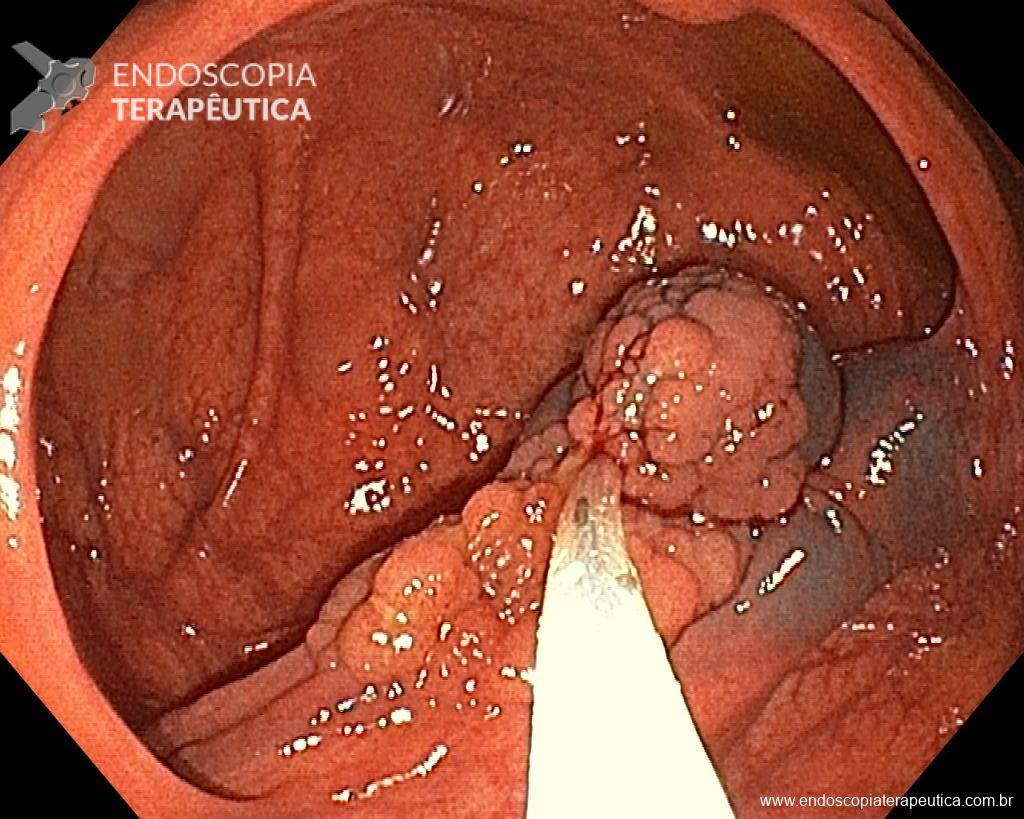
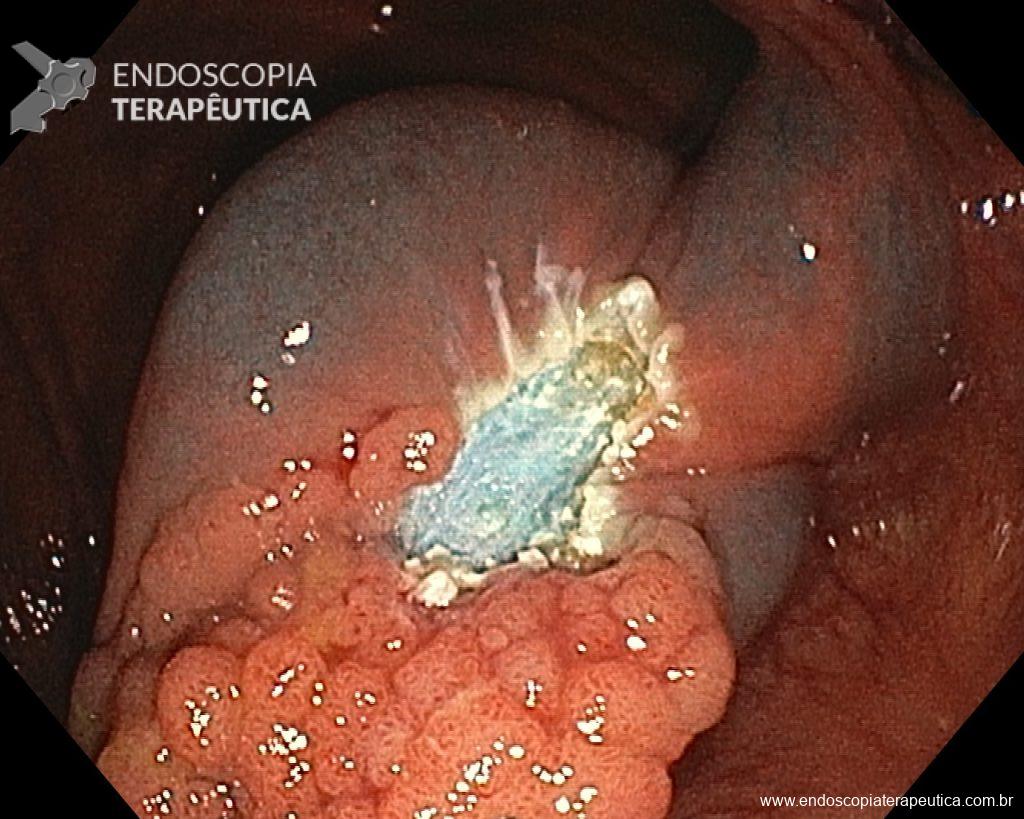
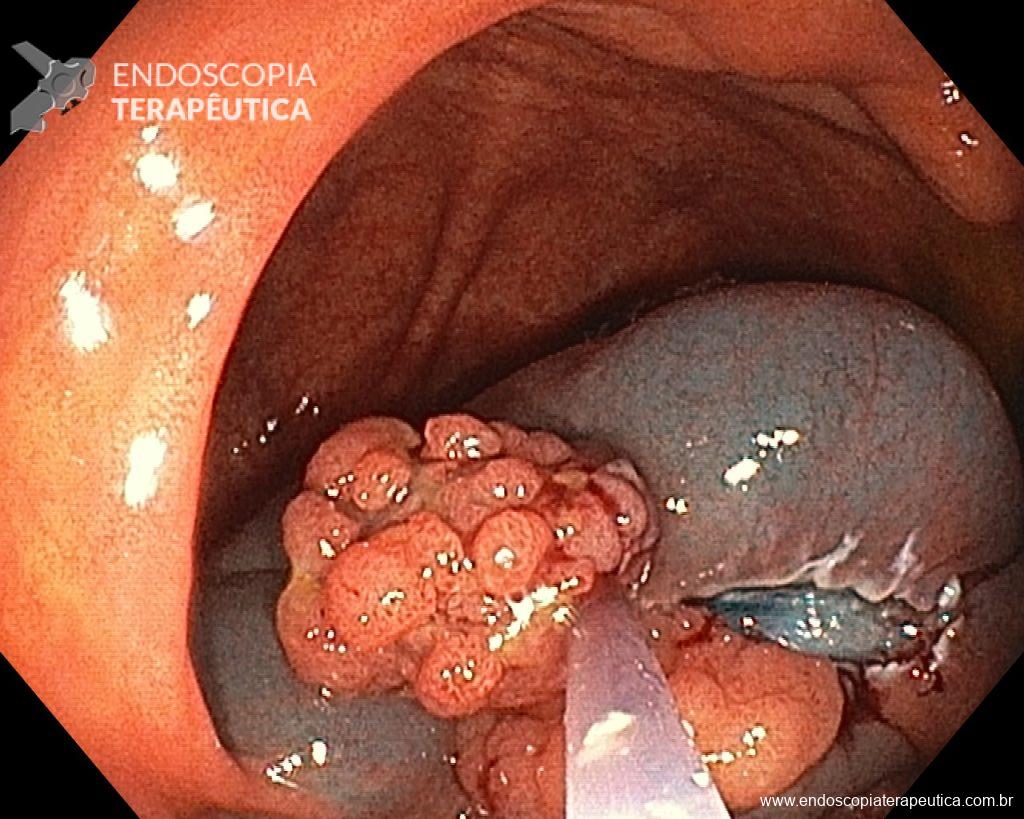
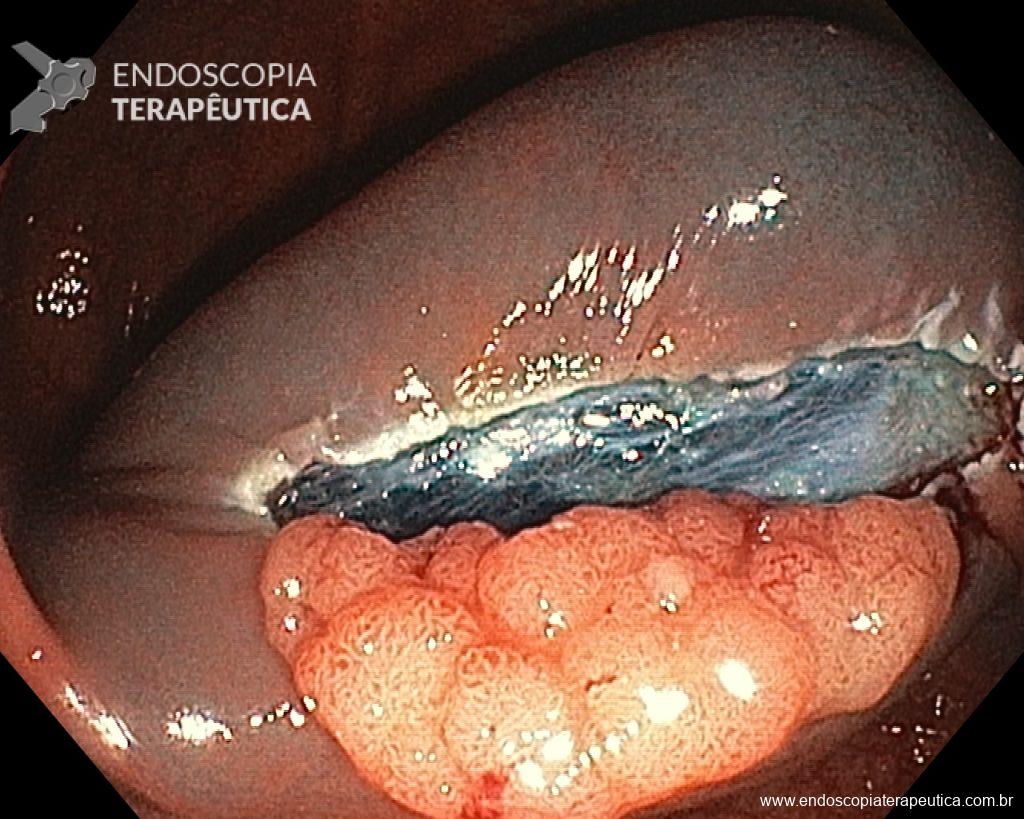
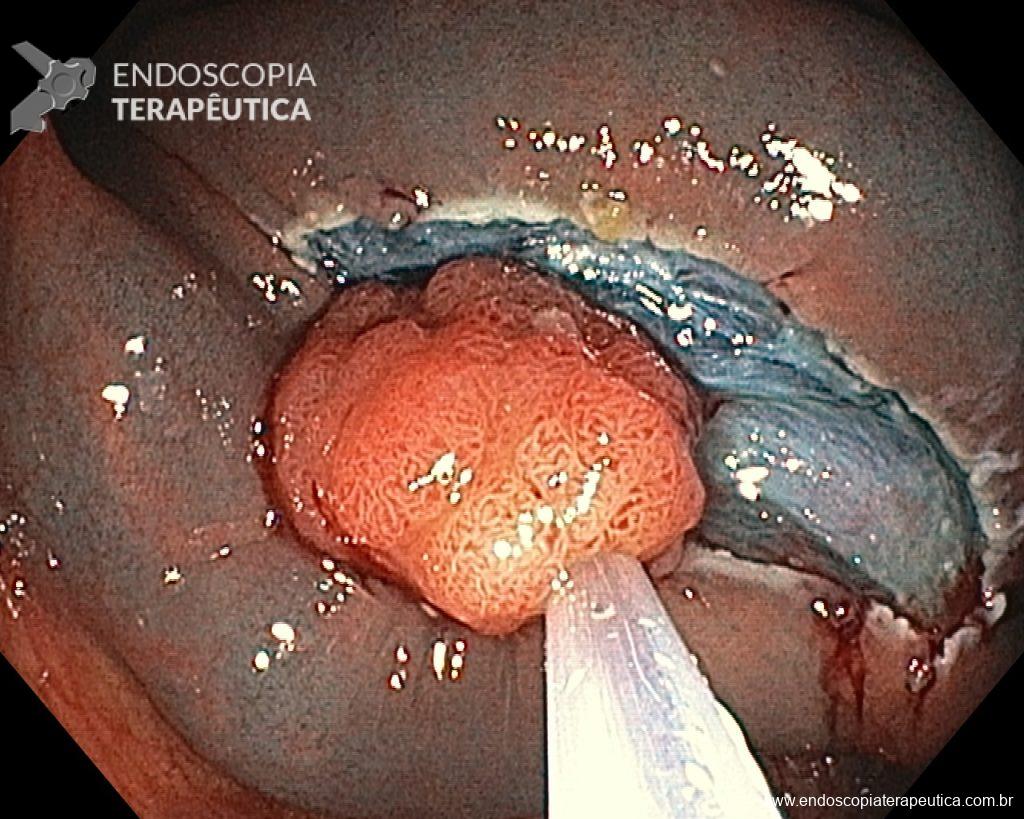
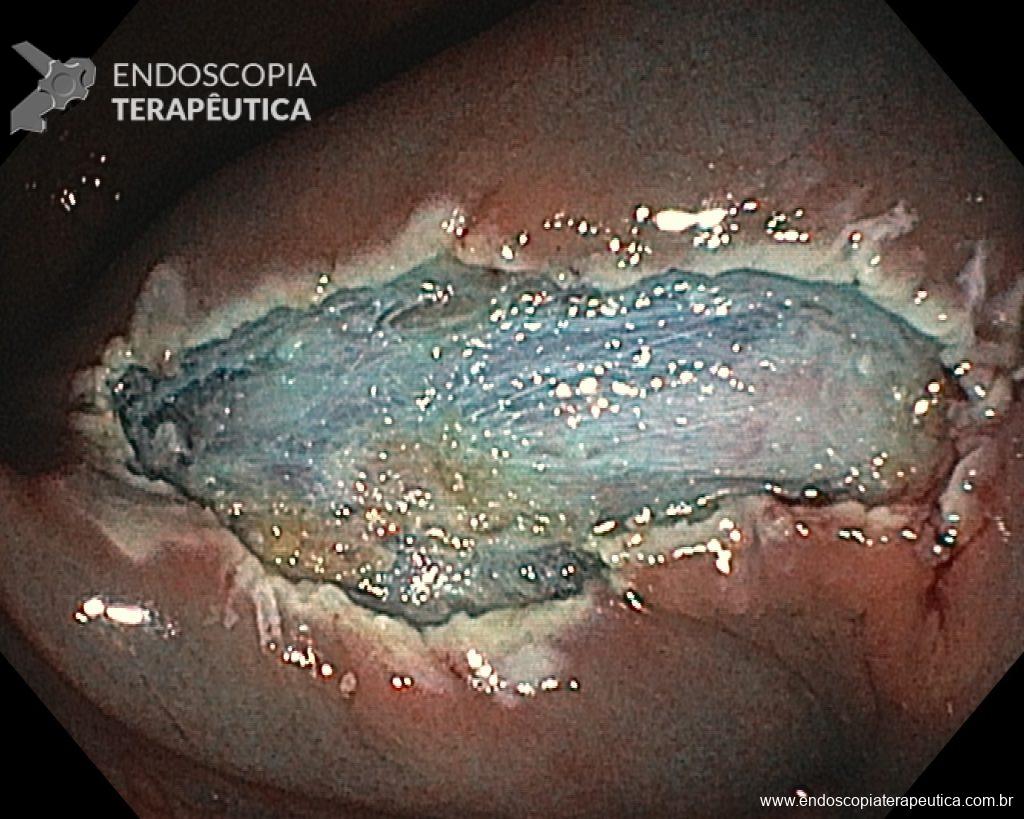
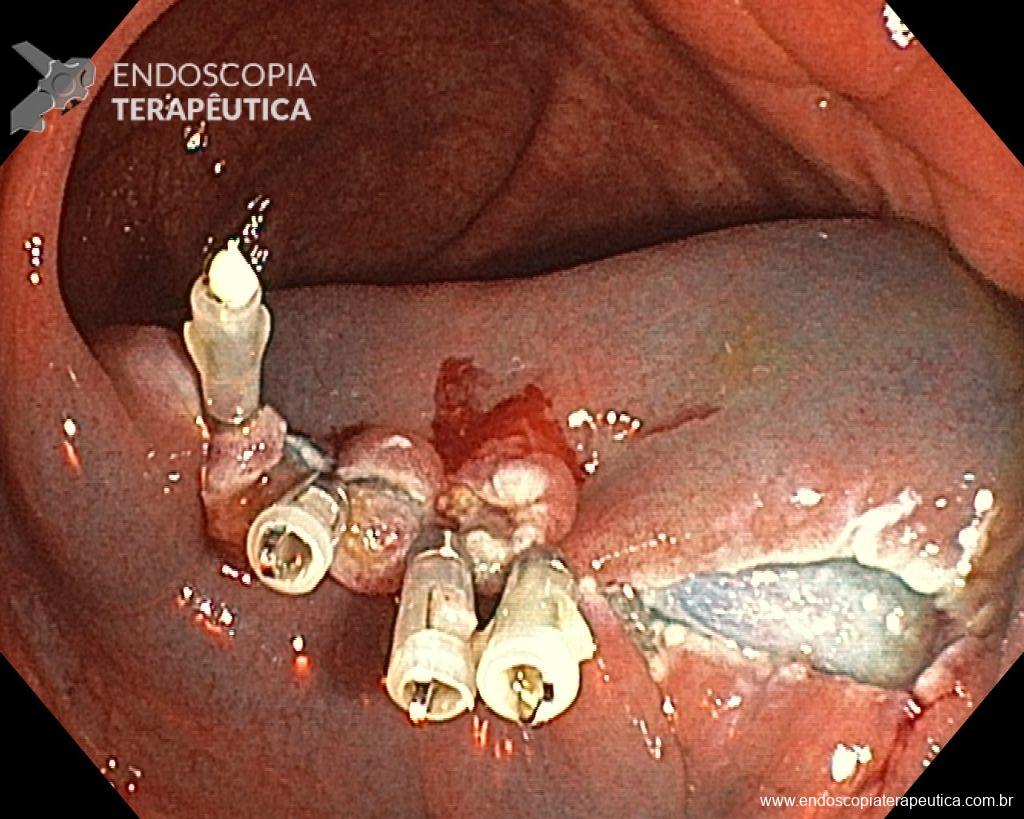
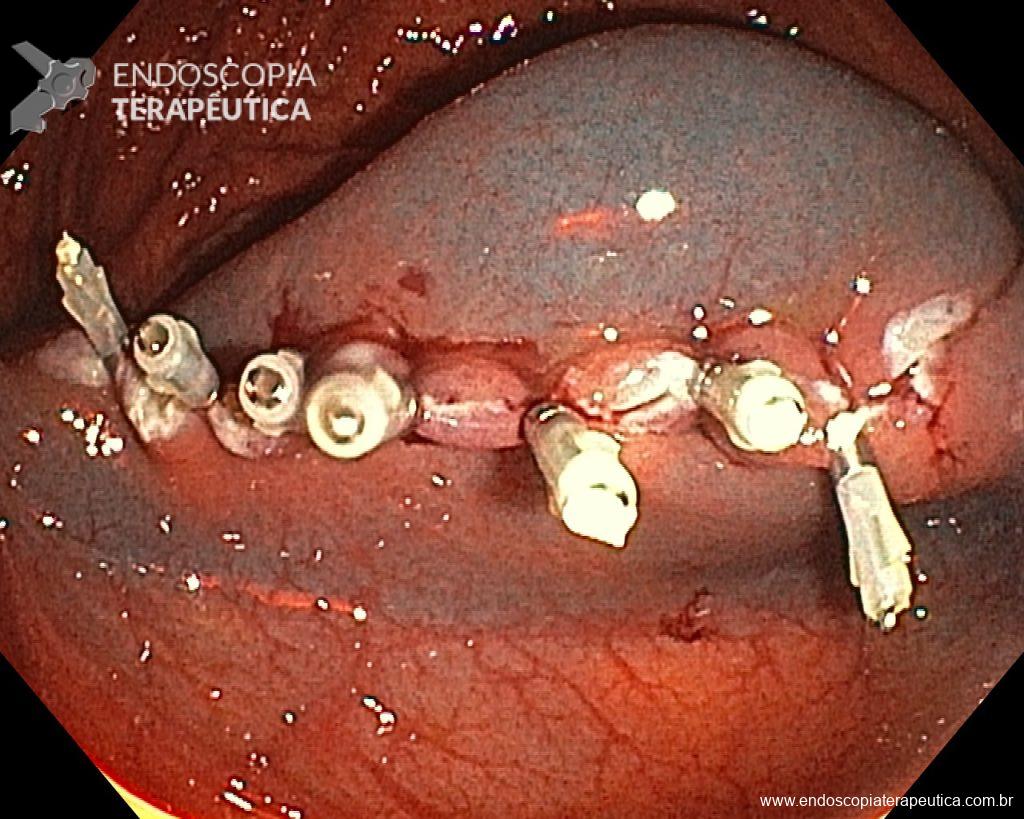
Ressecções de cólon com invasão acima de 1000 micras (sm1), acometimento linfovascular, pouco diferenciadas e budding de alto risco, tem sempre indicação cirúrgica?
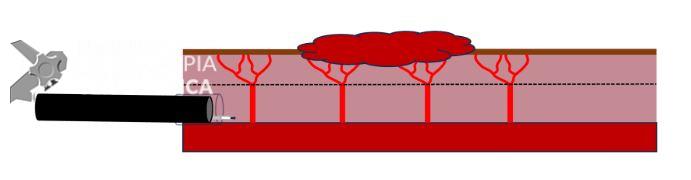
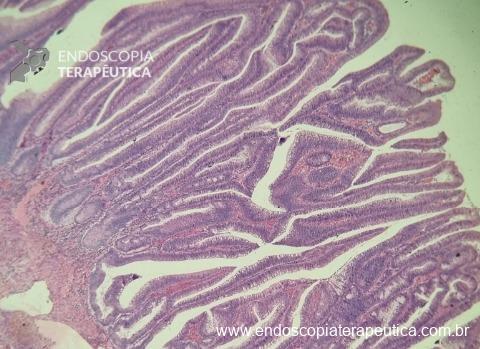
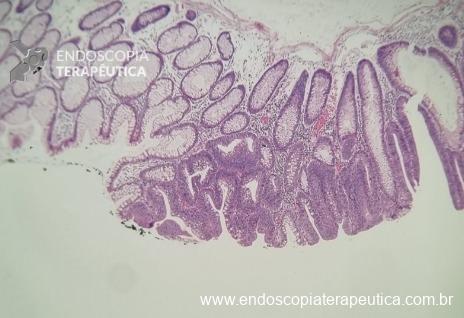
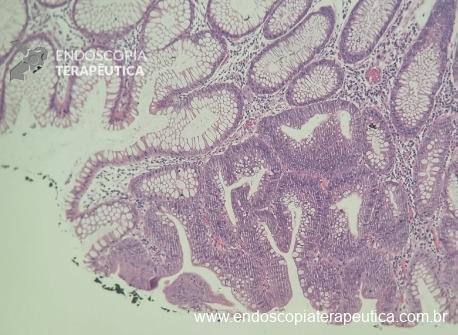
O guideline da ESGE publicado em 2022 recomenda que ressecções R0 em monobloco, com invasão submucosa superficial (sm1), bem a moderadamente diferenciadas, sem invasão linfovascular e sem budding de graus 2 ou 3, devam ser consideradas curativas.1
Isto pois, tumores com pelo menos uma característica citada acima, podem estar associados a um risco acometimento linfonodal de até 20%.2 Dessa forma, tradicionalmente cerca de 65% desses pacientes são submetidos a ressecção cirúrgica.3
No entanto esse é um conceito que está sendo revisto. O mesmo guideline, apesar da baixa qualidade de evidência nesse quesito, sugere que pacientes ressecções R0 atendendo ao critério único de alto risco de invasão submucosa mais profunda que sm1 (bem a moderadamente diferenciada, sem invasão linfovascular e sem budding 2 ou 3), possam ser submetidos a quimioradioterapia ou mesmo apenas acompanhamento, após uma avaliação individual e multidisciplinar.
Essa conduta conservadora já é muito utilizada especialmente para reto. Apesar de lesões nessa topografia serem um fator de risco para acometimento linfonodal (OR 1,36, P = 0,003), as opções cirúrgicas são também mais agressivas do que no cólon (incluindo amputação abdominoperineal) com taxas de mortalidade de 3% e morbidade de até 40%.1,4,5
Pontos Chaves:
Ressecção R0 colônica curativa:
- SM1;
- bem a moderadamente diferenciada;
- sem invasão linfovascular;
- sem budding 2 ou 3.
Ressecção R0 T1 de alto risco (com um fator):
- ≥ 1000µM;
- pouco diferenciada;
- invasão linfovascular;
- budding 2 ou 3.
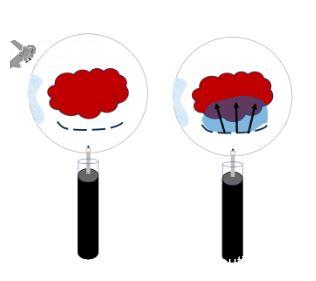
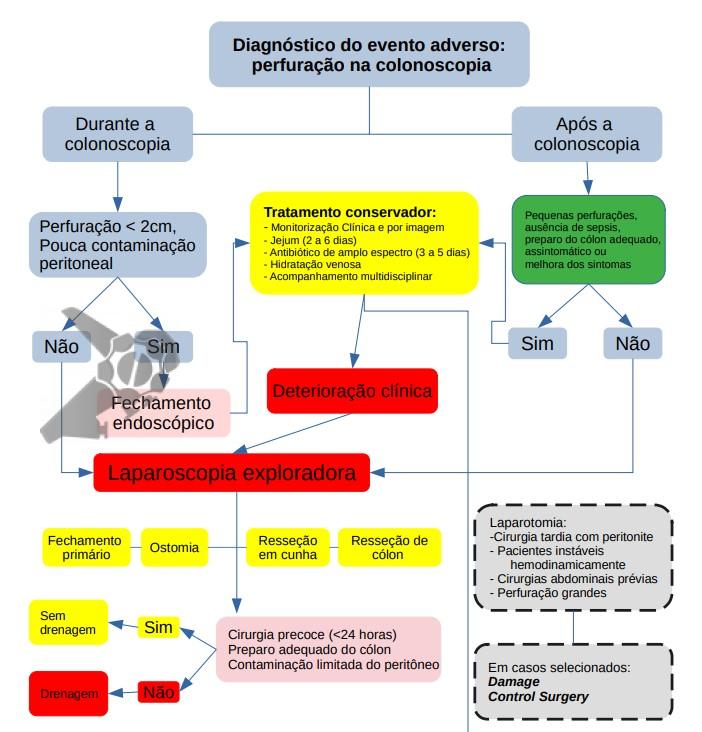
Com objetivo de avaliar pacientes submetidos a resseções R0 de alto risco, um recente estudo publicado comparou retrospectivamente entre 14 centros terciários, pacientes submetidos a complementação cirúrgica versus seguimento conservador (vigilância).6
Foram incluídos pacientes com pelo menos um dos fatores de risco citados e excluídos pacientes sem condições cirúrgicas com objetivo de homogeneizar os grupos. O grupo cirúrgico incluiu 107 pacientes e apresentou mais comumente riscos histopatológicos múltiplos e localização em cólon. No grupo vigilância foram incluídos 90 pacientes, sendo nestes mais prevalentes comorbidades clínicas e utilização da técnica ESD.6
Após um balanceamento das características dos grupos afim de se evitarem vieses, não foram encontradas diferença significativas nas taxas de morte e recorrência do câncer (taxa de risco ponderada 0,95; IC 95%, 0,52 -1,75). Não foram também encontradas diferenças significativas na sobrevida global entre os 2 grupos (1,19; IC 95%, 0,49-2,88) ou na taxa de morte e recorrência de câncer à distância (1,17; IC 95%, 0,66-2,1).6
Em uma análise de sensibilidade restrita a pacientes submetidos à ressecção em monobloco, comparando 87 pacientes submetidos à cirurgia com 75 pacientes controle, não foram encontradas diferenças significativas na taxa de morte e recorrência de câncer entre os grupos (1,42; IC 95%, 0,66-3,04).6
Apesar do contraste destes resultados com trabalhos anteriores, em um recente estudo multicêntrico retrospectivo, que incluiu mais de 200 pacientes submetidos a ESD com achados histopatológicos de alto risco, foram obtidos desfechos semelhantes.7 Numa meta-análise publicada, o risco de recorrência à distância da ressecção endoscópica comparado com ressecção endoscópica seguida de cirurgia adicional, foi também semelhante, 7,2% e 5,6%, respetivamente.8
Mesmo com maior presença de acometimento linfonodal nas ressecções de alto risco, estes pacientes não apresentam pior prognóstico clínico. A teoria que explica isso consiste em que os gânglios preservados são importantes para a educação imunológica, contribuindo para erradicação tumoral local. Entretanto esses achados não foram evidenciados em reto, demonstrando provavelmente um maior efeito imune no cólon.6
Novos estudos sugerem que pacientes com ressecções T1 de alto risco podem não se beneficiar de cirurgia adicional, especialmente na indicação de cirurgias retais ou em pacientes de alto risco cirúrgico. Pacientes devem estar sempre envolvidos na decisão, sendo informados sobre os riscos associados à cirurgia em relação à sua idade e comorbidades e os riscos de recorrência do câncer no longo prazo. Por outro lado, uma localização retal parece associado a um maior risco de recorrência, o que pode necessitar de tratamento adjuvante.
Conclusão:
Ressecção R0 T1 de alto risco, em casos selecionados, pode ser optado pela vigilância ao invés do procedimento cirúrgico. Entretanto lesões de reto ainda devem receber tratamento adjuvante.
Referências
- Pimentel-Nunes P, Libânio D, Bastiaansen BAJ, et al. Endoscopic submucosal dissection for superficial gastrointestinal lesions: European Society of Gastrointestinal Endoscopy (ESGE) guidelinedupdate 2022. Endoscopy 2022;54:591-622.
- Choi JY, Jung SA, Shim KN, et al. Meta-analysis of predictive clinicopathologic factors for lymph node metastasis in patients with early colorectal carcinoma. J Korean Med Sci 2015;30:398.
- Yoda Y, Ikematsu H, Matsuda T, et al. A large-scale multicenter study of long-term outcomes after endoscopic resection for submucosal invasive colorectal cancer. Endoscopy 2013;45:718-24.
- Ragg JL, Watters DA, Guest GD. Preoperative risk stratification for mortality and major morbidity in major colorectal surgery. Dis Colon Rectum 2009;52:1296-303.
- Lujan J, Valero G, Biondo S, et al. Laparoscopic versus open surgery for rectal cancer: results of a prospective multicentre analysis of 4,970 patients. Surg Endosc 2013;27:295-302
- Corre F, Albouys J, Tran VT, et al. Impact of surgery after endoscopically resected high-risk T1 colorectal cancer: results of an emulated target trial. Gastrointest Endosc. 2024 Mar;99(3):408-416.e2. doi: 10.1016/j.gie.2023.09.027. Epub 2023 Oct 2. PMID: 37793506.
- Spadaccini M, Bourke MJ, Maselli R, et al. Clinical outcome of noncurative endoscopic ubmucosal dissection for early colorectal cancer. Gut 2022;71:1998-2004.
- van Oostendorp SE, Smits LJH, Vroom Y, et al. Local recurrence after local excision of early rectal cancer: a meta-analysis of completion TME, adjuvant (chemo)radiation, or no additional treatment. Br J Surg 2020;107:1719-30.
Como citar este artigo
Oliveira JF. Ressecções de cólon com invasão acima de 1000 micras (sm1), acometimento linfovascular, pouco diferenciadas e budding de alto risco, tem sempre indicação cirúrgica? Endoscopia Terapeutica 2024, vol 1. Disponível em: https://endoscopiaterapeutica.net/pt/uncategorized/resseccoes-de-colon-com-invasao-acima-de-1000-micras-sm1-acometimento-linfovascular-pouco-diferenciadas-e-budding-de-alto-risco-tem-sempre-indicacao-cirurgica/