Drenagem biliar ecoguiada: resumo e considerações sobre o guideline americano (ASGE) de 2024
Introdução
A drenagem biliar ecoguiada (EUS-BD) vem ganhando cada vez mais espaço na rotina do ecoendoscopista terapêutico com aumento da disponibilidade de materiais, desenvolvimento de próteses dedicadas e aumento da expertise nos centros de referência. A EUS-BD é uma das principais alternativas – junto com a drenagem biliar transparietohepática (DTPH) – para drenagem biliar após falha da CPRE. A EUS-BD também foi estudada como técnica primária comparada à CPRE. Uma metanálise de 2019 baseada em três ensaios clínicos randomizados comparando EUS-BD x CPRE como técnica primária para drenagem biliar em obstrução maligna distal, demonstrou menor disfunção de prótese na EUS-BD com sucesso técnico, clínico e eventos adversos sem diferenças em relação a CPRE (1). Apesar dos resultados, essa abordagem não ganhou espaço na maioria dos centros, de forma que a indicação mais consagrada da drenagem biliar ecoguiada permanece nos casos de falha da CPRE. Desde 2016, quando foi publicado o primeiro artigo sobre Drenagem Biliar Ecoguiada – Breve Revisão da Literatura neste portal, houve evolução técnica e amadurecimento sobre o tema, que ganhou mais relevância na prática clínica, levando ao desenvolvimento de um guideline pela “American Society for Gastrointestinal Endoscopy” (ASGE), publicado em 2024 (2). Faremos um resumo do guideline da ASGE neste artigo baseado nas 5 questões trabalhadas pelo grupo. Apresentaremos a recomendação formal, a literatura que suportou a recomendação, as considerações colocadas no guideline sobre a questão e um espaço para comentários a respeito da questão feito pelo autor deste artigo.
Definições
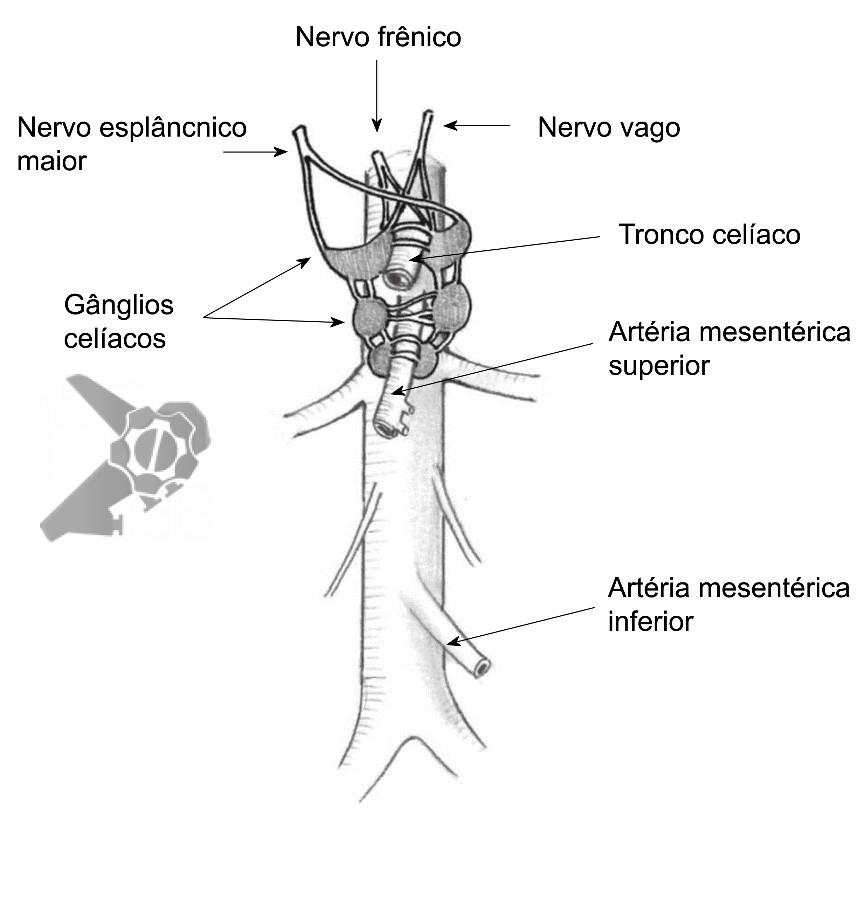
Drenagem biliar ecoguiada (EUS-BD) defini-se pela drenagem utilizando ecoendoscopia para puncionar a via biliar intra ou extra-hepática. Há quatro técnicas descritas: EUS-BD rendezvous, drenagem ecoguiada coledocoduodenal (EUS-CD), drenagem ecoguiada hepatogástrica (EUS-HG) e drenagem anterógrada.
- EUS-BD rendezvous: punção ecoguiada da via biliar seguida de progressão do fio-guia até o duodeno (transpapilar). Troca de aparelho por duodenoscópio e canulação transpapilar auxiliada pelo fio-guia
- EUS-CD: drenagem ecoguiada com prótese da via biliar extra-hepática através da janela bulbar, conectando a via biliar extra-hepática e o duodeno
- EUS-HG: drenagem ecoguiada com prótese da via biliar intra-hepática esquerda através da janela gástrica, conectando a via biliar intra-hepática esquerda com o estômago
- Drenagem ecoguiada da vesícula biliar (EUS-VB): drenagem ecoguiada da vesícula biliar com prótese através da janela gástrica ou bulbar, conectando a vesícula biliar com o estômago ou o duodeno
- CPRE por acesso transgástrico ecoguiado: passagem de prótese metálica com aposição de lumens (LAMS) conectando o estômago excluso e o “pouch” ou o jejuno, possibilitando a progressão do duodenoscópio até o duodeno, em pacientes submetidos a gastroplastia redutora (“bypass”)
- GATE (“Gastric Access Temporary for Endoscopy”): um termo mais amplo para técnica de conexão do estômago excluso com o “pouch” ou jejuno. Pode ser usado para realização de CPRE, ressecção/biópsias de lesões, sangramentos e outros motivos
- EDGE (“Endoscopic Ultrasound Directed Transgastric ERCP”): termo mais específico para quando se faz um GATE para a realização de CPRE
- OBS: muitas vezes GATE e EDGE são usados como sinônimos
Questões e recomendações da ASGE
EUS-BD vs. DTPH para pacientes com obstrução biliar após falha da CPRE
- Recomendação: sugere EUS-BD em relação à DTPH em obstrução biliar após falha da CPRE (recomendação condicional, baixa qualidade de evidência)
- Literatura: foram identificados 2 ensaios clínicos randomizados (ECR) e 11 estudos observacionais, com total de 379 pacientes no grupo EUS-BD e 376 no DTPH. A metanálise dos desfechos demonstrou menos eventos adversos e menos necessidade de reintervenção no grupo EUS-BD. Sucesso técnico e mortalidade em 30 dias foram iguais entre os grupos. Em relação ao sucesso clínico, as coortes demonstraram maior taxa no grupo EUS-BD enquanto nos dois ECR não houve diferença entre os grupos.
- Considerações:
- Suspeita de doença benigna: EUS-BD por rendezvous é a técnica preferida
- Pacientes com ascite volumosa: considerar drenar ascite antes da drenagem biliar
- Pacientes com possibilidade cirúrgica: discutir melhor via de drenagem com equipe cirúrgica
- DTPH é preferível se: instabilidade hemodinâmica, suspeita de etiologia maligna, falta de expertise/material adequado para EUS-BD
- Comentários: na discussão fica claro o receio dos autores em relação a possibilidade cirúrgica após EUS-BD, especialmente se realizada drenagem transmural coledocoduodenal, sendo recomendado nesses casos sempre discussão em equipe multidisciplinar. Um ponto controverso nessa primeira questão foi que, dentre as situações preferíveis para DTPH, foi colocado a etiologia maligna suspeita, porém na discussão não foi explicada essa questão. Dessa forma, ficou bastante controverso uma recomendação favorecendo EUS-BD no geral, porém dando preferência à DTPH em casos de suspeita de etiologia maligna, pois a grande maioria dos casos de obstrução biliar com falha de acesso pela CPRE são neoplásicas.
EDGE vs. CPRE assistida por laparoscopia (CPRE-LA) vs. CPRE por enteroscopia (CPRE-E) em pacientes com gastroplastia redutora tipo “by-pass” (BGYR) e obstrução biliar
- Recomendação: sugere EDGE como primeira opção para pacientes com BGYR e indicação de CPRE (recomendação condicional, baixa qualidade de evidência)
- Literatura: foram identificados 4 estudos observacionais e nenhum ECR, com total de 176 pacientes no grupo EDGE, 396 no CPRE-LA e 172 no CPRE-E. A metanálise dos desfechos comparando EDGE vs. CPRE-E demonstrou o grupo EDGE com maior sucesso tanto técnico quanto clínico, menos eventos adversos, menor necessidade de reintervenção e menor tempo de procedimento. A metanálise dos desfechos comparando EDGE vs. CPRE-LA demonstrou sucesso técnico, sucesso clínico e eventos adversos sem diferença entre os grupos, porém EDGE teve um menor tempo de procedimento.
- Considerações:
- EDGE é especialmente preferível à CPRE-LA quando: suspeita de lesão ampular, doença maligna ou necessidade de repetir CPRE no futuro
- CPRE-LA é preferível à EDGE quando o paciente tem indicação de colecistectomia
- Quando não há janela segura para EDGE, CPRE-LA ou CPRE-E podem ser realizadas
- Fístula gastrogástrica persistente pós-GATE: 9% em seguimento médio de 182 dias; não houve ganho de peso nesses pacientes. Os autores consideram que o reganho de peso pós-GATE não deve ser uma preocupação.
- Comentários: além dos óbvios vieses e limitações da metanálise de apenas 4 estudos observacionais, o que enfraquece a recomendação, é importante lembrar que o procedimento de EDGE é geralmente realizado em 2 tempos – acesso gastrogástrico com LAMS no primeiro momento e, cerca de 7 dias após, é feita a CPRE através da prótese num segundo momento. Apesar de alguns centros já realizarem EDGE em tempo único – especialmente em casos de emergência como colangite -, a técnica padrão preconizada ainda é em dois tempos. Dessa forma, quando observamos que a única diferença na metanálise entre EDGE e CPRE-LA foi o tempo de procedimento, devemos lembrar que se trata da soma dos tempos de procedimento dos dois tempos da EDGE versus o tempo total da CPRE-LA. Ou seja, o tempo “líquido” da EDGE foi menor, porém – considerando o procedimento em duas etapas – o tempo “bruto” (tempo decorrido do início do procedimento até a resolução da obstrução biliar) certamente foi menor na CPRE-LA.
EDGE vs. CPRE-E vs. DTPH em pacientes com outras alterações anatômicas cirúrgicas (Bilrroth II, pancreaticoduodenectomia, hepaticojejunostomia em Y de Roux) e obstrução biliar
- Recomendação: sugere E-CPRE como abordagem inicial em pacientes com outras alterações anatômicas e obstrução biliar. Na falha, tanto EUS-BD quanto DTPH podem ser realizados (recomendação condicional, baixa qualidade de evidência).
- Literatura: foram identificados 15 estudos observacionais e nenhum ECR, sendo 3 comparando EUS-BD vs. CPRE-E e 12 comparando EUS-BD vs DTPH. No total, foram estudados 299 pacientes no grupo EUS-BE, 92 no CPRE-E e 89 DTPH. A metanálise dos desfechos comparando EUS-BD vs. CPRE-E demonstrou maior sucesso técnico e clínico no grupo EUS-BD, porém com mais eventos adversos. A metanálise dos desfechos comparando EUS-BD vs. DTPH não demonstrou diferença entre os grupos em relação ao sucesso técnico, sucesso clínico, necessidade de reintervenção e eventos adversos.
- Considerações:
- CPRE-E foi sugerida como 1ª opção devido a menor taxa de eventos adversos, apesar de sucesso técnico e clínico menor que a EUS-BD
- O sucesso técnico da CPRE-E está diretamente relacionada ao tamanho da alça intestinal a ser percorrida até o acesso biliar. Os autores sugerem sempre que possível verificar a descrição cirúrgica para identificar esse dado e direcionar a melhor técnica
- EUS-BD: é necessária dilatação da via biliar intra-hepática esquerda para possibilidade técnica nesses casos
- Comentários: a recomendação de se tentar a CPRE-E como primeira opção é bastante racional tendo em vista a baixa taxa de eventos adversos envolvidos. Porém, em cirurgias com reconstrução em Y com alças longas, o sucesso técnico da CPRE-E é bastante reduzido, tanto pela dificuldade de acesso à anastomose enterobiliar quanto pela dificuldade e indisponibilidade de materiais dedicados à CPRE apropriados ao enteroscópio – que é mais longo e com canal de trabalho geralmente menor que o duodenoscópio. Apesar de não terem especificado quantos pacientes realizaram cada tipo de cirurgia em cada grupo – o que muda completamente o cenário -, podemos supor que uma quantidade considerável foram pacientes submetidos a gastrectomia com reconstrução a Billroth II, e o acesso à papila duodenal nesses casos pode ser realizada com gastroscópio, colonoscópio ou mesmo duodenoscópio, o que supera as limitações do uso do enteroscópio para CPRE. Dessa forma, utilizar a via enteral para realizar CPRE em paciente com Billroth II como primeira opção – preferencialmente utilizando outros aparelhos que não ou enteroscópio – é bastante óbvia. Por outro lado, em pacientes com reconstrução em Y de Roux e alças longas, a possibilidade de DTPH ou EUS-BD como técnicas primárias podem ser consideradas – apesar de uma primeira tentativa por CPRE-E ser válida.
EUS-VB vs. drenagem percutânea (DP-VB) vs. drenagem transcística por CPRE (CPRE-VB) para colecistite aguda em pacientes não cirúrgicos
- Recomendação: sugere EUS-VB para resolução da colecistite aguda em pacientes não cirúrgicos (recomendação condicional, baixa qualidade de evidência).
- Literatura: foram identificados 7 estudos observacionais e 1 ECR, sendo 5 comparando EUS-VB vs. DP-VB – incluindo 1 ECR – e 3 comparando EUS-VB vs. CPRE-VB. No total, foram estudados 346 pacientes no grupo EUS-VB, 276 no PT-VB e 163 CPRE-VB . A metanálise dos desfechos comparando EUS-VB vs. DP-VB demonstrou menor necessidade de reintervenção, menor readmissão e menor necessidade de colecistectomia no grupo EUS-VB. Não houve diferença na mortalidade em 30 dias nem no sucesso clínico. No ECR comparando as duas técnicas, ainda houve menos eventos adversos e menos colecistite recorrente após a drenagem no grupo EUS-VB. Os estudos observacionais a PT-VB apresentou maior sucesso técnico. Nos estudos comparando EUS-VB vs. CPRE-VB, a metanálise dos desfechos demonstrou maior sucesso técnico, maior sucesso clínico, menos pancreatite pós procedimento e menos colecistite recorrente no grupo EUS-VB. Não houve diferença em relação a mortalidade em 30 dias, eventos adversos, necessidade de reintervenção e necessidade de colecistectomia.
- Considerações:
- Preferência por DP-VB: perfuração da vesícula biliar; colecistite enfisematosa; instabilidade clínica; indisponibilidade de EUS-VB
- Preferência maior por EUS-VB: prótese metálica ocluindo o ducto cístico; grande quantidade de cálculos na vesícula biliar
- Evitar EUS-VB em pacientes candidatos a cirurgia após melhora clínica (colecistectomia ao transplante hepático)
- Preferência por CPRE-VB: ascite volumosa; infiltração maligna da vesícula biliar; coagulopatia severa; indicação de CPRE por outro motivo (ex: coledocolitíase associada)–
- Comentários: apesar da recomendação ser preferencialmente por EUS-VB, há dois principais pontos que devem ser considerados. O primeiro é em relação ao custo e disponibilidade da prótese adequada – que deve ser preferencialmente uma LAMS com eletrocautério. Apesar dos autores não terem identificado desfecho de custo nos estudos, sabemos que se trata de material mais caro e menos disponível que o dreno percutâneo na grande maioria dos hospitais, especialmente em países em desenvolvimento como o Brasil. O segundo ponto de atenção é em relação a possibilidade de colecistectomia após melhora clínica. Os autores colocam que deve ser evitada EUS-VB nesses pacientes pois a presença da prótese metálica transgástrica ou transduodenal pode dificultar a execussão da colecistectomia, de forma que a EUS-VB deve ser considerada em pacientes que não seriam candidatos a cirurgia mesmo antes do evento agudo – como pacientes com demência avançada, oncológicos avançados, paliativos em geral e outros -, limitando bastante o espectro de pacientes no qual a EUS-VB seria de fato a primeira opção.
Algoritmos
Com a intenção de sintetizar as recomendações, os autores sugeriram três algoritmos – traduzidos e adaptados a seguir – para o manejo das condições abordadas no guideline. É importante enfatizar que, devido a baixa qualidade de evidência de todas as recomendações e as inúmeras condições e considerações colocadas em cada questão, os algoritmos sugeridos devem ser utilizados com parcimônia e crítica.
Algoritmo proposto para drenagem biliar após falha da CPRE
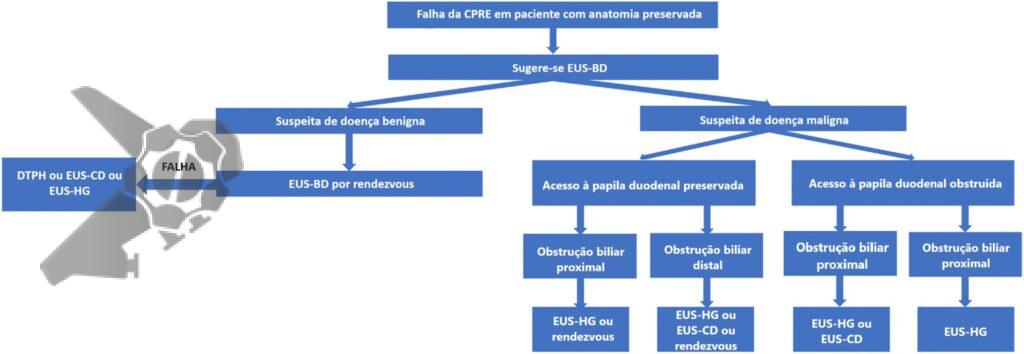
CPRE: colangiopancreatografia retrógrada endoscópica; EUS-BD: drenagem biliar ecoguiada; DTPH: drenagem transparietohepática; EUS-CD: drenagem ecoguiada coledocoduodenal; EUS-HG: drenagem ecoguiada hepatogástrica. Adaptado de “American Society for Gastrointestinal Endoscopy guideline on the role of therapeutic EUS in the management of biliary tract disorders: summary and recommendations”, GIE, 2024 (2)
Algoritmo proposto para drenagem biliar em pacientes com “bypass’ gástrico em Y de Roux
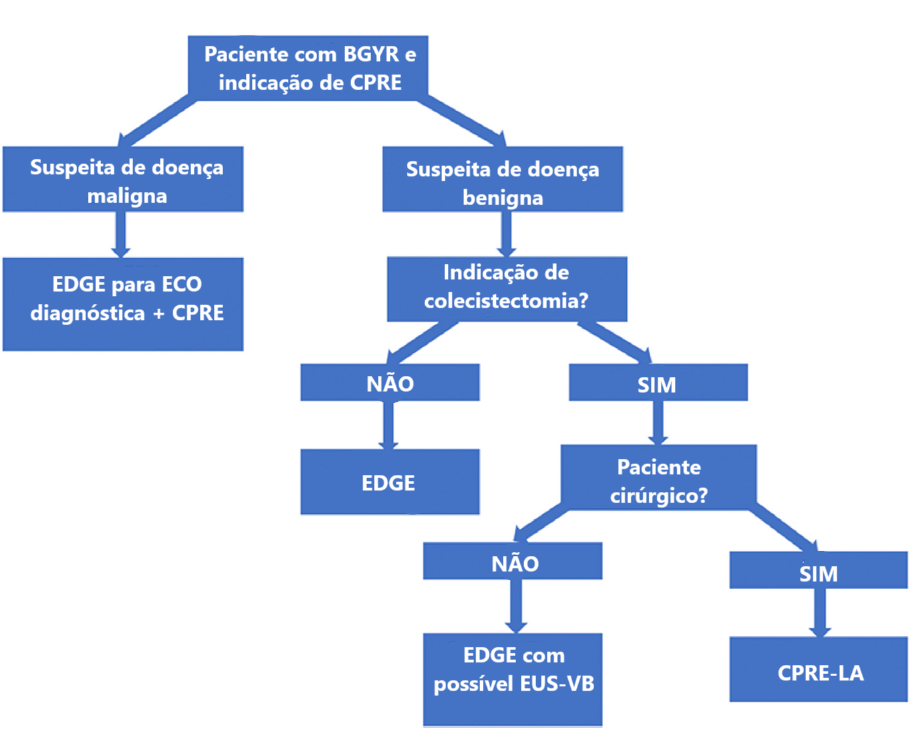
BGYR: by-pass gástrico em Y de Roux; CPRE: colangiopancreatografia retrógrada endoscópica; EDGE: “Endoscopic Ultrasound Directed Transgastric ERCP”; ECO: ecoendoscopia digestiva alta; EUS-VB: drenagem ecoguiada da vesícula biliar; CPRE-LA: CPRE assistida por laparoscopia. Adaptado de “American Society for Gastrointestinal Endoscopy guideline on the role of therapeutic EUS in the management of biliary tract disorders: summary and recommendations”, GIE, 2024 (2)
Algoritmo proposto para pacientes com colecistite aguda sem condições cirúrgicas com necessidade de drenagem da vesícula biliar
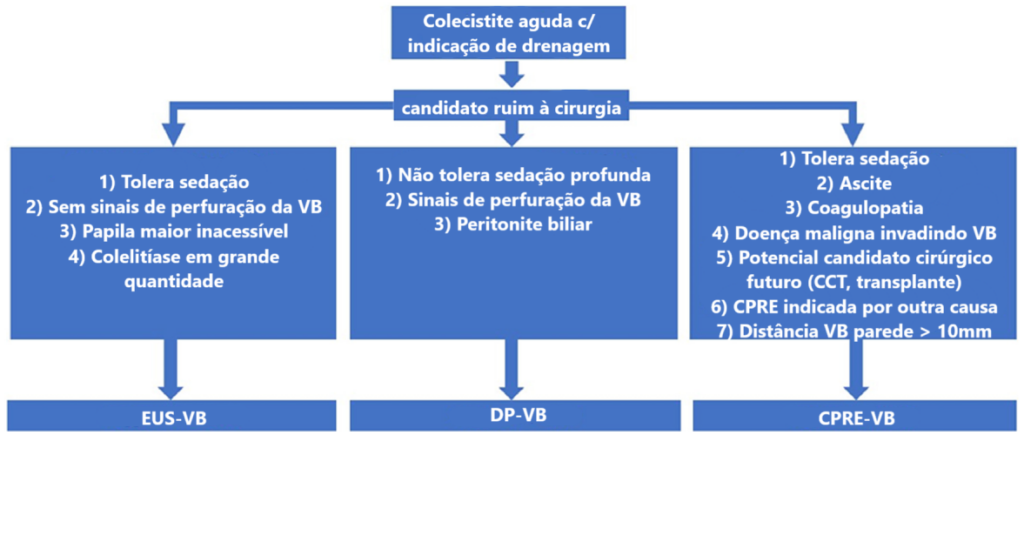
VB: vesícula biliar; CCT: colecistectomia; EUS-VB: drenagem ecoguiada da vesícula biliar; DP-VB: drenagem percutânea da vesícula biliar; CPRE-VB: drenagem transcística por colangiopancreatografia retrógrada endoscópica. Adaptado de “American Society for Gastrointestinal Endoscopy guideline on the role of therapeutic EUS in the management of biliary tract disorders: summary and recommendations”, GIE, 2024 (2)
Conclusão
A drenagem biliar ecoguiada vem ganhando cada vez mais espaço na resolução dos distúrbios biliares em diversos contextos e patologias diferentes. Apesar de uma técnica relativamente nova, que exige treinamento especializado e materiais dedicados, já demonstra algumas vantagens em relação a outras opções técnicas em alguns cenários – em especial quando comparada à drenagem transparietohepática (DTPH), que apesar de segura e bastante difundida, apresenta limitações e inconvenientes ao paciente que podem ser superados com a drenagem ecoguiada. Apesar do guideline da ASGE sugerir a drenagem ecoguiada como preferência na maioria dos cenários discutidos, as recomendações devem ser interpretadas com cautela, tanto pela baixa qualidade das evidências que suportam as recomendações quanto pelas diversas condições e considerações colocadas. A discussão interdisciplinar considerando as peculiaridades de cada caso é imprescindível para a determinação da melhor conduta.
Referências
- Logiudice, F. P., Bernardo, W. M., Galetti, F., Sagae, V. M., Matsubayashi, C. O., Madruga Neto, A. C., Brunaldi, V. O., de Moura, D. T. H., Franzini, T., Cheng, S., Matuguma, S. E., & de Moura, E. G. H. (2019). Endoscopic ultrasound-guided vs endoscopic retrograde cholangiopancreatography biliary drainage for obstructed distal malignant biliary strictures: A systematic review and meta-analysis. World journal of gastrointestinal endoscopy, 11(4), 281–291. https://doi.org/10.4253/wjge.v11.i4.281
- ASGE Standards of Practice Committee; Pawa S, Marya NB, Thiruvengadam NR, Ngamruengphong S, Baron TH, Bun Teoh AY, Bent CK, Abidi W, Alipour O, Amateau SK, Desai M, Chalhoub JM, Coelho-Prabhu N, Cosgrove N, Elhanafi SE, Forbes N, Fujii-Lau LL, Kohli DR, Machicado JD, Navaneethan U, Ruan W, Sheth SG, Thosani NC, Qumseya BJ; (ASGE Standards of Practice Committee Chair). American Society for Gastrointestinal Endoscopy guideline on the role of therapeutic EUS in the management of biliary tract disorders: summary and recommendations. Gastrointest Endosc. 2024 Dec;100(6):967-979. doi: 10.1016/j.gie.2024.03.027. Epub 2024 Jul 29. PMID: 39078360.
Como citar este artigo
Proença IM. Drenagem biliar ecoguiada: resumo e considerações sobre o guideline americano (ASGE) de 2024. Endoscopia Terapeutica, 2025 vol I. Dispnível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/drenagem-biliar-ecoguiada-resumo-e-consideracoes-sobre-o-guideline-americano-asge-de-2024/