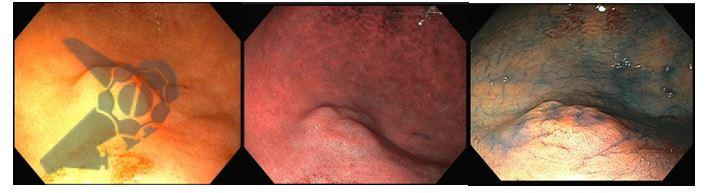
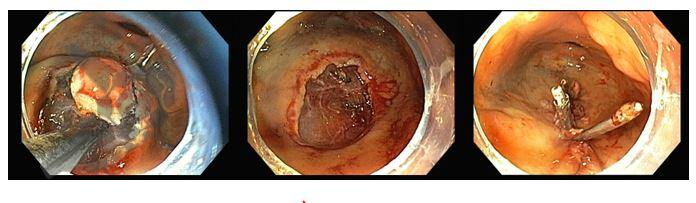
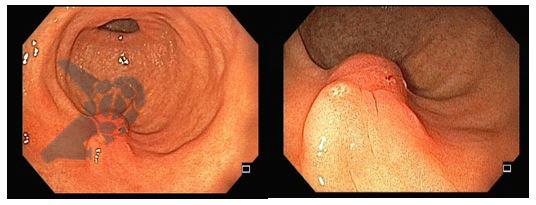
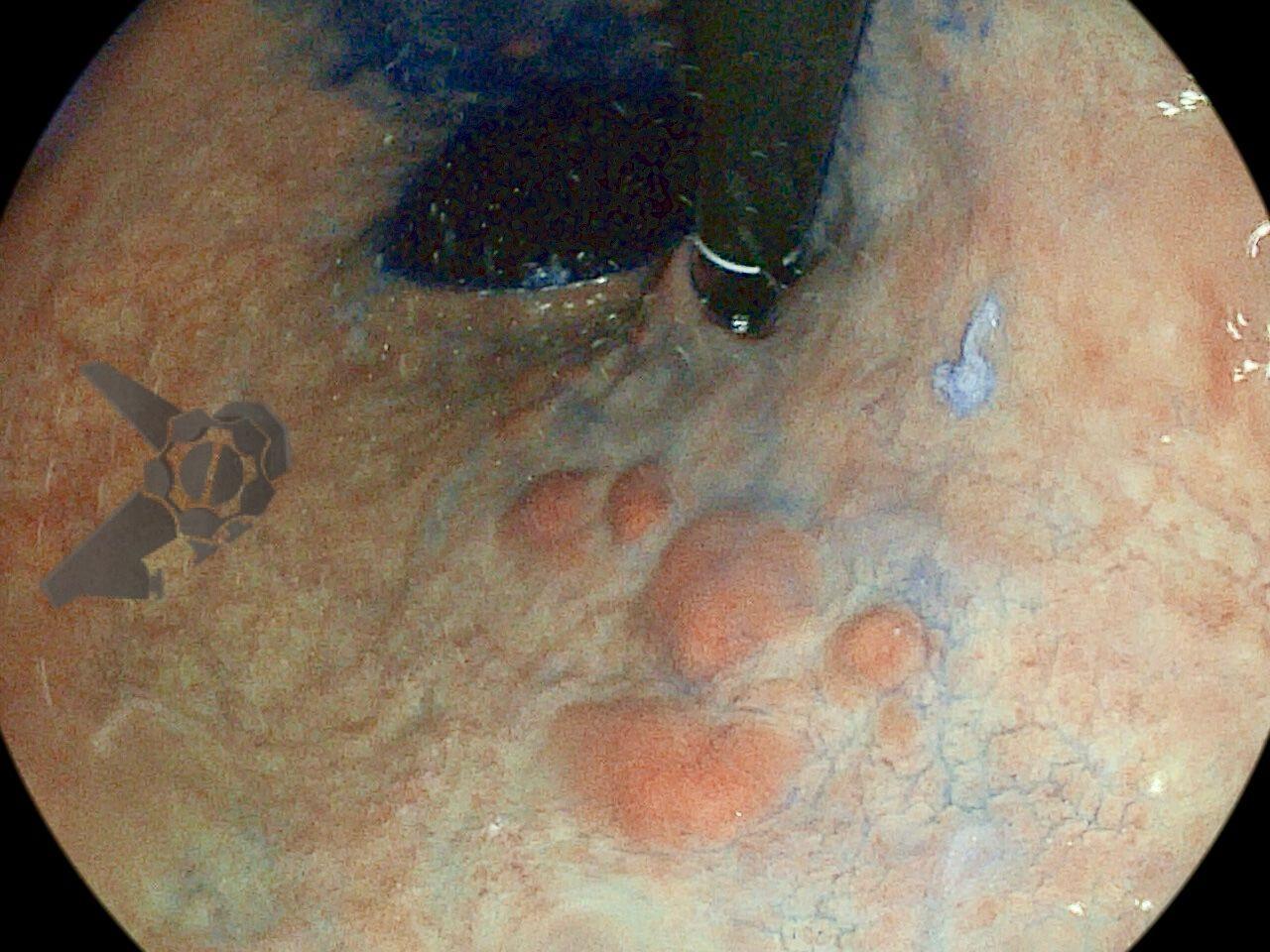
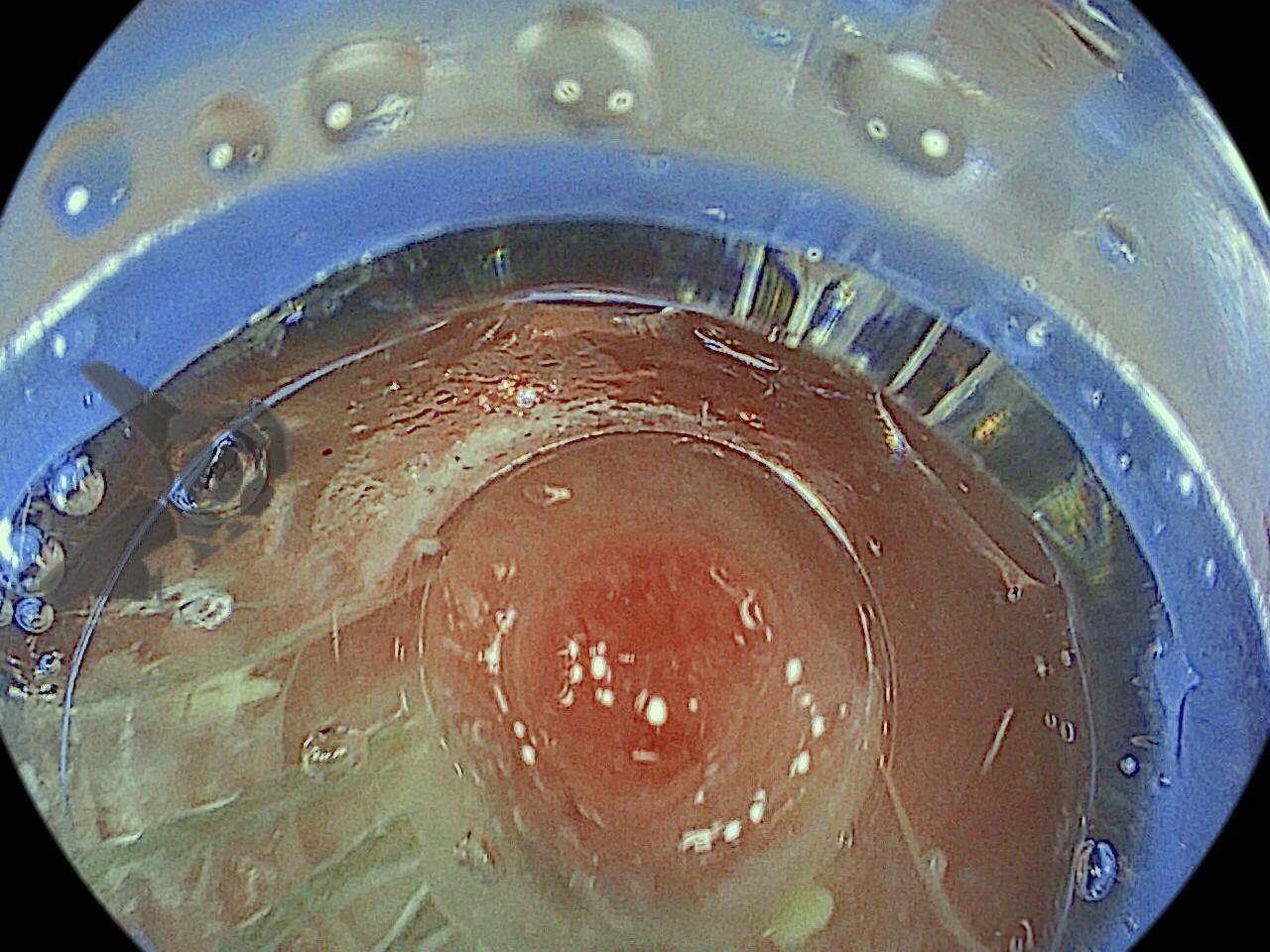
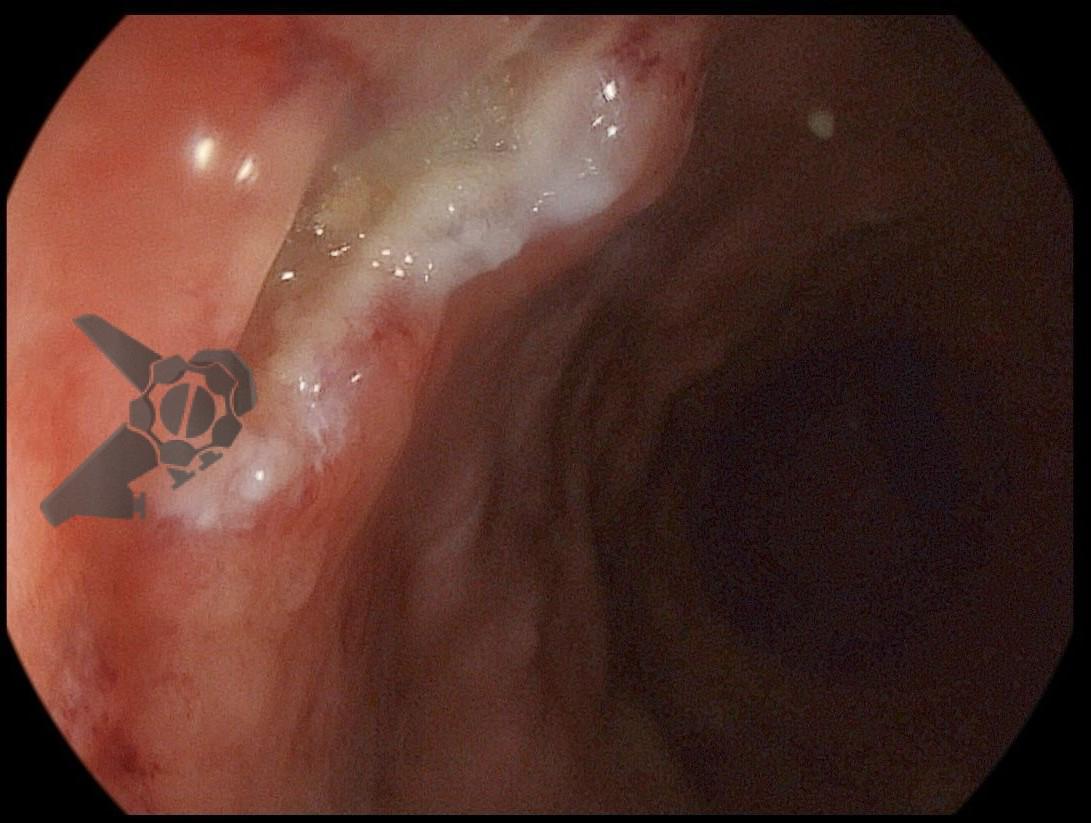
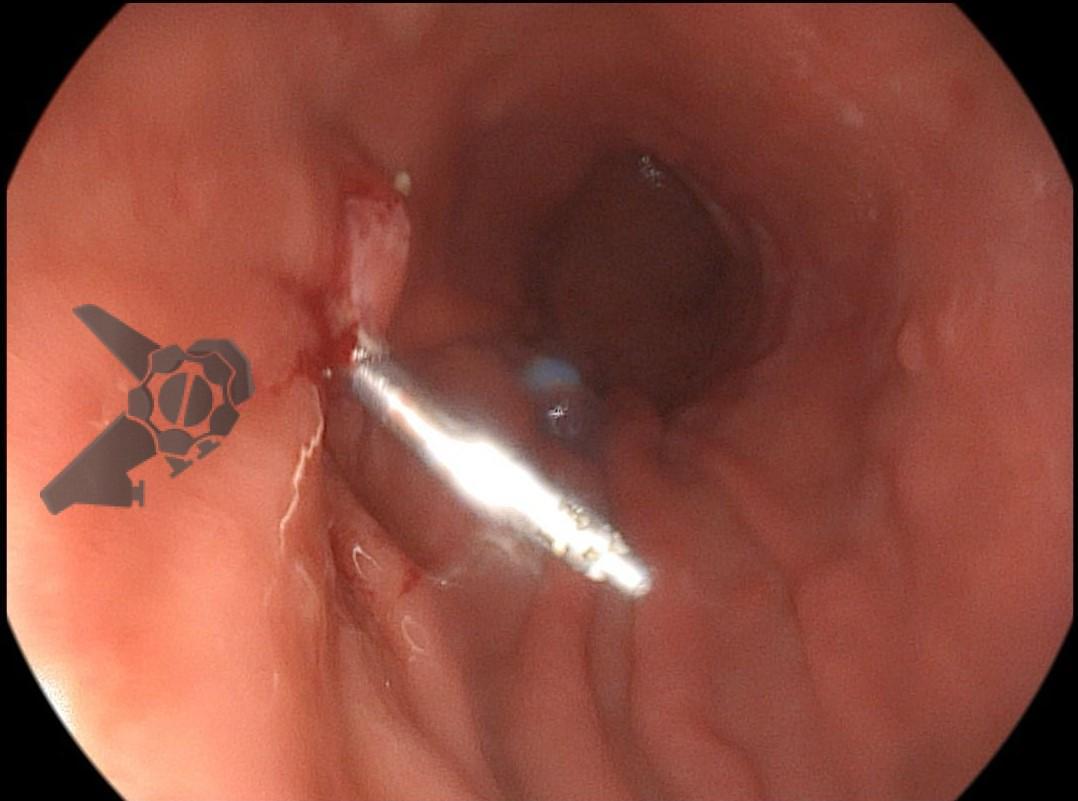
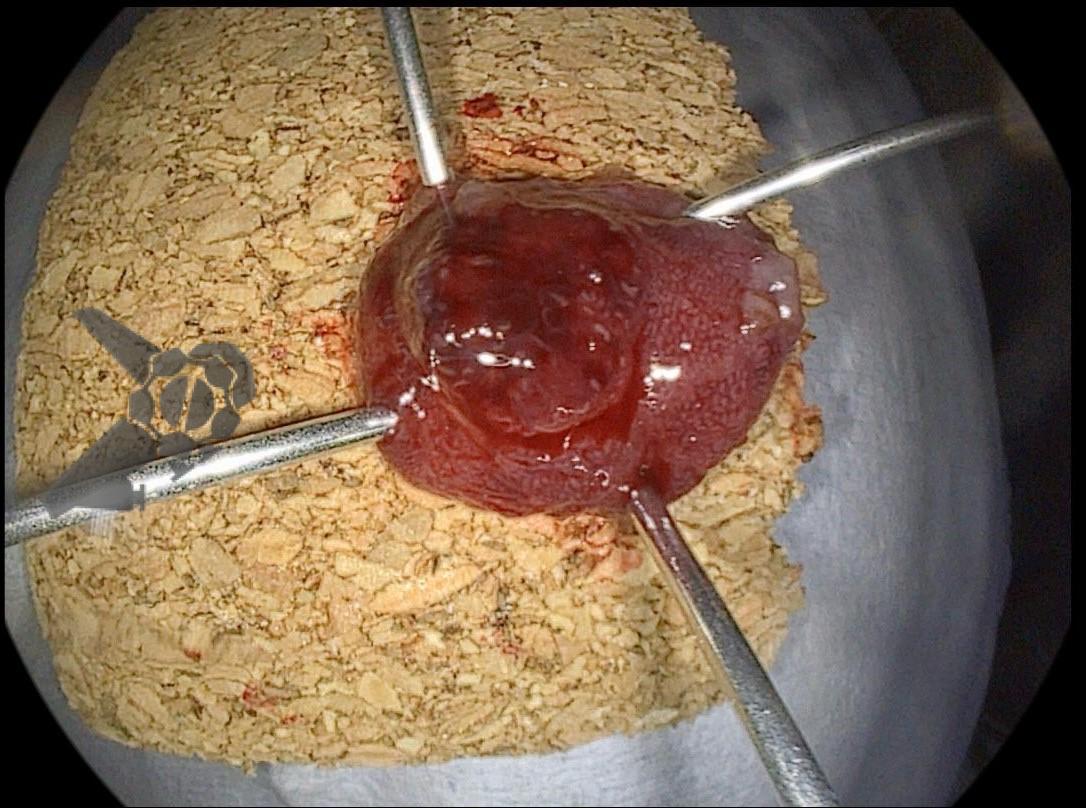
Perda de lesões em endoscopia digestiva alta: encarando a realidade
A endoscopia digestiva alta é o único método diagnóstico capaz de detectar lesões do trato gastrointestinal alto pré neoplásicas (adenomas e displasias) e neoplásicas precoces. Entretanto, mesmo pacientes previamente examinados não estão isentos do risco de detectar neoplasia nesses órgãos durante o seu seguimento de curto e médio prazo.
Conforme dados da World Health Organization, tumores do trato digestivo são detectados em estadio clínico inicial (ECI) na menor parte dos casos no ocidente, com taxas variando entre 7% e 16,9% para tumores esofágicos e entre 10,2 e 18% tumores gástricos.1 O diagnóstico em estágios avançados está diretamente associado à pobre sobrevida em 5 anos – 13% para tumores esofágicos e de 17% para tumores gástricos. Por outro lado, a identificação e o tratamento da doença localizada muda história natural da doença, atingindo taxas de sobrevida em 5 anos acima de 80%.2
Nesse contexto, vários estudos foram realizados para avaliar a taxa de perda de lesões neoplásicas em endoscopias digestivas altas. De forma geral, mas não consensual, define-se como lesão perdida aquela identificada no intervalo de 6 meses até 36 meses após a endoscopia índex. Esse período foi estabelecido considerando-se o tempo de duplicação tumoral gástrico de 2 a 3 anos sugerido por Fujita. Esse intervalo de tempo baseia-se no conceito de que os tumores gástricos podem ser visibilizados em endoscopias até 3 anos antes da sua apresentação clínica inicial. 3
Uma meta-análise de 2022 mostrou que 11,3% das neoplasias esofagogástricas e duodenais foram perdidas em endoscopias digestivas altas.2 Desses casos, 29% dos casos haviam realizado exame em um intervalo de 1 ano e 71% entre 1 e 3 anos do momento do diagnóstico.2
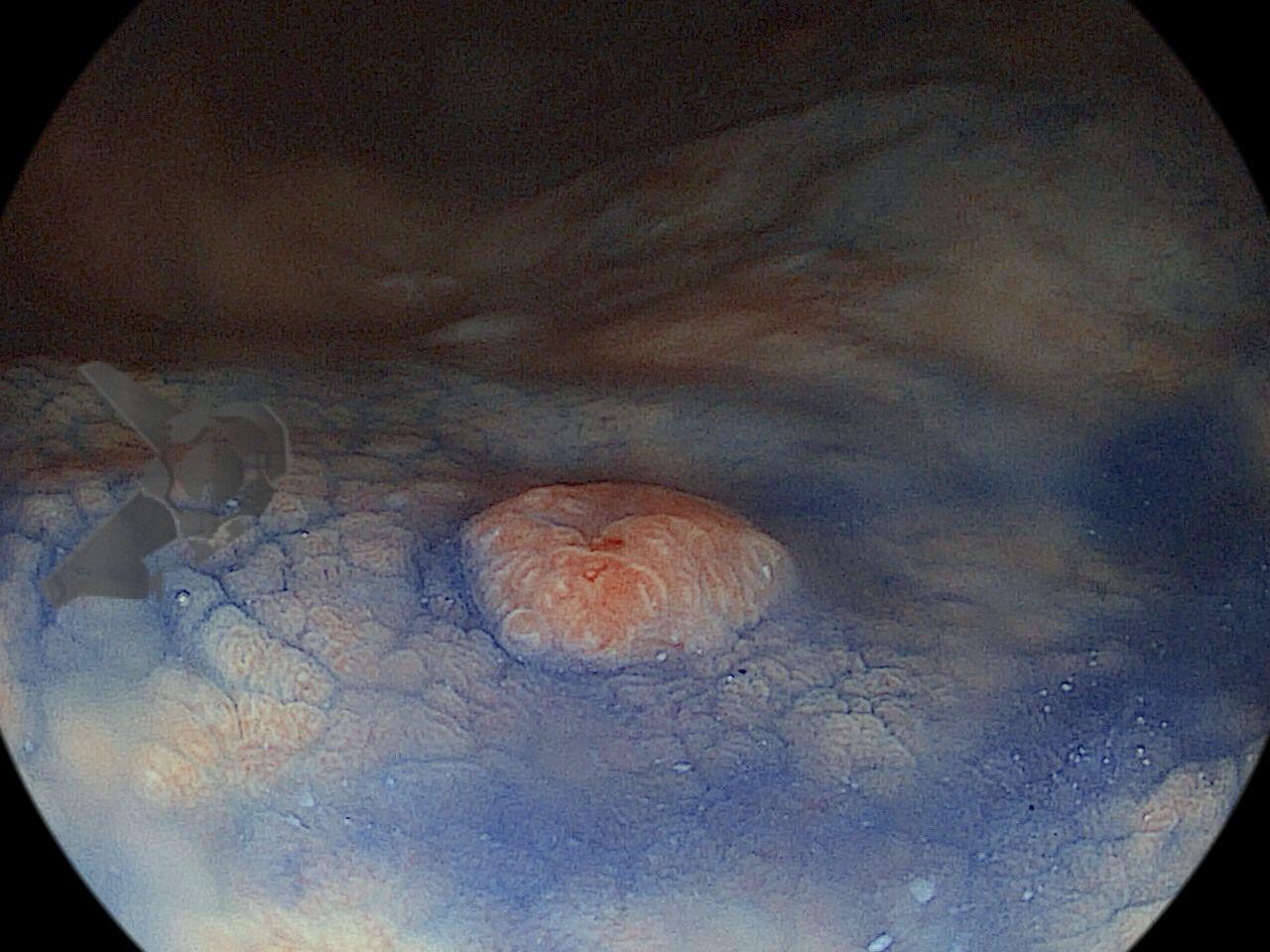
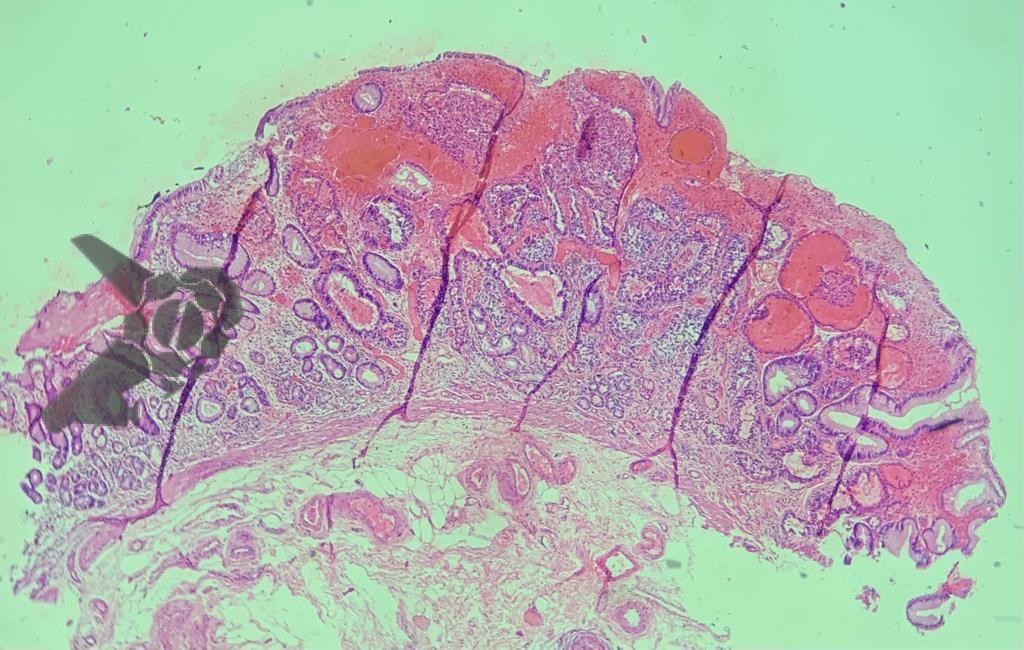
Uma revisão sistemática e metanálise de Pimenta-Melo A.R, et al mostraram resultados semelhantes: 9,4% dos tumores gástricos são potencialmente perdidos. A principal lesão perdida é o adenocarcinoma localizado no corpo gástrico. Os fatores preditivos para falha diagnóstica são: idade mais jovem (<55 anos), sexo feminino sexo, atrofia gástrica acentuada, adenoma ou úlcera gástrica e número inadequado de fragmentos de biópsia. 4
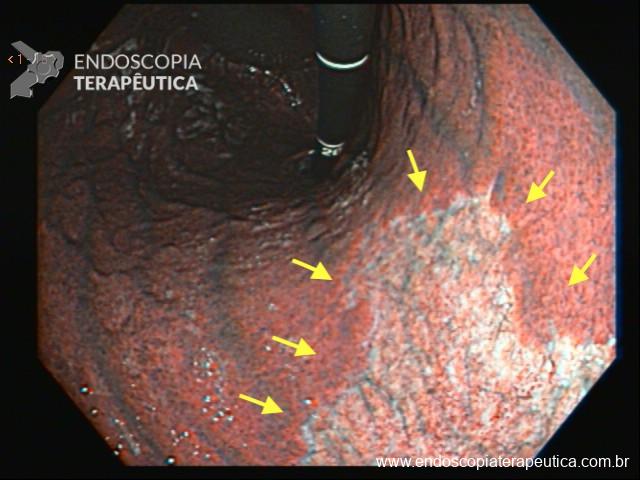
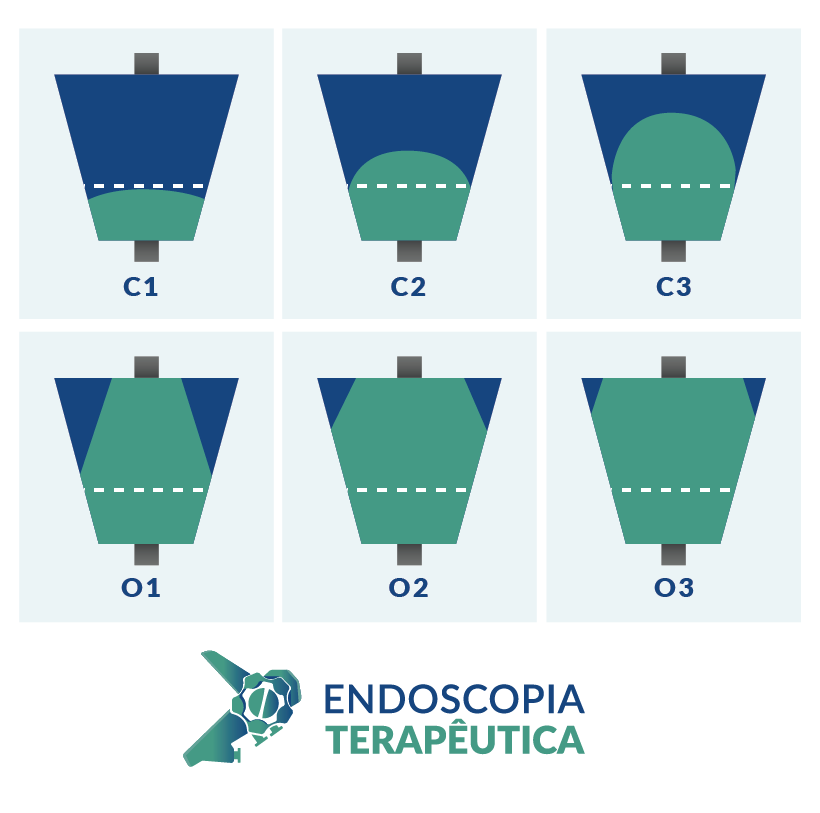
No Japão, foram realizadas endoscopias de seguimento em 44% dos 8.364 pacientes do estudo. Desses, 32 pacientes (0,9%) tiveram diagnóstico de câncer gástrico nos meses subsequentes. A incidência aumentou para 3,9% em pacientes com idade entre 60-69 anos com atrofia acentuada, definida como O2-3 de Kimura-Takemoto. 5
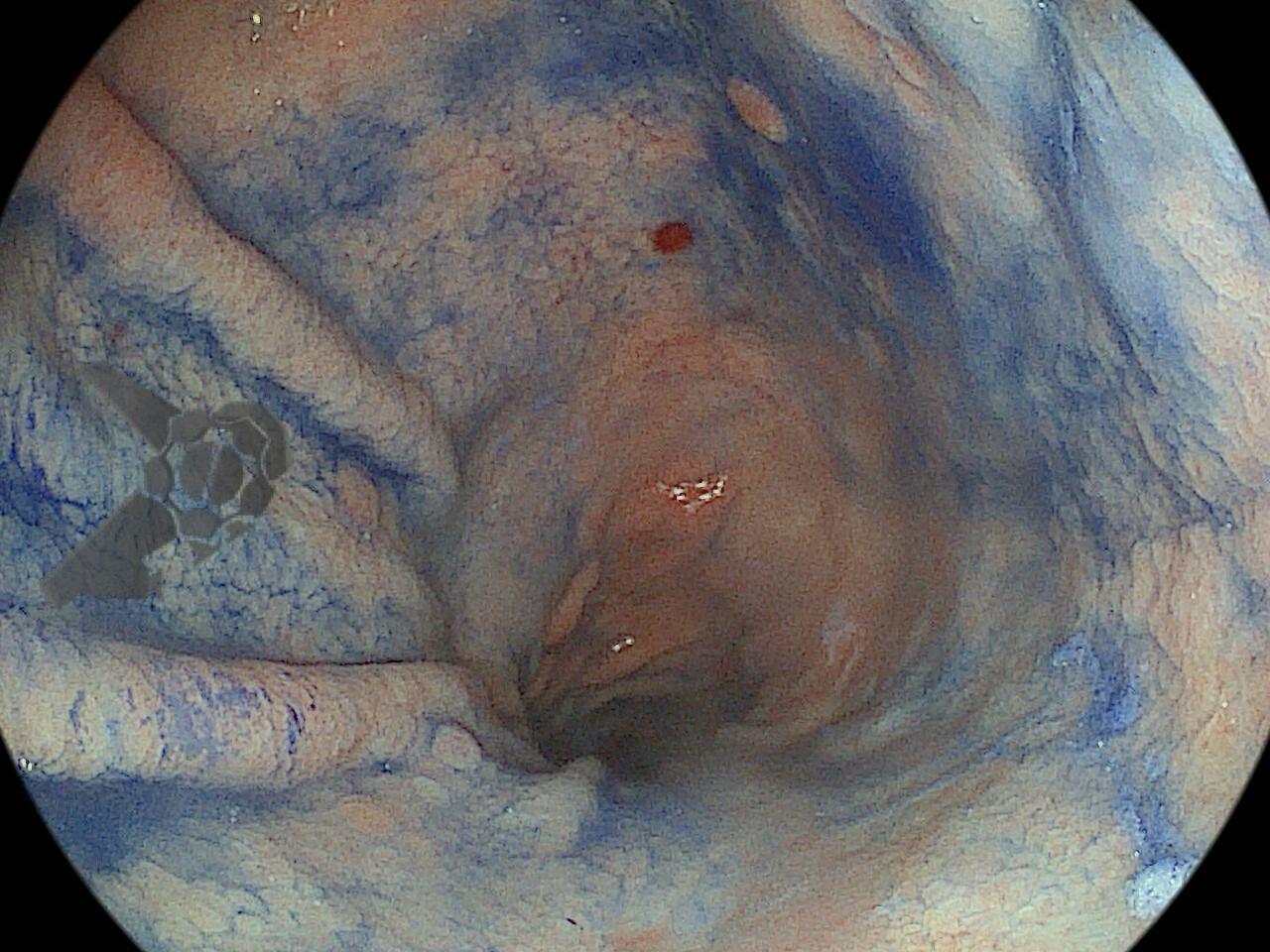
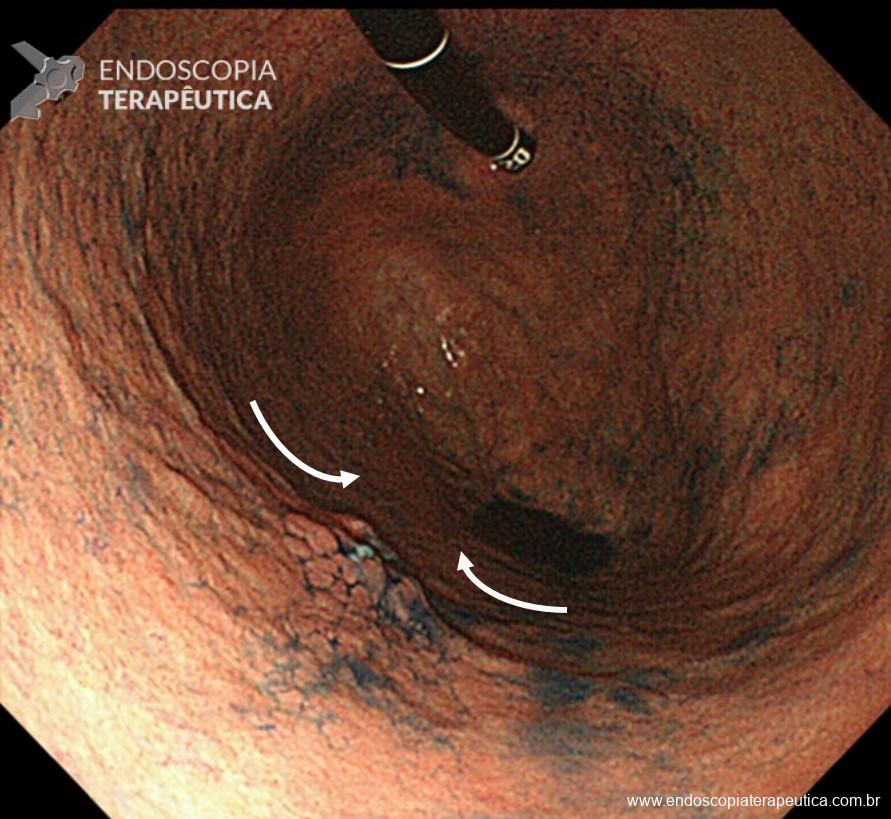
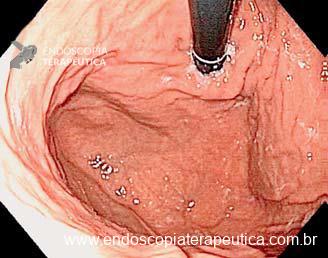
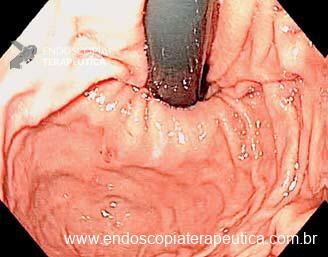
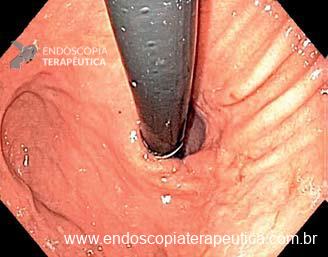
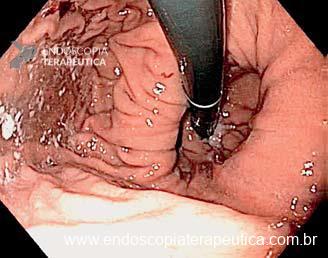
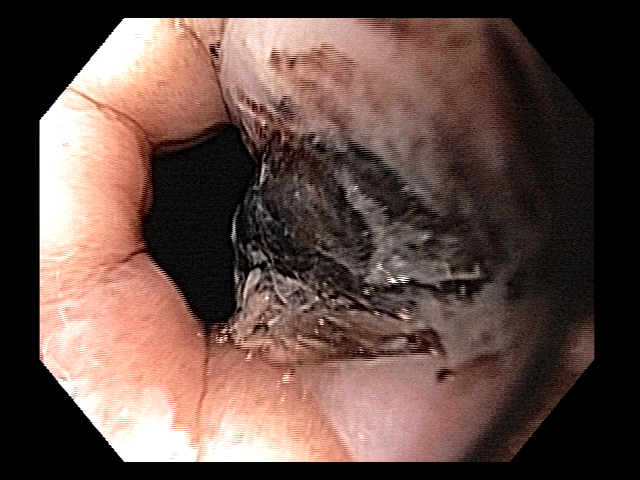
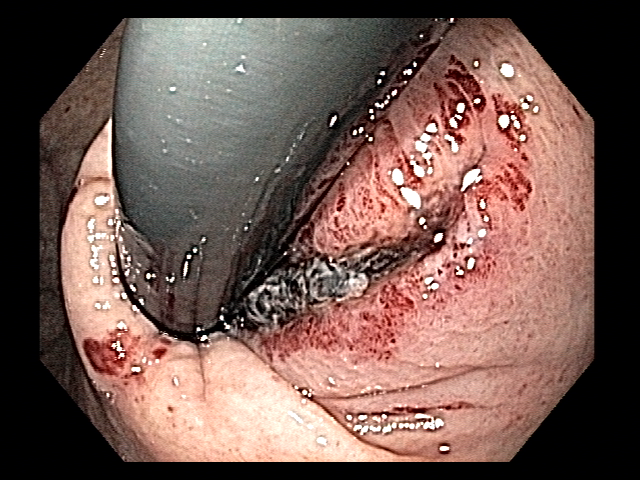
Os principais fatores atribuídos à falha de reconhecimento pelo endoscopista devem-se às alterações discretas na aparência dos tumores superficiais e à exploração incompleta da mucosa devido aos pontos cegos, especialmente em cárdia, pequena curvatura e parede posterior do corpo gástrico. 2,4 Outro fator é a presença de biópsia negativa, apesar da suspeição endoscópica pelo aspecto macroscópico da lesão. 6
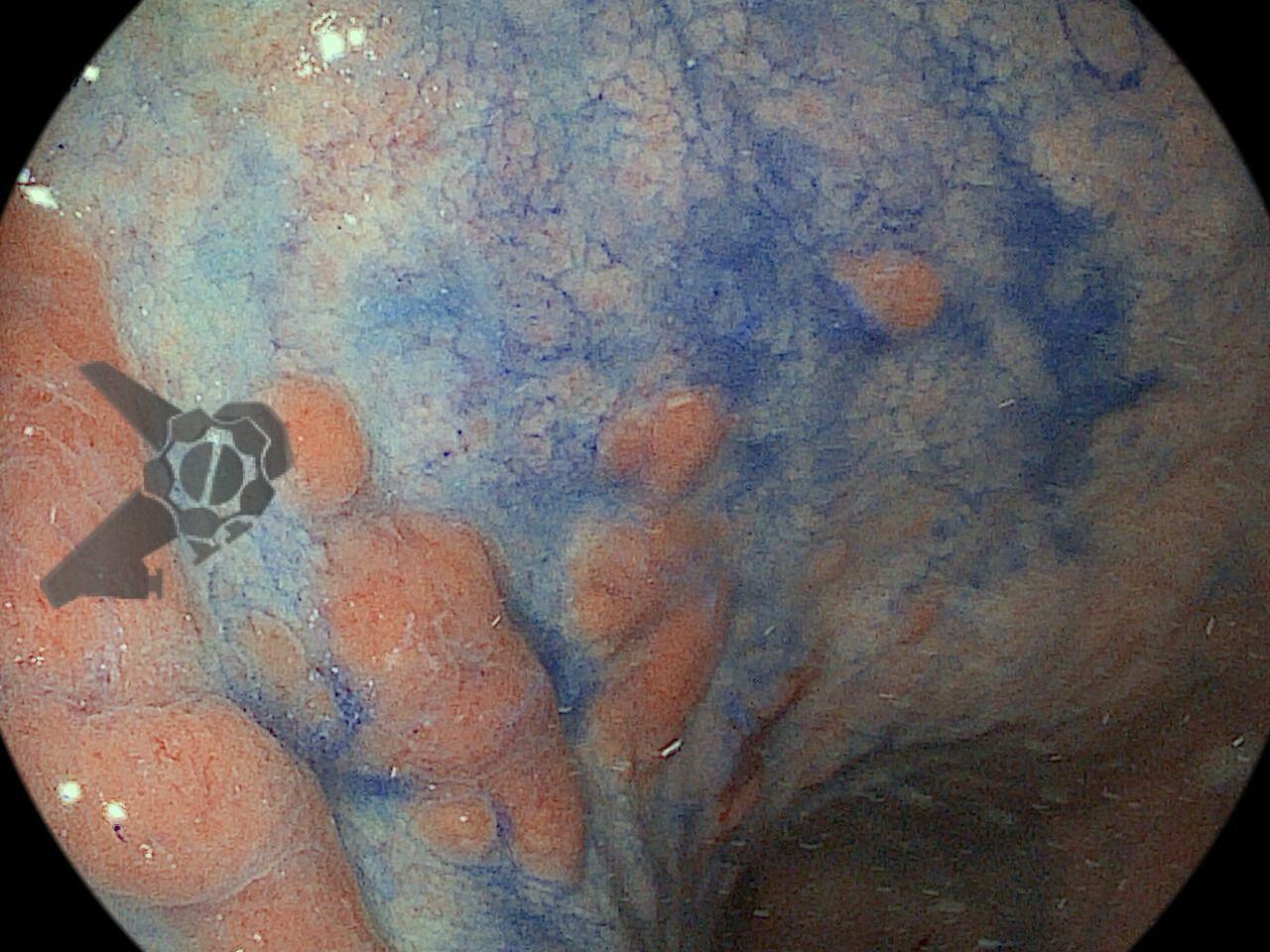
O subgrupo de pacientes com lesões gástricas sincrônicas também foi avaliado, mostrando que 23,3% das lesões sincrônicas foram perdidas. Com isso, os autores demonstram a necessidade de uma inspeção cuidadosa da mucosa adjacente, mesmo em pacientes com lesões visíveis. Os principais preditores de risco foram lesões pequenas, adenoma como tipo histológico e àquelas localizadas no terço superior gástrico. 4
Em uma revisão sistemática e meta-análise de 2022, ao avaliar apenas casos de esôfago de Barrett, a taxa de perda de lesões com displasia de alto grau ou adenocarcinoma foi de 26%. Nesse trabalho, foi considerado o intervalo de 1 ano entre a endoscopia índex com esôfago de Barrett (sem displasia, displasia de baixo grau ou indefinida) e a endoscopia que detectou displasia de alto grau ou adenocarcinoma.7 Realizar exame com aparelho de alta definição, dispender 1 minuto de inspeção a cada 1 cm do esôfago de Barrett, utilizar recursos de cromoscopia (virtual e com ácido acético) e identificar adequadamente e registrar fotograficamente os principais marcos anatômicos demonstrou aumento na taxa de detecção dessas lesões. 8
Em um estudo recente (Endoscopy 2022) com base nos registros de câncer da Polônia, a perda média de lesões no trato digestivo alto após uma endoscopia foi de 6% (N=33.241 total), percentual que se manteve estável entre os anos de 2012 e 2018. Foram definidos como tumores perdidos àqueles diagnosticados entre 6 e 36 meses da endoscopia índex. 9 Nesse mesmo trabalho, a maioria das lesões perdidas foram gástricas (81%), seguidas das esofágicas (17%) e duodenais (2%). No esôfago, as taxas de perda de adenocarcinomas e de carcinoma escamoso foram 6,1% e 4,2%, respectivamente. Além disso, estágios mais avançados no momento do diagnóstico foram observados nos pacientes com adenocarcinoma em relação aos tumores escamosos esofágicos. No estômago a taxa global de perda de adenocarcinomas foi de 5,7%. Quanto à localização, a proporção de lesões gástricas perdidas proximais e distais foi semelhante, porém as lesões proximais foram diagnosticadas em estágios mais avançados. Lesões definidas como perdidas (entre 6 e 36 meses) apresentaram-se proporcionalmente em estágios mais avançados em relação às lesões definidas como prevalentes (< 6 meses). Os principais fatores de risco associados à perda de lesões foram exames realizados de forma ambulatorial (RR: 1,3); sexo feminino (RR 1,3); e pacientes com múltiplas comorbidades (Charlson comorbidity index ≥ 5; RR 6). 9
Um estudo escocês mostrou que 73% dos casos de perda de lesões estiveram relacionados ao endoscopista ou ao seguimento: não identificação da lesão (27%); não realização de biópsias (14%); biópsias insuficientes (9%); ou seguimento inadequado (9%).10 Esse mesmo trabalho mostrou que 67% dos pacientes tinham endoscopia prévia em intervalo menor de 1 ano, 13% entre 1 e 2 anos e 20% entre 2 e 3 anos. 10 Cerca de 70% dos tumores esofágicos e gástricos e foram diagnosticados em estadio avançado (EC III e IV). Sintomas de alarme (disfagia, anemia, hematêmese, perda ponderal, vômito) estavam presentes na endoscopia inicial em 75% dos pacientes com tumores esofágicos e 57% daqueles com neoplasias gástricas.10
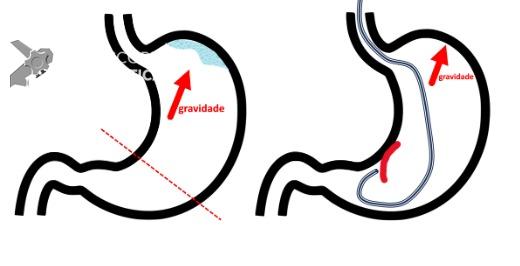
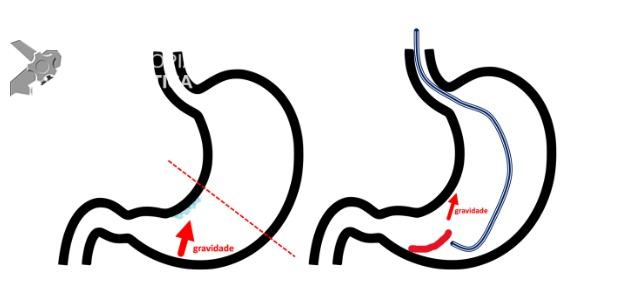
Entre as principais limitações no diagnóstico de lesões esofagogástricas e duodenais estão os fatores relacionadas ao operador, como a não identificação da lesão, à sedação inadequada, ao preparo inadequado do órgão, à distensibilidade insuficiente das pregas gástricas, a não realização de biópsias ou biópsias insuficientes. Fatores como a experiência do endoscopista e a qualidade dos aparelhos utilizados nos exames também são fatores relevantes, porém pouco estudados. A maioria dos trabalhos possuem dados anteriores à era da cromoscopia e da magnificação. Os principais fatores atribuídos à falha de reconhecimento pelo endoscopista devem-se às alterações discretas na aparência dos tumores superficiais, a baixa suspeição diagnóstica, e à exploração incompleta da mucosa devido aos pontos cegos, especialmente no estômago.
Apesar da endoscopia ter um alto valor preditivo negativo (99,7%)4, pacientes que persistem com sintomas de alarme após uma endoscopia sem achados críticos devem prosseguir a investigação, e aqueles com atrofia acentuada devem repetir a endoscopia anualmente.
Aparelhos com alta definição de imagem e com cromoscopia digital devem ser preconizados. É preciso realizar um preparo adequado, com lavagem e remoção de saliva e bolhas, adequada insuflação e tempo suficiente de inspeção. Ainda, o exame deve ser sistematizado, a fim de identificar discretas alterações da mucosa, caracterizando-as conforme as classificações endoscópicas, realizando a foto documentação (> 25 fotos) e coletando biópsias adequadas. Especial atenção deve ser dada para as seguintes regiões da câmera gástrica: grande curvatura do corpo, antro, incisura angularis e cárdia. Enfim, as boas práticas endoscópicas devem ser preconizadas para não perder a chance de diagnosticar lesões iniciais, passíveis de tratamentos curativos.
Referências
- Global Cancer Observatory. Cancer Survival. https://gco.iarc.fr/survival/survmark/.
- Menon S, Trudgill N, Open EI, et al. How commonly is upper gastrointestinal cancer missed at endoscopy ? A meta-analysis. 2014:46-50.
- Background IH. Biology of Early Gastric Carcinoma I . Historical Background. 1978;9:297-309. doi:10.1016/S0344-0338(78)80028-4
- Pimenta-Melo AR, Monteiro-Soares M, Libânio D, Dinis-Ribeiro M. Missing rate for gastric cancer during upper gastrointestinal endoscopy: A systematic review and meta-Analysis. Eur J Gastroenterol Hepatol. 2016;28(9):1041-1049. doi:10.1097/MEG.0000000000000657
- Hosokawa O, Watanabe K, Hatorri M, Douden K, Hayashi H, Kaizaki Y. Detection of gastric cancer by repeat endoscopy within a short time after negative examination. Endoscopy. 2001;33(4):301-305. doi:10.1055/s-2001-13685
- Hosokawa O. STEKKW. Diagnosis of gastric cancer up to three years after negative upper gastrointestinal endoscopy. Endoscopy. 1998;30(8):669-674.
- Sawas T, Majzoub AM, Haddad J, et al. Magnitude and Time-Trend Analysis of Postendoscopy Esophageal Adenocarcinoma: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2022;20(2):e31-e50. doi:10.1016/j.cgh.2021.04.032
- BasL.A. M.Weusten1, 2, Raf Bisschops3 , Mario Dinis-Ribeiro4, Massimiliano di Pietro5, Oliver Pech6 MCWS, , Francisco Baldaque-Silva8 9, , Maximilien Barret10, Emmanuel Coron11, 12 G-E, Rebecca C. Fitzgerald5, MarnixJansen14 MJ, , Ines Marques-de-Sa4 , ArtiRattan16 WKT, EvaP. D.Verheij17, Pauline A.Zellenrath7, Konstantinos Triantafyllou18 REP. Diagnosis and management of Barrett esophagus: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2023;55.
- Januszewicz W, Witczak K, Wieszczy P, et al. Prevalence and risk factors of upper gastrointestinal cancers missed during endoscopy: A nationwide registry-based study. Endoscopy. 2022;54(7):653-660. doi:10.1055/a-1675-4136
- Witherspoon P, Mccole D. Missed Diagnoses in Patients with Upper Gastrointestinal Cancers. doi:10.1055/s-2004-825853
Como citar este artigo
Casamali C. Perda de lesões em endoscopia digestiva alta: encarando a realidade. Endoscopia Terapeutica 2024, vol 1. Disponível em: https://endoscopiaterapeutica.net/pt/?p=18967