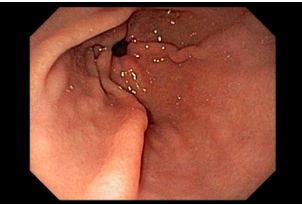
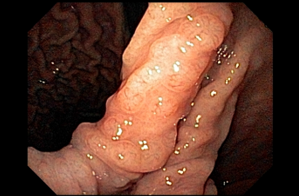
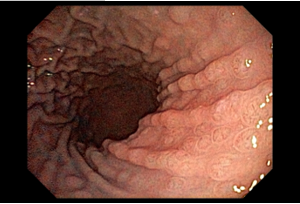
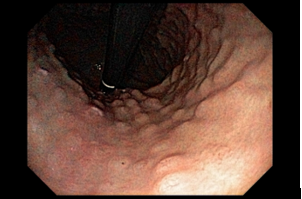
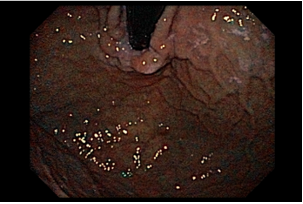
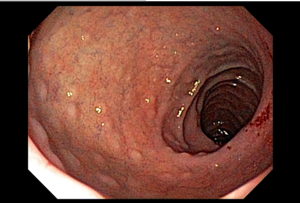
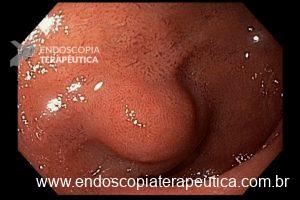
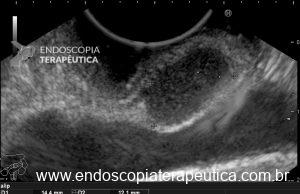
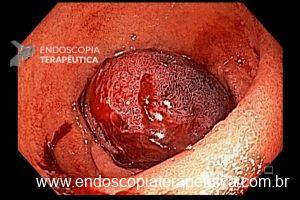
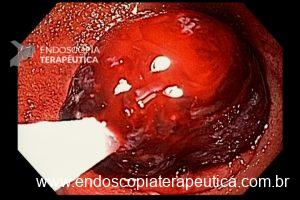
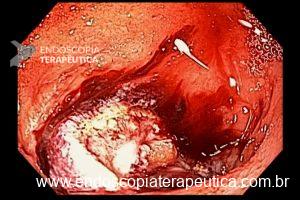
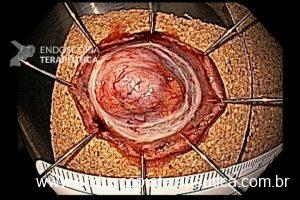
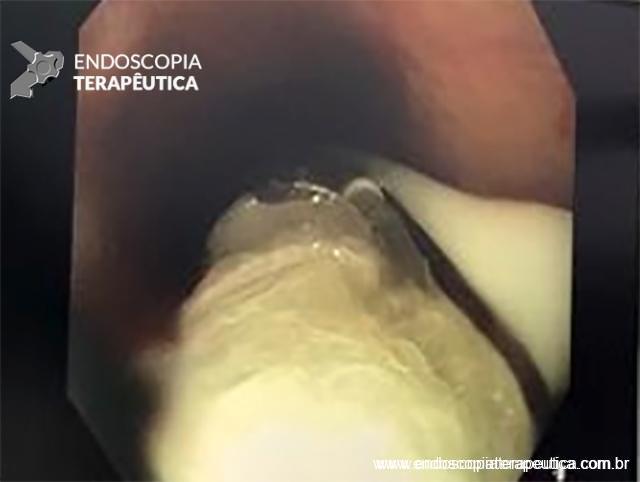
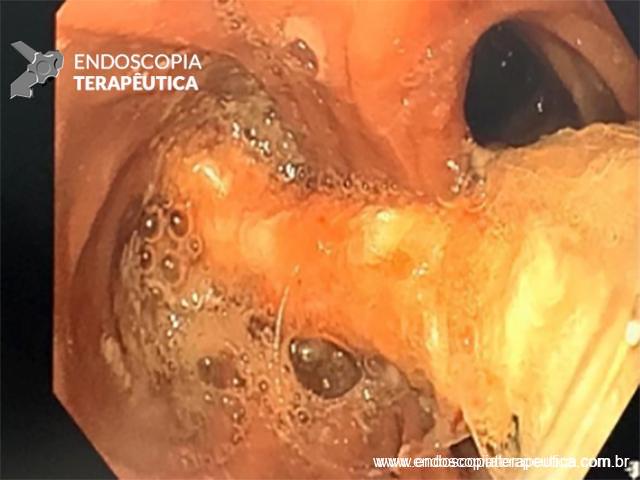
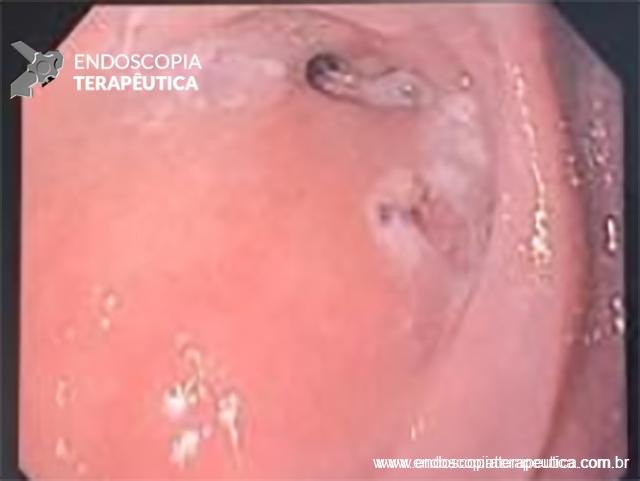
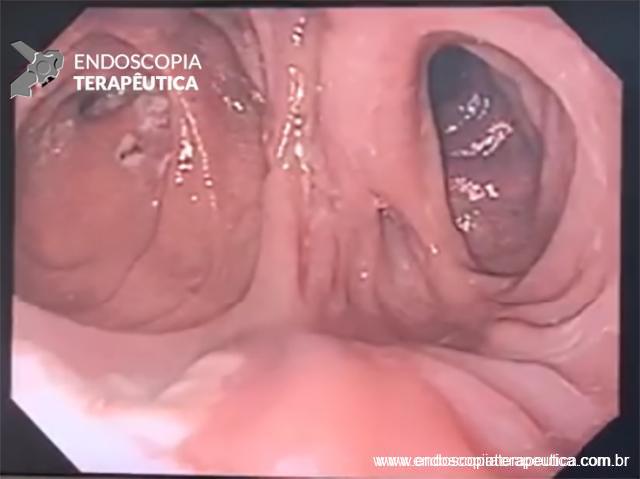
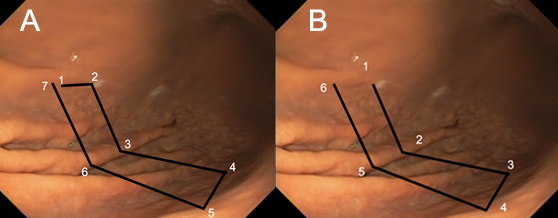
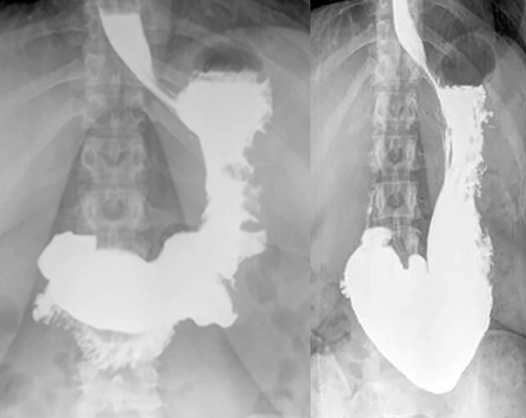
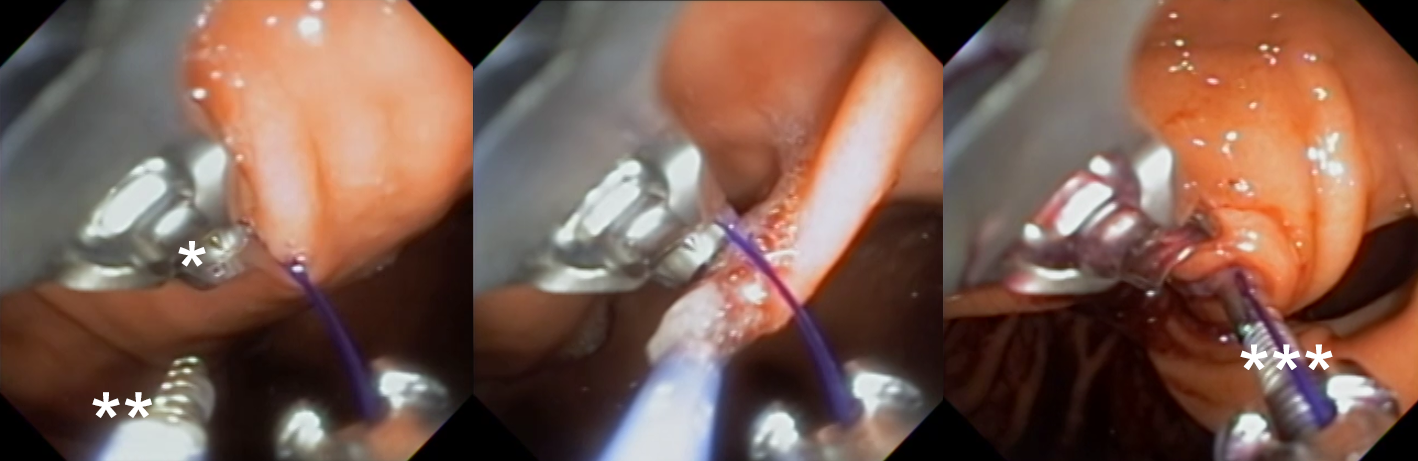
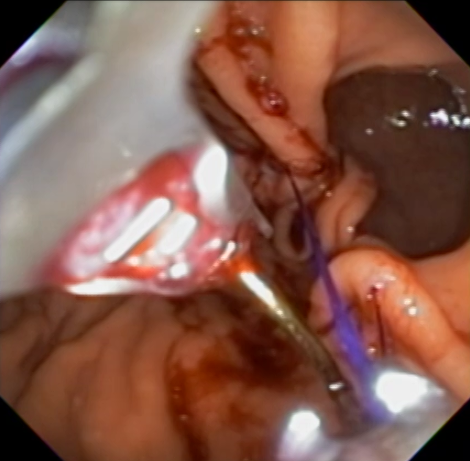
Com que frequência você observa úlcera de anastomose gastrojejunal pós-Bypass Gástrico em Y de Roux na sua prática diária?
A úlcera de anastomose gastrojejunal (AGJ), também chamada de úlcera marginal, é definida como “uma úlcera péptica na mucosa jejunal distal à AGJ após gastrectomia parcial para doenças benignas, como úlceras gástricas ou duodenais, ou após cirurgias bariátricas” (1).
Fatores de risco e Incidência
A incidência após Bypass gástrico em Y de Roux (BGYR) varia de 0,6 a 16% dos pacientes.
Sua etiologia não é totalmente compreendida, porém vários fatores parecem exercer influência como: diminuição do fluxo sanguíneo, tensão na anastomose, infecção pelo Helicobacter pylori (H. pylori), tamanho do pouch, técnica utilizada para confecção da AGJ, uso de AINEs, etilismo e tabagismo (2,3,4).
Algumas outras condições clínicas também parecem estar associadas, como imunossupressão, DRGE, DM, dislipidemia, doença arterial coronariana, doenças pulmonares crônicas, como asma e DPOC, e hipotiroidismo (5).
Além disso, visto que a mucosa do pouch não tem contato com a secreção alcalina do duodeno, a AGJ é exposta ao suco gástrico ácido não diluído produzido pela mucosa do pouch (3). O uso de inibidores de bomba de prótons (IBP) no pré-operatório parece ser um fator de proteção para o desenvolvimento das úlceras (5,6).
| Fatores de risco cirúrgicos | Fatores de risco não-cirúrgicos |
| IsquemiaTamanho do pouchCorpo estranho (fio de sutura, grampos)Tensão na anastomoseFístula gastrogástrica | TabagismoUso de AINEsAusência de uso de IBPH. pyloriConsumo de álcool |
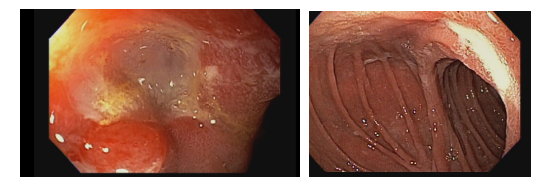
Apresentação e sintomas
A úlcera da AGJ pode ser dividida em precoce (< 12 meses) ou tardia (> 12 meses), para as quais a etiologia subjacente pode ser diferente, assim como o tratamento (1, 2).
- As úlceras precoces geralmente estão relacionadas a problemas técnicos da cirurgia.
- Úlceras tardias podem ter como causa deiscência dos grampos, pouch alargado, uso de AINE e infecção pelo H. pylori (5).
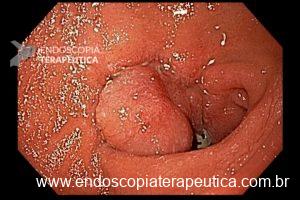
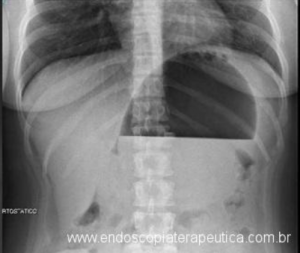
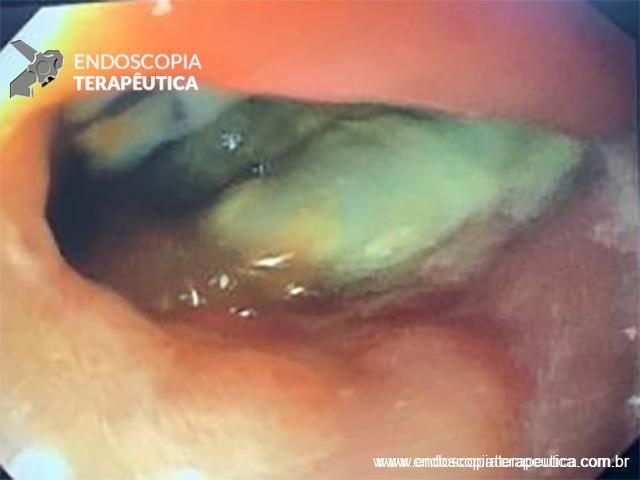
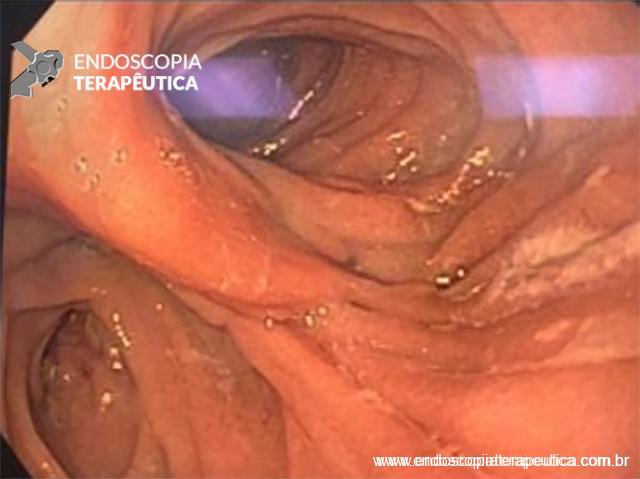
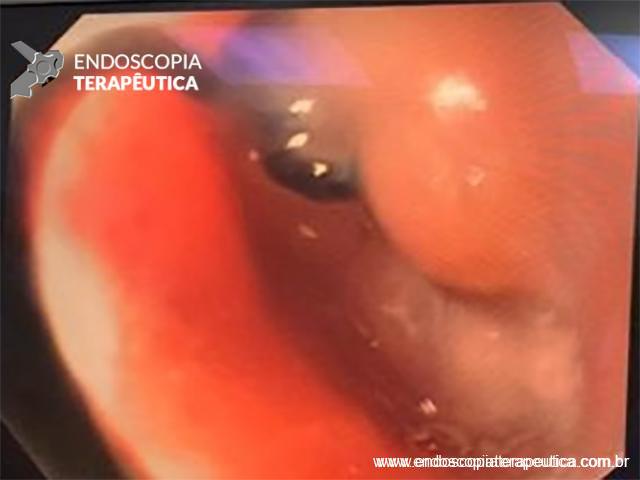
Os pacientes podem apresentar uma variedade de sintomas. Para úlceras agudas, dor epigástrica, vômitos e hemorragia digestiva alta (HDA), tanto visível quanto oculta, são as principais formas de apresentação (1,7). Pacientes portadores de úlcera crônica frequentemente tem dor epigástrica noturna e bem localizada (1). Cerca de 25% dos pacientes são assintomáticos e são diagnosticados durante endoscopia digestiva alta (EDA) de rotina no pós-operatório (2).
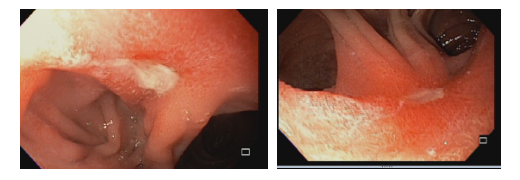
Papel da endoscopia
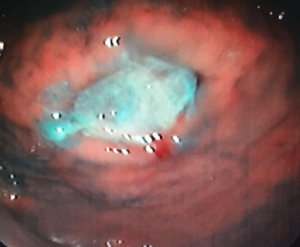
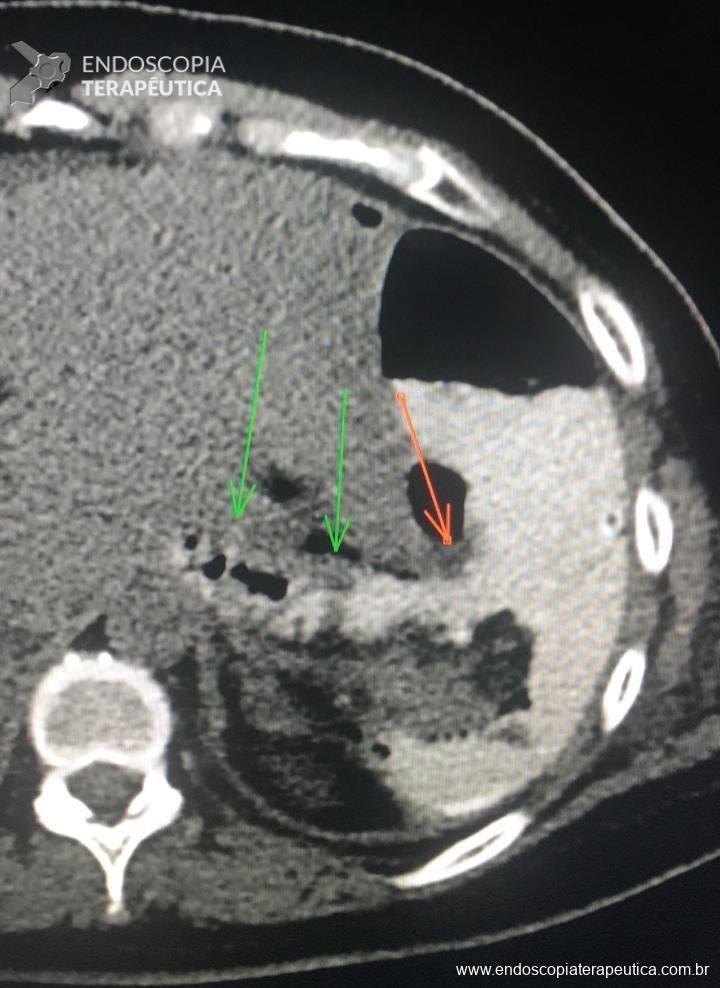
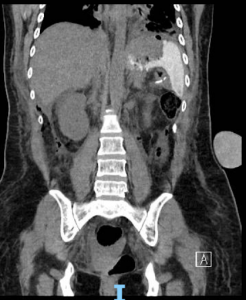
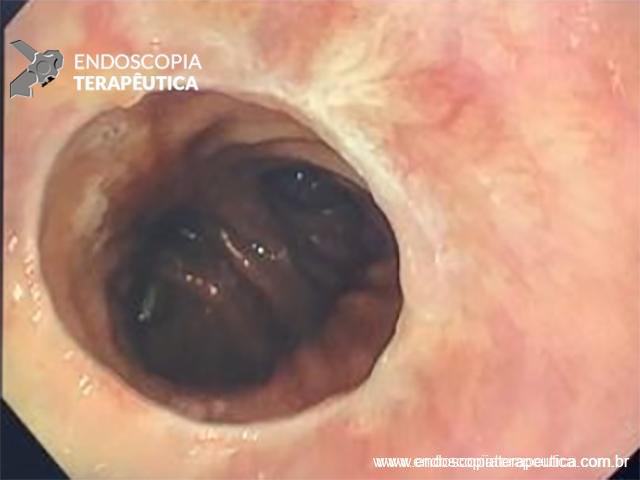
O diagnóstico é feito por EDA, que também tem a função de tratar uma grande complicação dessas úlceras que é o sangramento.
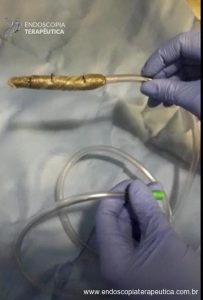
Em caso de HDA, o tratamento endoscópico deve ser feito, assim como nas úlceras de outra etiologia, com as modalidades endoscópicas disponíveis: injeção, métodos térmicos ou mecânicos. Os métodos mecânicos devem ser preferidos nesses casos, especialmente nas úlceras agudas (7).
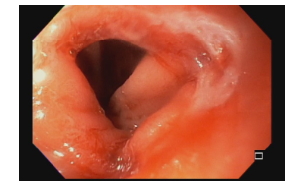
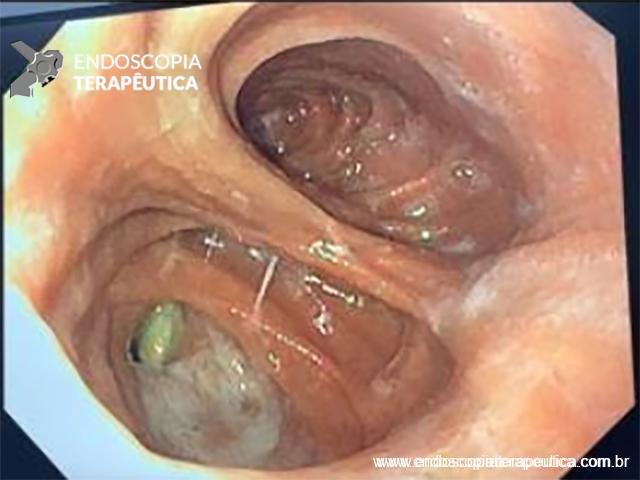
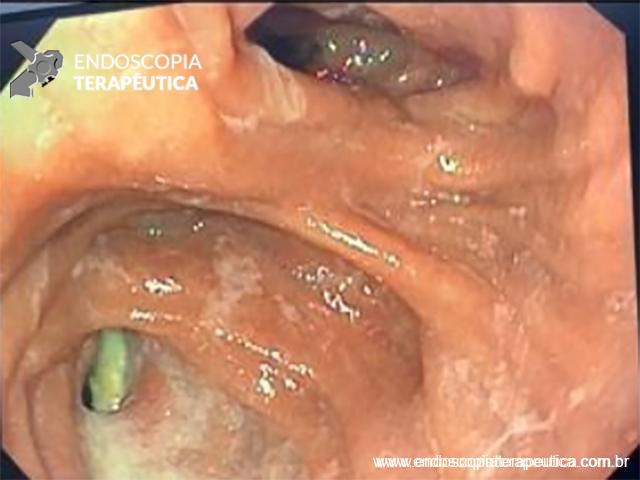
Em casos em que se observa a presença de fios de sutura na anastomose, estes devem ser retirados, pois promovem uma reação inflamatória local que dificulta a cicatrização da úlcera.
De maneira geral, a endoscopia deve ser repetida em 08 semanas para confirmar a cicatrização da úlcera (7).
Tratamento
O tratamento é feito com IBP ou associação de IBP com sucralfato (2,3,5).
Em casos de úlceras refratárias ao tratamento clínico, é importante investigar a presença de fístula gastrogástrica ou deiscência da anastomose (7).
Para úlceras refratárias, parte dos autores recomenda o tratamento cirúrgico (3). Um estudo mostrou que 43% dos pacientes submetidos a tratamento cirúrgico da úlcera tinham fístula gastrogástrica e que a recorrência após a reoperação pode chegar a 57% (5).
Para saber mais sobre este tema e outros relacionados, acesse o site Gastropedia clicando aqui!
Referências
- Carr WR, Mahawar KK, Balupuri S, Small PK. An evidence-based algorithm for the management of marginal ulcers following Roux-en-Y gastric bypass. Obes Surg. 2014 Sep;24(9):1520-7. doi: 10.1007/s11695-014-1293-z. PMID: 24851857
- Süsstrunk, J., Wartmann, L., Mattiello, D. et al. Incidence and Prognostic Factors for the Development of Symptomatic and Asymptomatic Marginal Ulcers After Roux-en-Y Gastric Bypass Procedures. OBES SURG 31, 3005–3014 (2021). https://doi.org/10.1007/s11695-021-05363-4
- Steinemann DC, Bueter M, Schiesser M, Amygdalos I, Clavien PA, Nocito A. Management of anastomotic ulcers after Roux-en-Y gastric bypass: results of an international survey. Obes Surg. 2014 May;24(5):741-6. doi: 10.1007/s11695-013-1152-3. PMID: 24347350.
- Sundaresan, N., Sullivan, M., Hiticas, B.A. et al. Impacts of Gastrojejunal Anastomotic Technique on Rates of Marginal Ulcer Formation and Anastomotic Bleeding Following Roux-en-Y Gastric Bypass. OBES SURG 31, 2921–2926 (2021). https://doi.org/10.1007/s11695-021-05292-2
- Di Palma A, Liu B, Maeda A, Anvari M, Jackson T, Okrainec A. Marginal ulceration following Roux-en-Y gastric bypass: risk factors for ulcer development, recurrence and need for revisional surgery. Surg Endosc. 2021 May;35(5):2347-2353. doi: 10.1007/s00464-020-07650-0. Epub 2020 May 18. PMID: 32424625.
- D’Hondt MA, Pottel H, Devriendt D, Van Rooy F, Vansteenkiste F. Can a short course of prophylactic low-dose proton pump inhibitor therapy prevent stomal ulceration after laparoscopic Roux-en-Y gastric bypass? Obes Surg. 2010 May;20(5):595-9. doi: 10.1007/s11695-009-0062-x. Epub 2010 Jan 8. Erratum in: Obes Surg. 2010 Jun;20(6):829. André D’Hondt, Mathieu [corrected to D’Hondt, Mathieu André]. PMID: 20058097.
- Souto-Rodríguez R, Alvarez-Sánchez MV. Endoluminal solutions to bariatric surgery complications: A review with a focus on technical aspects and results. World J Gastrointest Endosc. 2017 Mar 16;9(3):105-126. doi: 10.4253/wjge.v9.i3.105. PMID: 28360973; PMCID: PMC5355758.
Como citar este artigo
Arraes L. Com que frequência você observa úlcera de anastomose gastrojejunal pós-Bypass Gástrico em Y de Roux na sua prática diária? Endoscopia Terapeutica 2023, vol 1. Disponível em: https://endoscopiaterapeutica.net/pt/com-que-frequencia-voce-observa-ulcera-de-anastomose-gastrojejunal-pos-bypass-gastrico-em-y-de-roux-na-sua-pratica-diaria