Remoção endoscópica de corpo estranho impactado no íleo distal: relato de caso e revisão da literatura.
Relato de caso
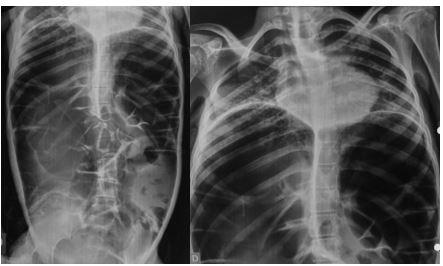
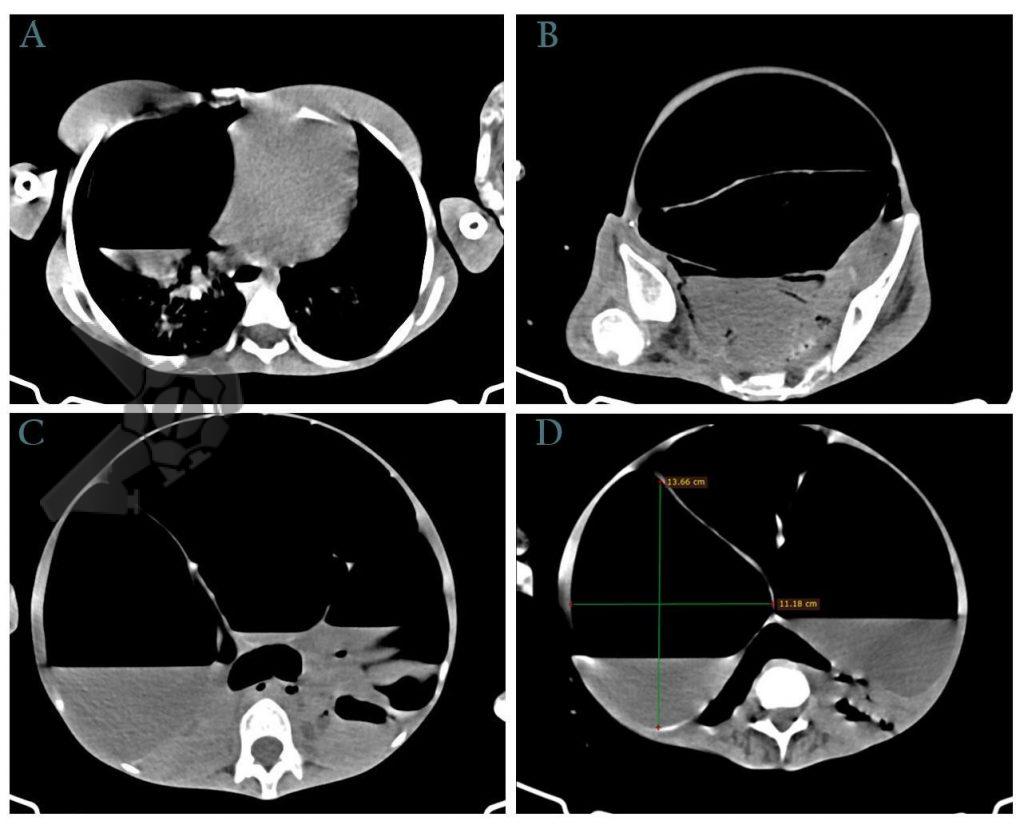
Masculino, 88 anos, aposentado, apresentando quadro demencial leve, assintomático, foi encaminhado ao serviço de endoscopia após a ingestão acidental de sua prótese dentária fixa. O incidente ocorreu há 15 dias, sem eliminação do objeto nas fezes desde então. Ele buscou atendimento na unidade de emergência de sua cidade, onde uma radiografia revelou a presença do objeto na topografia da fossa ilíaca direita (foto 1). Ao exame físico, não havia alterações relevantes com palpação do abdome inocente.
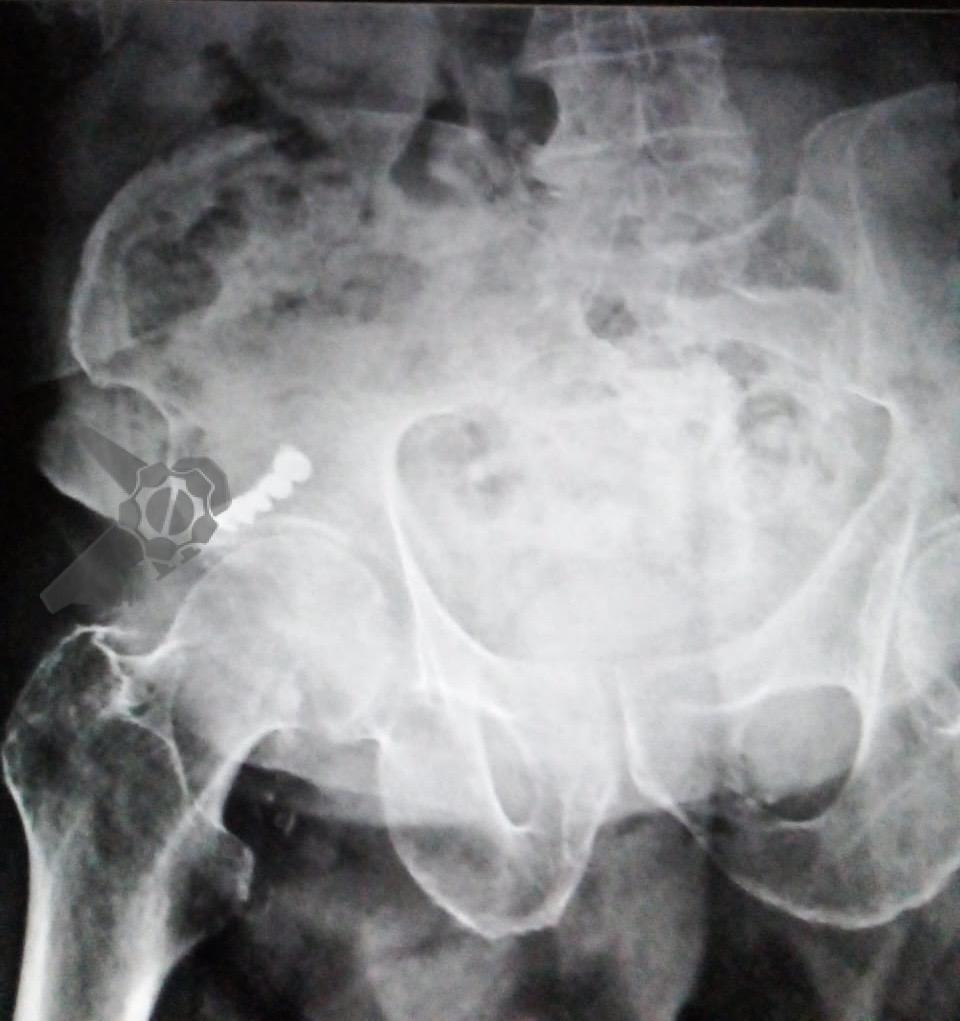
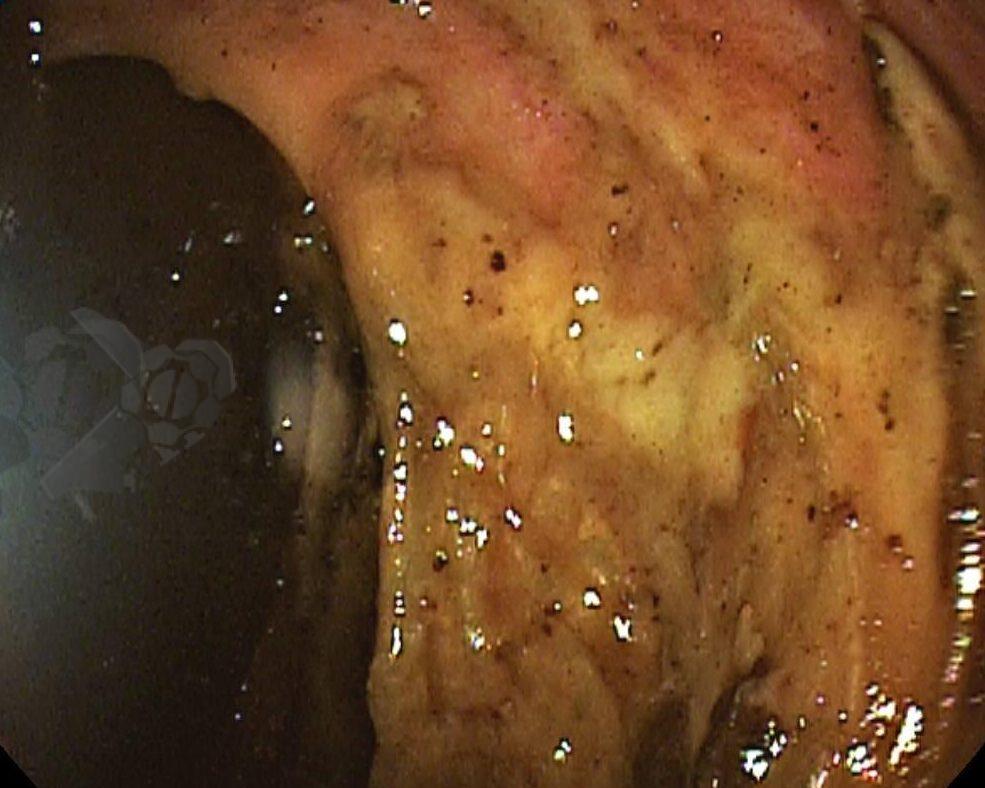
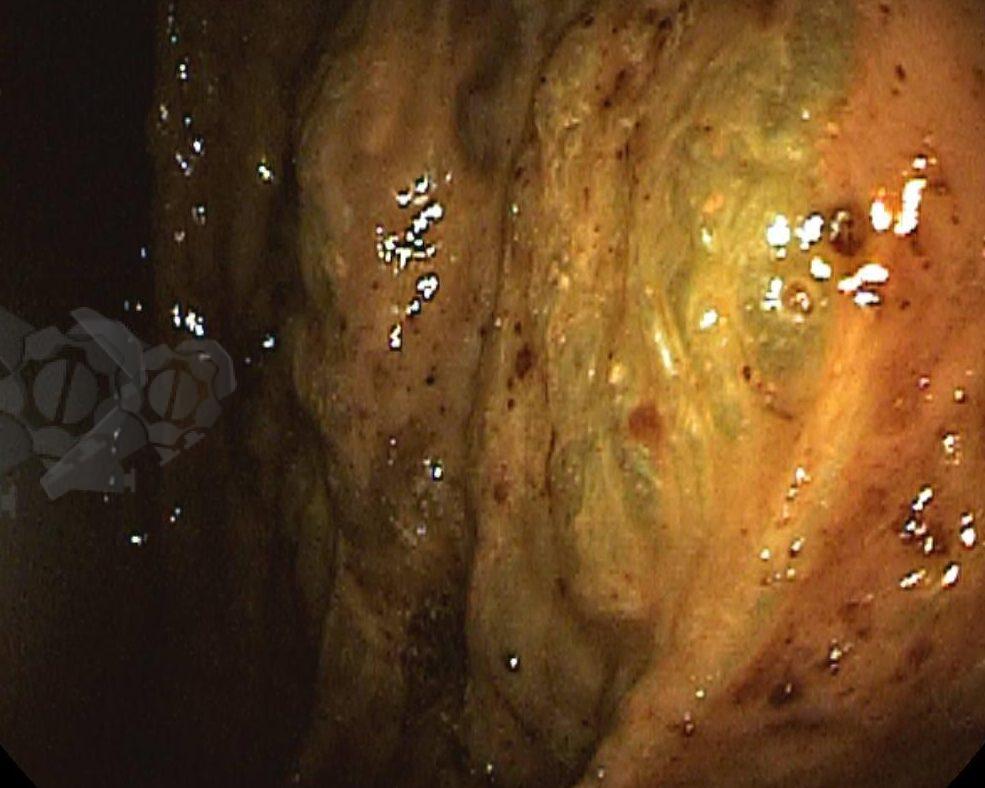
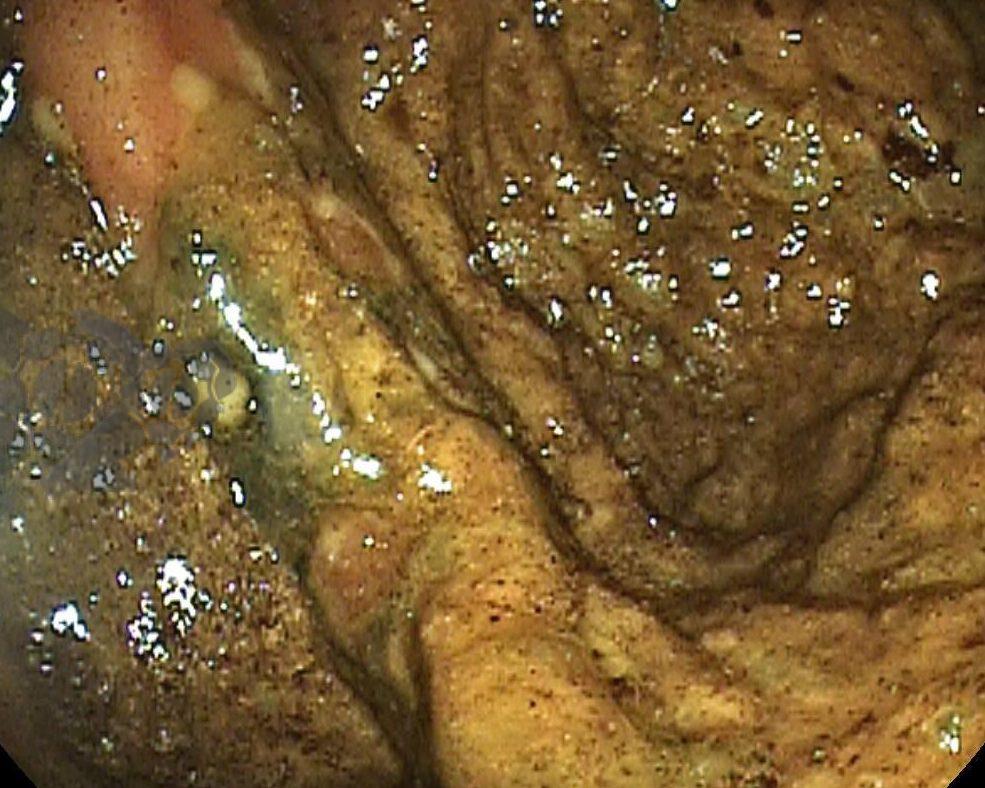
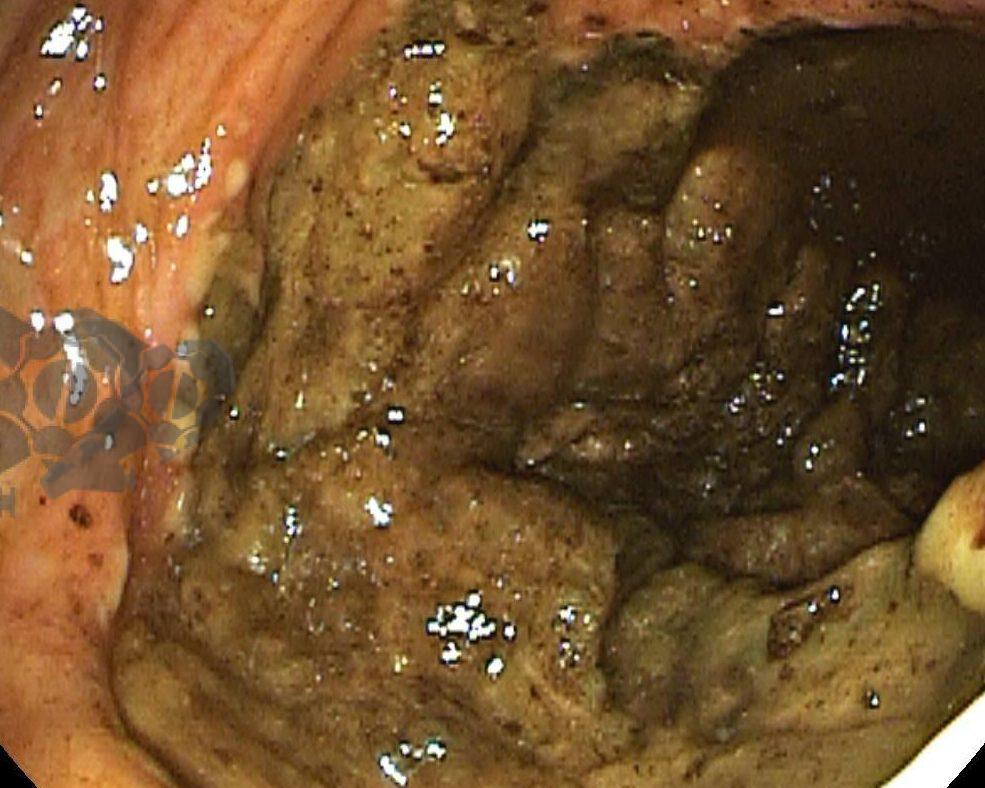
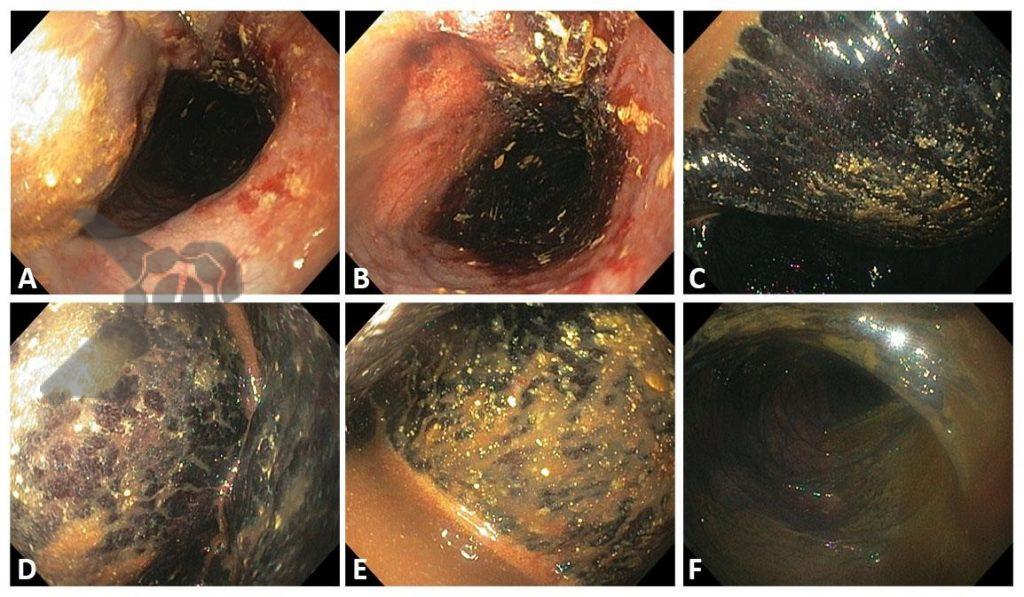
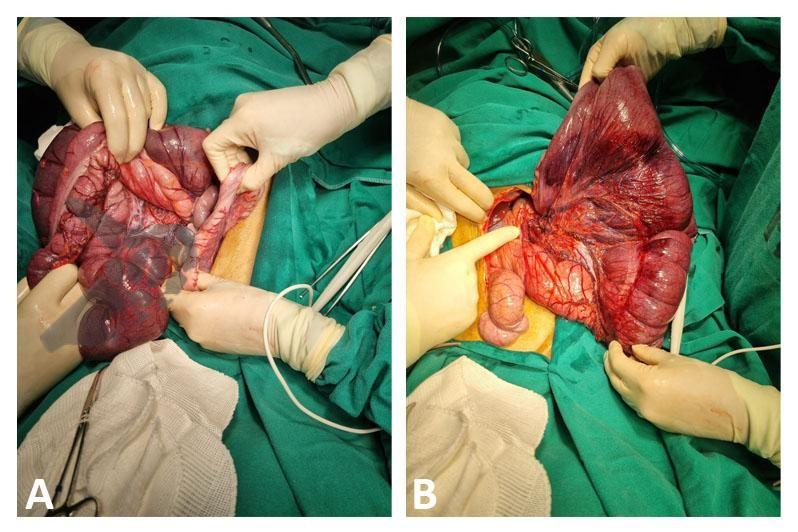
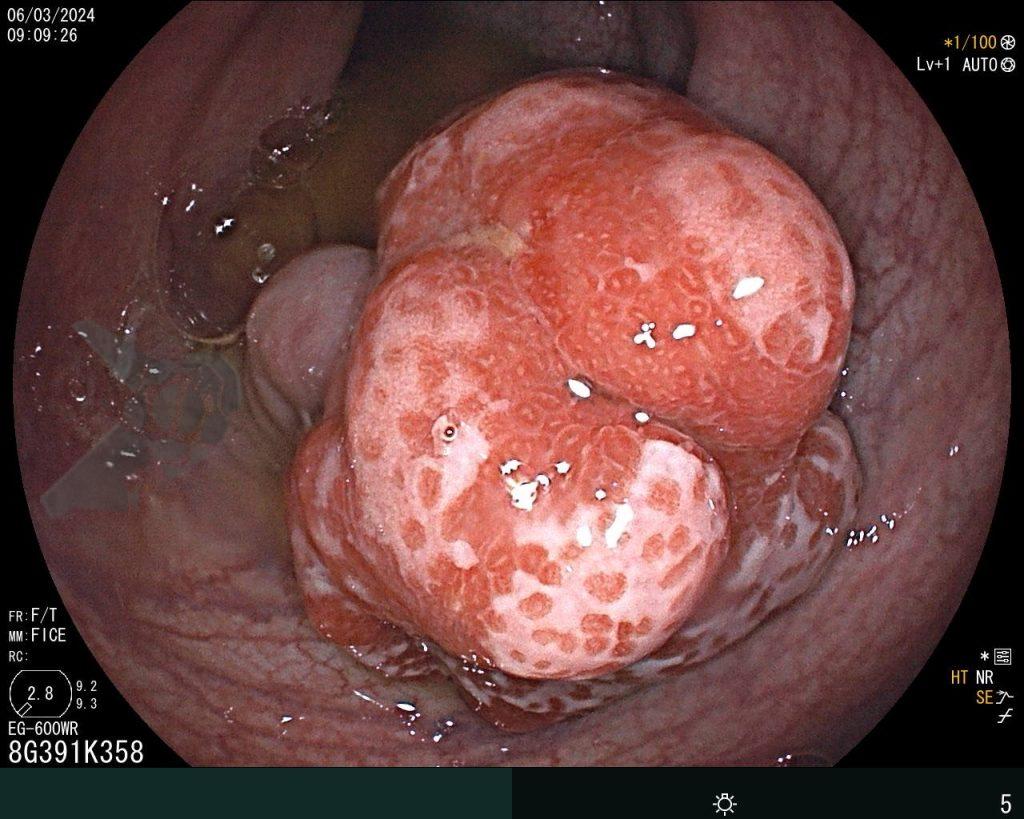
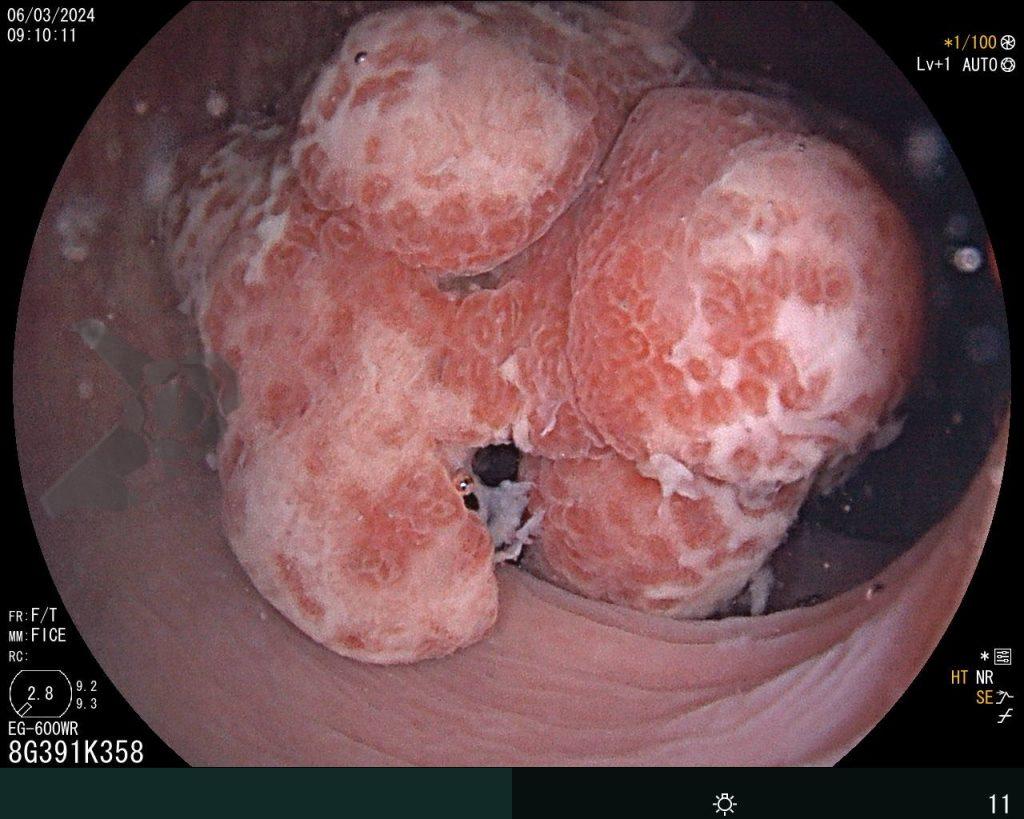
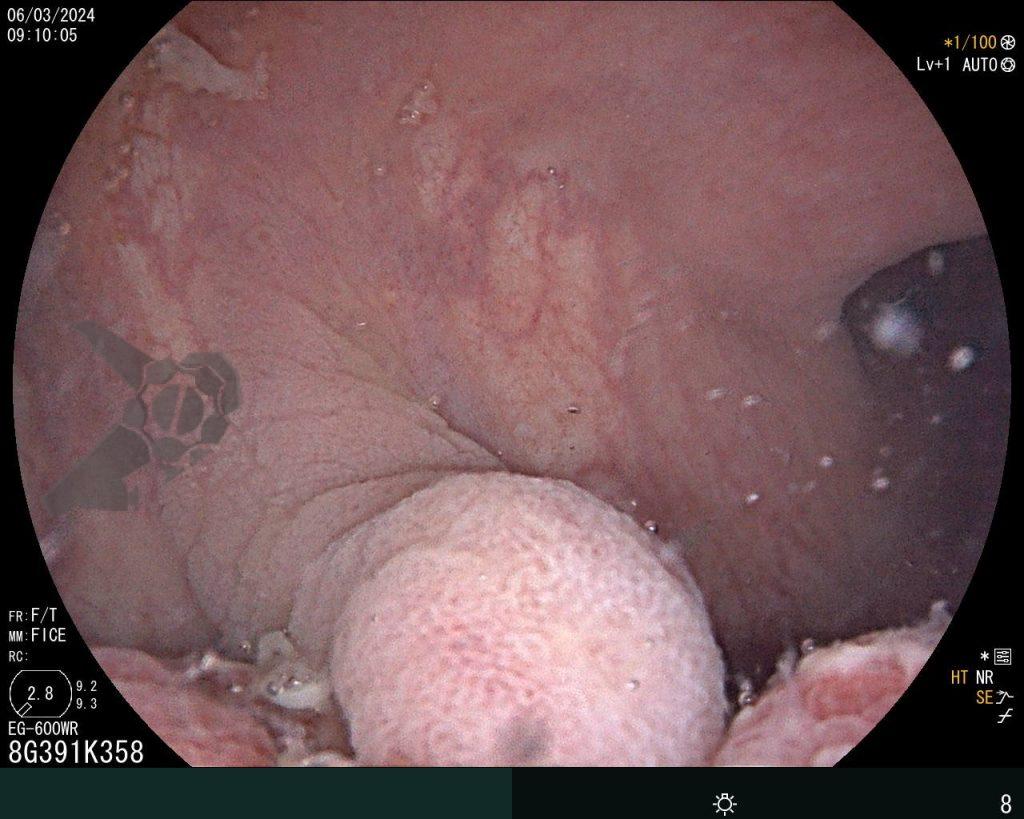
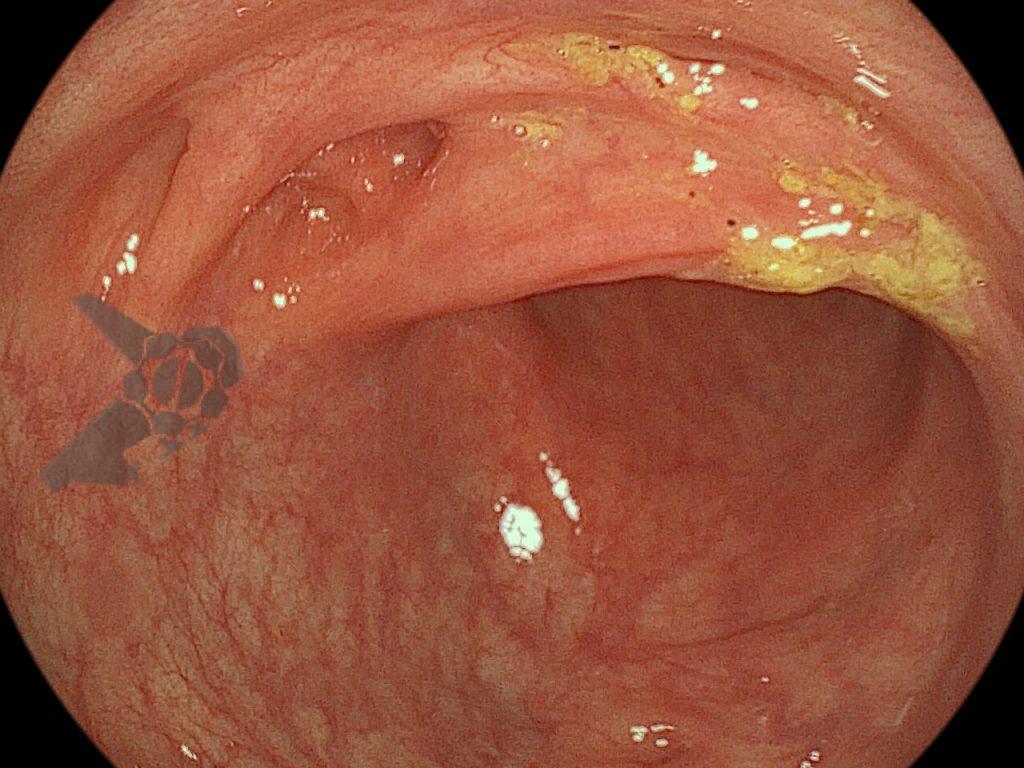
Após preparo colônico com manitol e a realização de uma nova radiografia, que não apontou qualquer mudança na posição inicial da prótese dentária desde a admissão, o paciente foi submetido a colonoscopia. Até a intubação cecal o corpo estranho não foi encontrado, com presença de doença diverticular no hemicólon esquerdo (foto 2 e 3).
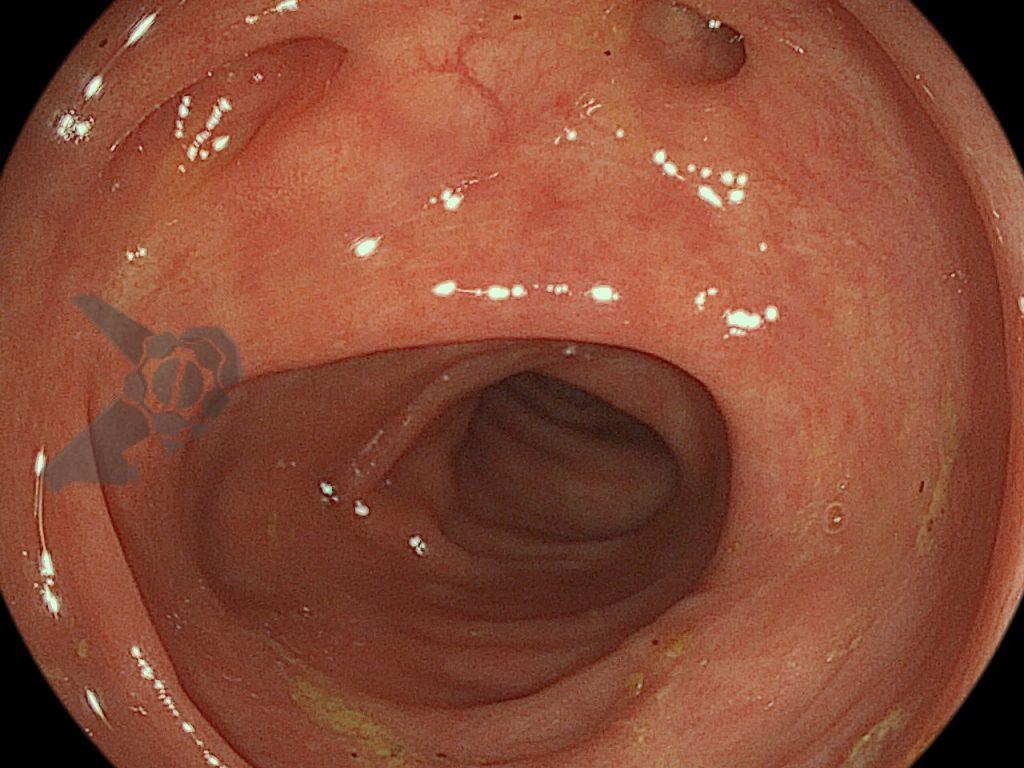
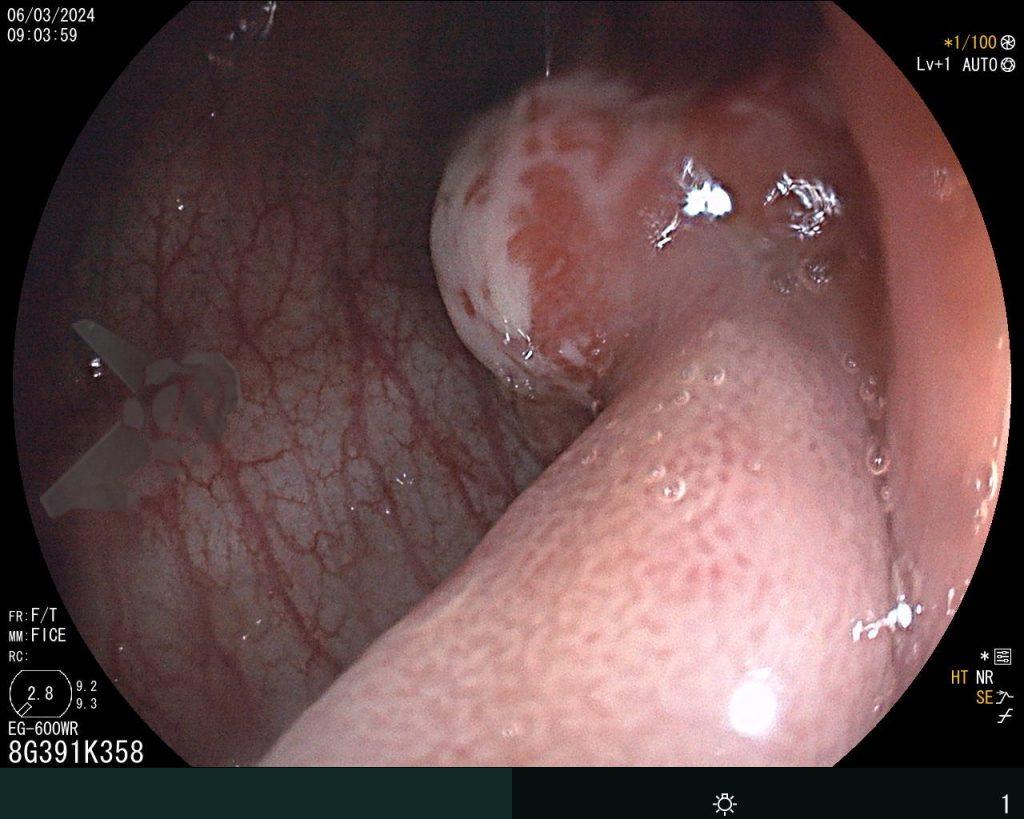
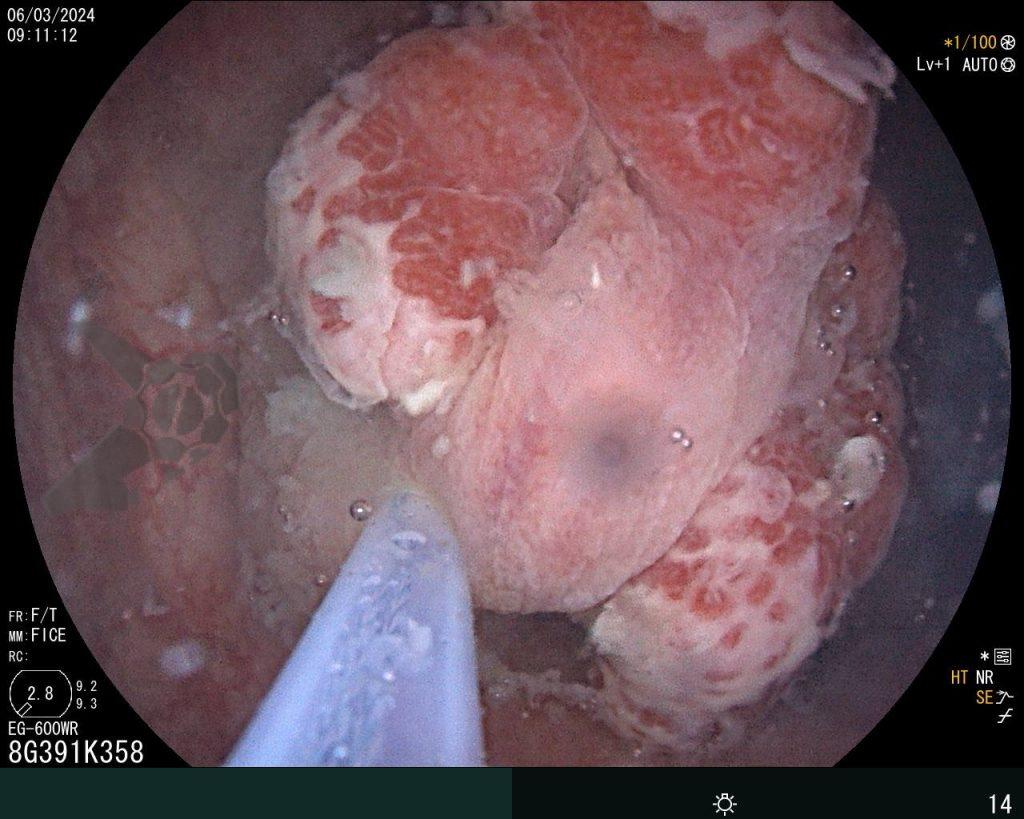
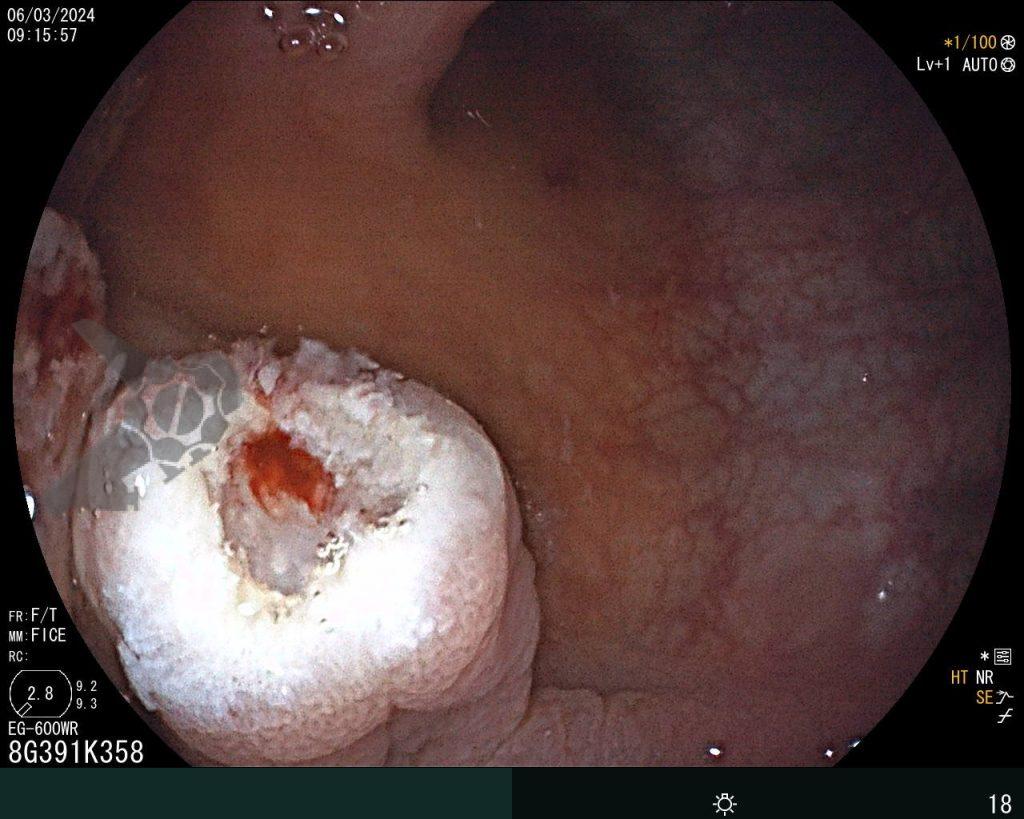
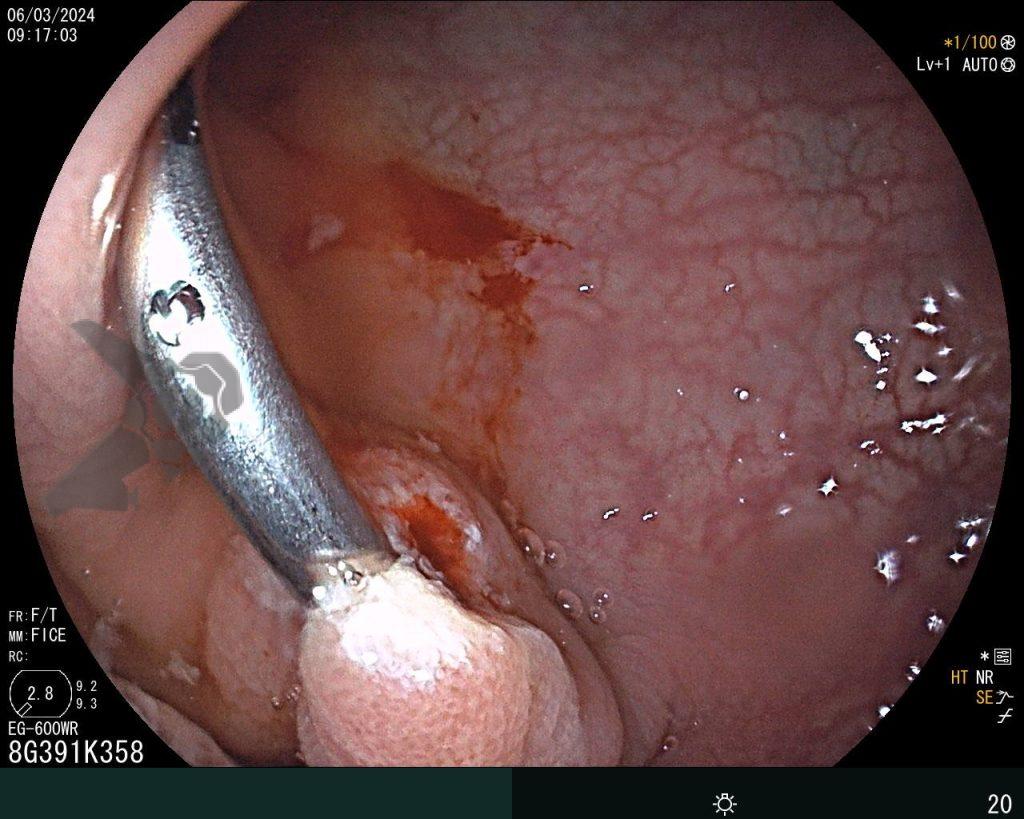
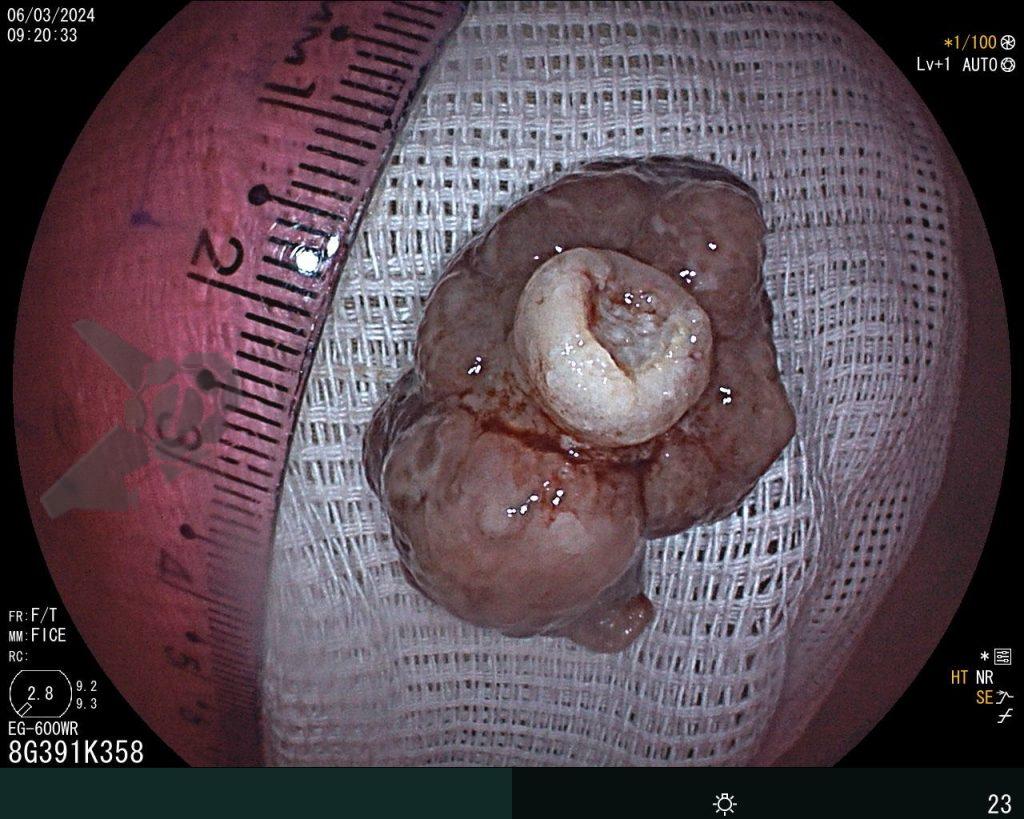
Percorridos cerca de 15 cm do íleo distal, a prótese dentária foi localizada. Com o auxílio de uma alça multifilamentar, foi possível mobilizá-la e, em seguida, capturar o corpo estranho impactado, trazendo-o até o ceco (vídeo 1). A remoção cuidadosa através dos cólons foi realizada com insuflação máxima e manobras delicadas nas angulações até a extração por via retal. Durante todo o procedimento, utilizou-se CO2 como gás insuflador e foi administrado antiespasmódico (escopolamina). Na revisão pós-remoção, não havia laceração da mucosa ou sinais de perfuração nos segmentos avaliados.
A prótese mediu 3 cm sendo composta por 5 dentes com três espiculas de superfície pontiaguda (pinos de fibra de vidro), tornando o segmento envolvido na impactação vulnerável a perfuração. (vídeo 2).
Clique aqui para visualizar outro caso de corpo estranho tratado por colonoscopia.
Discussão
A ingestão de corpos estranhos (CE) afeta diversos grupos etários e pode ser extremamente desafiador. Na maioria dos casos (quase 80%), não é necessária uma intervenção invasiva, já que os corpos estranhos passam pelo trato gastrointestinal (TGI) sem agravos. No entanto, cerca de 20% dos pacientes podem enfrentar complicações relativa a migração de objetos ao longo do trajeto pelo TGI, incluindo impactação (com ou sem obstrução), formação de fístulas, abscessos, sangramento e perfuração. Esta última, embora seja extremamente rara, ocorrendo em até 1% dos casos, é a complicação mais temida e potencialmente grave.
Desde o primeiro relato em 1972 da remoção bem-sucedida de um CE usando um endoscópio flexível por McKechnie et al, este método continua a evoluir. A técnica endoscópica representa uma abordagem segura e minimente invasiva, com baixa morbidade e taxa de sucesso na remoção próximo a 95%.
Entre os grupos com risco aumentado para ingestão acidental de corpos estranhos estão crianças, idosos, pessoas com transtornos psiquiátricos, aqueles sob intoxicação (alcoólica/entorpecentes), além dos indivíduos encarcerados (proposital para ganho secundário). Adultos e idosos, como no relato do caso, com problemas bucais e dentários (p. ex. usuários de próteses), estão particularmente expostos a ingestão acidental de CE devido a dificuldades mastigatórias e à redução da sensibilidade da cavidade oral.
Os segmentos do TGI mais expostos à perfuração por CE são aqueles estreitados e com angulações naturais. Por essa razão possuem risco aumentado os esfíncteres esofágicos superior e inferior, o piloro, o duodeno, a válvula ileocecal, o apêndice e o cólon sigmoide. Quando o objeto ultrapassa o canal pilórico o intestino delgado se torna particularmente vulnerável devido ao seu lúmen ser relativamente reduzido. Pacientes com histórico cirúrgico abdominal (com anastomoses/aderências), doença diverticular, bem como massas intra-abdominais, merecem atenção especial.
Existem diretrizes claras para as indicações de intervenções endoscópicas quando o objeto se encontra no trato gastrointestinal proximal ao ligamento de Treitz. No entanto, atualmente, há evidências limitadas sobre o papel da colonoscopia após a migração distal de corpos estranhos para o íleo e cólon, assim como escassos protocolos sobre o manejo para remoção desses objetos.
Quando optado pelo tratamento conservador, em assintomáticos, o monitoramento por até uma semana pode ser realizado, visto que a maioria dos corpos estranhos ingeridos é excretada sem intercorrências pelo trato digestivo. A radiografia seriada a cada 72 horas é uma estratégia para acompanhar a progressão do CE ao longo do TGI.
As indicações para a intervenção cirúrgica após ingestão de corpos estranhos incluem: (1) falha na remoção endoscópica, (2) inaptidão do paciente para endoscopia, (3) presença de complicações graves (perfuração, sangramento maciço, sinais de peritonite, abscessos cavitários, etc.).
Avaliar as características do corpo estranho ingerido como sua forma, quantidade, tamanho, superfície, consistência, mobilidade, entre outros, é crucial ao considerar a remoção colonoscópica, a fim de traçar uma estratégia terapêutica e prever possíveis complicações. Esse risco aumenta consideravelmente quando o objeto é alongado e possui uma superfície pontiaguda, como espinhas de peixe, ossos de galinha ou palitos de dente. Há uma variedade de dispositivos disponíveis para auxiliar a extração, e a escolha deve ser feita após análise minuciosa das peculiaridades do corpo estranho. Estes dispositivos incluem CAPs (rígidos, flexíveis, plásticos, de látex), alças e pinças de diferentes tamanhos e formatos, rede coletora (Roth Net), overtube, fio guia, entre outros. A radiografia e a tomografia de abdome são importantes para definir o posicionamento do CE ao longo do TGI, se possível, deve ser realizado antes e após o preparo do cólon, para se certificar que não houve mudança do posicionamento do objeto.
Com relação ao intestino delgado a válvula ileocecal constitui uma barreira anatômica natural a progressão. A enteroscopia, quando disponível, pode ser utilizada para recuperar corpos estranhos nessa topografia.
Conclusão
A abordagem endoscópica para remoção de corpos estranhos é uma alternativa segura e eficaz quando a intervenção se torna imperativa. Apesar de não estar isenta de riscos, sua natureza menos invasiva e traumática, em comparação com procedimentos cirúrgicos, a torna uma opção a ser considerada, especialmente para pacientes sem sinais de complicações, conforme exemplificado neste caso.
Referências
- Descending colon perforation due to ingestion of Foreign Body. Christos Tepelidis et al. Journal List. Cureus. Oct 2023;
- Small bowel perforation secondary to foreign body ingestion mimicking acute appendicitis. Ma, Tantan MSa; Zheng, Wentao BDb; An, Beiying MSa; Xia, Yan MDa; Chen, Geng MD. Medicine July 2019;
- Endoscopic removal of foreign bodies: A retrospective study in Japan. Kenji JL Limpias Kamiya et al. World Journal of Gastrointestinal Endoscopy. Jan. 2020;
- Endoscopic foreign body retrieval from the caecum – A case report and push for intervention guidelines Sharie Apikotoa, Helen Ballal, and Ruwan Wijesuriya Internal Journal of Surgery. Jan 2022;
- Minimally invasive extraction of a Foreign Body from the small intestine using double baloon endoscopy. Nakamura ET AL. Nagoya Journal of Medincine Science. Feb. 2015;
- The role of endoscopy in the management of patients with known and suspected colonic obstruction and pseudo-obstruction. M. Edwyn Harrison. GIE – Gastrointestinal endoscopy. April 2010;
- Management of ingested foreign bodies and food impactions. ASGE Standards of Practice Committee. June 2011.
Como citar este artigo
Vieira B B. Remoção endoscópica de corpo estranho impactado no íleo distal: relato de caso e revisão da literatura. Endoscopia Terapeutica 2024 vol 1. Disponível em: https://endoscopiaterapeutica.net/pt/?p=18662