Antrombóticos (Antiagregantes e Anticoagulantes): Manejo na Endoscopia
O termo antitrombótico compila as drogas que possuem efeito antiagregante plaquetário ou anticoagulante. Muitos pacientes têm feito uso dessas medicações contínuas em situações clínicas como fibrilação atrial, implante de valvas mecânicas, trombose venosa profunda e tromboembolismo pulmonar.
Visando redução dos riscos e um uso adequado das drogas antitrombóticas periprocedimentos, incluindo aqueles com abordagens endoscópicas, faz-se necessário um adequado entendimento dos processos de hemostasia, dos mecanismos de ação dessas medicações, suas indicações de uso, farmacocinética e abordagem em caso de sangramento. Para tal, as condutas citadas serão baseadas nos Guidelines da American Society for Gastrointestinal Endoscopy (ASGE) e European Society of Gastrointestinal Endoscopy (ESGE) [1,2].
Mecanismos de Coagulação
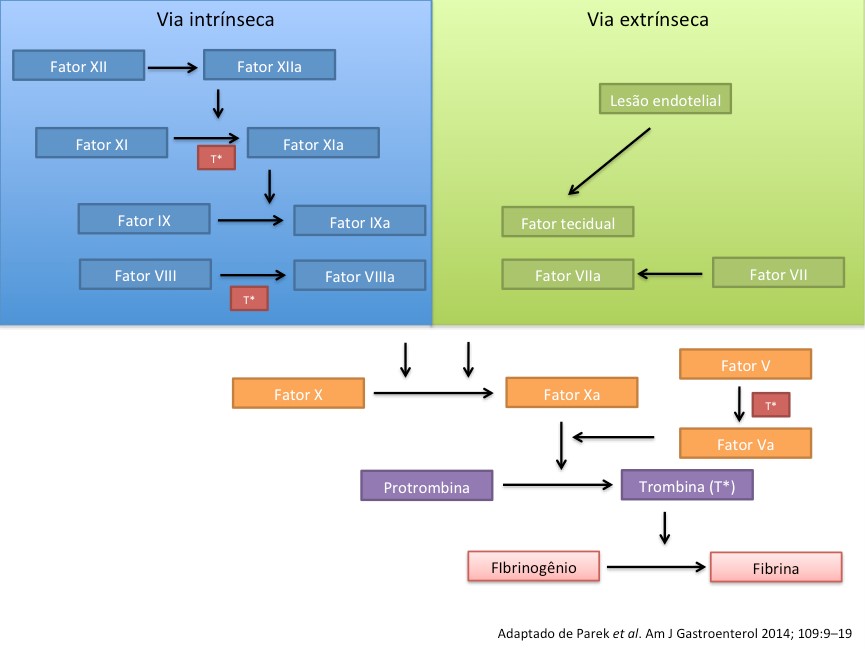
A hemostasia primária é o processo inicial da coagulação desencadeado pela lesão vascular. Imediatamente, mecanismos locais produzem vasoconstrição, alteração da permeabilidade vascular com produção de edema, vasodilatação dos vasos tributários da região em que ocorreu a lesão e adesão das plaquetas. O endotélio do vaso lesionado libera difosfato de adenosina, serotonina e tromboxano A2. As plaquetas respondem a essas citocinas com a expressão de glicoproteína IIb/IIIa e junto à molécula de adesão celular plaqueta endotélio tipo 1 levam a formação de um tampão plaquetário inicial (Figura 1).
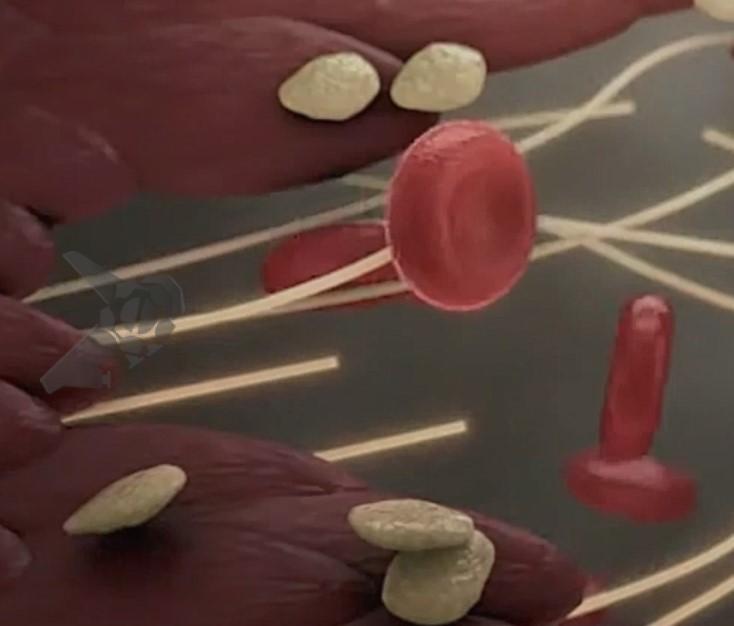
Na hemostasia secundária, a coagulação sanguínea consiste na conversão de uma proteína solúvel do plasma, o fibrinogênio, em um polímero insolúvel, a fibrina, por ação de uma enzima denominada trombina (Figura 2).
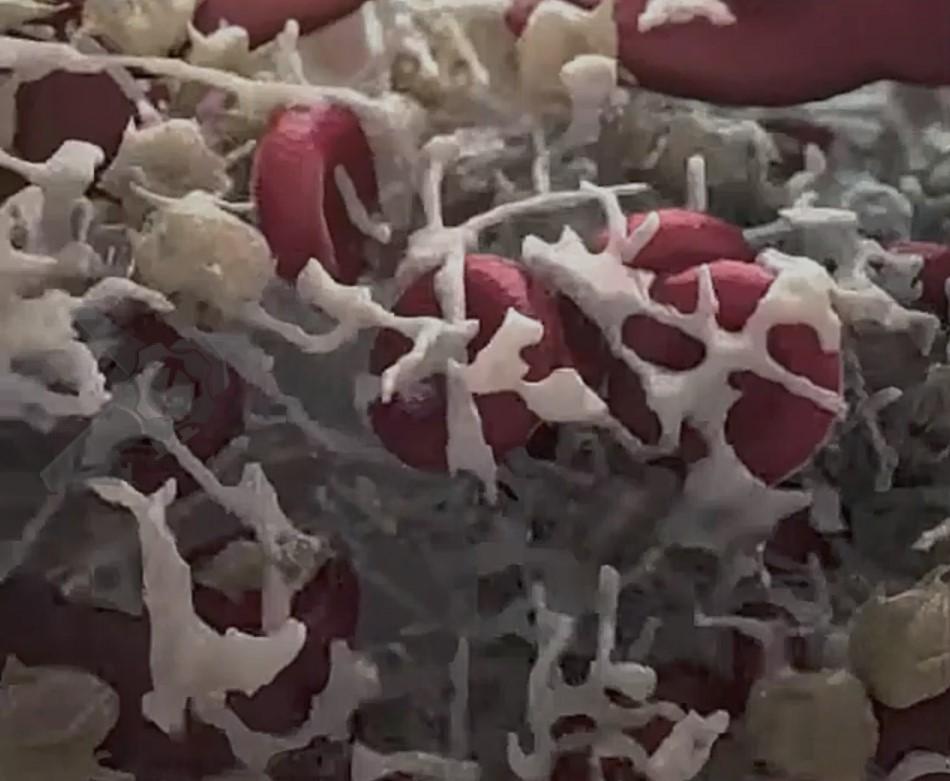
Isso ocorre com a exposição do fator tecidual no local da lesão endotelial junto com as cascatas de coagulação em suas vias intrínseca e extrínseca (Figura 3).
Drogas Antitrombóticas
Além das drogas antigas como a Varfarina, um antagonista da vitamina K com ação anticoagulante, e o ácido acetil salicílico (AAS), um inibidor da ciclooxigenase com efeito antiagregante plaquetário, temos novas classes de drogas que serão discutidas a seguir.
– Antiagregante plaquetários: Tienopiridinas
As tienopiridinas atuam como antagonistas do receptor P2Y12, inibindo a agregação plaquetária dependente da adenosina difosfato que é liberada após a lesão endotelial, durante a hemostasia primária. As principais drogas desse grupos são Clopidogrel (Plavix), Prasugrel (Effient) e Ticagrelor (Brillinta).
– Antiagregante plaquetários: Inibidores da GPIIbIIIa
Os inibidores do complexo glicoprotéico IIb/IIIa constituem classe heterogênea de fármacos capazes de bloquear a via final comum da agregação plaquetária. Para uso clínico, por via endovenosa, constituído por: Tirofiban (Aggrastat), Abciximab (ReoPro) e Eptifibatide (Integrilin).
– Anticoagulante: Varfarina e Heparinas
Apesar de possuir largo tempo de utilização e efetividade bem definida, a Varfarina (Warfarin, conhecido como Coumadin e Marevan) possui algumas desvantagens frente às novas drogas anticoagulantes que são: sua estreita janela terapêutica e margem de segurança necessitando de monitorização laboratorial frequente, inicio lento de ação, com alcance de faixa terapêutica somente após alguns dias em muitos casos, e a potencial influência da dieta e outras medicações na sua atividade. Por outro lado, é uma droga difusamente conhecida, com potencial de reversão dos seus efeitos de modo rápido e fácil com uso de vitamina K ou mesmo plasma.
Já as heparinas interagem com a antitrombina, um anticoagulante natural que inativa os fatores IXa, Xa e XIa, aumentando o efeito deste anticoagulante em mais de 1000 vezes. Representando pela Heparina não fracionada (HNF) e as de baixo peso molecular (HBPM), devido ao seu tempo de meia-vida curto, elas são utilizadas como método de ponte: troca de anticoagulante de longa duração por curta em procedimentos de alto risco.
– Anticoagulante: Inibidores Xa
Representando pela Rivaroxabana (Xarelto), os inibidores do fator Xa inibem competitivamente o fator X ativado e atuam da cascata como um todo, já que o fator X unifica as vias intrínseca e extrínseca da coagulação. Ao se associar com o fator Va o fator X forma um complexo chamado protrombinase que atua na transformação da protrombina em trombina. A rivaroxabana atua prevenindo a formação da protrombinase e consequentemente da trombina.
– Anticoagulante: Inibidores diretos da Trombina
Os inibidores diretos da trombina são representados pelas drogas Bivalirudina (Angiomax) e Dabigatran (Pradaxa). A Bivalirudina é um droga utilizada principalmente em procedimentos de intervenção coronariana percutânea. Já o Dabigatran é uma droga aprovada na prevenção de isquemia cerebral em casos de fibrilação atrial não valvular e no tromboembolismo venoso.
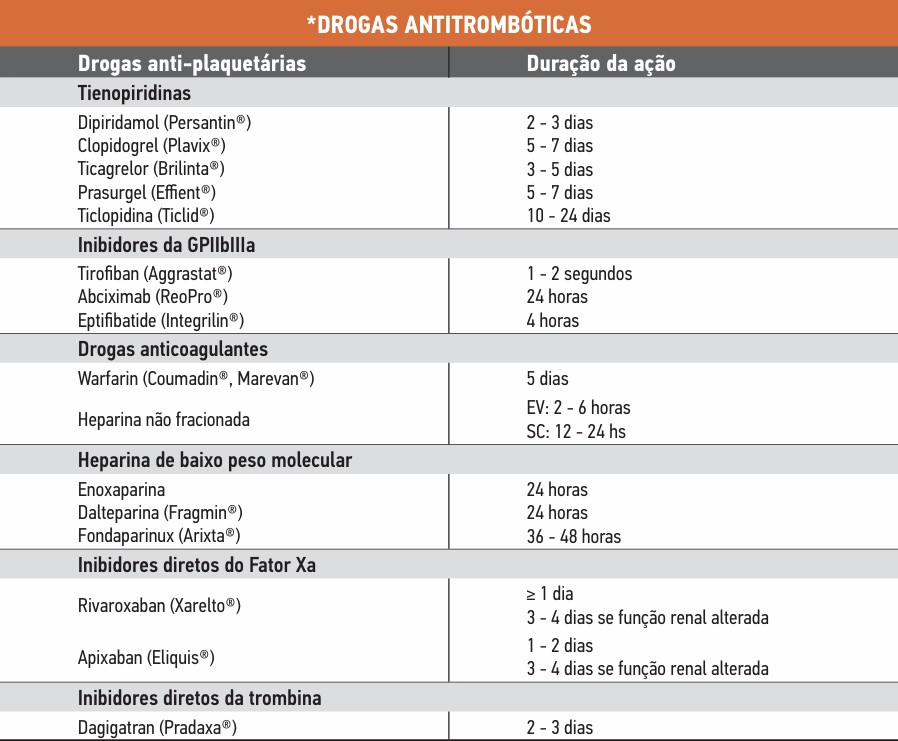
Vide resumo da tabela abaixo com o tempo de duração dos antitrombóticos equivalente ao tempo de suspensão caso seja indicado (Tabela 1).
Manejo Endoscópico
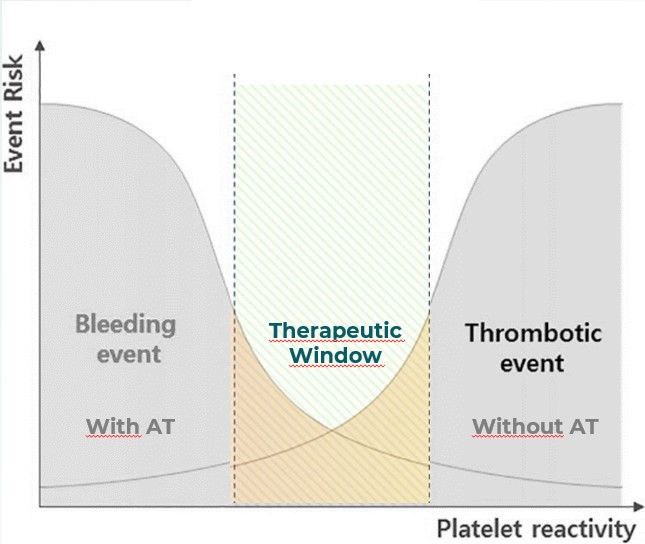
Com base nos conceitos acima, a forma como iremos abordar quaisquer procedimentos endoscópicos baseiam-se na janela terapêutica: em que há menor risco de sangramento (baixo risco do procedimento ou suspensão da medicação antitrombótica) versus o risco tromboembólico (doença trombótica de base), ilustrado na Figura 4.
Para isso, devemos inicialmente avaliar o risco versus benefício e adiar, quando possível, os procedimentos eletivos até que a terapia antitrombótica de curto prazo seja concluída. Antes da suspensão de qualquer medicação antitrombótica, o paciente deverá realizar avaliação com seu médico prescritor quanto à suspensão das medicações e indicação do exame.
Sendo um exame indicado, o primeiro passo é seguir com estratificação de risco de sangramento do procedimento, seguido de estratificação de risco tromboembólico e conduta.
Risco de sangramento do procedimento
| BAIXO Risco de Sangramento | ALTO Risco de Sangramento |
| Procedimentos diagnósticos com ou sem biópsia | Polipectomia endoscópica |
| CPRE com passagem de prótese biliar ou pancreática (Sem esfincterotomia) |
CPRE com esfincterotomia |
| Colocação de próteses esofágicas, enterais ou colônicas | Ampulectomia |
| Ecoendoscopia diagnóstica | Mucosectomia e ESD |
| Dilatação de estenose | |
| Tratamento de varizes | |
| Gastrostomia endoscópica | |
| Ecoendoscopia com punção ou terapêutica | |
| Ablação esofágica ou gástrica |
Risco tromboembólico
| Baixo Risco Tromboembólico | Alto Risco Tromboembólico |
| Válvula cardíaca biológica | Válvula cardíaca metálica mitral ou aórtica |
| Válvula cardiáca com Fibrilação Atrial | |
| Fibrilação Atrial com Estenose Mitral | |
| Fibrilação Atrial Sem Alto Risco (CHADS 2 ≤ 4 pontos): * Insuficiência cardíaca (1 ponto) * Hipertensão (1 ponto) * Idade > 75 anos (1 ponto) * Diabetes mellitus (1 ponto) * AVE ou AIT (2 pontos) |
Fibrilação Atrial Com Alto Risco (CHADS 2 >4 pontos) |
| Fibrilação Atrial com AVE ou AIT com menos de 3 meses | |
| TVP com mais de 3 meses de tratamento | TVP com menos de 3 meses de tratamento |
Conduta
- Procedimentos de BAIXO Risco de Sangramento:
- Mantém antiagregação;
- Mantém Varfarina se dentro da faixa terapêutica, caso contrário, aguardar correção de dose com especialista;
- Suspender outros anticoagulantes somente no dia;
- Procedimentos de ALTO Risco de Sangramento e BAIXO Risco Tromboembólico:
- Suspender Clopidogrel, Ticagrelol ou Prasugrel 7 dias antes e reiniciar 1 a 2 dias após procedimento, mantendo sempre o AAS;
- Suspender anticoagulantes orais diretos (DOAC – Direct Oral AntiCoagulants: Dabigatrana, Rivaroxabana, Apixabana e Edoxabana) 3 dias antes, sendo 5 dias se doença renal com clearance de 30-50mL/min, e retomar em 2 a 3 dias após procedimento;
- Suspender Varfarina 5 dias antes (checar se INR<1,5 antes do exame) e retomar dose usual ao fim do dia do procedimento.
- Procedimentos de ALTO Risco de Sangramento e ALTO Risco Tromboembólico:
- Suspender Clopidogrel, Ticagrelol ou Prasugrel 7 dias antes e reiniciar 1 a 2 dias após procedimento, mantendo sempre o AAS;
- Suspender anticoagulantes orais diretos (DOAC – Direct Oral AntiCoagulants: Dabigatrana, Rivaroxabana, Apixabana e Edoxabana) 3 dias antes, sendo 5 dias se doença renal com clearance de 30-50mL/min, e retomar em 2 a 3 dias após procedimento;
- Realizar ponte de anticoagulação: Suspender Varfarina 5 dias antes, com início de HBPM (Enoxaparina) 3 dias antes do procedimento, seguida de suspensão no dia do procedimento. Retomar o uso da Varfarina ao fim do dia do procedimento, mantendo a HBPM até faixa de INR terapêutica.
- Manter AAS em todos os casos, principalmente para prevenção secundária. As exceções são: suspender imediatamente em quadro agudo de sangramento, prevenção primária que poderá ser suspensa 5 dias antes em procedimentos de alto risco de sangramento e, segundo a ESGE, suspender para ampulectomia. [1,5]
- Em casos de alto risco trombóticos de pacientes com stent coronariano ou dúvidas do risco tromboembólico, recomenda-se avaliação do cardiologista para manejo de antiagregação e anticoagulação.
Referências:
- Veitch AM, Radaelli F, Alikhan R, et al. Endoscopy in patients on antiplatelet or anticoagulant therapy: British Society of Gastroenterology (BSG) and European Society of Gastrointestinal Endoscopy (ESGE) guideline update. Endoscopy. 2021 Sep;53(9):947-969. doi: 10.1055/a-1547-2282. Epub 2021 Aug 6. PMID: 34359080; PMCID: PMC8390296.
- ASGE Standards of Practice Committee; Acosta RD, Abraham NS, et al. The management of antithrombotic agents for patients undergoing GI endoscopy. Gastrointest Endosc. 2016 Jan;83(1):3-16. doi: 10.1016/j.gie.2015.09.035. Epub 2015 Nov 24. Erratum in: Gastrointest Endosc. 2016 Mar;83(3):678. PMID: 26621548.
- Parekh PJ, Merrell J, Clary M, Brush JE, Johnson DA. New anticoagulants and antiplatelet agents: a primer for the clinical gastroenterologist. Am J Gastroenterol. 2014 Jan;109(1):9-19. doi: 10.1038/ajg.2013.228. PMID: 24402526.
- Huo Y, Jeong YH, Gong Y, et al. 2018 update of expert consensus statement on antiplatelet therapy in East Asian patients with ACS or undergoing PCI. Sci Bull (Beijing). 2019 Feb 15;64(3):166-179. doi: 10.1016/j.scib.2018.12.020. Epub 2018 Dec 28. PMID: 36659616.
- Biondi-Zoccai GG, Lotrionte M, Agostoni P, et al. A systematic review and meta-analysis on the hazards of discontinuing or not adhering to aspirin among 50,279 patients at risk for coronary artery disease. Eur Heart J. 2006 Nov;27(22):2667-74. doi: 10.1093/eurheartj/ehl334. Epub 2006 Oct 19. PMID: 17053008.
Como citar este arquivo
Kum AST e Medrado B. Antrombóticos (Antiagregantes e Anticoagulantes): Manejo na Endoscopia. Endoscopia Terapeutica 2024 vol II. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/antromboticos-antiagregantes-e-anticoagulantes-manejo-na-endoscopia/