Técnica para neurólise do plexo celíaco por Ecoendoscopia
Introdução
Cerca de metade dos pacientes com neoplasia malignas abdominais apresentam dor crônica, com uma incidência ainda maior em pacientes com câncer gástrico e pancreático em estado avançado (clique aqui para critérios de rastreio de neoplasia pancreática). O mecanismo da dor é multifatorial, com componentes nociceptivo (somático e visceral) e neuropático, sendo este último o mais resistente à terapêutica analgésica. O câncer pancreático apresenta-se com maior propensão para invasão perineural e, portanto, dor neuropática, o que explica uma maior prevalência do sintoma em pacientes com esta doença.
O controle inadequado da dor não prejudica apenas o aspecto da qualidade de vida dos pacientes, mas também está relacionado a desfechos clínicos piores, incluindo uma maior mortalidade.1,2,3
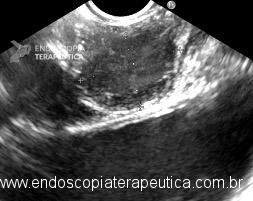
O manejo da dor deve ser feito de maneira multimodal, incluindo o uso de analgésicos não opioides, opioides e moduladores da dor, mas o efeito colateral destas medicações, sobretudo dos opioides (náusea, vômitos, constipação, sonolência, pruridos) é um fator limitante. Outro aspecto que dificulta o controle álgico é a tendência a resistência à ação das medicações e necessidade de aumento progressivo das doses, com consequente aumento dos efeitos colaterais. Neste contexto a neurólise do plexo celíaco (Figura 14) surge como um importante método complementar no tratamento da dor oncológica abdominal, podendo ser indicada também em contexto não oncológico como no caso da pancreatite crônica dolorosa. A intervenção direta no plexo celíaco atua na redução da transmissão dolorosa independente do tipo do sinal (nociceptivo ou neuropático).
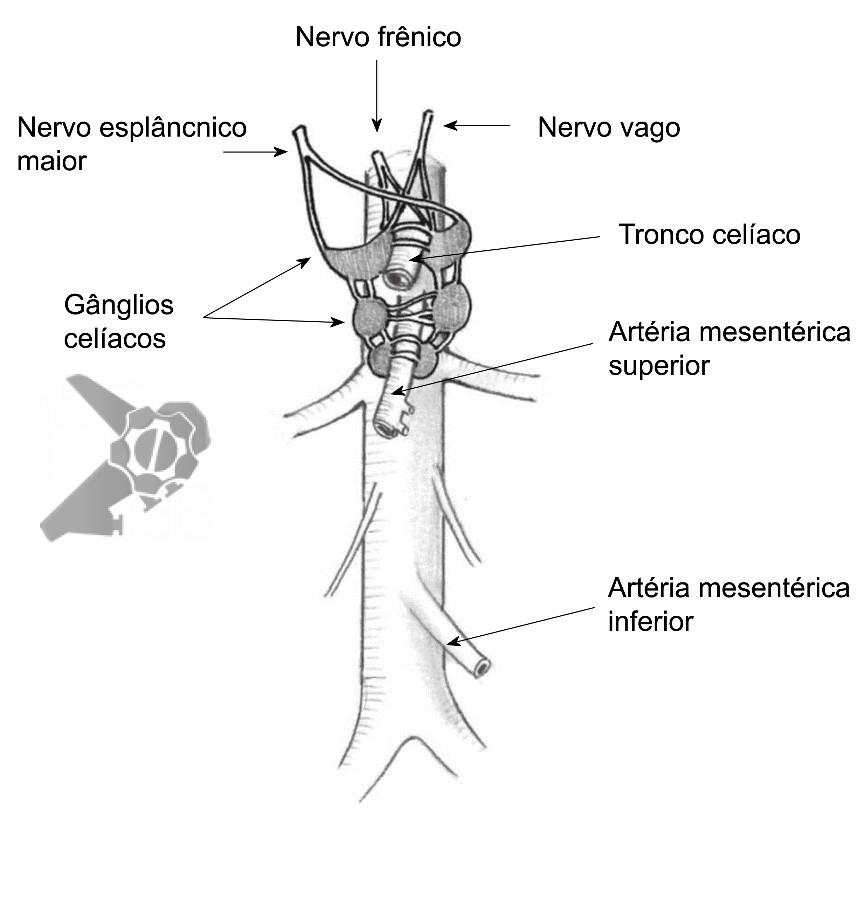
A neurólise consiste na destruição permanente do plexo pela injeção de uma substância neurolítica, como o etanol. É importante diferenciar do bloqueio celíaco que se refere a interrupção temporária da transmissão dolorosa pela injeção de corticoides ou anestésicos de longa duração.
Técnica
O procedimento de neurólise do plexo celíaco foi classicamente descrito por abordagem posterior guiada por tomografia. Entretanto o advento da Ecoendoscopia, permitiu uma abordagem com menos eventos adversos, mais cômoda aos pacientes, mais custo-efetiva e com a possibilidade de visão em tempo real. A técnica ecoguiada foi descrita por Wiersema et al 5 em 1996.
A preparação do paciente deve levar em consideração avaliação da coagulação e função plaquetária, com descontinuação de agendes anticoagulantes e antiplaquetários, conforme recomendações habituais. As contraindicações relativas e absolutas estão expostas na tabela 1.
| Tabela 1. Contraindicações da neurólise celíaca guiada por Ecoendoscopia |
| Absoluta | Relativa |
| Câncer pancreático ressecável | Varizes esofágicas ou gástricas |
| Coagulopatia (INR > 1,5) | Cirurgia gástrica prévia |
| Plaquetas baixas (< 50.000) | Anomalias do tronco celíaco |
Devido a perda do tônus simpático, os pacientes podem apresentar hipotensão nos pós procedimento. Assim, há a necessidade de administração de cristaloides venosos no pré, intra e pós procedimento, com monitorização multiparamétrica até momento da alta.
O procedimento ecoguiado por ser feito por injeção única central, com uma agulha com ponta cônica e porção dista multiperfurada projetada especificamente para esta técnica (Agulha EchoTip® Ultra para neurólise do plexo celíaco, Cook Medical – Figura 2), que sendo posicionada acima do tronco celíaco permite que a injeção seja pulverizada em um forma radial e uniforme, ou por agulha standard com duas injeções laterais ao tronco. Devido a maior disponibilidade das agulhas standard, transcrevemos a seguir técnica bilateral, conforme descrição do professor Sergio Eijii Matuguma, professor do serviço de endoscopia digestiva do hospital das clínicas da faculdade de medicina da universidade de São Paulo (HC-FMUSP).

Materiais necessários:
- 01 agulha fina de aspiração (FNA) 22G;
- 01 frasco 20 ml de Bupivacaína 0,5%, sem vasoconstrictor;
- 02 frascos 10 ml álcool absoluto estéril (98% GL);
- 02 ampolas Soro Fisiológico (SF) 10 ml;
- 02 seringas 10 ml (para solução de Bupivacaína);
- 02 seringas 10 ml (para solução de Álcool absoluto);
- 02 seringas 10 ml (para SF).
Preparo prévio:
- Bupivacaína 0,25%
- Aspirar na seringa de 10 ml = Bupivacaína 0,5% 5 ml + 5 ml SF;
- Total final: 10 ml de Bupivacaína 0,25% ;
- Preparar 2 seringas da solução.
- Álcool absoluto estéril
- Aspirar na seringa de 10 ml = álcool absoluto estéril 10 ml;
- Total final: 10 ml de álcool;
- Preparar 2 seringas de álcool.
- Soro fisiológico
- Aspirar na seringa de 10 ml = 10 ml SF;
- Total final: 10 ml de SF;
- Preparar 2 seringas SF.
- Agulhas 22G (FNA)
- Preencher agulha com 3 ml SF (para retirar o ar de dentro da luz da agulha) e deixar conectada a seringa 10 ml com SF.
- Preparo do paciente
- Administrar 500 a 1000 ml de ringer lactato IV antes do procedimento.
Sequência da técnica:
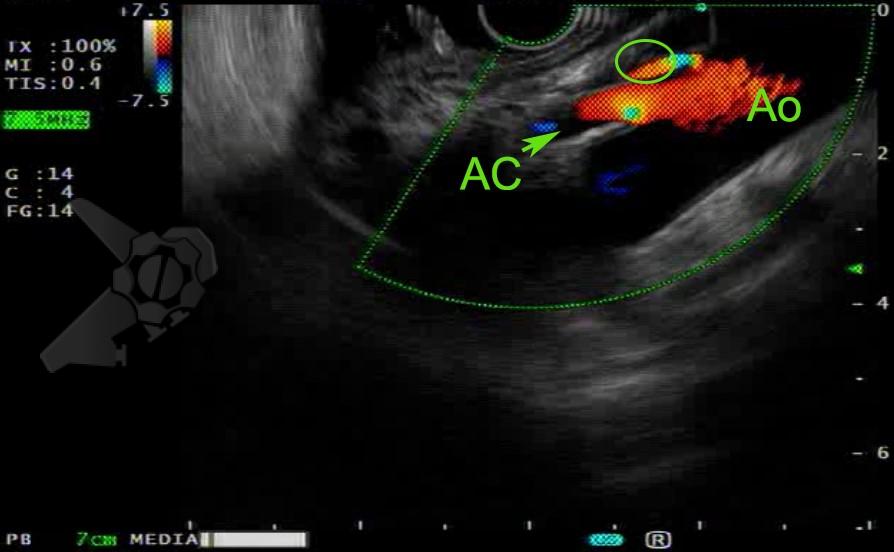
- Localizar a artéria celíaca;
- Memorizar o ponto no espaço retroperitoneal, junto ao ângulo obtuso da emergência da artéria celíaca e parede gástrica. Fixar o ponto (local – Figura 3);
- Torque anti-horário (milimétrico) até desaparecer a aorta (para direita da aorta abdominal);
- Puncionar o local “espelho” do lado direito que havia fixado, junto ao ângulo obtuso da emergência da artéria celíaca, com agulha 22G (Figura 4);
- Injetar 3 ml SF no espaço retroperitoneal (formar um coxim de SF que afasta os vasos arteriais maiores, por exemplo vertebrais);
- Seguir com injeção de 10 ml da solução de bupivacaina 0,25%;
- Após, injetar de 10 ml de álcool absoluto estéril;
- Recolocar a seringa de SF, injetar 3 a 5 ml de SF, a fim de empurrar todo o álcool da luz da agulha;
- Remover a agulha;
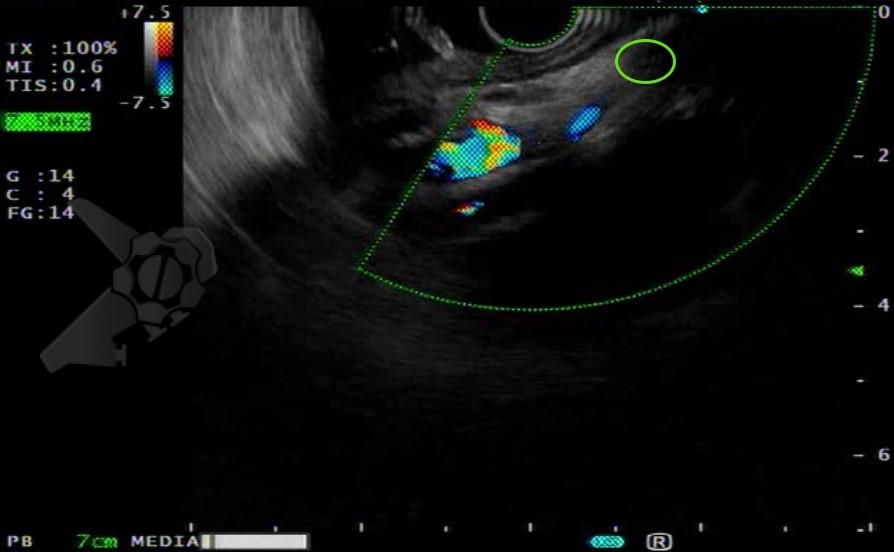
- Para outro lado (à esquerda da aorta), localizar a artéria celíaca;
- Memorizar o ponto no espaço retroperitoneal, junto ao ângulo obtuso da emergência da artéria celíaca e parede gástrica. Fixar o ponto (local – Figura 3);
- Torque horário (milimétrico) até desaparecer a aorta (para esquerda da aorta abdominal);
- Puncionar o local “espelho” do lado esquerdo que havia fixado, junto ao ângulo obtuso da emergência da artéria celíaca, com agulha 22G (Figura 5);
- Injetar 3 ml SF no espaço retroperitoneal (formar um coxim de SF que afasta os vasos arteriais maiores, por exemplo vertebrais);
- Seguir com injeção de 10 ml da solução de bupivacaína 0,25%;
- Após, injeção de 10 ml de álcool absoluto estéril;
- Recolocar a seringa de SF e injetar 3 a 5 ml de SF para empurrar todo o álcool da luz da agulha;
- Remover a agulha.
Cuidados pós procedimento:
- Observar:
- Hipotensão postural (imediata). Se necessário administrar mais fluidos intravenosos;
- Dor abdominal (primeiras 48 horas). É esperado pelo efeito de neurólise do álcool;
- Diarreia transitória (primeiras 48h);
- Alteração neurológica membros inferiores (primeiras 48h).
- Após 48h é esperada reduz da dose de opioide, entretanto a maioria dos pacientes ainda necessitará de uso complementar de analgésicos.
Resultados e complicações
O alívio da dor bom ou excelente é esperado em 89% dos pacientes submetidos ao procedimento, nas primeiras 2 semanas, sendo mantida por 3 meses em cerca de 90% destes pacientes e alcançando eficácia significativa de 70 a 90% no momento da morte.6
Apesar de não haver aumento de sobrevida associada ao procedimento, há significativo aumento da qualidade de vida destes pacientes, com melhora do status funcional, capacidade de trabalhar, sono e aproveitamento de atividades de laser.7,8 Esses achados estão associados com a melhora da dor e com a diminuição dos efeitos colaterais associados aos analgésicos opioides.
A maior parte das complicações associadas ao procedimento são leves e transitórias (descritas acima na sessão referente à técnica: hipotensão postural, dor abdominal, diarreia, alteração neurológica em membros inferiores. Entretanto foram descritas na literatura casos isolados de complicações graves como trombose do tronco celíaco, paraplegia permanente por infarto da medula espinhal e abscesso retroperitoneal, provavelmente associados a erros técnicos na realização do procedimento.
Conclusão
A neurólise do plexo celíaco é um procedimento seguro e efetivo, que pode ser utilizado no manejo da dor abdominal crônica em doenças malignas e benignas (sobretudo neoplasia pancreática e pancreatite crônica dolorosa).9 Ele deve ser considerado um procedimento complementar no manejo destes pacientes e geralmente sua realização não leva a uma completa descontinuação do uso de analgésicos, porém ao promover sua redução, tem importante papel na melhora da qualidade de vida, especialmente quando indicado de forma mais precoce no manejo da doença.
Referências
- Koulouris AI, Banim P, Hart AR. Pain in patients with pancreatic cancer: prevalence, mechanisms, management and future developments. Dig Dis Sci 2017;62(04):861–870.
- Kelsen DP, Portenoy RK, Thaler HT, et al. Pain and depression in patients with newly diagnosed pancreas cancer. J Clin Oncol 1995;13(03):748–755
- Cornman-Homonoff J, Holzwanger DJ, Lee KS, Madoff DC, Li D. Celiac Plexus Block and Neurolysis in the Management of Chronic Upper Abdominal Pain. Semin Intervent Radiol. 2017 Dec;34(4):376-386.
- Seicean A. Celiac plexus neurolysis in pancreatic cancer: the endoscopic ultrasound approach. World J Gastroenterol. 2014 Jan 7;20(1):110-7.
- Wiersema MJ, Wiersema LM. Endosonography-guided celiac plexus neurolysis. Gastrointest Endosc. 1996 Dec;44(6):656-62. doi: 10.1016/s0016-5107(96)70047-0. PMID: 8979053.
- Eisenberg E, Carr DB, Chalmers TC. Neurolytic celiac plexus block for treatment of cancer pain: a meta-analysis. Anesth Analg 1995; 80(02):290–295
- Leblanc JK, Rawl S, Juan M, Johnson C, Kroenke K, McHenry L, Sherman S, McGreevy K, Al-Haddad M, Dewitt J. Endoscopic Ultrasound-Guided Celiac Plexus Neurolysis in Pancreatic Cancer: A Prospective Pilot Study of Safety Using 10 mL versus 20 mL Alcohol. Diagn Ther Endosc 2013; 2013: 327036
- Seicean A, Cainap C, Gulei I, Tantau M, Seicean R. Pain palliation by endoscopic ultrasound-guided celiac plexus neurolysis in patients with unresectable pancreatic cancer. J Gastrointestin Liver Dis 2013; 22: 59-64
- Pérez-Aguado G, de la Mata DM, Valenciano CM, Sainz IF. Endoscopic ultrasonography-guided celiac plexus neurolysis in patients with unresectable pancreatic cancer: An update. World J Gastrointest Endosc. 2021 Oct 16;13(10):460-472. doi: 10.4253/wjge.v13.i10.460. PMID: 34733407; PMCID: PMC8546561.
Como citar este artigo
Mendoça EQ e Matuguma SE. Técnica para neurólise do plexo celíaco por Ecoendoscopia. Endoscopia Terapeutica 2024 Vol. 1. Disponível em: https://endoscopiaterapeutica.net/pt/uncategorized/tecnica-para-neurolise-do-plexo-celiaco-por-ecoendoscopia/