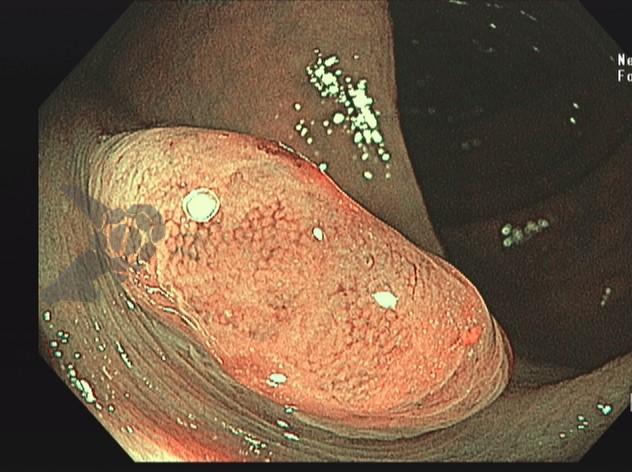
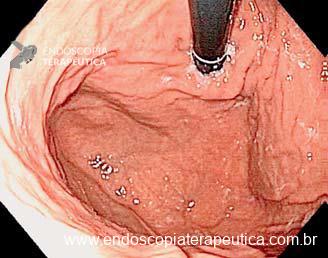
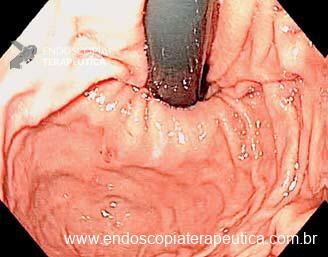
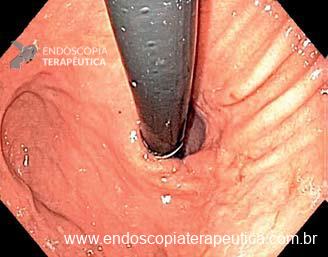
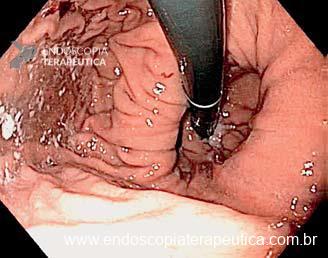
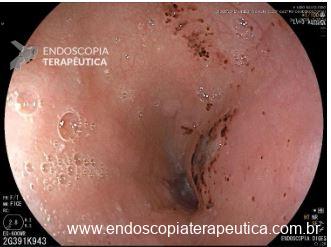
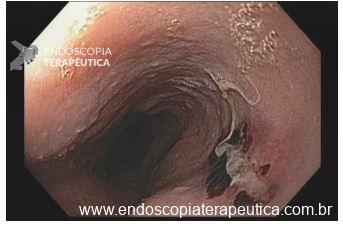
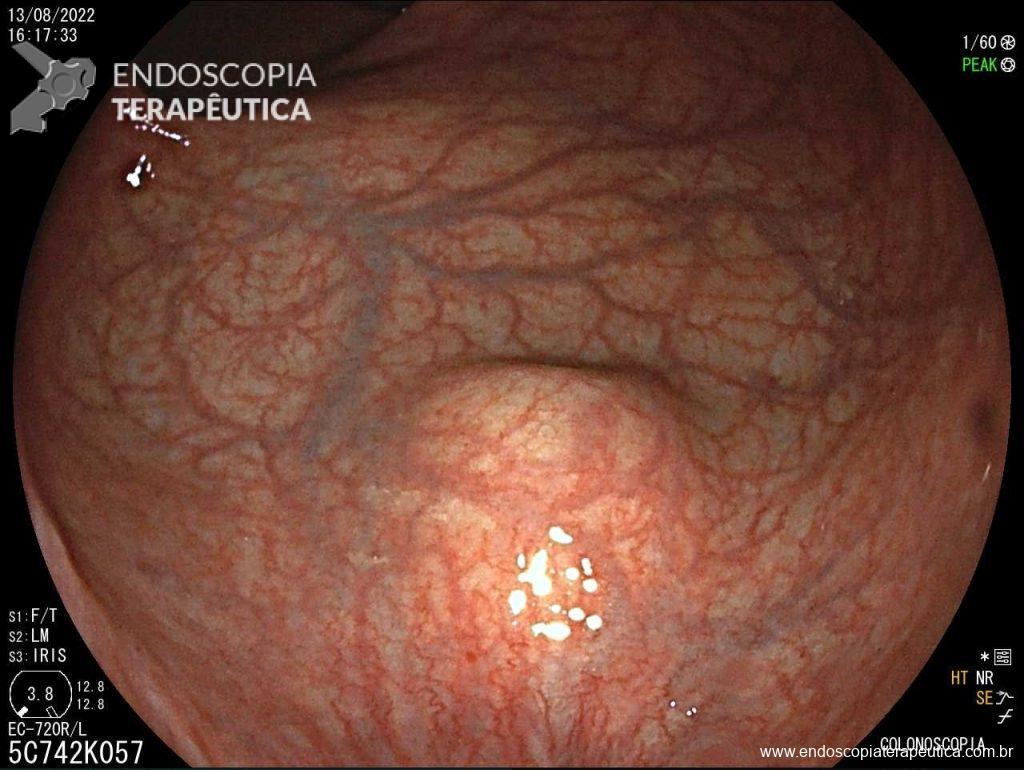
Como fazer uma punção ecoguiada transvascular?
Durante anos, a presença de vasos de grande calibre entre o ecoendoscópio e a lesão representava um obstáculo intransponível. Mas os tempos mudaram: a evolução técnica e a experiência crescente com punção transvascular guiada por EUS/EBUS (TVNA) mostram que esse caminho, antes temido, pode ser seguro e altamente eficaz, desde que bem indicado.
O que é a TVNA?
A TVNA é uma técnica de punção por agulha fina em que a agulha atravessa um vaso sanguíneo interposto (como a aorta, artéria pulmonar ou veia cava) para alcançar uma lesão torácica ou abdominal.
- Objetivo: coletar tecido para análise citopatológica ou histológica
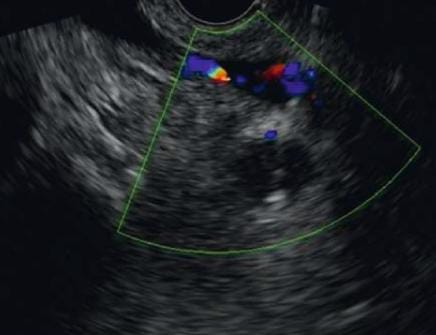
- Guia: ecoendoscopia em tempo real com doppler
- Público alvo: pacientes sem outra via de acesso para diagnóstico
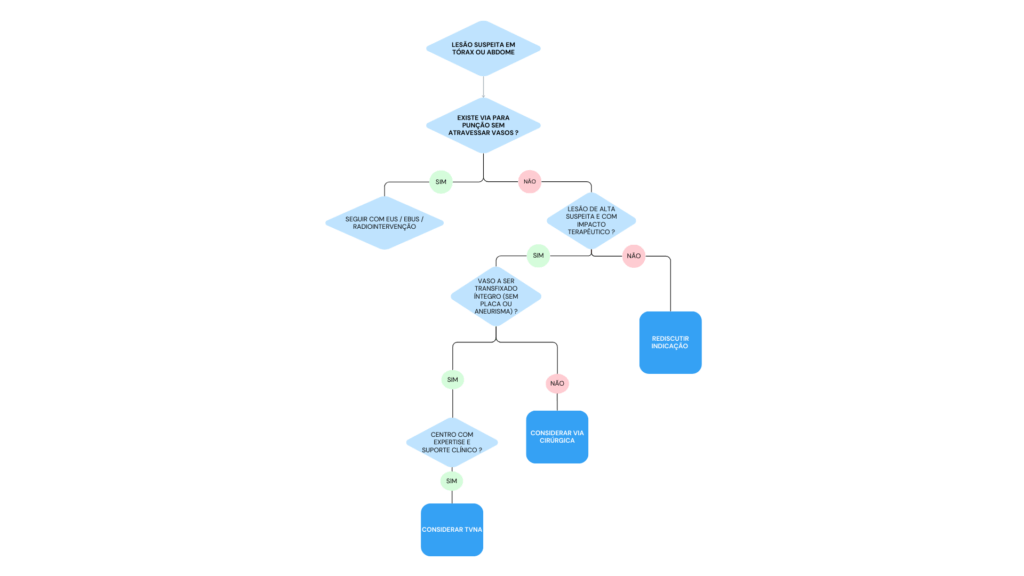
Quando considerar?
Abaixo um fluxograma para indicar a técnica:
Evidências atuais:
Estudo multicêntrico espanhol (Garcia-Sumalla et al., 2020)
- Pacientes: 49 (50 procedimentos)
- Vasos transfixados: Aorta (n=19), sistema portal (n=17)
- Lesões: Linfonodos mediastinais (n=13), tumores pancreáticos (n=11)
- Sensibilidade: 88%
- Especificidade: 100%
- Acurácia: 90%
- Complicações: 3 leves (2 hematomas murais, 1 sangramento autolimitado)
Meta-análise (Giri et al., 2023)
- Estudos analisados: 17
- Pacientes: 411
- Acurácia diagnóstica: 85%
- Adequação da amostra: 91,5%
- Taxa de sangramento: 1,4% (todos autolimitados)
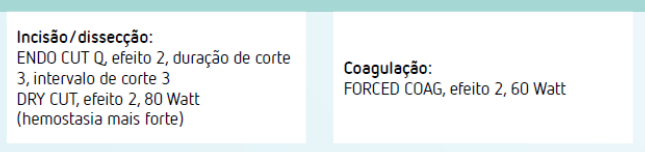
Técnica passo a passo:
- Avaliação prévia com imagem (TC ou RNM)
- Estudo cuidadoso com doppler
- Evitar vasos com calcificação ou aneurismas
- Escolher agulhas finas (FNA 25G ou 22G)
- Preferir técnica com ROSE, se disponível
- Após punção, monitorar área por 2 minutos com doppler
- Observação clínica de 6 horas à 24 horas
Pontos-chave:
- Permite diagnóstico de lesões “inacessíveis”
- Evita procedimentos cirúrgicos mais invasivos
- Alta acurácia quando bem indicada
- Necessita de centro especializado
- Contraindicado em coagulopatia ou hipertensão portal
- Monitoramento rigoroso no pós-procedimento
- Ainda sem estudos com FNB
Conclusão
A TVNA representa uma verdadeira virada de chave na econdoscopia diagnóstica. Ao vencer a barreira dos grandes vasos com precisão, segurança e racionalidade, ampliamos o espectro de pacientes que podem se beneficiar de diagnósticos menos invasivos e mais ágeis. É uma técnica que exige respeito, preparo e critério, mas que, nas mãos certas, torna o impossível acessível.
Referências
- GARCIA-SUMALLA, Albert et al. Endoscopic ultrasound-guided transvascular needle biopsy of thoracic and abdominal lesions: a multicenter experience. Endoscopy International Open, v. 8, p. E1900–E1908, 2020. DOI: 10.1055/a-1288-0030
- GIRI, Suprabhat et al. Efficacy and safety of endosonography-guided transvascular needle aspiration of thoracic and abdominal lesions: A systematic review and meta-analysis. Journal of Clinical Ultrasound, v. 51, n. 4, p. 723–730, 2023. DOI: 10.1002/jcu.23441
- KAZAKOV, Jordan et al. Endobronchial and Endoscopic Ultrasound-Guided Transvascular Biopsy of Mediastinal, Hilar, and Lung Lesions. The Annals of Thoracic Surgery, v. 103, n. 3, p. 951–955, 2017.
- MOLINA, Juan Carlos et al. Transvascular endosonographic-guided needle biopsy of intrathoracic lesions. The Journal of Thoracic and Cardiovascular Surgery, v. 159, n. 5, p. 2057–2065, 2020. DOI:
10.1016/j.jtcvs.2019.10.017
Como citar este artigo
Oliveira JF. Como fazer uma punção ecoguiada transvascular? Endoscopia Terapeutica 2025, Vol 1. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/como-fazer-uma-puncao-ecoguiada-transvascular/