Trauma à órgãos abdominais sólidos – você conhecia essa incomum complicação pós colonoscopia?
Artigo original: Emara MH, Mazid U, Elshaer YA, Elkerdawy MA, Malik DF, Mahros AM. Trauma to the solid abdominal organs: The missed dark box of colonoscopy. World J Gastroenterol. 2024 Feb 21;30(7):624-630.
Acabamos de passar pelo março azul, mês de conscientização do câncer colorretal, e debatemos sobre os muitos benefícios da colonoscopia como método de prevenção desta grave patologia, sem menosprezar seus riscos inerentes.
Num artigo original publicado no ano passado, Emara MH e colaboradores discutem a lesão de órgãos sólidos abdominais, tecendo considerações sobre sua incidência, diagnóstico e manejo.
Sem entrar no mérito dos benefícios, eventos adversos após colonoscopia podem estar relacionados ao preparo colônico, sedação e ao procedimento em si, incluindo neste último dor abdominal, sangramento, perfuração e distensão abdominal. Todas estas complicações são bem descritas e conhecidas pelos colonoscopistas.
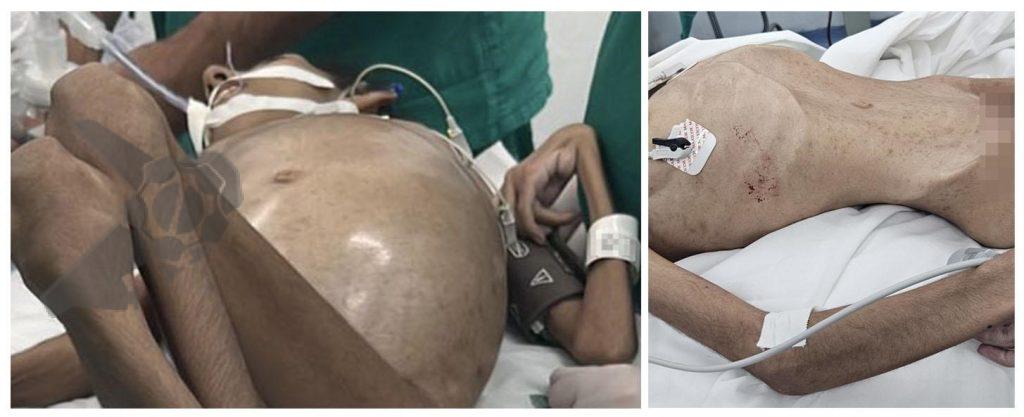
A queixa de dor abdominal após colonoscopia pode ser considerada uma manifestação comum, habitualmente associada a distensão gasosa e tração secundária ao exame, porém podem estar relacionadas a diversas outras causas. Pacientes com dor contínua, persistente ou em ascensão, associada ou não a sintomas como náuseas, vômitos, distensão abdominal relevante, hipotensão e instabilidade hemodinâmica devem despertar a atenção sobre possibilidade de perfuração, hemorragia ou lesão à órgãos intra-abdominais. Dentre as lesões de órgãos sólidos, a publicação destaca:
Lesão esplênica
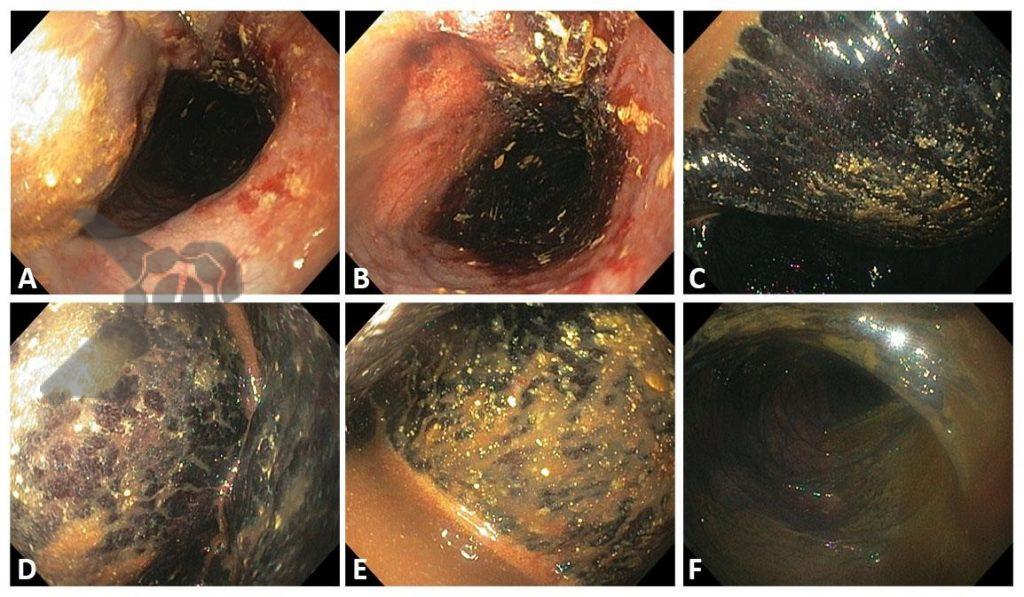
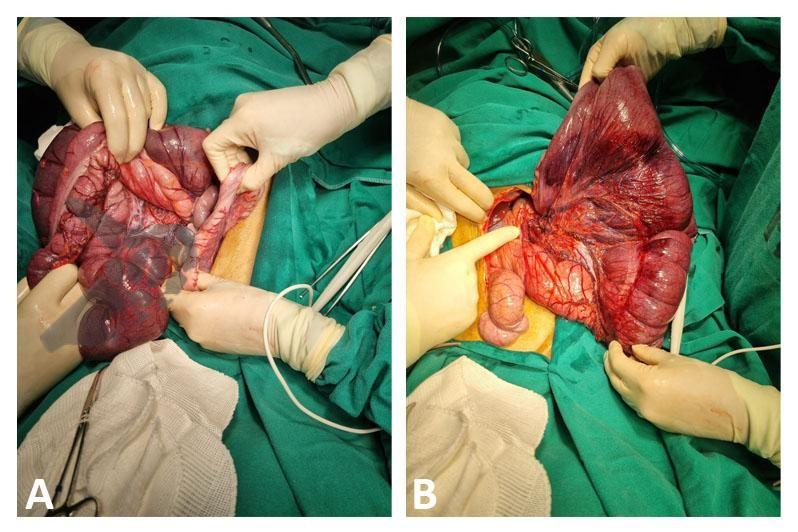
Embora rara como complicação geral, é a mais frequente dentre as lesões de órgãos sólidos pós colonoscopia, com relato inicial em 1974 e incidência variável entre as publicações sendo descrita entre 0,2 – 0,3 a cada 10.000 colonoscopias em publicação de Laanani et al.
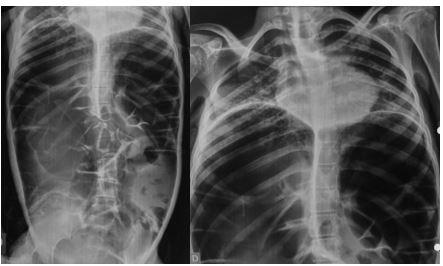
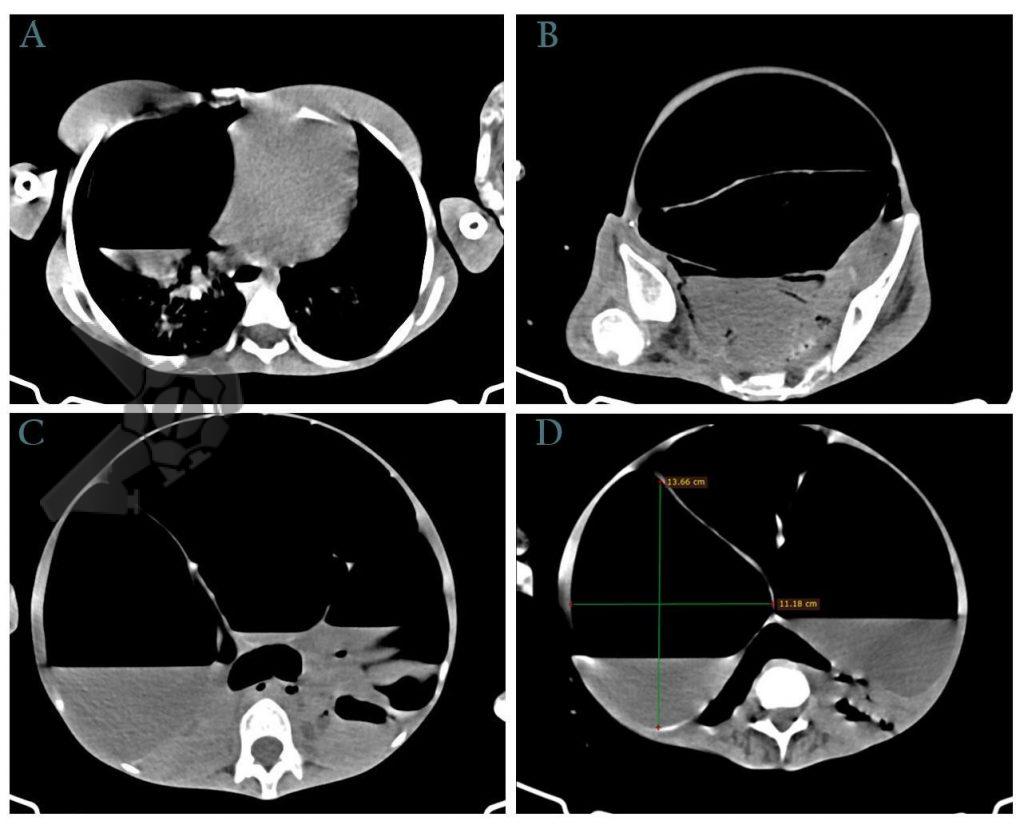
Apresenta-se habitualmente nas primeiras 24h com quadro de dor abdominal persistente, sem irritação peritoneal ou evidências de perfuração, com queda de hematimetria e sinais de choque hipovolêmico a depender da gravidade da lesão a qual pode incluir hematoma subcapsular, laceração, ruptura ou avulsão. O método diagnóstico padrão ouro é a tomografia abdominal com contraste, oferecendo detalhamento sobre a gravidade das lesões e excluindo outras causas visto que a lesão esplênica é um diagnóstico de exclusão.
O tratamento depende das condições do paciente e gravidade da lesão sendo sugerido tratamento conservador para casos de hematoma subcapsular sem repercussão hemodinâmica através de internação hospitalar, reposição volêmica, controle de níveis hematimétricos e exames de imagem de controle. Em pacientes instáveis, com sangramento ativo e peritonite, o tratamento pode ser realizado com embolização de artéria esplênica ou esplenectomia cirúrgica.
Lesão hepática
O relato desta complicação também foi descrito inicialmente na década de 70, em uma paciente com doença inflamatória intestinal que apresentou simultaneamente lesão hepática, esplênica e mesentérica. Os relatos envolvem casos de lesão hepática isolada raramente, sendo mais frequente encontrar lesão hepática e esplênica associadas. O quadro clínico descrito é semelhante ao de lesões esplênicas, dependendo de estabilidade hemodinâmica e extensão da lesão. Embora a ultrassonografia traga informações bastante precisas sobre a anatomia hepática, a tomografia computadorizada segue sendo padrão ouro pela sua habilidade em detectar outras causas ou mesmo lesões concomitantes em outros órgãos. A terapêutica inclui tratamento conservador, arteriografia, drenagem percutânea e laparotomia exploradora.
Lesão pancreática
As lesões pancreáticas descritas incluem casos de pancreatite aguda, pancreatite com sangramento na cauda do pâncreas e vazamento de ducto pancreático com posterior fístula colo-pancreática. Os sintomas foram descritos entre duas a seis horas após colonoscopia incluindo dor epigástrica, náuseas, vômitos e elevação de enzimas pancreáticas.
Dentre os fatores de risco cita-se trauma pancreático por dificuldades na progressão do colonoscópio (especialmente próximo da flexura esplênica), lesões transmurais por eletrocautério, hiperinsuflação do cólon, compressão sobre parede abdominal para facilitar passagem do colonoscópio e cirurgias prévias, aderências.O tratamento proposto segue os mesmos parâmetros de pancreatite por outras etiologias.
Lesão de outros órgãos
Não foram descritos casos de lesão direta aos rins ou adrenais, porém há relatos de laceração de mesentério, perfuração de bexiga e alça de delgado. As lesões podem ser únicas ou múltiplas e estar relacionadas ao uso de eletrocautério, distensão gasosa (hiperinsuflação), cirurgias prévias e aderências.
Mecanismos de trauma e prevenção
Organomegalias secundárias a diversas causas (hematológicas, infiltrativas ou intrínsecas) aumentam a possibilidade de lesão de vísceras, algo particularmente notado nas lesões esplênicas em pacientes com esplenomegalia. Outros fatores de risco foram identificados como histórico prévio de pancreatite, hiperinsuflação de gás durante o exame, uso de corrente elétrica, posição supina durante o exame, uso de pressão abdominal externa, formação de “alças” ou manobras de retificação do cólon esquerdo. Doença inflamatória intestinal, polipose e divertículos também são descritos como possíveis fatores predisponentes, particularmente em idosos.
O principal fator de risco para lesão de vísceras durante colonoscopia são aderências secundárias a cirurgias abdominais prévias. A passagem do aparelho pelo cólon pode exercer tração sobre os ligamentos do cólon (particularmente o ligamento espleno-cólico) e aderências entre esses órgãos e outros da cavidade abdominal causando lesões.
Por fim os autores destacam que não existem guidelines específicos para prevenção destas lesões sendo importante manter medidas de boas práticas e treinamento adequado para realização de colonoscopia evitando formação de alças e uso excessivo de força/tração.
Os sintomas variam de acordo com a severidade de lesões podendo aparecer desde horas a dias após o exame sendo essencial manter grau de suspeição, particularmente para pacientes de alto risco, informando o paciente sobre possíveis sinais de alarme como dor abdominal, distensão e hipovolemia. O diagnóstico precoce de possíveis complicações pode evitar eventos com desfecho potencialmente fatal.
Postula-se que manter o paciente em decúbito lateral esquerdo pode reduzir o risco de lesões esplênicas pois nesta posição o baço desloca-se para uma posição mais próxima ao cólon deixando possíveis aderências entre os dois órgãos mais frouxas. Em contrapartida, em posição supina a gravidade favorece o deslocamento do baço para região oposta ao cólon, aumentando a tensão sobre o ligamento espleno-cólico. Sugere-se portanto que pacientes de alto risco sejam mantidos em decúbito lateral esquerdo durante o exame. O uso de compressão manual sobre a parede abdominal, utilizada corretamente, pode reduzir a formação de alças e reduzir o risco de dano às vísceras.
Clique Perfuração na Colonoscopia: Cuidados e Manejo para mais informações sobre o tema e veja abaixo nas referências alguns artigos para quem se interessar mais no tópico com uma boa explanação sobre mecanismos de trauma e tratamento conservador na publicação de Lukies M et al. e um relato de caso com detalhamento sobre estratificação de lesões esplênicas no trabalho de Abdelrahim A et al.
Referências
- Emara MH, Mazid U, Elshaer YA, Elkerdawy MA, Malik DF, Mahros AM. Trauma to the solid abdominal organs: The missed dark box of colonoscopy. World J Gastroenterol. 2024 Feb 21;30(7):624-630.
- Lukies M, Clements W. Splenic artery embolisation for splenic injury during colonoscopy: A systematic review. United European Gastroenterol J. 2024 Feb;12(1):44-55. doi: 10.1002/ueg2.12498. Epub 2023 Dec 4. PMID: 38047383; PMCID: PMC10859723.
- Abdelrahim A, Ali O, Khawaja A. Splenic haematoma: a rare complication of colonoscopy. BMJ Case Rep. 2021 Mar 24;14(3):e240253. doi: 10.1136/bcr-2020-240253. PMID: 33762280; PMCID: PMC7993349.
- D’Orazio B, Cudia B, Martorana G, Di Vita G, Geraci G. Conservative Treatment of Splenic Haematoma After Colonoscopy: A Case Report. Cureus. 2020 Sep 18;12(9):e10531. doi: 10.7759/cureus.10531. PMID: 33094071; PMCID: PMC7574971.
Como citar este artigo
Ferreira F. Trauma à órgãos abdominais sólidos – você conhecia essa incomum complicação pós colonoscopia? Endoscopia Terapeutica, 2025 Vol I. Disponível em: https://endoscopiaterapeutica.net/pt/artigoscomentados/trauma-a-orgaos-abdominais-solidos-voce-conhecia-essa-incomum-complicacao-pos-colonoscopia/