Avaliação Óptica de Cicatrizes Pós-Ressecção Endoscópica de Pólipos Colorretais Grandes: A Biópsia de Rotina Ainda é Necessária?
Resumo da publicação de Meulen et al., entitulado “Optical assessment of scars after endoscopic mucosal resection of large colorectal polyps in a multicenter, community hospital setting: is routine biopsy still necessary?”, publicado na Endoscopy, em 2025 [1].
Introdução
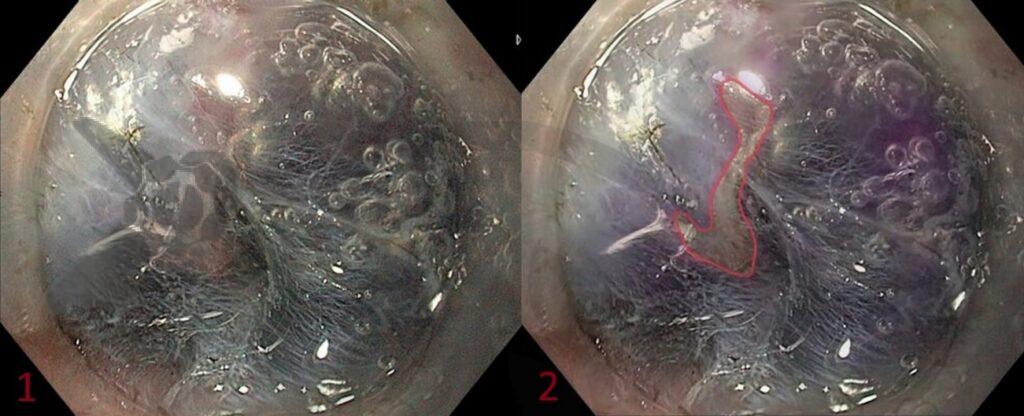
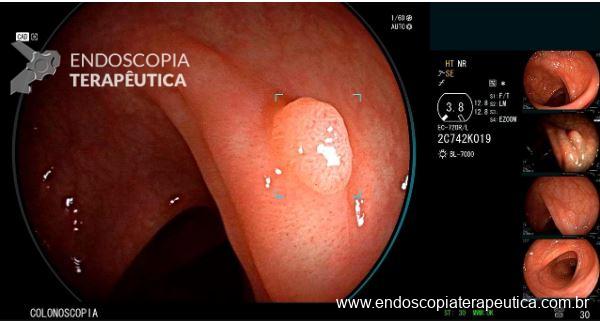
O manejo de pólipos colorretais grandes não pediculados (LNPCPs) por ressecção endoscópica da mucosa (EMR) é uma prática comum. A vigilância pós-EMR, tipicamente aos 6 meses, visa identificar recorrências na cicatriz. Tradicionalmente, isso envolvia biópsias de rotina e, por vezes, tatuagem da lesão para facilitar a identificação. No entanto, diretrizes recentes da European Society of Gastrointestinal Endoscopy (ESGE) sugerem que biópsias de rotina podem ser omitidas se endoscopistas bem treinados avaliarem a cicatriz opticamente com imagens aprimoradas. Este estudo multicêntrico, uma análise post-hoc do estudo STAR-LNPCP, buscou verificar se a acurácia da avaliação óptica em hospitais comunitários seria suficiente para dispensar biópsias padronizadas e a necessidade de tatuagem universal.
Metodologia
Este foi um estudo prospectivo multicêntrico, realizado em 30 hospitais comunitários holandeses entre outubro de 2019 e maio de 2022. O estudo original STAR-LNPCP foi um ensaio clínico randomizado por cluster, no qual 59 endoscopistas de 30 hospitais comunitários incluíram todos os LNPCPs consecutivos. Para esta análise post-hoc, foram incluídos pacientes consecutivos submetidos a colonoscopias de acompanhamento após EMR prévia de um LNPCP. Os critérios de exclusão incluíram EMR inicialmente incompleta, doença inflamatória intestinal e preparo intestinal inadequado (escore de Boston Bowel Preparation < 2 para o segmento de interesse).
Desfechos e Análise Estatística
O desfecho primário foi a avaliação óptica da recorrência. Foram calculadas a acurácia diagnóstica, sensibilidade, especificidade, valor preditivo positivo (VPP) e valor preditivo negativo (VPN). O valor preditivo da tatuagem para identificação da cicatriz também foi avaliado. Além disso, foram avaliadas as diferenças na identificação da cicatriz pós-EMR entre endoscopistas especialistas e não especialistas em seguimento de ressecção. A taxa de falha na detecção óptica da recorrência foi definida como todas as recorrências histologicamente confirmadas que foram opticamente avaliadas como negativas para recorrência. Falsos positivos foram definidos como todas as recorrências opticamente avaliadas que não foram confirmadas por histologia.
A análise estatística incluiu estatísticas descritivas, testes de qui-quadrado de Pearson ou testes exatos de Fisher para comparar grupos. A regressão de risco com correção para agrupamento de pacientes dentro dos endoscopistas (equação de estimativa generalizada) foi realizada para avaliar variáveis independentemente relacionadas à identificação da cicatriz pós-EMR e o efeito do clipe na avaliação óptica da recorrência. O kappa de Cohen foi usado para determinar a concordância entre a avaliação óptica e a histológica. Uma análise por protocolo foi realizada, incluindo apenas cicatrizes encontradas, avaliadas e biopsiadas. Uma análise de intenção de tratar também foi realizada, assumindo que cicatrizes não encontradas e não biopsiadas não teriam mostrado sinais de recorrência histologicamente.
Resultados Chave
Um total de 1277 pacientes (média de idade de 68 ± 9 anos), fizeram a colonoscopia de controle em 6 meses após a EMR de um LNPCP. Um total de 1215 cicatrizes foram identificadas, sendo maior em endoscopistas especialistas quando comparado aos não especialistas (96% vs. 88%, Bonferroni corrected P < 0,001). A influência de clipes pós-EMR aumenta a taxa de falsos positivos (11% vs. 5 %; P = 0.02), com VPP caindo de 78% para 63%, na avaliação comparada com EMR sem clipe. Além disso, houve alta certeza sobre a avaliação da cicatriz pós-REM realizada por endoscopistas especialistas e não especialistas (95% vs. 94%, respectivamente; P = 0,71).
Em resumo, a avaliação óptica das cicatrizes demonstrou alta acurácia diagnóstica, conforme detalhado na tabela abaixo:
| Métrica Diagnóstica | Valor |
| Sensibilidade | 93% |
| Especificidade | 92% |
| Valor Preditivo Positivo | 74% |
| Valor Preditivo Negativo | 98% |
| Acurácia Diagnóstica | 93% |
| Kappa de Cohen | 0.78 |
O alto Valor Preditivo Negativo (VPN) de 98% da avaliação óptica sugere que a biópsia de rotina das cicatrizes pós-EMR pode ser dispensada na maioria dos casos, pois um resultado óptico negativo indica com alta probabilidade a ausência de recorrência.
Limitações do Estudo
O estudo, embora robusto em seu desenho multicêntrico e prospectivo, apresenta algumas limitações. Primeiramente, trata-se de uma análise post-hoc de um estudo maior (STAR-LNPCP), o que pode introduzir vieses. Embora tenha sido realizado em hospitais comunitários, a generalização dos resultados para todos os centros não especializados pode exigir cautela. A definição de endoscopistas especialistas e não especialistas, embora clara no estudo, pode variar na prática clínica. Além disso, a taxa de falsos positivos foi maior após o uso prévio de clipes, o que pode ser uma consideração importante na avaliação óptica, podendo corresponder ao granuloma de cicatrização. Por fim, o estudo foi realizado em hospitais holandeses com disponibilidade de Near Focus e Zoom, uma realidade em que nem todos os hospitais do Brasil possuem, e a aplicabilidade dos resultados a outras populações e sistemas de saúde podem necessitar de validação adicional.
Conclusão
Os achados deste estudo suportam a omissão da biópsia de rotina de cicatrizes pós-EMR de pólipos colorretais grandes, com base na avaliação óptica. Isso pode levar a uma redução de custos, tempo de procedimento e desconforto para o paciente, sem comprometer a segurança. A implementação dessa abordagem na prática clínica pode otimizar o manejo de pacientes submetidos à ressecção de pólipos colorretais.
Referência
- Meulen LWT, Bogie RMM, Siersema PD et al. Optical assessment of scars after endoscopic mucosal resection of large colorectal polyps in a multicenter, community hospital setting: is routine biopsy still necessary? Endoscopy. 2025 Jun;57(6):620-628. doi: 10.1055/a-2498-7114. Epub 2024 Dec 9. PMID: 39653123; PMCID: PMC12119144.
Como citar este artigo
Kum, AST. Avaliação Óptica de Cicatrizes Pós-Ressecção Endoscópica de Pólipos Colorretais Grandes: A Biópsia de Rotina Ainda é Necessária? Endoscopia Terapeutica 2025, Vol II. Disponível em: https://endoscopiaterapeutica.net/pt/artigoscomentados/avaliacao-optica-de-cicatrizes-pos-resseccao-endoscopica-de-polipos-colorretais-grandes-a-biopsia-de-rotina-ainda-e-necessaria/