Doença Digestiva Relacionada ao IgG4: do diagnóstico ao tratamento
A doença digestiva relacionada ao IgG4 (DR-IgG4) é uma condição fibroinflamatória sistêmica, crônica e imunomediada, que pode afetar virtualmente qualquer órgão. Sua capacidade de mimetizar malignidades, especialmente no pâncreas e nas vias biliares, representa um desafio diagnóstico significativo na prática clínica.
Diagnóstico
O diagnóstico da DR-IgG4 não depende de um único teste definitivo. Pelo contrário, exige uma abordagem abrangente e criteriosa que integra achados clínicos, sorológicos, de imagem e histológicos, além da avaliação da resposta à terapia com glicocorticoides (Para ver um exemplo clínico detalhado de diagnóstico diferencial de colangite por IgG4 versus colangiocarcinoma hilar, leia este relato de caso). Esta abordagem multifacetada é crucial para evitar diagnósticos equivocados, sendo o mais grave a confusão com adenocarcinoma de pâncreas ou colangiocarcinoma, o que pode levar a tratamentos inadequados e potencialmente danosos.
Biomarcadores Séricos
A análise de marcadores séricos é um dos primeiros passos na investigação, mas seus resultados devem ser interpretados com cautela.
• Níveis Séricos de IgG4: Embora a dosagem de IgG4 seja um exame fundamental na suspeita da doença, ela, isoladamente, carece de sensibilidade e especificidade. Muitos pacientes com a doença podem ter níveis normais, enquanto outras condições inflamatórias podem apresentar elevações. Contudo, níveis muito elevados — especificamente acima de quatro vezes o limite superior da normalidade — aumentam consideravelmente o valor diagnóstico e a especificidade do teste.
• Antígeno CA19-9: Este marcador tumoral é frequentemente utilizado na investigação de malignidades pancreatobiliares. No contexto da DR-IgG4, sua precisão é limitada, especialmente na presença de colangite obstrutiva, que pode causar elevações acentuadas. Apesar disso, por ser um teste barato e de fácil execução, pode ser usado para diagnóstico diferencial com o adenocarcinoma de pâncreas, mas nunca como um marcador isolado para confirmar ou excluir malignidade.
Portanto, a abordagem sorológica é mais útil para levantar suspeitas e compor o quadro diagnóstico do que para confirmar ou excluir a doença de forma isolada, reforçando a necessidade de correlação com imagem e histologia.
Achados Clássicos de Imagem e Histologia
A Pancreatite Autoimune (PAI) tipo 1 é a manifestação pancreática da DR-IgG4 e possui características de imagem e histológicas bem definidas que são pilares para o diagnóstico.
• Critérios de Imagem (TC/RM): A tomografia computadorizada (TC) e a ressonância magnética (RM) revelam achados clássicos que levantam a suspeita de PAI:
◦ Aumento difuso ou focal do pâncreas, com perda do padrão lobulado, conferindo um aspecto de “salsicha”.
◦ Presença de um halo peripancreático de baixo sinal em T1 na RM, representando edema e fibrose.
◦ Estreitamento do ducto pancreático principal, caracteristicamente sem dilatação significativa a montante — um achado chave que o diferencia de obstruções malignas, que tipicamente causam dilatação ductal acentuada.
• Achados Histológicos Fundamentais: A confirmação histológica é frequentemente necessária, e a PAI tipo 1 é definida por quatro características chave:
◦ Infiltrado linfoplasmocitário denso, frequentemente acompanhado por eosinófilos.
◦ Fibrose estoriforme, com um padrão clássico em “roda de carroça”.
◦ Flebilite obliterante, que é a inflamação e oclusão de vênulas.
◦ Aumento expressivo de plasmócitos IgG4 positivos. A contagem deve ser superior a 50 células por campo de grande aumento (HPF) em espécimes cirúrgicos e >10 células/HPF em amostras de biópsia (média de contagens em três focos de maior densidade [400x]), com uma razão IgG4/IgG superior a 40%.
O Papel da Endoscopia
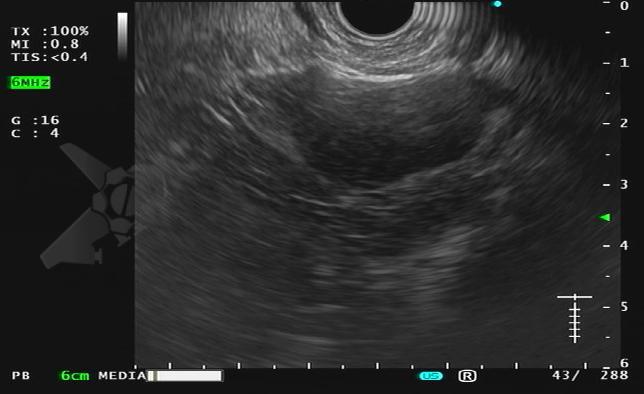
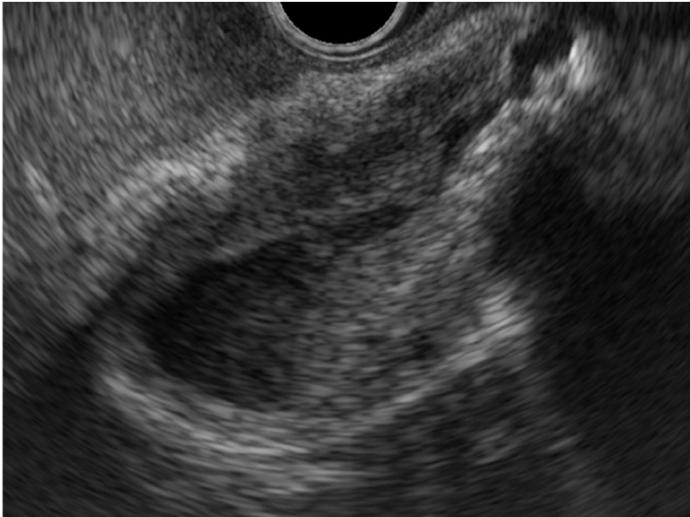
Para o gastroenterologista, a endoscopia, particularmente a ecoendoscopia (EUS), desempenha um papel indispensável. A EUS permite uma avaliação detalhada do parênquima pancreático, identificando achados sugestivos como o aumento hipoecoico difuso. Sua função mais crítica, no entanto, é a aquisição de tecido por punção ecoguiada, que é essencial para obter o diagnóstico histológico e, principalmente, para diferenciar a PAI de um carcinoma pancreático.
Nos pacientes ictéricos a CPRE também pode ser útil tratando as estenoses com a colocação de próteses biliares e identificando os padrões suspeitos da colangiopatia.
A complexidade do diagnóstico é um reflexo direto da natureza sistêmica e multifacetada desta doença.
Fonte da imagem: Mendoça EQ. Colangite por IgG4 como diagnóstico diferencial do colangiocarcinoma hilar. Endoscopia Terapeutica 2023, Vol 1. Disponível em: https://endoscopiaterapeutica.net/pt/colangite-por-igg4-como-diagnostico-diferencial-do-colangiocarcinoma-hilar/
Manifestações Clínicas
É fundamental reconhecer a DR-IgG4 como uma doença sistêmica. Embora o pâncreas e as vias biliares sejam os sítios mais comuns de manifestação digestiva, o envolvimento de outros órgãos é frequente e deve ser ativamente investigado em todos os pacientes com suspeita diagnóstica, pois isso reforça o diagnóstico e impacta o manejo terapêutico.
Pâncreas (Pancreatite Autoimune Tipo 1)
O prognóstico e os desfechos a longo prazo da PAI tipo 1 são marcados por uma excelente resposta inicial ao tratamento e a cronicidade da condição.
• Resposta ao Tratamento: A PAI tipo 1 tipicamente apresenta uma resposta excelente e rápida à terapia inicial com glicocorticoides.
• Taxa de Recidiva: Apesar da boa resposta inicial, as taxas de recidiva da doença são altas, variando de 7% a 55% nos estudos europeus, o que frequentemente exige terapia de manutenção.
• Sequelas a Longo Prazo: Com o tempo, é comum o desenvolvimento de insuficiência pancreática exócrina e endócrina, o que demanda um acompanhamento vitalício para manejo nutricional e controle glicêmico.
Fígado e Vias Biliares (Colangite Relacionada ao IgG4)
A Colangiopatia Relacionada ao IgG4 (IRC) é a manifestação hepatobiliar mais comum da doença, frequentemente associada à PAI tipo 1, mas podendo ocorrer de forma isolada.
• Apresentação Clínica: Os pacientes geralmente se apresentam com icterícia (tipicamente indolor), prurido e desconforto abdominal.
• Perfil Bioquímico: O padrão laboratorial é colestático, com elevação de fosfatase alcalina, gama-GT e bilirrubinas. É importante notar que o CA 19-9 pode estar acentuadamente elevado. Essa elevação, combinada com estenoses biliares na imagem, é um dos principais fatores que mimetizam o colangiocarcinoma, tornando a diferenciação histológica imperativa.
• Achados Colangiográficos: A classificação de Nakazawa, baseada em achados de colangiografia, descreve quatro padrões de estenoses biliares. O Tipo 1 (estenose do colédoco distal) é o mais comum, ocorrendo em 64% dos casos.
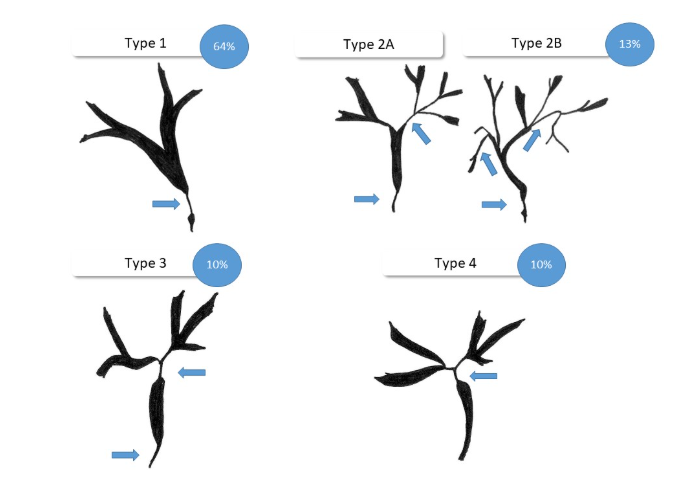
Classificação colangiografica de Nakazawa e a sua frequência.
Fonte da imagem: Classification and characteristics of IgG4-associated cholangitis and how to differentiate it from hepatobiliary malignancies — mimicry in hepatobiliary endoscopy. Endoscopy-campus.com.
Envolvimento Sistêmico
A DR-IgG4 é, por definição, uma condição sistêmica, com o envolvimento de múltiplos órgãos ocorrendo em até 75% dos pacientes. A investigação de outras manifestações é mandatória. Além do trato pancreato-hepatobiliar, os órgãos mais frequentemente acometidos incluem:
• Glândulas salivares e lacrimais (Doença de Mikulicz)
• Retroperitônio (Fibrose retroperitoneal)
• Rins (Nefrite túbulo-intersticial)
• Pulmões
• Aorta (Aortite)
Esta ampla gama de apresentações clínicas converge para o principal desafio diagnóstico: a distinção entre esta doença inflamatória e o câncer.
O Dilema Diagnóstico: DR-IgG4 vs. Câncer
A diferenciação entre DR-IgG4 e malignidades — como o câncer de pâncreas, o colangiocarcinoma ou o linfoma — é um dos maiores e mais críticos desafios na gastroenterologia. Um diagnóstico preciso é de importância estratégica fundamental: ele evita cirurgias de grande porte desnecessárias em pacientes com uma doença benigna e tratável e, inversamente, previne o atraso no início de um tratamento oncológico em pacientes com câncer.
• Clínica e Laboratório: Os sintomas são frequentemente sobreponíveis. Perda de peso, icterícia e dor abdominal são comuns a ambas as condições. Não existe um exame de sangue específico que possa, de forma isolada, diferenciar confiavelmente as duas doenças.
• Radiologia: Embora alguns achados combinados em TC e RM possam auxiliar, a diferenciação radiológica de uma massa focal de PAI de um adenocarcinoma pancreático permanece extremamente desafiadora.
• Histologia em Biópsias: Em amostras pequenas obtidas por biópsia, a diferenciação é particularmente difícil. O risco de erro amostral é significativo, e a presença de inflamação inespecífica com células IgG4 positivas pode ocorrer tanto na DR-IgG4 quanto em tecidos peritumorais de malignidades.
Na prática clínica, diante da impossibilidade de excluir malignidade com segurança, um pequeno número de ressecções pancreáticas por suspeita de câncer acaba sendo inevitável.
Tratamento Sistêmico
Os objetivos do tratamento da DR-IgG4 são claros: suprimir a atividade inflamatória, retardar a progressão da fibrose e prevenir complicações e a falência de órgãos a longo prazo.
Terapia de Indução de Remissão
Indicações: A decisão de iniciar o tratamento deve ponderar a presença de sintomas e o risco de dano orgânico irreversível. A terapia é indicada para pacientes sintomáticos (com dor, icterícia obstrutiva) e para assintomáticos que apresentam risco de desenvolver falência orgânica devido ao processo fibroinflamatório.
• Droga de Escolha: Os glicocorticoides são a pedra angular da terapia de indução.
• Esquema Posológico: O tratamento deve ser iniciado com prednisona oral em uma dose baseada no peso, de 0,6-0,8 mg/kg/dia (tipicamente 30-40 mg/dia), mantida por um mês para induzir a remissão.
• Avaliação da Resposta: A resposta ao tratamento deve ser reavaliada em 2 a 4 semanas, utilizando marcadores clínicos (melhora dos sintomas), bioquímicos (queda de bilirrubinas e enzimas hepáticas) e morfológicos (melhora nos exames de imagem).
• Desmame: Após a indução, a dose de corticoide deve ser reduzida gradualmente ao longo de 3 a 6 meses.
Manejo da Recidiva e Terapia de Manutenção
A alta taxa de recidiva exige uma estratégia clara para o manejo a longo prazo, especialmente em pacientes que apresentam retorno da atividade da doença durante ou após o desmame dos corticoides.
• Quando Considerar: A terapia de manutenção ou de segunda linha deve ser considerada se não houver melhora, se a doença recidivar durante os primeiros 3 meses de tratamento, ou em pacientes com alto risco de recidiva (ex: doença multiorgânica).
• Opções de Segunda Linha: Vários agentes imunossupressores podem ser utilizados como poupadores de corticoides ou para tratar recidivas:
◦ Rituximabe: Este anticorpo monoclonal anti-CD20 deve ser considerado em pacientes resistentes ou intolerantes aos glicocorticoides, ou naqueles que falharam com outros imunossupressores.
◦ Outros Imunossupressores: Agentes como as tiopurinas (azatioprina), micofenolato de mofetila e metotrexato são opções válidas como terapia poupadora de corticoides para manter a remissão.
Conclusão
Pense de Forma Sistêmica: Lembre-se sempre que a DR-IgG4 é uma doença multiorgânica. A presença de uma manifestação (ex: PAI) deve levar à busca ativa por envolvimento em outros órgãos.
• Diagnóstico é difícil: Nenhum teste isolado confirma o diagnóstico. A certeza diagnóstica vem da combinação criteriosa de dados clínicos, laboratoriais, de imagem e histológicos.
• A EUS com Biópsia é fundamental: A ecoendoscopia com punção por agulha é a ferramenta mais poderosa para diferenciar a PAI tipo 1 focal do câncer de pâncreas, uma etapa indispensável no diagnóstico.
• Resposta Rápida aos Corticoides: Uma resposta clínica e laboratorial dramática à corticoterapia em 2-4 semanas é uma característica marcante da doença e apoia fortemente o diagnóstico.
• Vigie o Risco de Malignidade: A DR-IgG4 pode estar associada a um risco aumentado de desenvolvimento de câncer. A vigilância é recomendada para todos os pacientes.
Referências
- Löhr JM, Beuers U, Vujasinovic M, Alvaro D, Frøkjær JB, Buttgereit F, Capurso G, Culver EL, de-Madaria E, Della-Torre E, Detlefsen S, Dominguez-Muñoz E, Czubkowski P, Ewald N, Frulloni L, Gubergrits N, Duman DG, Hackert T, Iglesias-Garcia J, Kartalis N, Laghi A, Lammert F, Lindgren F, Okhlobystin A, Oracz G, Parniczky A, Mucelli RMP, Rebours V, Rosendahl J, Schleinitz N, Schneider A, van Bommel EF, Verbeke CS, Vullierme MP, Witt H; UEG guideline working group. European Guideline on IgG4-related digestive disease – UEG and SGF evidence-based recommendations. United European Gastroenterol J. 2020 Jul;8(6):637-666. doi: 10.1177/2050640620934911. Epub 2020 Jun 18. PMID: 32552502; PMCID: PMC7437085.
Como citar este artigo
Orso IRB. Doença Digestiva Relacionada ao IgG4: do diagnóstico ao tratamento. Endoscopia Terapêutica 2026 Vol I. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/doenca-digestiva-relacionada-ao-igg4-do-diagnostico-ao-tratamento/