Fístula gastropancreática secundária a neoplasia intraductal mucinosa papilar pancreática – achados de endoscopia digestiva alta e de ultrassom endoscópico.
A neoplasia intraductal mucinosa papilar (NIMP) pancreática é uma neoplasia epitelial, que se caracteriza por proliferação papilar e dilatação do ducto pancreático principal, com consequente formação de cisto[i]. As NIMPs são classificadas como tipo ducto pancreático principal (DP), tipo ducto pancreático secundário (DS), ou misto com base no envolvimento topográfico ductal do tumor. Sua identificação usualmente é feita por colangiopancreatoressonância magnética (ColangioRM), podendo ser confirmada pelo ultrassom endoscópico (USE) com ou sem punção ecoguiada, cujo principal achado é a confirmação de comunicação ductal, corroborado pela presença de células mucinosas. Seu tratamento baseia-se nos fatores de risco (sintomas clínicos, achados de imagem) pelo fato da NIMP progredir para carcinoma de forma infrequente e muitos pacientes serem assintomáticos. Atualmente, as recomendações de sociedade sugerem acompanhamento de 2 a 3 anos para cistos < 1 cm; anual de cistos (1 e 2 cm) por um período total de 2 anos e de 3-6 meses para cistos > 2 cm. Qualquer paciente ictérico ou com história de pancreatite aguda é candidato à cirurgia com base na localização do cisto e na extensão do envolvimento do DP[ii]. A NIMP pode apresentar-se como uma variável fistulizante, usualmente para o duodeno. Os autores apresentam um caso de formação espontânea de fístula gastropancreática secundária a uma NMIP tipo misto detectada e avaliada por endoscopia digestiva alta e ecoendoscopia.
CASO CLÍNICO
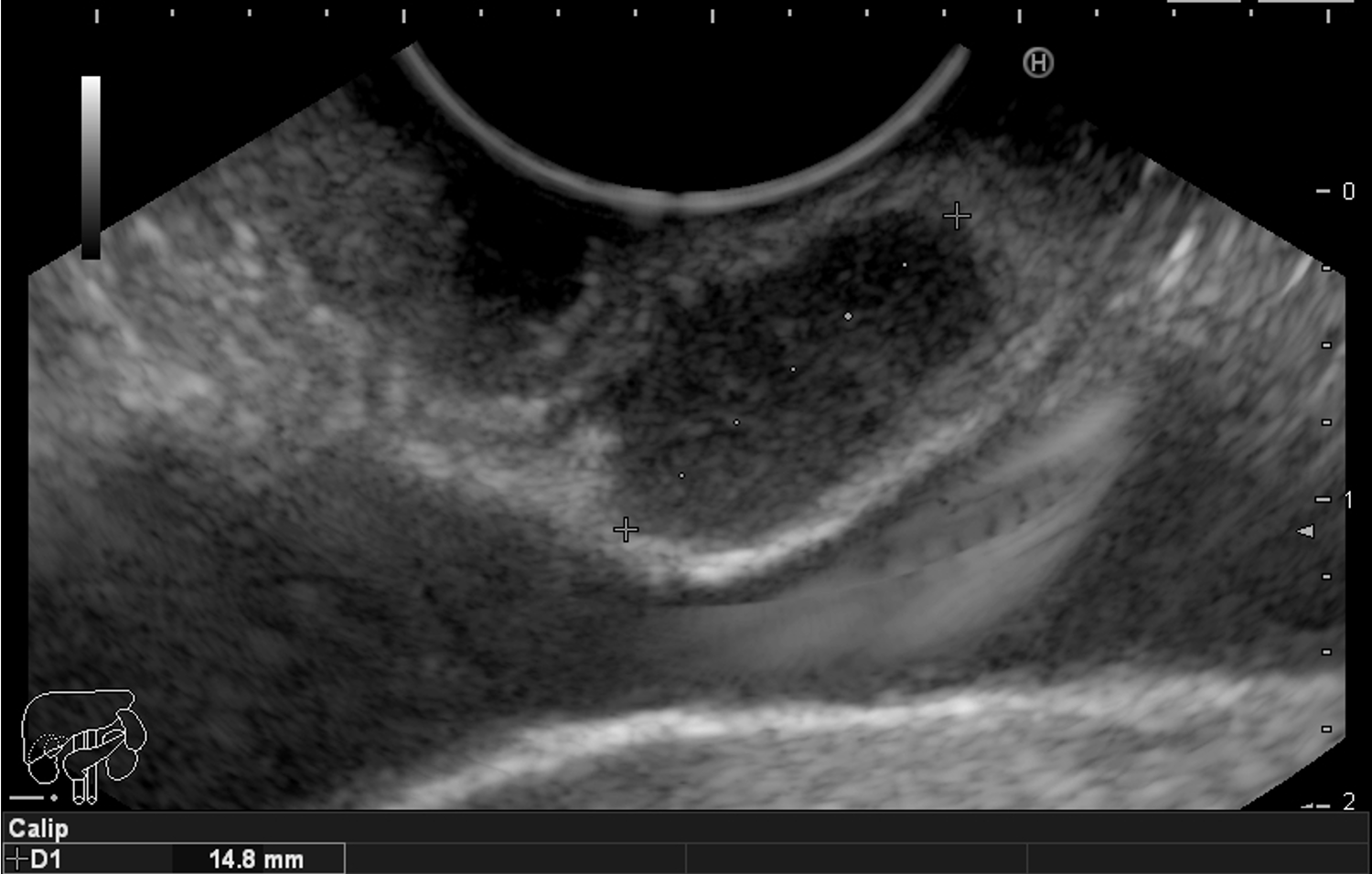
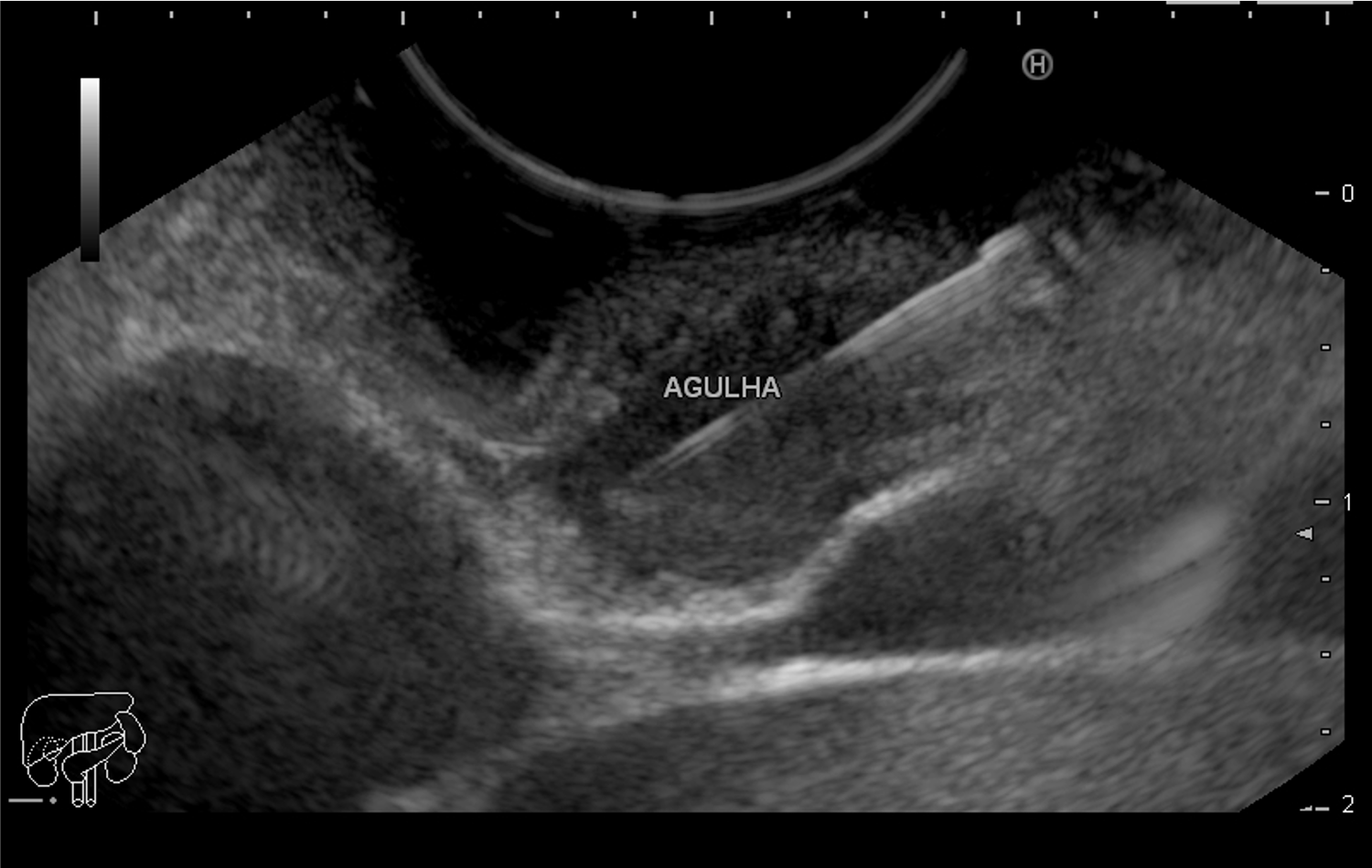
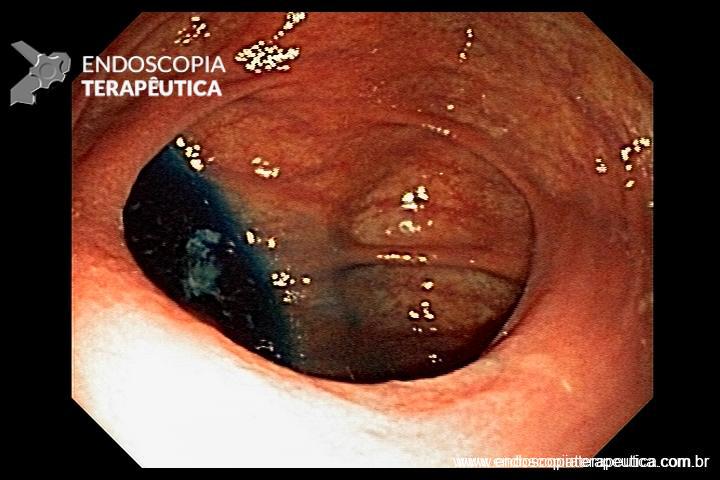
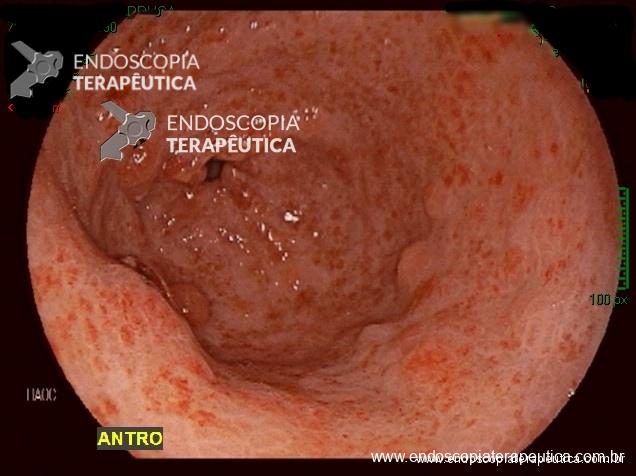
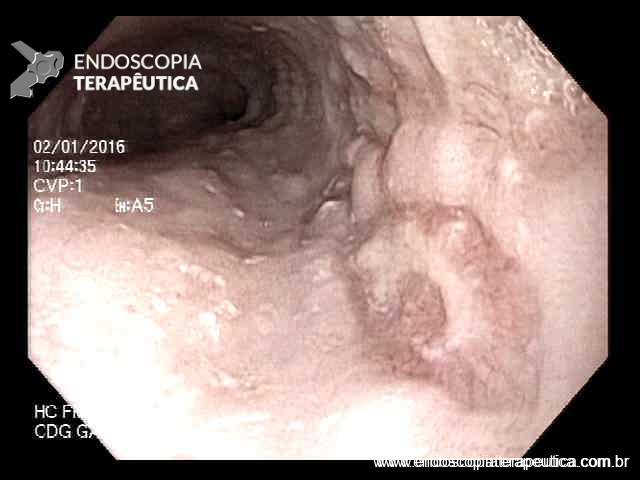
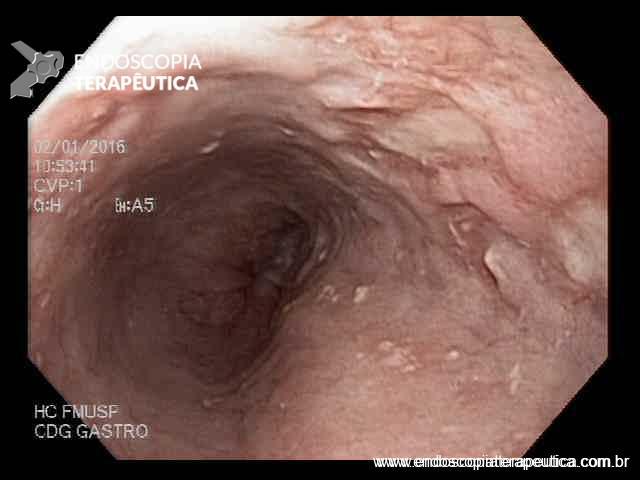
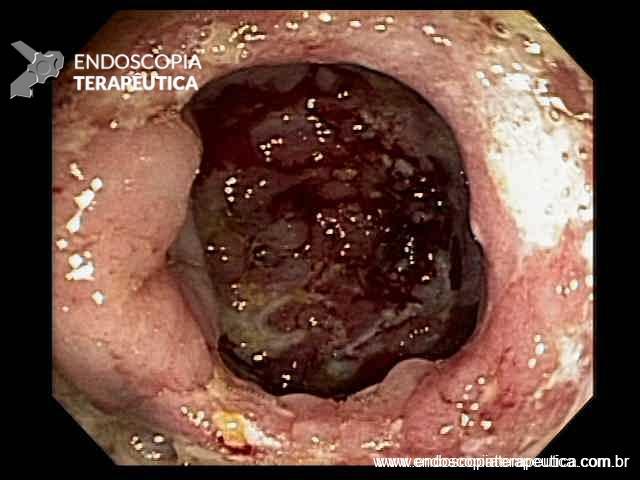
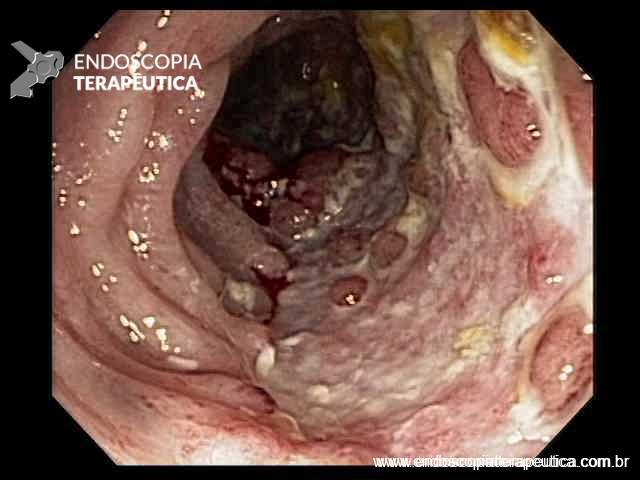
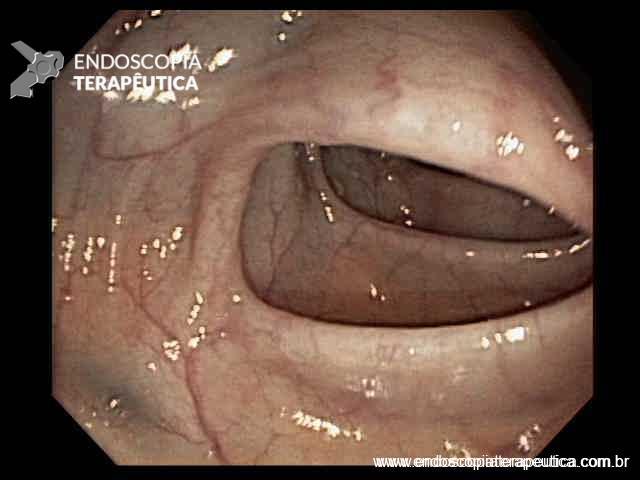
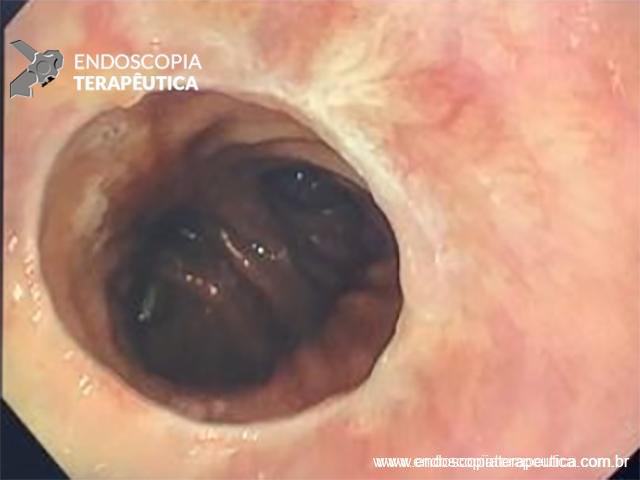
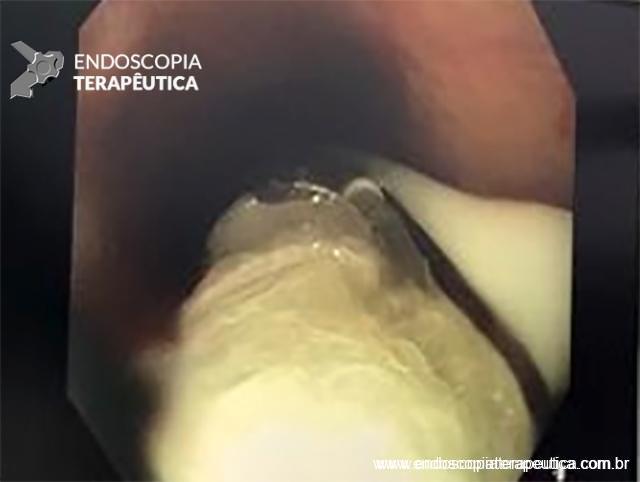
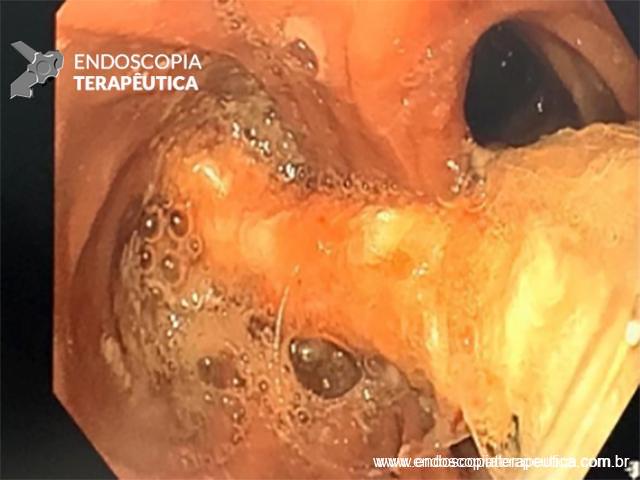
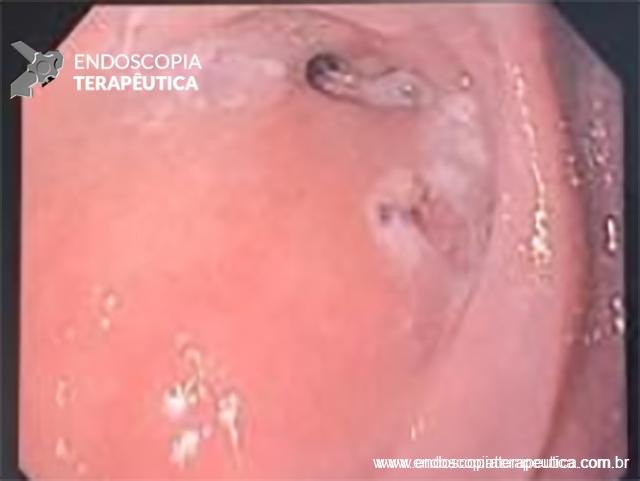
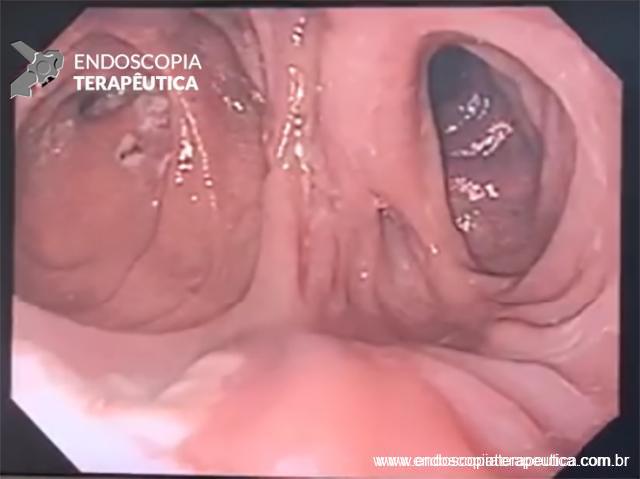
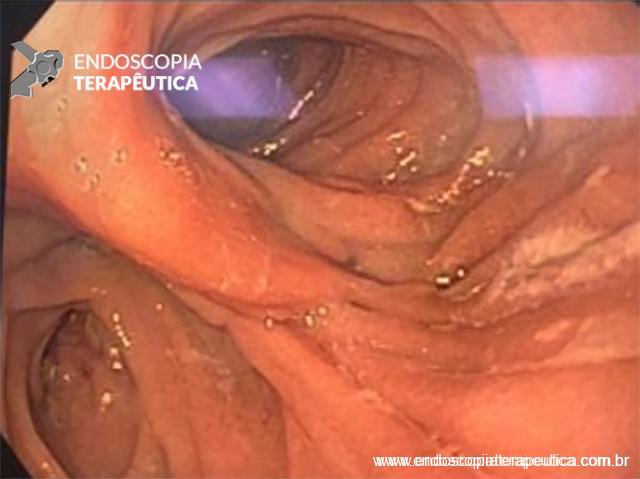
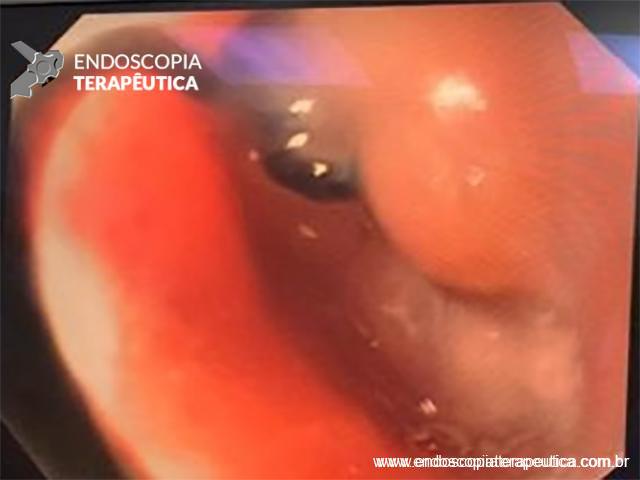
Paciente do sexo feminino, 68 anos, procurou o serviço de gastroenterologia do CHC-UFPR em maio 2018 com queixa de plenitude pós-prandial e desconforto abdominal. Solicitados exames diagnósticos de rotina, em que um US mostrou lesão solido-cística pancreática a esclarecer. Um exame de ColangioRM mostrou dilatação e irregularidade ductal a esclarecer, tendo como hipóteses diagnósticas NMIP do tipo misto ou pancreatite crônica calcificante (FIGURA 1). Foi submetida a ecoendoscopia e endoscopia digestiva alta o qual evidenciou NIMP com fistulização para o estômago e acentuada dilatação ductal pancreática com vegetações em seu interior (FIGURAS 2, 3 e 4). Foi possível adentrarmos no trajeto fistuloso para obteção de biópsias das vegetações.
A biópsia endoscópica confirmou NIMP do tipo misto padrão intestinal (FIGURA 5) e, conforme os critérios de Fukuoka 2016 (sintomas, acentuada dilatação ductal) acometimento de toda a glândula pancreática e o elevado risco de malignidade, foi decidido por pancreatectomia total como opção para tratamento curativo. Durante o ato cirúrgico, não foi possível a dissecção da cabeça pancreática devido a aderências em grandes vasos. Foi optado então por pancreatectomia corpo-caudal, cuja congelação de margem evidenciou lesão papilar ductal sem displasia. O procedimento foi associado a gastrectomia parcial e esplenectomia. A paciente apresentou evolução pós-operatória favorável, recebendo alta 10 dias pós-procedimento. O anatomopatológico evidenciou neoplasia mucinosa intraductal papilífera com displasia de alto grau, sem foco de neoplasia invasora, com acometimento ductal extenso e margem proximal positiva para presença de epitélio papilar sem displasia. Seis meses após o procedimento, a paciente retorna ao hospital por diarreia e desnutrição, a qual foi manejada com orientações dietéticas e revisão da reposição de enzimas pancreáticas. Um mês após, a paciente é reinternada com quadro de sepse sem origem determinada, evoluindo a óbito em 3 dias a despeito de medidas suportivas e uso de antibiótico de largo espectro.
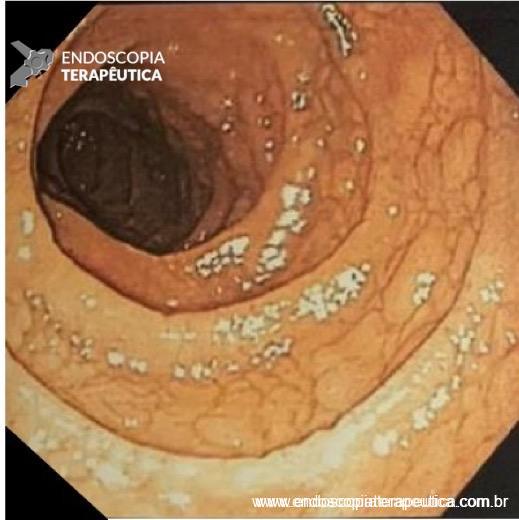
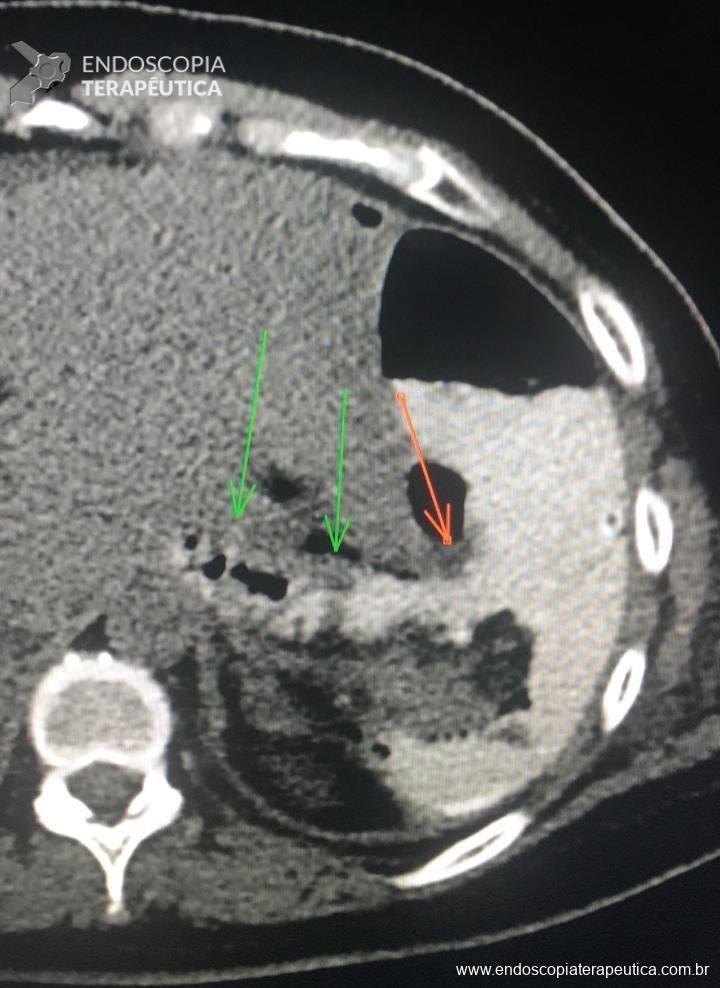
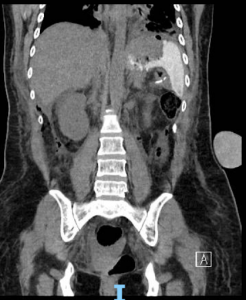
FIGURA 1 – Colangioressonância – acentuada dilatação e tortuosidade do ducto pancreático principal (flechas verdes) com sinais de comunicação fistulosa com o estômago ao nível do corpo pancreático (flecha azul).
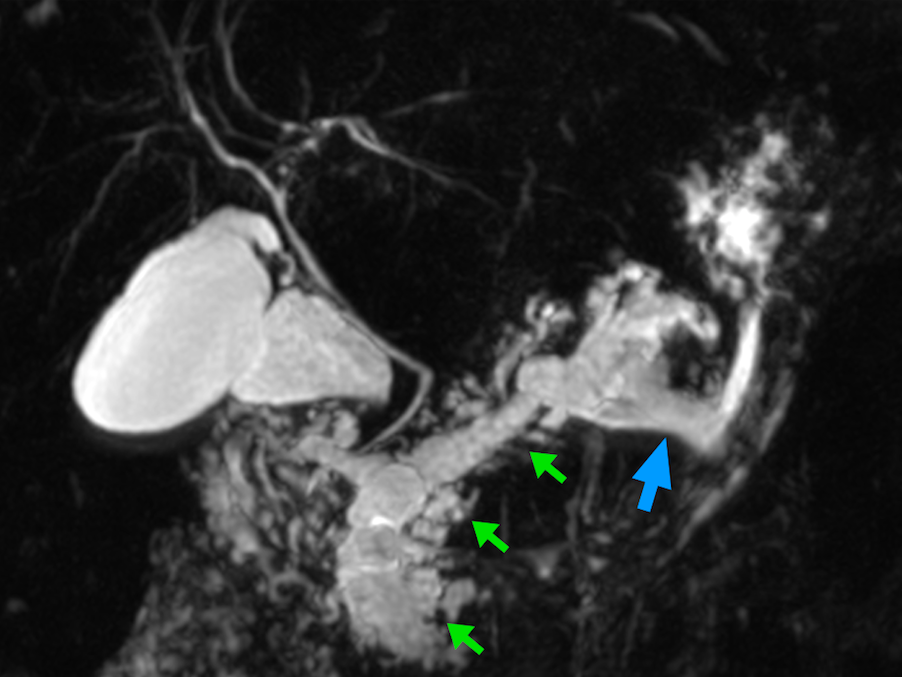
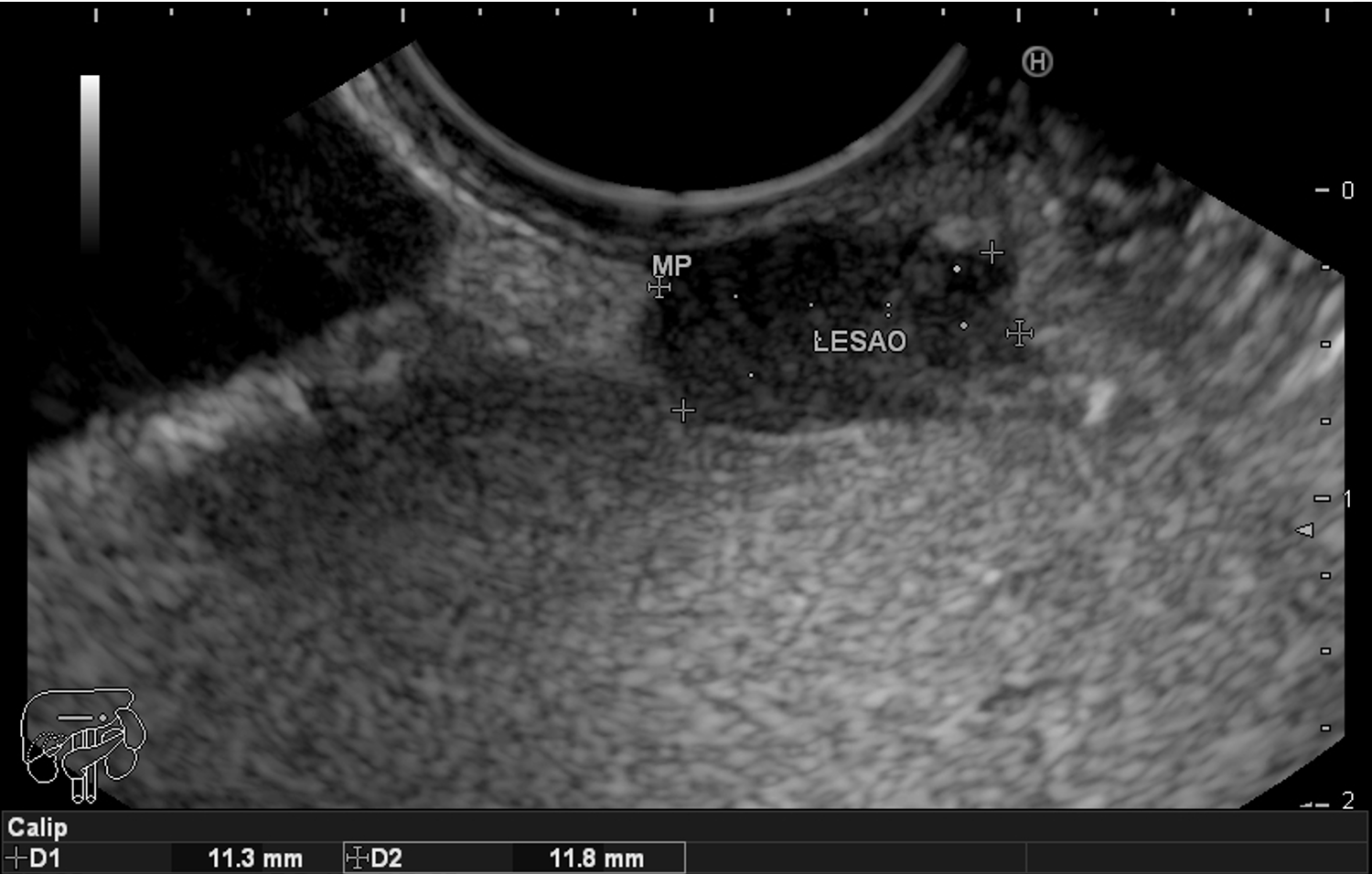
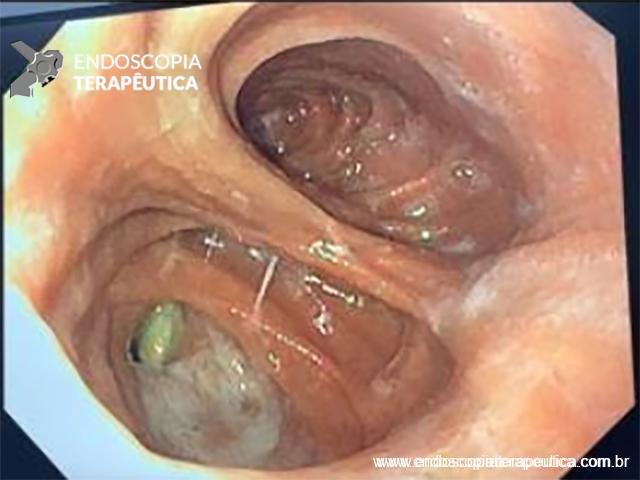
FIGURA 2 – Achado ecoendoscópico – presença de vegetação intraductal doppler-positivo dentro do ducto pancreático principal (este dilatado), confirmando tratar-se de NIMP tipo misto.
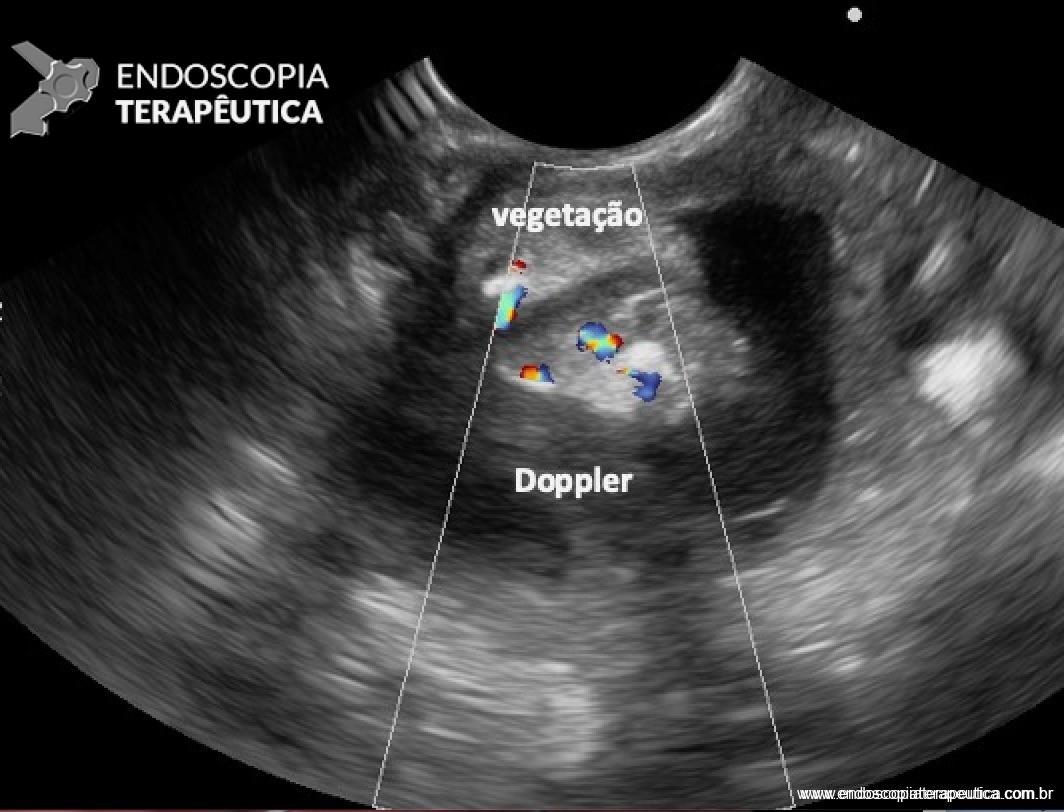
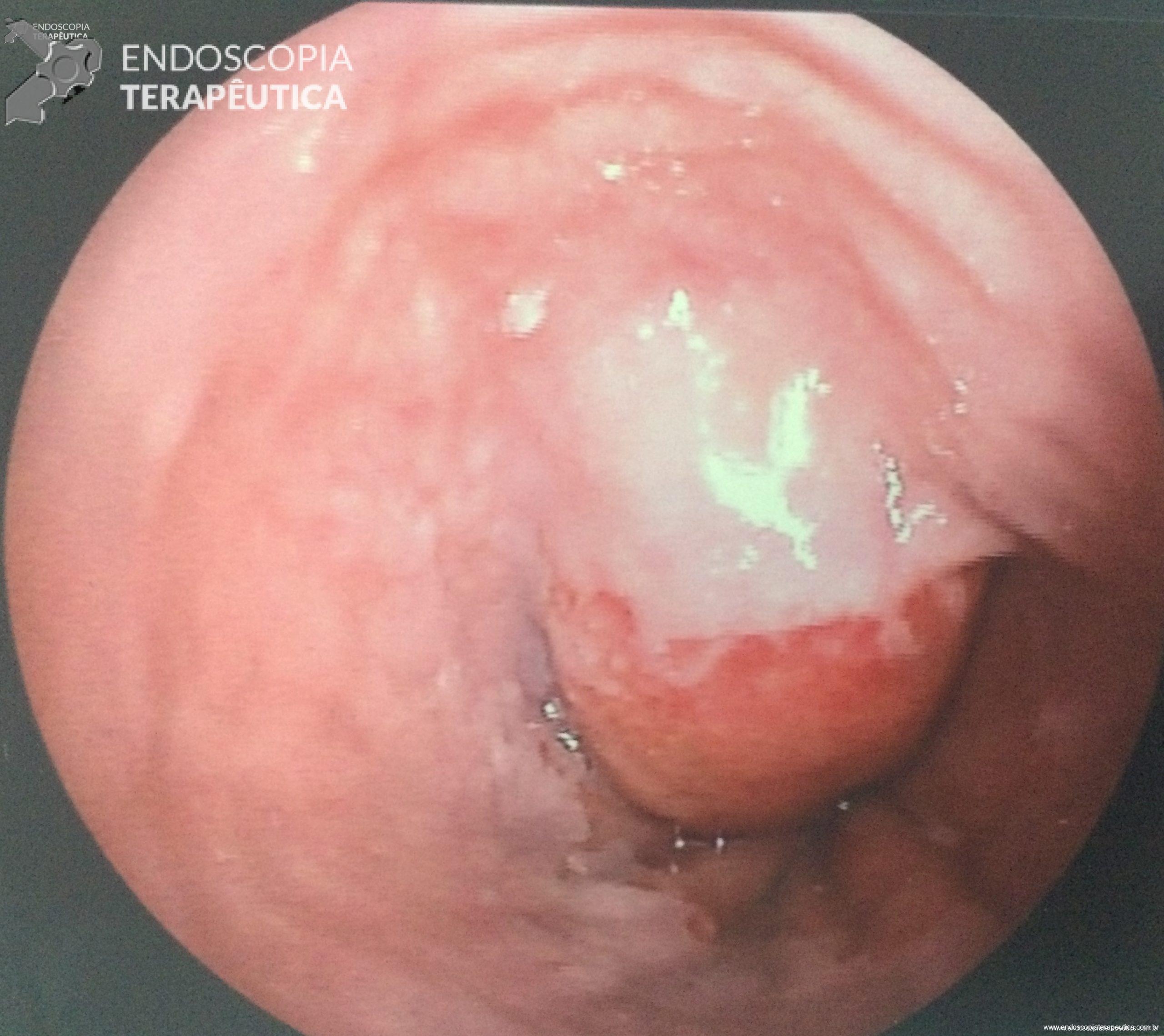
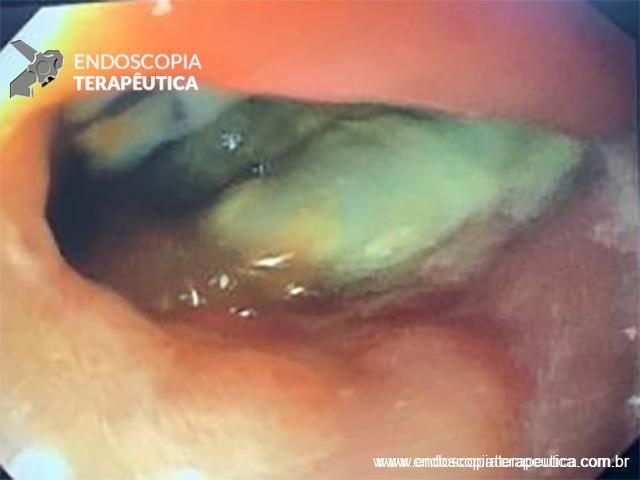
FIGURA 3 – Achado endoscópico – presença de uma gota de muco junto à parede posterior do estômago, confirmando tratar-se de uma neoplasia mucinosa.
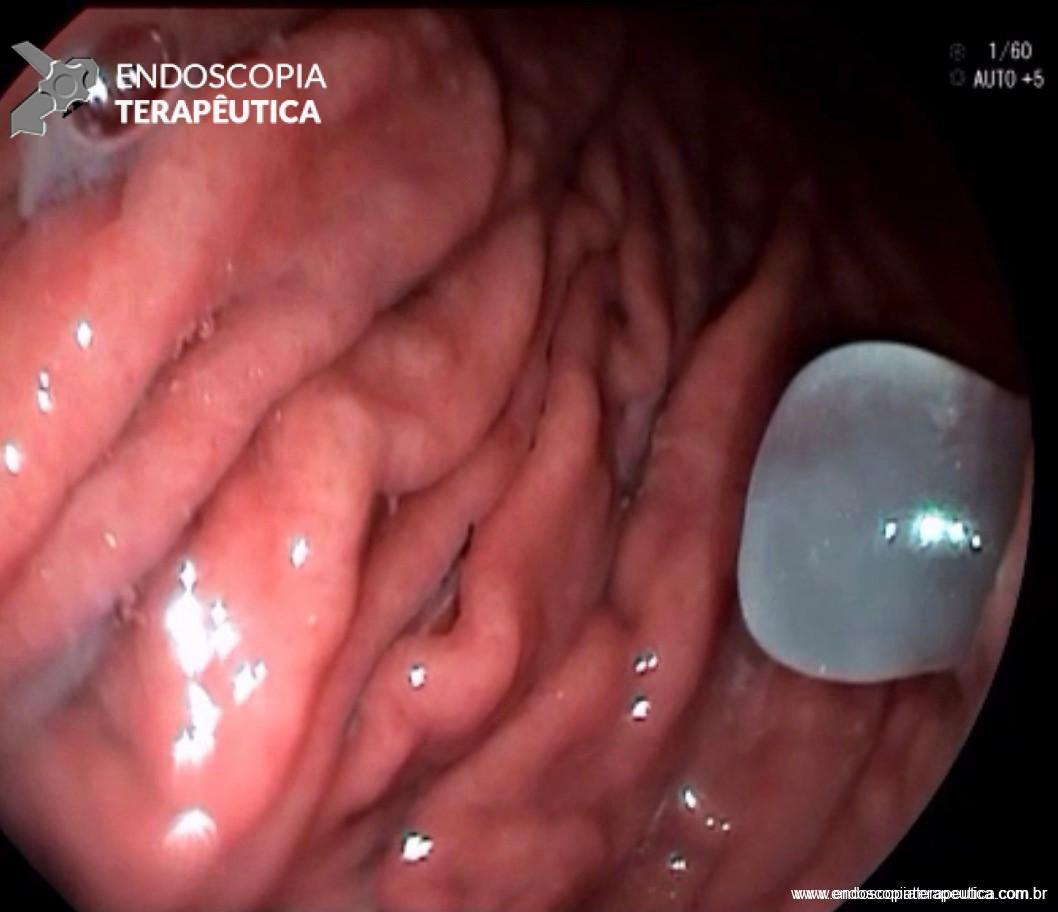
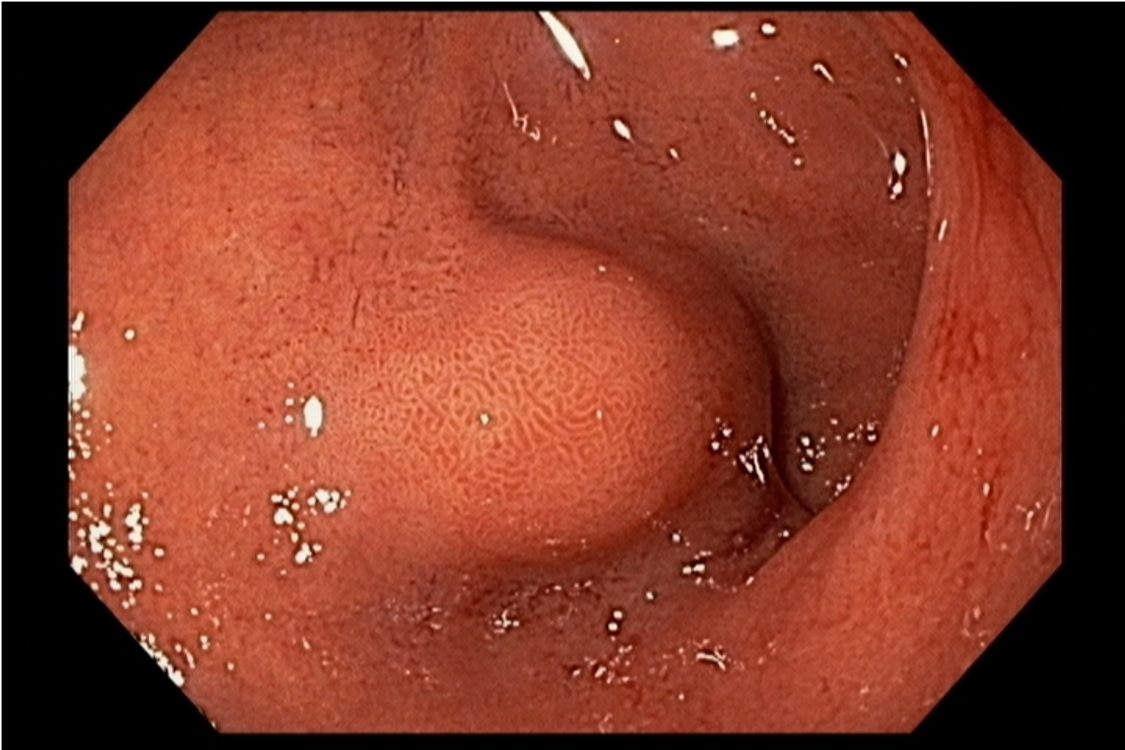
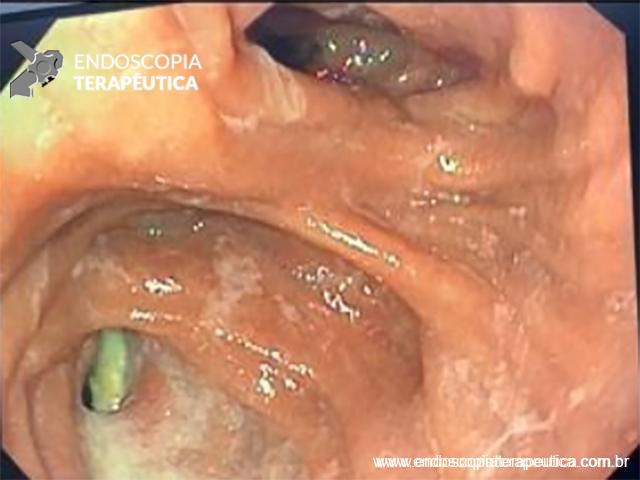
FIGURA 4 – Achado endoscópico – após adentrado no orifício fistuloso, nota-se a parede do ducto pancreático principal (ao fundo) e uma vegetação (à direita).
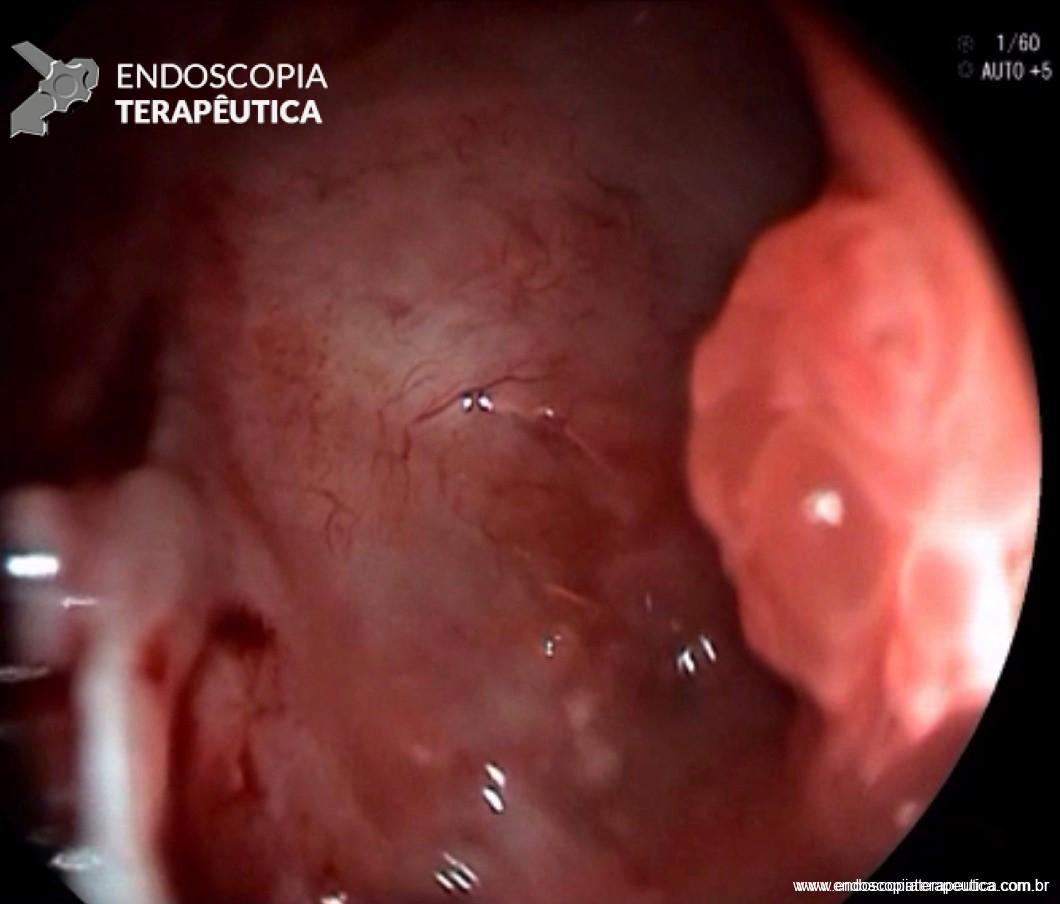
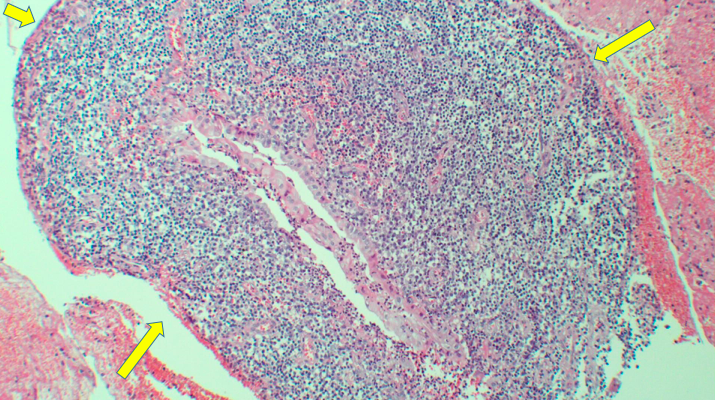
FIGURA 5 – Fotomicrografia demonstrando projeção papilar e epitélio tipo intestinal (flechas amarelas). Hematoxilina-eosina 40x.
DISCUSSÃO
A NIMP pode apresentar como complicação durante seu seguimento a formação de fístula espontânea em órgãos adjacentes em até 6% dos casos[i], ou mesmo, muito raramente, ruptura em peritônio livre[ii]. A presença de uma fístula é usualmente identificada por exames de imagem não invasivos, tais como a TC de abdômen e a ColangioRM, pois permitem a identificação anatômica da fístula. Tais achados podem ser confirmados por ultrassom endoscópico.
As fístulas podem ser múltiplas, ocorrendo em qualquer dos tipos de NIMP (DP, DS ou misto) [iii]. O tipo de fístula pode variar em comportamento como sendo invasor (tipo penetrante) devido à infiltração por neoplasia avançada ou por compressão local e isquemia da parede do tubo digestivo (tipo mecânico), este usualmente não associado à malignidade e responsável por até cerca de 2/3 dos casos de NIMP fistulizante (4). Dentre os sítios descritos, a NIMP pode fistulizar para o duodeno (65%), seguido de colédoco (11%), estômago (19%) e cólon (3%)[iv]. Dentre as fístulas para o estômago, identificamos na literatura um total de 5 casos publicados e 2 séries de casos.
Embora o achado de fístula sugira agressividade, nos casos em que ocorre compressão (tipo mecânico), a sua presença não está necessariamente associada à neoplasia invasiva. De fato, o tipo histológico usual nas fístulas é o intestinal6, considerado de baixa agressividade dentre os quatro tipos histológicos de NIMP descritos na literatura. No presente caso, a paciente apresentava tipo histológico intestinal com foco de displasia de alto grau, sem sinais de neoplasia invasora. Entretanto, o acometimento ductal desses pacientes tende a ser difuso por toda a extensão do pâncreas. Isso determina um dilema terapêutico para pacientes com alto risco cirúrgico e idosos, uma vez que a cirurgia com potencial de cura seria a pancreatectomia total, um procedimento de elevado risco e morbidade pré e pós-operatória. Clinicamente, a presença de fístula em si não representa uma situação de risco para o paciente. A fistulização, em verdade, pode promover descompressão ductal pancreática[v] e melhora dos sintomas[vi], restando apenas o componente secretor da doença, que teoricamente poderia espoliar o paciente por perda proteica. No presente estudo, a paciente referia-se à dor abdominal crônica, provavelmente decorrente de pancreatite crônica adjacente.
Em relação à conduta, no presente caso, optou-se, inicialmente, por pancreatectomia total, mas foi tecnicamente possível somente a realização de pancreatectomia corpo-caudal (aderências ao nível da cabeça pancreática) e gastrectomia parcial com remoção do componente fistuloso. A despeito de ter sido realizada uma cirurgia que poupou tecido pancreático, a paciente desenvolveu desnutrição grave em curto espaço de tempo de pós-operatório.
A fístula gastropancreática é considerada rara na literatura e suas consequências, a longo prazo; risco de neoplasia e o intervalo de seguimento não estão definidos7. No presente caso, o exame endoscópico e endossonográfico foram cruciais para o diagnóstico e, quanto ao tratamento, faz-se necessária uma avaliação do risco, ponderando-se as ressecções pancreáticas extensas, principalmente em pacientes idosos e de alto risco.
AUTORES
Eduardo Aimore Bonin1, Raquel Canzi Almada de Souza1, Renata Pereira Mueller1, Sergio Ossamu Ioshii1, José Celso Ardengh 2.
1- Complexo Hospital de Clínicas, Universidade Federal do Paraná, Curitiba, Brasil.
2- Hospital 9 de Julho, Setor de Endoscopia, São Paulo, SP, Brasil, Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (HCFMRP-USP). Endoscopia, Ribeirão Preto, SP, Brasil.
Como citar esse artigo:
Aimore E., Canzi R., Pereira R., Ossamu S. e Celso J. Casos Clínicos: Fístula gastropancreática secundária a neoplasia intraductal mucinosa papilar pancreática. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/casosclinicos/fistula-gastropancreatica-secundaria-neoplasia-intraductal-mucinosa-papilar-pancreatica-achados-de-endoscopia-digestiva-alta-e-de-ultrassom-endoscopico/
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
Referências
[i] Kobayashi G., Fujita N., Noda Y., Ito K., Horaguchi J., Obana T. Intraductal papillary mucinous neoplasms of the pancreas showing fistula formation into other organs. J Gastroenterol. 2010;45(October, 10):1080–1089.
[ii] Mizuta Y, Akazawa Y, Shiozawa K, Ohara H, Ohba K, Ohnita K, Isomoto H, Takeshima F, Omagari K, Tanaka K, Yasutake T, Nakagoe T, Shirono K, Kohno S. Pseudomyxoma peritonei accompanied by intraductal papillary mucinous neoplasm of the pancreas. Pancreatology. 2005; 5(4-5):470-4.
[iii] Ravaud S., Laurent V., Jausset F., Cannard L., Mandry D., Oliver A. CT and MR imaging features of fistulas from intraductal papillary mucinous neoplasm of the pancreas to adjacent organs: a retrospective study of 423 patients. Eur J Radiol. 2015;84(November, 11):2080–2088.
[iv] Ravaud S., Laurent V., Jausset F., Cannard L., Mandry D., Oliver A. CT and MR imaging features of fistulas from intraductal papillary mucinous neoplasm of the pancreas to adjacent organs: a retrospective study of 423 patients. Eur J Radiol. 2015;84(November, 11):2080–2088.
[v] Patel A,Allen A, Kuwahara J, Tracy Wadsworth T, Loeffler DM,Xie KL. Intraductal papillary mucinous neoplasm complicated by a gastropancreatic fistula Radiol Case Rep. 2019 Mar; 14(3): 320–323.
[vi] Gebran Khneizer,a,d Kavya M. Reddy,b Muhammad B. Hammami,c and Samer Alkaadeb Formation of Pancreatoduodenal Fistula in Intraductal Papillary Mucinous Neoplasm of the Pancreas Decreased the Frequency of Recurrent Pancreatitis. Gastroenterology Res. 2019 Feb; 12(1): 43–47.
VEJA TAMBÉM !