Tumores Suprarrenales: Diagnóstico, Conducta y el Papel de la Punción Ecoguiada
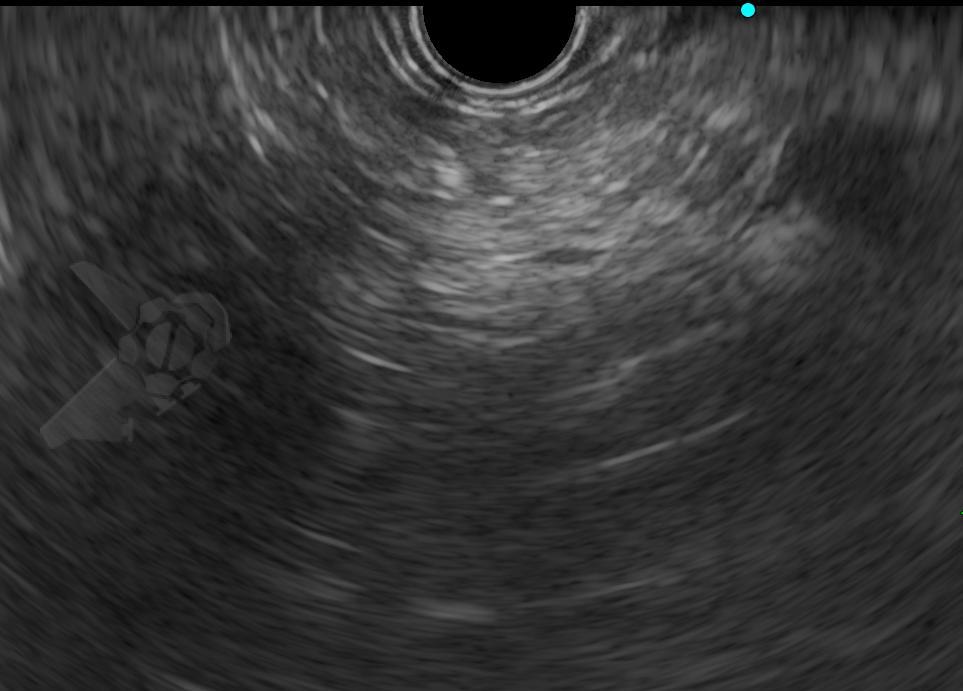
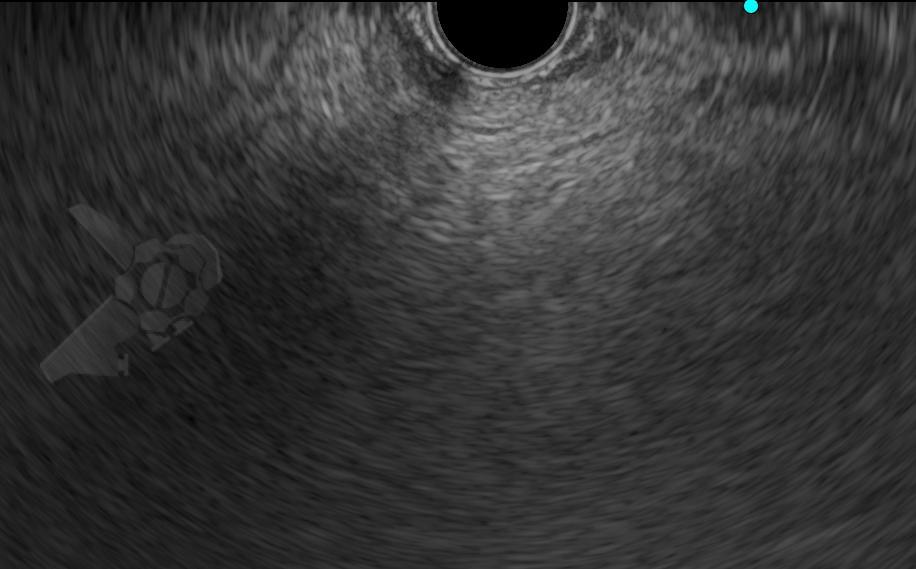
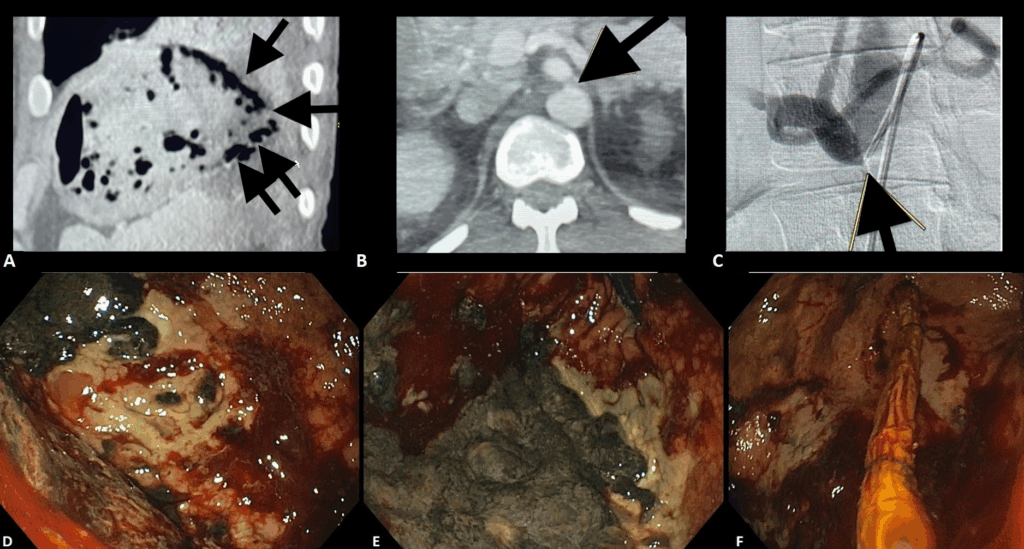
Durante el examen de ecoendoscopia, fue identificada la imagen en la adrenal isquierda:
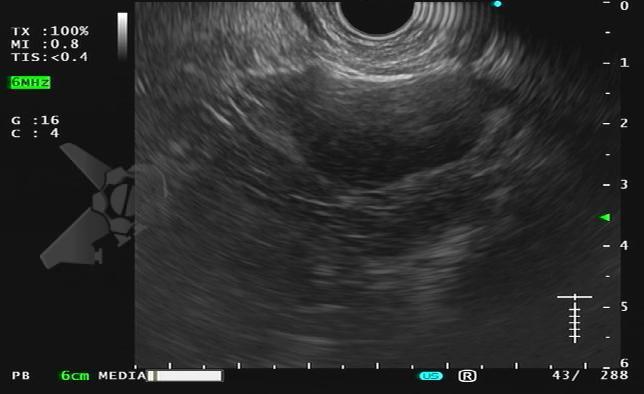
Ante este hallazgo incidental, ¿cuál sería su conducta?
- Punción ecoguiada con FNA
- Punción ecoguiada con FNB
- Discusión multidisciplinar
Los tumores suprarrenales — también llamados incidentalomas suprarrenales — son hallazgos cada vez más frecuentes en estudios de imagen realizados por otras razones. Este artículo revisa las principales recomendaciones para la evaluación, el diagnóstico diferencial y el tratamiento de estas lesiones, destacando el papel de la ecoendoscopia en la caracterización de las masas suprarrenales.
¿Qué es un incidentaloma suprarrenal?
Un incidentaloma suprarrenal es una masa ≥1 cm detectada incidentalmente en estudios de imagen sin sospecha clínica de enfermedad suprarrenal. Su prevalencia estimada es de alrededor del 2% en la población general y puede superar el 10% en personas mayores de 80 años.
La glándula suprarrenal también es un sitio común de metástasis, especialmente de tumores de pulmón, mama, riñón, melanoma y del tracto gastrointestinal, siendo el cuarto sitio más frecuente de diseminación metastásica. En pacientes con cáncer extrasuprarrenal, hasta el 75% de las masas suprarrenales representan metástasis.
La distinción entre lesiones benignas y malignas es esencial, ya que define el curso de acción: seguimiento, cirugía o quimioterapia.
Avaliación inicial y cribado hormonal
Incluso los tumores funcionales pueden ser clínicamente asintomáticos. Por lo tanto, todo incidentaloma debe evaluarse bioquímicamente para descartar:
- Feocromocitoma: medir metanefrinas plasmáticas o urinarias;
- Hiperproducción de cortisol: prueba de supresión con dexametasona (1 mg);
- Hiperaldosteronismo primário: en pacientes hipertensos.
La exclución de feocromocitoma es recomendada antes de cualquier biópsia de la suprarrenal, para prevenir la precipitación de una posible crise hipertensiva.
Diagnóstico por imagen
La tomografia computadorizada (TC) sin contraste es el examen de primeira linea.
- Lesiones benignas: homogeneas, < 4 cm y con atenuaciones ≤ 10 unidades Hounsfield (UH), são consideradas adenomas e não necessitam de acompanhamento adicional.
- Lesiones suspeitas: tamaño > 4 cm, heterogeneas, UH > 10, márgenes irregulares o áreas de necrosis y calcificación indican mayor riesgo de carcinoma adrenocortical (CAC).
El riesgo de CAC es < 2% en lesiones < 4 cm, 6% entre 4–6 cm y ≥ 25% en masas ≥ 6 cm.
Cuando las TC no son concluyentes, se puede utilizar la resonancia magnética (RM) o la tomografía por emisión de positrones (PET) con 18F-fluoro-2-desoxi-D-glucosa (FDG) para una caracterización más detallada.
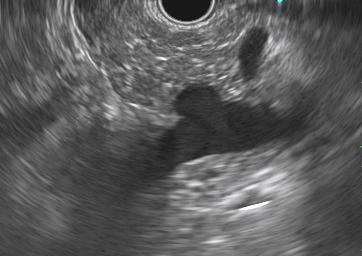
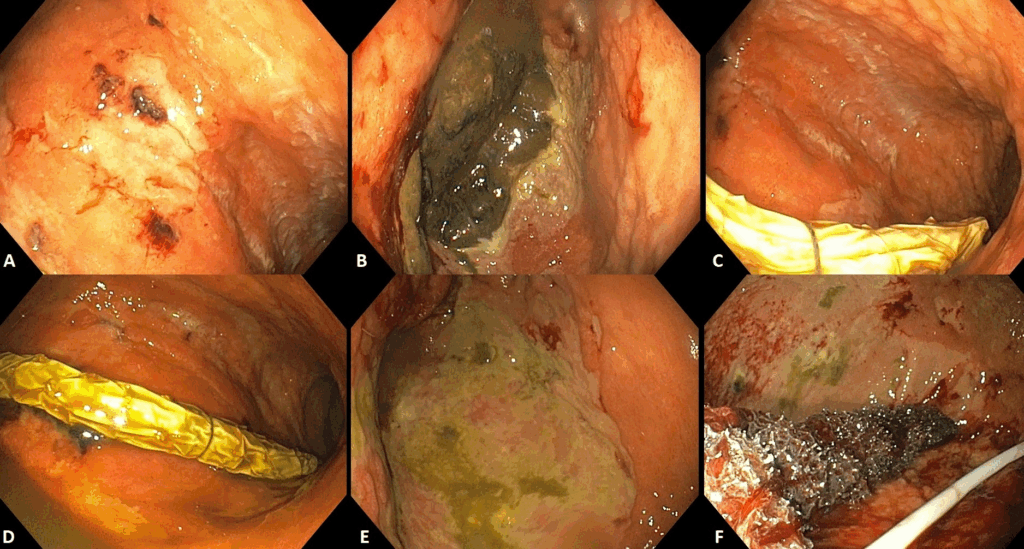
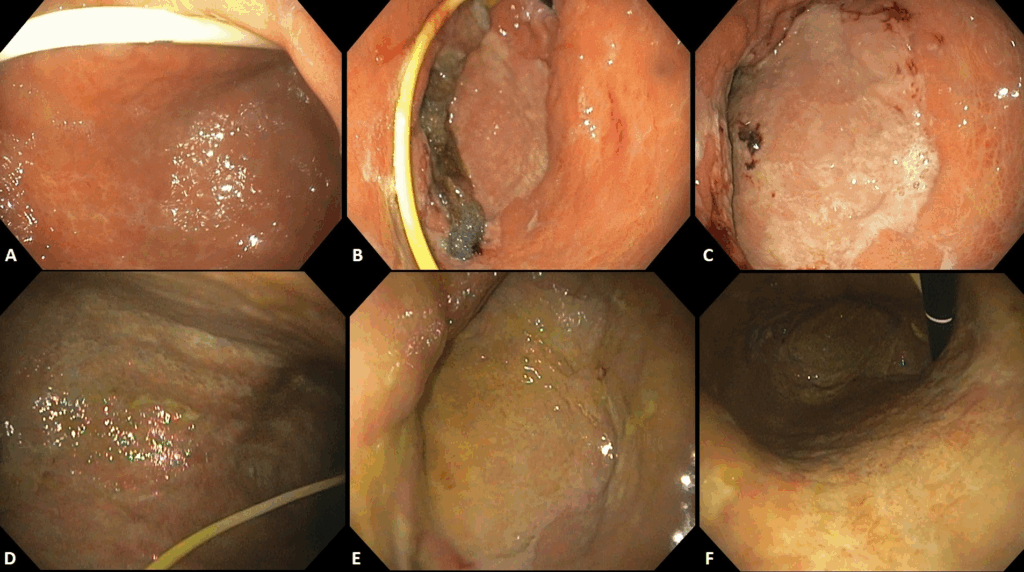
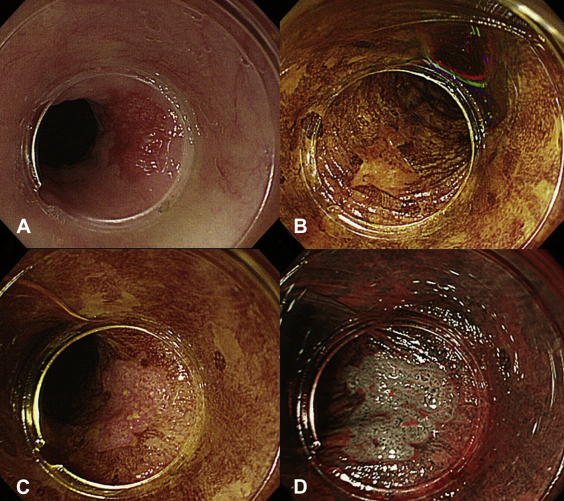
Punción ecoguiada de la suprarrenal
La biopsia suprarrenal rara vez es necesaria, pero puede ser crucial en casos con antecedentes de neoplasia maligna extrasuprarrenal (sospecha de metástasis) o cuando el diagnóstico influye directamente en el tratamiento.
La biopsia por aspiración con aguja fina guiada por ecografía (EUS-FNA/FNB) está ganando popularidad por su seguridad y precisión.
Ventajas de la EUS-FNA/FNB:
- Seguridad: tasas de complicaciones cercanas al 0%, en comparación con hasta un 4% con el abordaje percutáneo.
- Alta precisión: sensibilidad del 86% al 100% y especificidad del 97% al 100% para metástasis.
- Acceso anatómico favorable: la glándula suprarrenal izquierda es fácilmente accesible a través de la pared gástrica posterior, sin estructuras críticas interpuestas.
- Impacto clínico: la confirmación de metástasis puede evitar cirugías innecesarias y guiar el tratamiento sistémico.
La biópsia es recomendada si se cumplen tres criterios:
1. La lesión presenta inactividad hormonal (feocromocitoma excluido);
2. Las imágenes no caracterizan de forma concluyente una lesión benigna;
3. El resultado histológico puede modificar el tratamiento clínico.
En pacientes oncológicos, el estudio es útil para confirmar metástasis aisladas, evaluar la respuesta terapéutica o redefinir el estadificación.
Conducta e tratamento
El tratamiento debe individualizarse según el tipo de lesión y el perfil hormonal.
- Lesiones benignas y no funcionantes (< 4 cm, ≤ 10 UH): generalmente no requieren intervención ni seguimiento prolongado.
- Lesiones sospechosas o malignas: se indica adrenalectomía laparoscópica. La decisión quirúrgica debe considerar el tamaño, el crecimiento, las características radiológicas y el estado funcional.
- Metástasis suprarrenales confirmadas: pueden tratarse con quimioterapia sistémica o cirugía de resección en casos seleccionados.
El manejo ideal es multidisciplinar, con la participación de un endocrinólogo, un radiólogo, un cirujano y un endoscopista intervencionista.
Puntos clave
- Alta prevalencia: los incidentalomas suprarrenales aumentan con la edad y con frecuencia son benignos.
- Diagnóstico inicial: la tomografía computarizada sin contraste define la benignidad (≤10 UH, <4 cm).
- Cribado hormonal: feocromocitoma, hipercortisolismo y, en pacientes hipertensos, hiperaldosteronismo.
- Biopsia ecoguiada (EUS-FNA/FNB): un método seguro, mínimamente invasivo y de alta precisión para confirmar metástasis.
- Biopsia selectiva: indicada solo si el resultado altera el manejo clínico.
- Enfoque integrado: las decisiones terapéuticas deben discutirse en un equipo multidisciplinario.
Consideraciones finales
Los tumores suprarrenales requieren una evaluación cuidadosa para evitar cirugías innecesarias y retrasos en el diagnóstico de neoplasias malignas. La ecoendoscopia con PAAF/BAAF puede ayudar en el diagnóstico diferencial de los tumores suprarrenales; sin embargo: 1.) solo debe indicarse tras una consulta multidisciplinaria y 2.) debe descartarse el feocromocitoma antes de la biopsia.
Referencias
- DeWitt J, Alsatie M, LeBlanc J, McHenry L, Sherman S. Endoscopic ultrasound-guided fine-needle aspiration of left adrenal gland masses. Endoscopy. 2007;39(1):65-71. doi:10.1055/s-2006-945042
- Martin-Cardona A, Fernandez-Esparrach G, Subtil JC, et al. EUS-guided tissue acquisition in the study of the adrenal glands: Results of a nationwide multicenter study. PLoS One. 2019;14(6):e0216658. Published 2019 Jun 6. doi:10.1371/journal.pone.0216658
- Sherlock M, Scarsbrook A, Abbas A, et al. Adrenal Incidentaloma. Endocr Rev. 2020;41(6):775-820. doi:10.1210/endrev/bnaa008
- Kebebew E. Adrenal Incidentaloma. N Engl J Med. 2021;384(16):1542-1551. doi:10.1056/NEJMcp2031112
- Fassnacht M, Tsagarakis S, Terzolo M, et al. European Society of Endocrinology clinical practice guidelines on the management of adrenal incidentalomas, in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol. 2023;189(1):G1-G42. doi:10.1093/ejendo/lvad066
- Zhang CD, Erickson D, Levy MJ, et al. ENDOSCOPIC ULTRASOUND-GUIDED FINE-NEEDLE ASPIRATION IN THE DIAGNOSIS OF ADRENAL METASTASIS IN A HIGH-RISK POPULATION. Endocr Pract. 2017;23(12):1402-1407. doi:10.4158/EP-2017-0022
- Carasel A, Calissendorff J, Juhlin CC, Falhammar H. Cytological Assessment of Adrenal Tumours: Insights From 22-Years Single Centre Experience. Clin Endocrinol (Oxf). 2025;103(2):157-166. doi:10.1111/cen.15254
- Eloubeidi MA, Black KR, Tamhane A, Eltoum IA, Bryant A, Cerfolio RJ. A large single-center experience of EUS-guided FNA of the left and right adrenal glands: diagnostic utility and impact on patient management. Gastrointest Endosc. 2010;71(4):745-753. doi:10.1016/j.gie.2009.10.022
- Martinez M, LeBlanc J, Al-Haddad M, Sherman S, DeWitt J. Role of endoscopic ultrasound fine-needle aspiration evaluating adrenal gland enlargement or mass. World J Nephrol. 2014;3(3):92-100. doi:10.5527/wjn.v3.i3.92
- Novotny AG, Reynolds JP, Shah AA, et al. Fine-needle aspiration of adrenal lesions: A 20-year single institution experience with comparison of percutaneous and endoscopic ultrasound guided approaches. Diagn Cytopathol. 2019;47(10):986-992. doi:10.1002/dc.24261
Cómo citar este artículo
Mendieta PJO, Penaloza CSQ. Tumores Suprarrenales: Diagnóstico, Conducta y el Papel de la Punción Ecoguiada. Endoscopia Terapéutica 2025, Vol II. Disponible en: https://endoscopiaterapeutica.net/es/sin-categoria/tumores-suprarrenales-diagnostico-conducta-y-el-papel-de-la-puncion-ecoguiada/