Até onde vamos com as ressecções “à frio”?
Nos últimos anos, as resseções por alça fria (CSP) de lesões colorretais tem sido amplamente aceitas e cada vez mais utilizadas. Como principais benefícios, a CSP costuma ser um procedimento mais rápido e com menor risco associado de lesão térmica profunda quando comparado às ressecções diatérmicas (quente) (HSP).
Pontos importantes:
- CSP é equivalente a HSP na ressecção completa de pólipos colorretais de até 9 mm de tamanho.
- A taxa de sangramento imediato é maior com CSP em comparação com HSP, mas isso raramente é clinicamente significativo e pode ser controlado com medidas hemostáticas simples durante o procedimento, se necessário.
- Ressecções à frio em “piece meal” se constituem em opções técnicas mesmo em algumas lesões maiores do 10 mm.
E quanto às lesões duodenais?
Sabe-se que eventos adversos após a ressecção de lesões duodenais são desafiadores, particularmente o sangramento tardio, síndrome pós polipectomia e perfuração. Partindo do mesmo princípio que levou a utilização cada vez maior de técnicas à frio no cólon, será que a ressecção de lesões à frio no duodeno poderia ser benéfica na redução de eventos adversos?
Em estudo publicado na revista Gut de setembro, Repici e colaboradores avaliaram a proposição de que a eliminação do cautério na ressecção de lesões não ampulares esporádicas no duodeno poderia ser factível e levaria a redução das taxas de complicação após o procedimento.
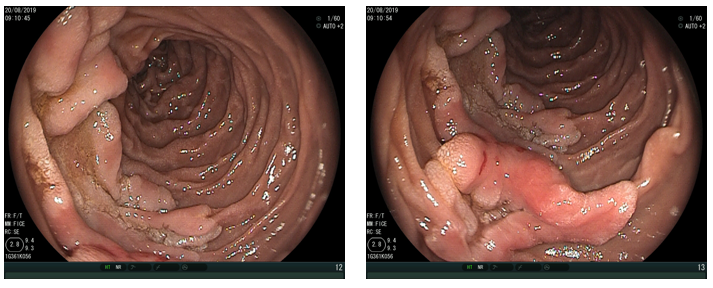
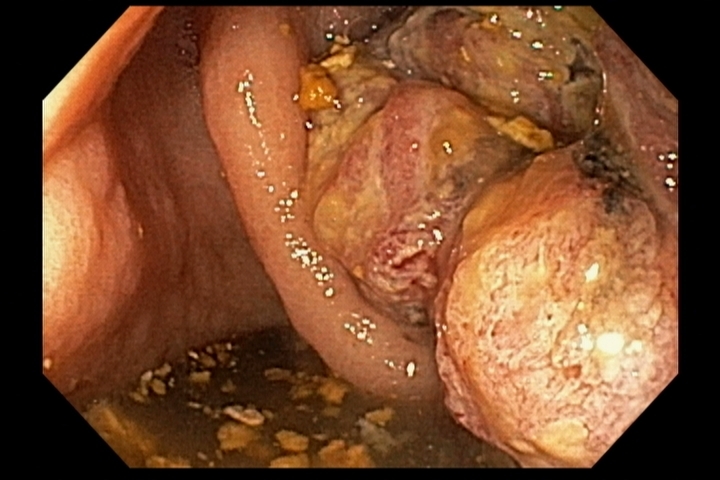
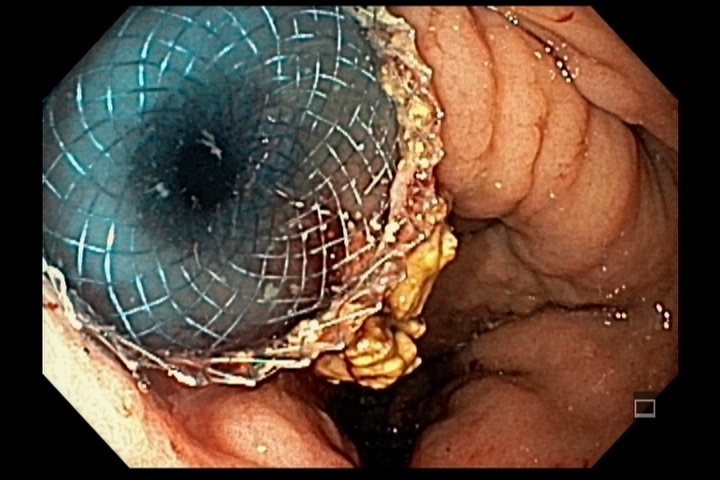
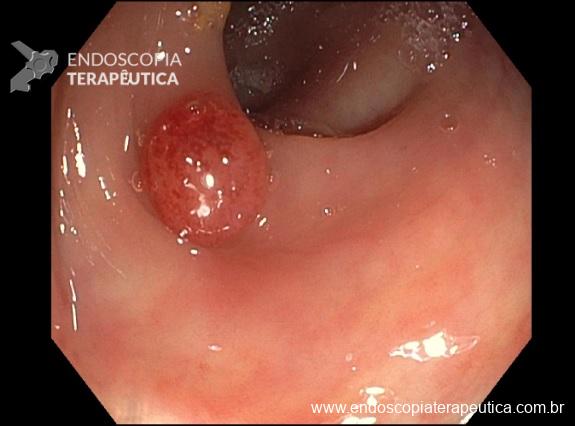
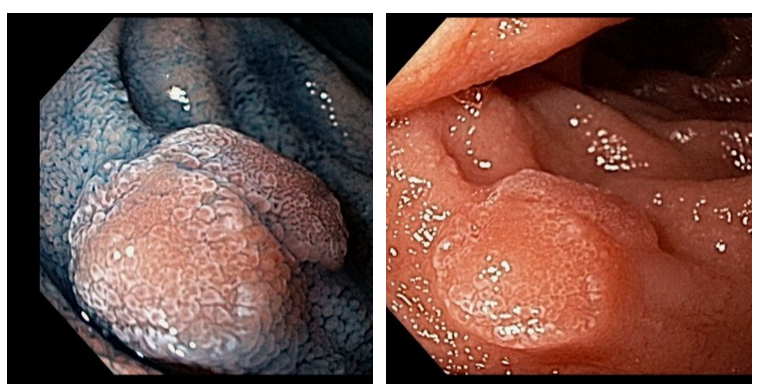
Em uma série retrospectiva envolvendo 04 centros europeus, entre fevereiro de 2020 e junho de 2021 comparou-se os resultados da ressecção endoscópica da mucosa (EMR) à frio e quente para adenomas duodenais não ampulares > 20 mm.
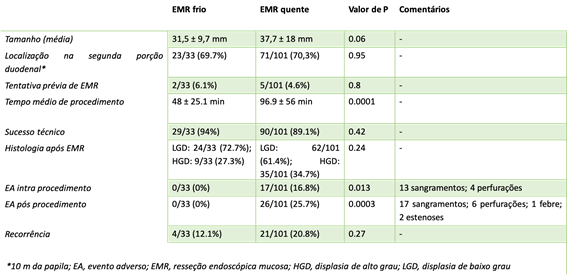
Os principais resultados são apresentados abaixo:
- Todos os pacientes foram acompanhados após procedimento com biópsias de rotina nas áreas cicatriciais (tempo médio de 3,8 meses no grupo EMR frio e 13,8 meses no grupo EMR quente)
- Recorrência foi tratada com nova ressecção ou ablação por plasma de argônio.
- Em 134 pacientes (EMR quente = 101, EMR frio = 33), a duração do procedimento (96.9 ± 56.0 minutos vs 48.0 ± 25.1) e eventos adversos pós-procedimento (25,7% vs 0,0%; P = 0,0003) foram maiores no grupo EMR quente.
- O sucesso técnico (89,1% vs 94,0%; P = 0,42) e as taxas de recorrência (20,8% vs 12,1%; P = 0,27) foram comparáveis entre EMR quente e à frio.
Comentários:
O trabalho apresentado revela dados bastante interessantes sobre a possibilidade de ressecção à frio de lesões duodenais, considerando principalmente as elevadas taxas de complicações vistas em ressecções com uso de eletrocautério nesse órgão.
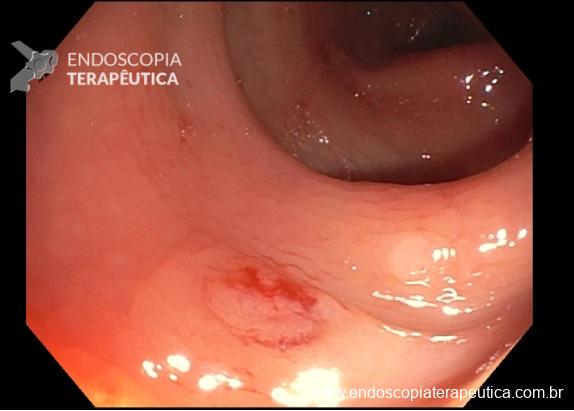
Grupo EMR quente apresentou 17 casos de sangramento tardio e 10 pacientes (quase 10%) experimentando perfuração, imediata ou tardia, levando a 1 óbito. Enquanto o grupo EMR frio não apresentou complicações intra e pós procedimento.
No grupo EMR frio, as lesões foram menores de modo não significativo (P= 0.06), e as taxas de recorrência no braço de EMR frio são interessantemente baixas e animadoras.
O tempo de seguimento descrito foi menor no grupo EMR frio, podendo haver aumento das taxas de recorrência ao longo do tempo, contudo essas recorrências costumam ser identificadas de forma precoce e tem tratamento em sua maioria endoscópico.
Por fim, certamente novas séries randomizadas se fazem interessantes na avaliação de técnica da mucosectomia à frio, mas o estudo atual introduz um conceito que pode contribuir determinantemente na mudança de conduta no tratamento das lesões adenomatosas esporádicas não ampulares duodenais.
Referências
- Repici A, Capogreco A, Spadaccini M, Maselli R, Galtieri PA, Fugazza A, Carrara S, Colombo M, Schachschal G, Creutzfeldt A, Aslam SP, Alkandari A, Bhandari P, Meining A, Hassan C, Rösch T. Cold versus hot EMR for large duodenal adenomas. Gut. 2022 Sep;71(9):1763-1765.
- Tutticci NJ, Kheir AO, Hewett DG. The Cold Revolution: How Far Can It Go? Gastrointest Endosc Clin N Am. 2019 Oct;29(4):721-736.
- Thoguluva Chandrasekar V, Spadaccini M, Aziz M, Maselli R, Hassan S, Fuccio L, Duvvuri A, Frazzoni L, Desai M, Fugazza A, Jegadeesan R, Colombo M, Dasari CS, Hassan C, Sharma P, Repici A. Cold snare endoscopic resection of nonpedunculated colorectal polyps larger than 10 mm: a systematic review and pooled-analysis. Gastrointest Endosc. 2019 May;89(5):929-936.e3.
- Ortigão R, Weigt J, Afifi A, Libânio D. Cold versus hot polypectomy/endoscopic mucosal resection-A review of current evidence. United European Gastroenterol J. 2021 Oct;9(8):938-946.
Como citar este artigo
Medrado, B. Até onde vamos com as ressecções à frio?. Endoscopia Terapeutica, 2022. Disponível em https://endoscopiaterapeutica.net/pt/artigoscomentados/ate-onde-vamos-com-as-resseccoes-a-frio