Introdução
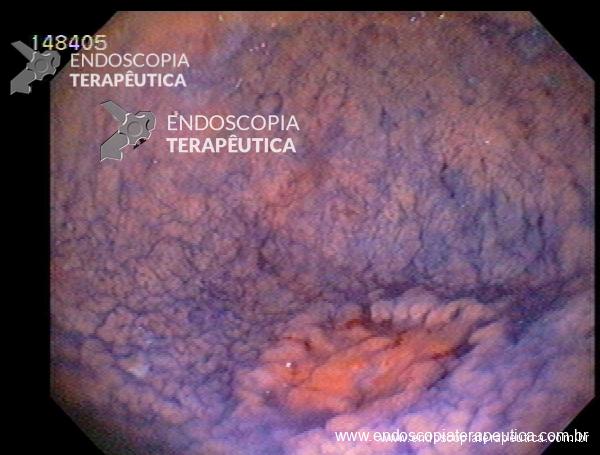
A acalasia é um distúrbio de motilidade esofágica caracterizado pelo relaxamento incompleto do esfíncter esofágico inferior (EEI), aumento do tônus do EEI ou perda da peristalse do esôfago devido à degeneração dos neurônios mioentéricos da parede esofágica.
A incidência desta patologia varia 0,03 a 1,63/100.000 pessoas e sua prevalêcia é de quase 10/100.000, não havendo diferença entre os sexos1.
A acalasia pode ser classificada em primária ou idiopática, e secundária à infecção pelo protozoário Trypanossoma cruzi, agente etiológico da doença de Chagas.
Os principais sintomas do megaesôfago consistem: disfagia de longa duração, odinofagia, regurgitação, azia, dor retroesternal e perda ponderal2.
O tratamento da patologia é funcional, consistindo em métodos que visam à diminuição da pressão de repouso do EEI, sejam eles endoscópicos, medicamentosos ou cirúrgico3.
O tratamento de melhor resultado é baseado no rompimento da musculatura do EEI, tanto através da dilatação com balão pneumático quanto através da miotomia laparoscópica de Heller.
A eficácia de ambos os procedimentos aparentemente é semelhante, porém estima-se que o alívio dos sintomas conseguido através da cirurgia seja mais duradouro e definitivo, sem a necessidade de repetidas dilatações endoscópica e os riscos que delas decorrem4,5.
POEM (MIOTOMIA ENDOSCÓPICA PERORAL)
Em 1980, Ortega et al.6 descreveu a técnica da miotomia endoscópica em 17 pacientes com acalasia através do corte da mucosa seguido da secção da musculatura circular do esôfago distal, obtendo melhora dos sintomas e queda da pressão do esfíncter esofágico inferior à manometria, com baixos índices de complicação. Em 2007, Pasricha et al.7 desenvolveu a técnica de secção da musculatura circular do EEI associado ao túnel submucoso em modelo experimental.
Em 2010, Inoue et al.8 descreveu pela primeira vez a miotomia endoscópica peroral (POEM) em 17 pacientes consecutivos com megaesôfago. Em todos os casos, o POEM reduziu significativamente o escore dos sintomas de disfagia e foi responsável pela queda de pressão de repouso do EEI da média de 52,4 mmHg para 19,9 mmHg. Não foram relatadas complicações graves relacionadas ao POEM nesses pacientes.
Indicações
Inicialmente Inoue et al.8 realizou o POEM nos pacientes com acalasia e megaesôfago Grau I e II. Posteriormente, as indicações foram expandidas para megaesôfago com tortuosidade. Entretanto, existem maiores dificuldades técnicas na realização do POEM nos pacientes apresentando um alongamento sigmoide do esôfago.
O POEM também pode ser realizado em casos de espasmo esofageano difuso e esôfago em quebranozes. Shiwaku et al.9 relatou um caso submetido ao POEM com sucesso em paciente com espasmo esofageano difuso sendo realizada uma miotomia extensa. Minami et al.10 obteve a mesma efetividade do POEM em espasmo esofageano difuso.
Terapêuticas endoscópicas prévias como a injeção de toxina botulínica e a dilatação balonada causam uma fibrose e distorção da anatomia tornando o POEM tecnicamente desafiador, particularmente em pacientes com tortuosidade do esôfago. Sharata et al.11 publicou os resultados de 40 pacientes submetidos ao POEM. Nesta série estavam incluídos 10 pacientes com tratamento endoscópico prévio e evoluíram com queda do escore de Eckardt após o POEM.
Onimaru et al.12 e Vigneswaran et al.13 relataram excelentes resultados do POEM em pacientes com falha no tratamento cirúrgico da acalasia pela técnica de Heller com vávula antirefluxo. Entretato, o POEM é tecnicamente mais difícil devido à fibrose nesses casos de cirurgia prévia.
Técnica
A miotomia endoscópica da acalasia do esôfago consiste na criação de túnel submucoso, dissecção do músculo do EEI e fechamento da mucosa.
1 – Criação do túnel submucoso
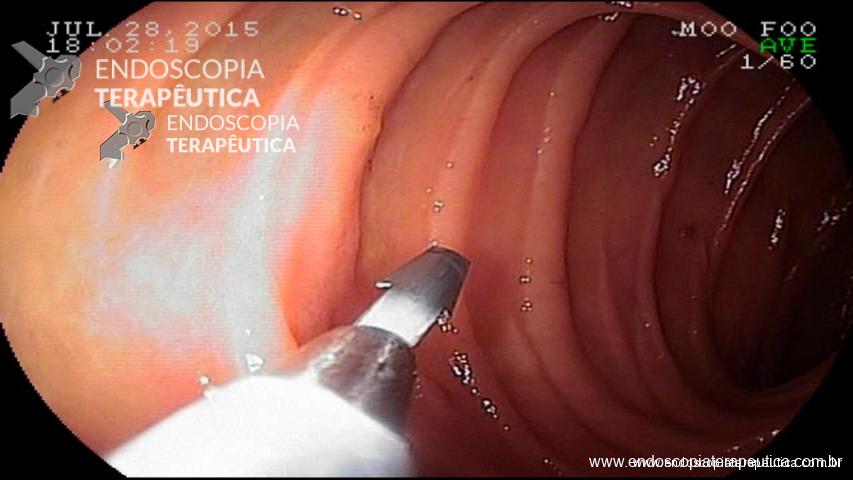
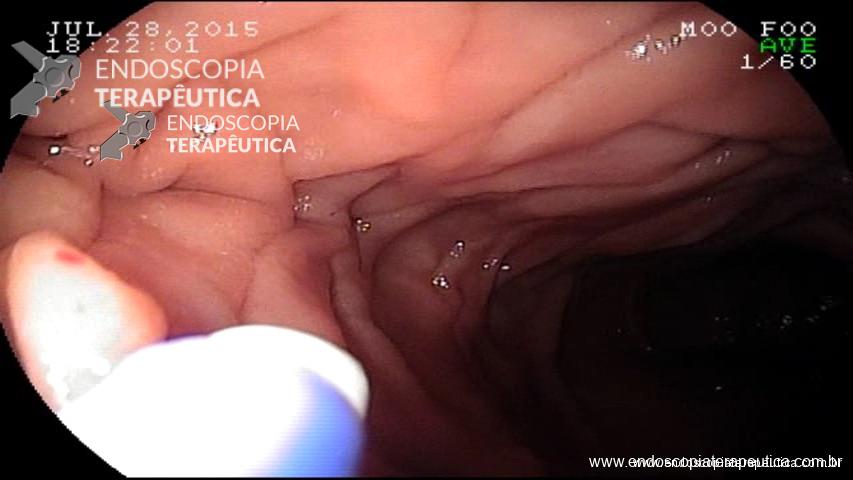
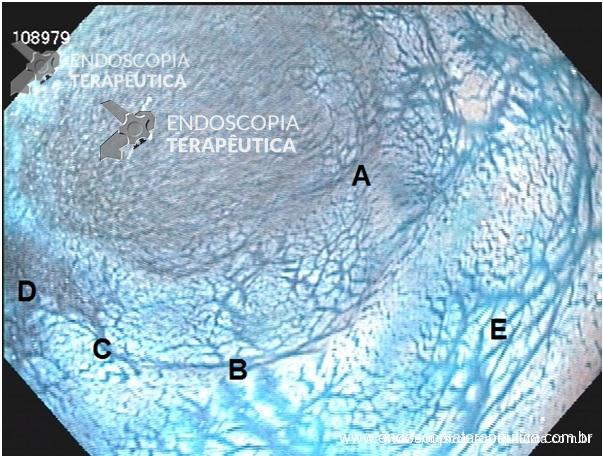
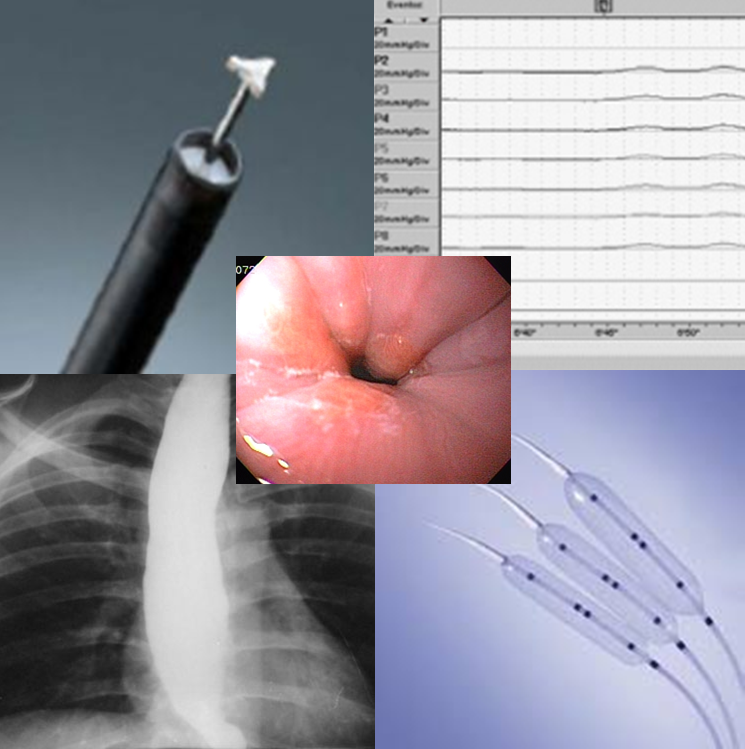
Inicialmente, realiza-se a injeção submucosa com solução de soro fisiológico e índigo carmim no esôfago, 10 cm proximal à transição esofagogástrica (TEG) (Figura 1). Em seguida, efetua-se incisão de 2 cm na mucosa, longitudinalmente, criando-se um espaço na submucosa. Uma vez no espaço da submucosa, cria-se um túnel usando a coagulação no modo spray, ultrapassando-se a TEG em cerca de 2 cm, correspondendo ao estômago proximal (Figura A,B).
2 – Dissecção do músculo do EEI
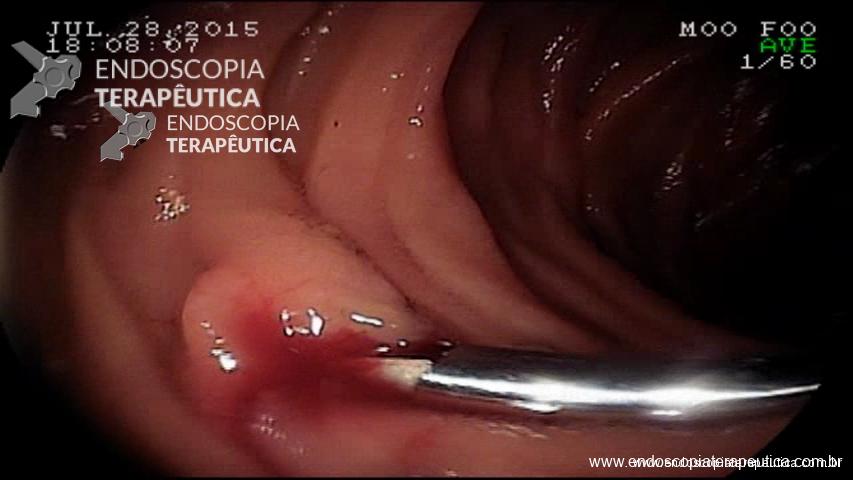
Dá-se início à dissecção do feixe muscular circular 2 cm distalmente à entrada da mucosa e cerca de 6 cm acima da TEG.
É importante a identificação da camada longitudinal, que é geralmente muito mais fina. A miotomia prossegue distalmente até que se atinja a submucosa gástrica, extendendo-se até cerca de 2 ou 3 cm distalmente à TEG (Figura C).
3 – Fechamento do túnel submucoso
A abertura do túnel submucoso geralmente com 2 cm de comprimento é fechada através da colocação de clipes hemostáticos (Figura D).
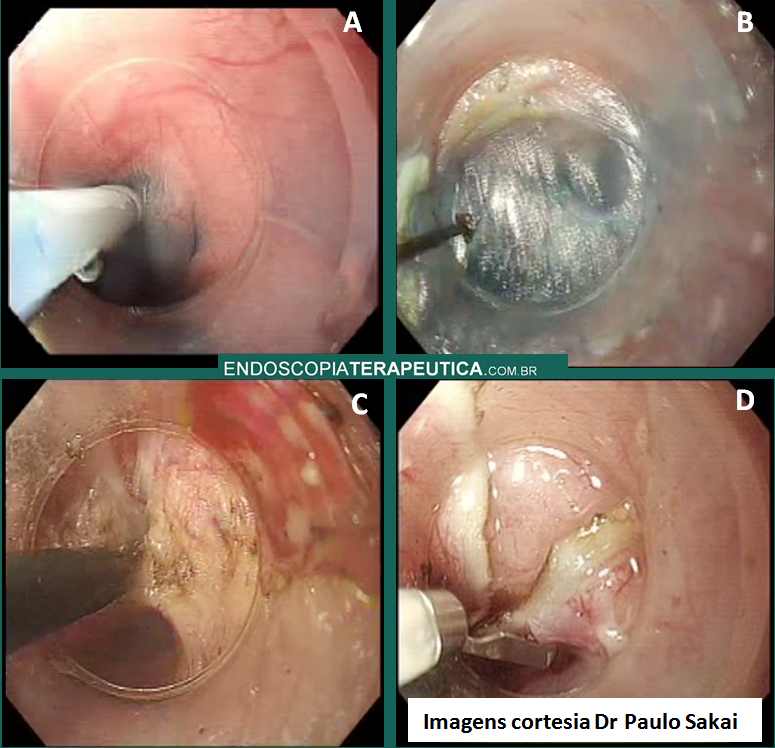
Figura – A) Injeção submucosa para incisão da entrada do túnel. B) Disseçcão da submucosa e formação do túnel. C) Miotomia. D) Fechamento do orifício mucoso com clipes. (Clique para ampliar).
Pós-operatório
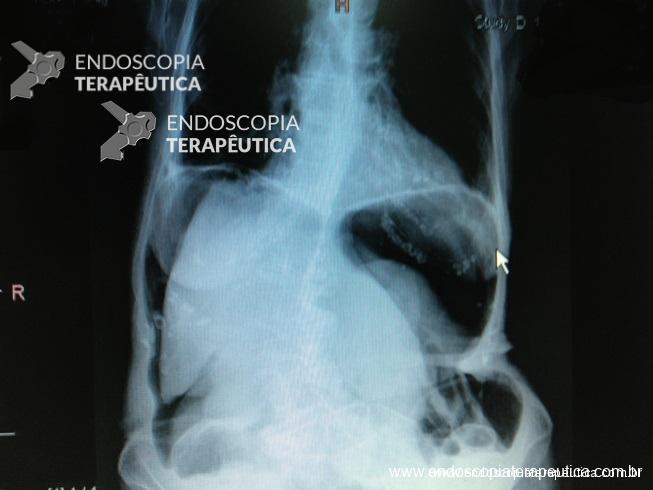
Imediatamente após o procedimento, o paciente deve ser submetido a RX de tórax para avaliação de eventual pneumotórax ou pneumomediastino. De acordo com Ponsky et al.,14 é possível a dissecção de CO2 para abdômen, tórax e mediatino em até 20% dos pacientes.
Deve-se manter o paciente em jejum por 24h e esofagograma com contraste hidrossolúvel para descartar fístula e avaliar a passagem do líquido para o estômago. O paciente deve manter dieta líquida por 7 dias, quando então se progride a dieta para pastosa e subsequentemente, sólida. Os pacientes recebem alta 1 dia após o procedimento, com uso de inibidor de bomba de prótons por 30 dias.
Resultados
O POEM é considerado bem sucedido quando os pacientes passam a apresentar escore de Eckardt ≤ 3.
Nos estudos recentes, nota-se melhora importante tanto dos sintomas quando das medidas de pressão de repouso do esfíncter inferior do esôfago. Costamagna et al.3 completou o POEM em 10 dos 11 pacientes. Num paciente que foi previamente submetido à radioterapia do mediastino para o câncer de mama, a criação do túnel submucoso foi impossibilitada devido à alterações fibróticas na submucosa . O sucesso clínico foi obtido em todos os pacientes tratados em três meses de seguimento (média do escore de Eckardt pré-tratamento versus pós- tratamento (7,1 vs 1,1) e a média da pressão do esfíncter esofágico inferior diminuiu de 45,1 para 16.9mmHg . Nenhum paciente desenvolveu sintomas de refluxo gastroesofágico após o tratamento.
Von Renteln et al.15 realizou o POEM em 16 pacientes. O sucesso do tratamento foi alcançada em 94% dos casos após 3 meses de seguimento (pontuação média de Eckardt diminui de 8,8 para 1,4), e a média da pressão do esfíncter esofágico inferior foi de 27.2mmHg (pré-tratamento) para 11.8mmHg (pós-tratamento). Nenhum paciente desenvolveu sintomas de refluxo gastroesofágico após o tratamento, mas um paciente apresentou uma erosão no esôfago distal (grau A de Los Angeles) na endoscopia digestiva alta de seguimento.
Referências bibliográficas
- Fei L, Rossetti G, Moccia F, Cimmino M, et al. Definition, incidence and etiology: what’s new in the 21st century?. Ann Ital Chir 489-94, 2013.
- Ferrari Jr AP, Siqueira ES, Brant CQ. Treatment of achalasia in Chagas’ disease with botulinum toxin (letter). N Engl J Med 332:24, 1995.
- Costamagna G, Marchese M, Familiari P, et al. Peroral endoscopic myotomy (POEM) for oesophageal achalasia: preliminary results in humans. Dig Liver Dis.; 44:827-832, 2012.
- Muehldorfer SM, Schneider TH, Hochberger J, et al. Esophageal achalasia: intrasphincteric injection of botulinum toxin A versus balloon dilation. Endoscopy 1999; 31:517.
- Vaezi MF, Richter JE, Wilcox CM, et al. Botulinum toxin versus pneumatic dilatation in the treatment of achalasia: a randomised trial. Gut 1999; 44:231.
- Ortega JA, Madureri V, Perez L. Endoscopic myotomy in the treatment of achalasia. Gastrointest Endosc 1980: 26:8-10.
- Inoue H, Minami H, Kobayashi Y, et al. Peroral endoscopic myotomy (POEM)
for esophageal achalasia. 42:265–271, 2010.
- Pashricha PJ, Hawari R, Ahmed I, et al. Submucosal endoscopic esophageal
myotomy: a novel experimental approach for the treatment of achalasia. 2007;39:761–764.
- Shiwaku H, Inoue H, Beppu R, et al. Succesful treatment of diffuse esophageal spasm by peroral endoscopic myotomy. Gastrointest Endosc. 2013; 77: 149-150.
- Minami H, Isomoto H, Yamaguchi N, et al. Peroral endoscopic myotomy (POEM) for diffuse esophageal spasm. Endoscopy 2014; 46 (Suppl 1 UCTN): E79-80.
- Sharata A, Kurian AA, Dunst CM, Bhayani NH, Reavis KM, Swanström LL. Peroral endoscopic myotomy (POEM) is safe and effective in the setting of prior endoscopic intervention. J Gastrointest Surg. 2013; 17: 1188-92.
- Onimaru M, Inoue H, Ikeda H, et al. Peroral endoscopic myotomy is a viable option for failed surgical esophagocardiomyotomy instead of redo surgical Heller myotomy: a single center prospective study. J Am Coll Surg. 2013;217: 598-605.
- Vigneswaran Y, Yetasook AK, Zhao JC, Denham W, Linn JG, Ujiki MB. Peroral endoscopic myotomy (POEM): feasible as reoperation following Heller myotomy. J Gastrointest Surg. 2014; 18: 1071-6.
- Ponsky JL, Marks JM, Pauli EM. How i do it: per-oral endoscopic myotomy (POEM). J Gastrointest Surg 2012; 16:1251–1255.
- Von Rentelm D, Inoue H, Minami H, et al. Peroral endoscopic myotomy for the treatment of achalasia: a prospective study. Am J Gastroenterol. 2012; 107: 411-417.
Assuntos relacionados
Imagens – Megaesôfago chagásico
Caso clínico – Estenose benigna de esôfago
Fundoplicatura gástrica – como avaliar?
Caso clínico – Ruptura de anel de bariátrica com balão de acalásia
Caso clínico – Tratamento endoscópico do divertículo de Zenker
O autor