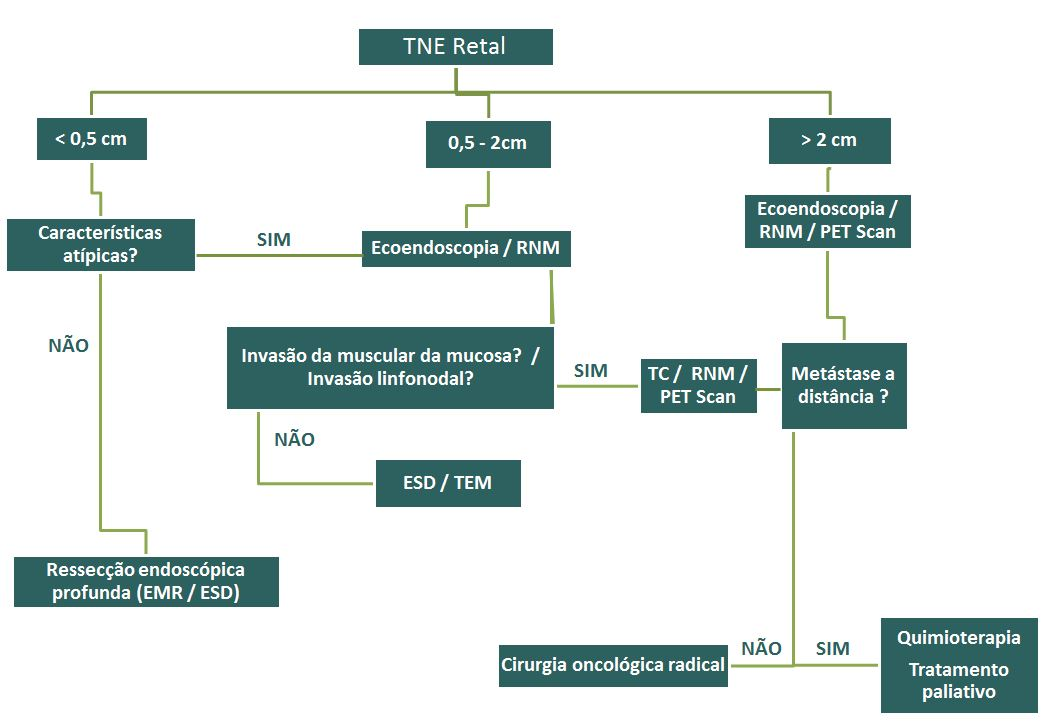
Diagnóstico da infecção por Helicobacter pylori
HISTÓRICO
Em 1982 os pesquisadores australianos Marshall e Warren conseguiram isolar bacilos gram negativos espiralados da mucosa gástrica, e comprovaram ser patogênicos e causas de gastrites, e posteriormente descoberta sua associação com câncer gástrico. Originalmente foi denominado GCLO (Gastric Campilobacter Like Organism) e posteriormente, recebeu nomes de Campylobacter pyloridis, C. pyloricus, C. pylori, e em 1989, o nome definitivo de Helicobacter pylori.
PATOGENIA
Habitualmente não é invasiva, permanecendo na superfície da mucosa gástrica. Uma pequena proporção de bactérias adere ao epitélio da mucosa gástrica e libera substâncias que provocam alterações no epitélio e reações imunológicas com resposta inflamatória. A forma espiralada e os flagelos a tornam móvel no ambiente mucoso e sua capacidade de produção de urease a protege contra o ácido por catalisar a hidrólise de uréia em amônia, produzindo um meio alcalino em sua proximidade.
EPIDEMIOLOGIA
A prevalência de infecção por H. pylori correlaciona-se com o status socioeconômico e de condições sanitárias da população, sendo maior nos países ou comunidades em desenvolvimento.
Em países desenvolvidos, como nos EUA e Europa, a prevalência da infecção em indivíduos adultos situa-se em torno de 30%. Por outro lado, a prevalência da infecção em países em desenvolvimento, como no Brasil situa-se acima de 50%.
Estudo realizado no HC-FMUSP em pacientes submetidos a exame endoscópico no ano de 2005 demonstrou positividade para H. pylori em 53 % dos casos pesquisados. Há uma tendência de queda na prevalência decorrente de melhorias nas condições sanitárias e de tratamentos para erradicação da infecção.
DIAGNÓSTICO HELICOBACTER PYLORI
O diagnóstico da infecção por H. pylori pode ser feito por meio de testes invasivos, obtidos por biópsias gástricas e não invasivos, sem a necessidade de biópsias.
TESTES INVASIVOS HELICOBACTER PYLORI
1. Exame endoscópico
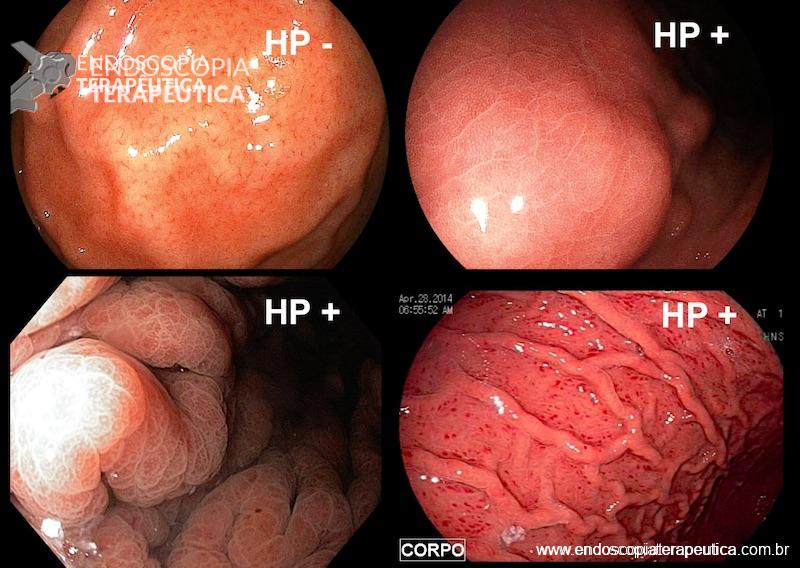
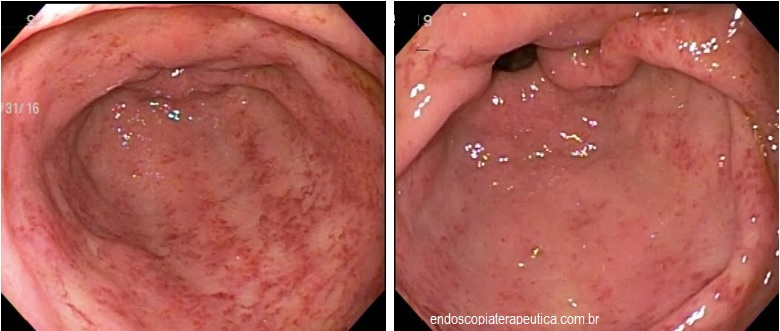
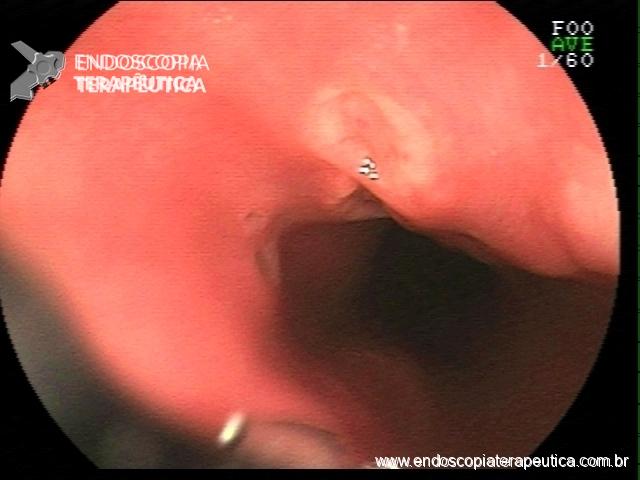
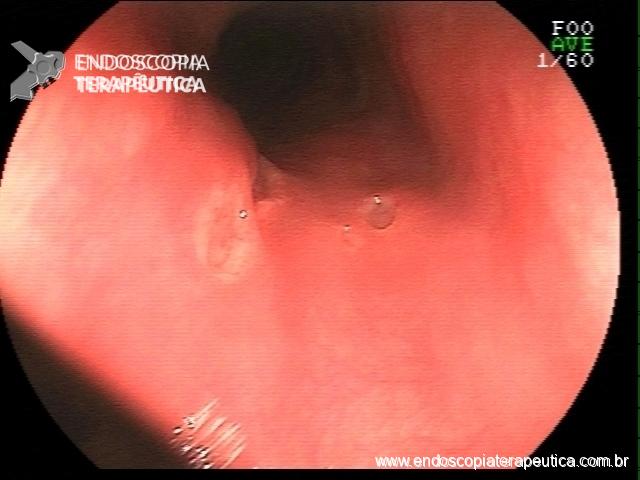
Por meio do exame endoscópico é possível prever a presença de infecção, especialmente com os avanços tecnológicos nos novos aparelhos com alta definição, filtros de luz e magnificação de imagens.
No corpo a presença de enantema e exsudato aumenta a probabilidade de infecção e no antro a nodularidade de mucosa tem correlação com infecção por H. pylori em mais que 90% dos casos.
Imagens obtidas por magnificação associadas a filtros de luz de banda estreita, como NBI (Narrow Band Imaging, Olympus Co.) e BLI (Blue Laser Imaging, Fujinom Co.) avaliam alterações da superfície epitelial e de microvasos provocados pela infecção, corroborando para diagnóstico da infecção com taxas de sensibilidade em torno de 90% e especificidade de 80-85%. No corpo gástrico há alteração da superfície epitelial em forma em favo de mel além de alterações nas vênulas coletoras.
A infecção também pode ser comprovada por equipamentos de elevada magnificação, como endomicroscopia confocal a laser (Cellvizio) e endocitoscopia.
2. Teste de urease
Dos métodos invasivos, o teste de urease é o mais simples e de boa acurácia. Nesse método, fragmentos da mucosa gástrica são colocados em um meio contendo uréia e um indicador de pH, em meio ácido. A presença de urease do H. pylori provoca hidrólise da uréia em amônia, que aumenta o pH da solução e modifica a cor da solução.
O teste de urease realizado com apenas um fragmento de mucosa antral em pacientes sem qualquer tratamento medicamentoso, apresenta sensibilidade de 90% a 95% e especificidade de 98%.
Estudos comparando a sensibilidade desse método entre grupos de pacientes recebendo diferentes tipos de medicações inibidoras de secreção gástrica mostraram que um fragmento de biópsia antral apresenta sensibilidade superior a 90% em pacientes sem tratamento, 70% em pacientes com uso de bloqueadores de receptores H2, e em torno de 60% em pacientes em uso de inibidores de bomba de prótons. Neste caso, a adição de um fragmento de mucosa de corpo aumenta significativamente a positividade do teste para em torno de 70-80%.
3. Estudo anatomopatológico
O exame histológico das amostras de biópsias gástricas fornece outras informações além da comprovação de infecção, incluindo grau e padrão de inflamação, atrofia, metaplasia intestinal e displasia do epitélio gástrico.
Esse exame apresenta sensibilidade e especificidade para diagnóstico da infecção por H. pylori em torno de 98% quando dois fragmentos de biópsia são avaliados.
Como no teste de urease, a sensibilidade reduz significativamente com o uso de medicamentos inibidores da secreção gástrica, em especial quando os sítios das biópsias são da região antral, pois além da redução na densidade bacteriana, pode ocorrer mudança da forma curva para cocóide. Em pacientes com uso de IBP a sensibilidade reduz de forma significativa, em torno de 60% e deve-se realizar biópsias de segmentos gástricos mais proximais (corpo e fundo). O emprego de técnicas especiais de coloração como Giemsa e prata ou ainda, a utilização de imuno-histoquímica aumentam a sensibilidade do teste.
4. Cultura
A cultura para H. pylori de fragmentos de biópsias gástricas é dispendiosa, demorada, e recomendada, principalmente, nos casos em que a sensibilidade aos antimicrobianos deve ser determinada. Tem sensibilidade baixa, em torno de 60%, mas com especificidade de 100%. Os meios de cultura com melhores resultados são os que utilizam ágar sangue e ambiente microaerófico, com 5% oxigênio e 5-10% de gás carbônico.
5. PCR
A técnica de biologia molecular por PCR (Reação em Cadeia da Polimerase) é outro método invasivo que permite analisar a informação genética da H. pylori e informações sobre fatores de patogenicidade, como a genotipagem do gene vacA, com alelos nas porções s (sinal) que codifica o sinal peptídico com 2 alelos, s1 (s1a, s1b, s1c) e s2, porção i (intermediária) e m (média), m1, m2.
A região de maior importância é a ilha de patogenicidade de cag-A (cag-PAI), um locus de 31 genes, dos quais o principal é o gene cag-A, responsável pela síntese da citotoxina CagA. Ao ser secretada esta citotoxima é injetada dentro das céulas epiteliais do hospedeiro e provocam alterações que geram alterações celulares em microfilamentos, adesão celular, junções celulares, porosidade e respostas inflamatórias, que associam-se a formas mais intensas de gastrite, maiores riscos de atrofia, metaplasia intestinal e câncer gástrico.
Apesar de caro, pode-se estudar resistência a antibióticos relacionados a alterações nos genes por PCR, como à claritromicina (A2143G, gene 23S rRNA), levofloxacino (C261A/G, gene gyrA) e furazolidona (C347A/T/G, gene porD).
TESTES NÃO INVASIVOS HELICOBACTER PYLORI
1. Sorologia
Dos principais métodos diagnósticos não invasivos, os sorológicos são os mais simples, por meio da determinação dos níveis séricos de IgG específica. Apresenta sensibilidade de aproximadamente 90-95% e especificidade de 85% a 95%. Não sofrem alterações por uso de antisecretores gástricos e podem ser úteis em pacientes com estágios avançados de atrofia e metaplasia intestinal, nos quais os demais testes apresentam baixa sensibilidade. No entanto, deixam cicatriz sorológica, permanendo positivos em um grande intervalo de tempo naqueles pacientes que foram erradicados da infecção, não servindo como controle de cura.
2. Teste respiratório
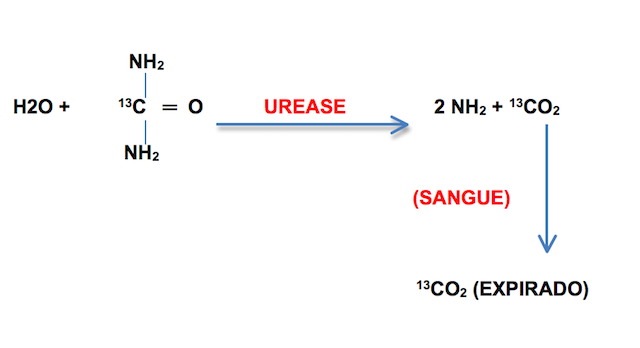
Outro método relevante é o teste respiratório, no qual o paciente ingere uma cápsula contendo 50mg de uréia marcada com C13 (não radioativo) ou C14 (radioativo, pouco usado). Na presença de urease bacteriana a uréia é hidrolisada e o carbono dióxido proveniente desta molécula (com C13 ou C14) é detectado nas amostras expiratórias. Os testes respiratórios são altamente sensíveis (95%) e específicos (98%) para diagnóstico da infecção por H. pylori, mas assim como nos métodos invasivos, os medicamentos antisecretores e antibióticos devem ser suspensos pelo menos duas semanas antes da realização do exame para evitar falso negativo.
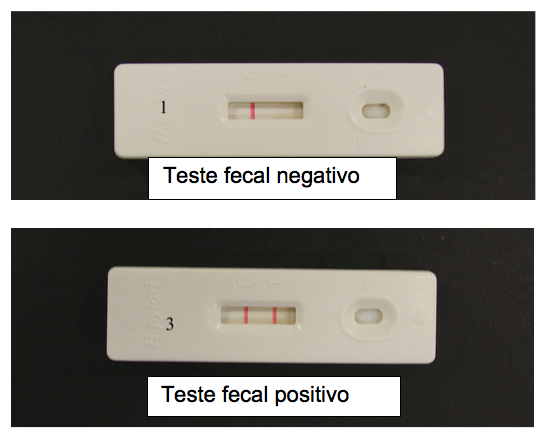
3. Teste de antígeno fecal
O teste de antígeno fecal é elaborado com anticorpos monoclonais (mais sensíveis) ou policlonais que se ligam a antígenos da bactéria H. pylori presente nas fezes. Estudos demonstram sensibilidade em torno de 94% e especificidade de 97%, e são usados principalmente em crianças por serem menos invasivos e ultimamente é o principal método não invasivo para controle de cura da infecção. Também tem a sensibilidade reduzida com uso de antisecretores gástricos.
O gráfico abaixo compara a sensibilidade dos diferentes métodos diagnósticos:
- Em azul = sem uso de IBP
- Em vermelho = com o uso de IBP
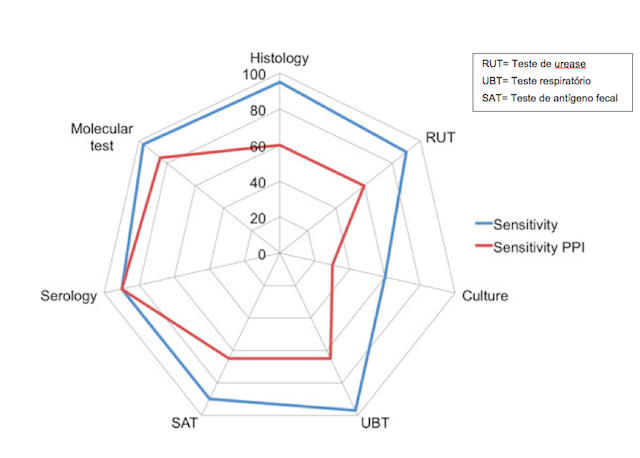
Calvet X. Diagnosis of Helicobacter pylori infection in the proton pump inhibitor era. Gastroenterol Clin N Am 44 (2015) 507–518.
Veja mais sobre o tema no fórum de discussão:
https://endoscopiaterapeutica.net/pt/foruns/topico/gastrite-cronica-h-pylori/
Bibliografia
- Malfertheiner P, Megraud F, O’Morain CA. et al. Management of Helicobacter pylori infectiondthe Maastricht IV/ Florence Consensus Report. Gut 2012; 61:646-664.
- Marques SB, Mattar R, Artifon ELA, Sakai P, Carrilho FJ. High prevalence of duodenal ulcer in a tertiary care hospital in the city of São Paulo, SP, Brazil. Arquivos de Gastroenterologia (Impresso) , v. 48, p. 171-174, 2011.
- Tonkic A, Tonkic M, Lehours P. et al. Epidemiology and Diagnosis of Helicobacter pylori Helicobacter 2012; 17(suppl 1): 1-8.
- Mattar R, Marques SB, Monteiro MS, Santos AF, Iriya K, Carrilho FJ. Helicobacter pylori cag pathogenicity island genes: clinical relevance for peptic ulcer disease development in Brazil. Journal of Medical Microbiology , v. 56, p. 9-14, 2007.
- Calvet X. Diagnosis of Helicobacter pylori infection in the proton pump nhibitor era. Gastroenterol Clin N Am 2015; 44: 507–518.