Artigo comentado pelo autor: Peroral endoscopic pyloromyotomy for gastroparesis: a sistematic review and meta-analysis
Neste artigo, foi realizada uma revisão sistemática e metanalise sobre a eficácia do GPOEM em pacientes com gastroparesia.
A gastroparesia é uma doença crônica incapacitante, com fisiopatologia complexa, caracterizada por sintomas como náusea, vômito, saciedade precoce e dor abdominal.
As principais causas são idiopática, decorrente do diabetes mellitus ou pós-cirúrgica.
O diagnóstico é obtido através da suspeição clínica e exames demonstrando atraso do esvaziamento gástrico na cintilografia de 4h (GES) e endoscopia digestiva alta sem sinais de obstrução mecânica.
O tratamento de primeira linha inclui modificação da dieta (com baixo teor de gordura e pobre em fibras) e medicamentos como agentes antieméticos e procinéticos. Entretanto, a terapia medicamentosa deixa de fazer efeito em algum momento ou o seu uso precisa ser suspenso devido seus efeitos adversos. Além disso, a progressão da própria doença, faz opções terapêuticas se tornam necessárias.
Sabe-se que a disfunção pilórica pode desempenhar um papel na fisiopatologia da gastroparesia e portanto, algumas técnicas tem sido sugeridas com o objetivo de interromper a função da barreira pilórica e facilitar o esvaziamento gástrico. Injeções de botox, dilatação endoscópica com balão, piloroplastia, piloromiotomia (cirúrgica e endoscópica – G-POEM) e colocação de stent transpilórico têm sido empregadas com sucessos variados. O uso de toxina botulínica é controverso e não demonstrou benefício em estudos randomizados, não sendo, portanto, mais recomendado pelo American College of Gastroenterology.
Embora pareça haver um papel para a estimulação gástrica e a piloroplastia laparoscópica, ambas são técnicas invasivas com altas taxas de complicações e recorrência dos sintomas, fazendo da piloromiotomia endoscópica (G-POEM) uma técnica cada vez mais promissora e cada vez mais realizada em todo o mundo.
Métodos: Revisão sistemática e metanálise de estudos que analisaram o índice de sintomas cardinais da gastroparesia (GCSI) e a cintilografia de esvaziamento gástrico em fase sólida (GES) de 4 horas, antes e após o G-POEM, para verificar a sua eficácia, desde o início da sua descrição até janeiro 2019.
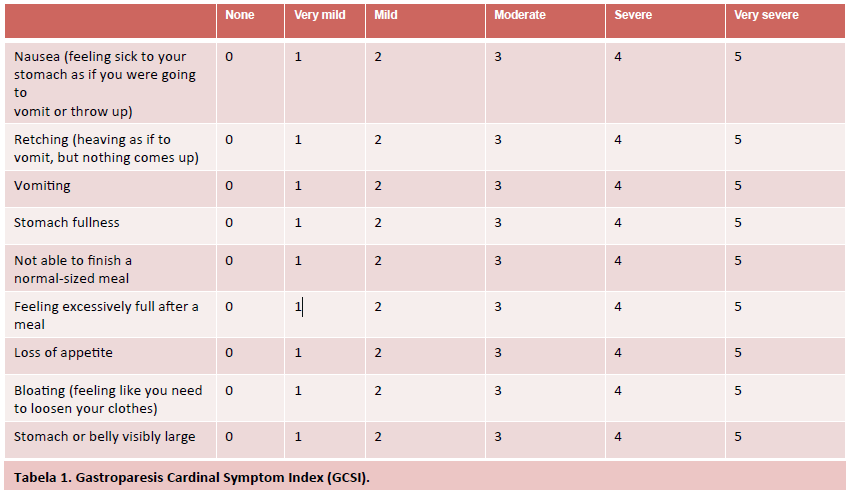
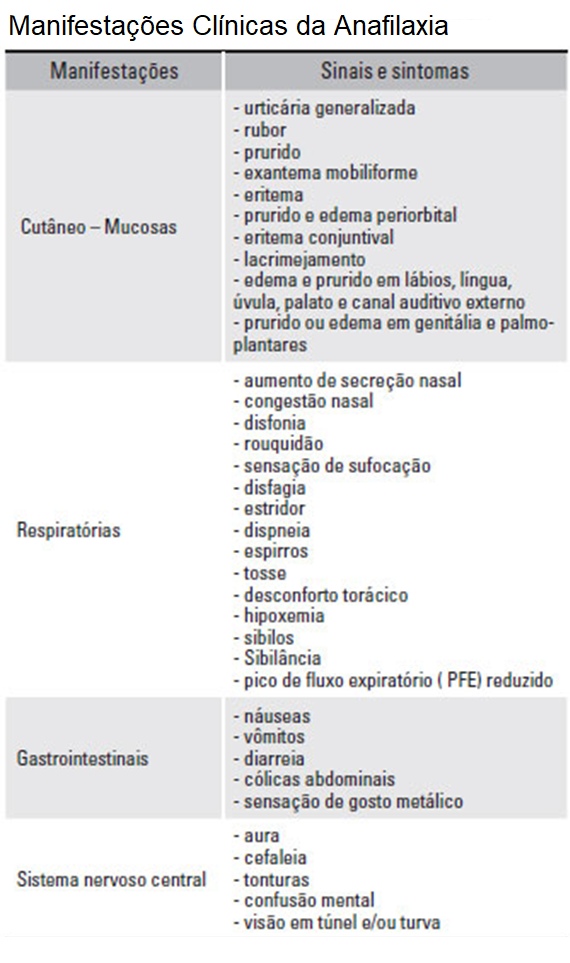
Segue uma tabela para melhor entendermos as pontuações GCSI que são calculadas usando uma escala Likert de 6 pontos e relatadas como subescores médios para as respostas dos pacientes à 9 perguntas que envolvem 3 principais grupos de sintomas: inchaço (2 perguntas), náusea/vômito (3 perguntas) e plenitude pós prandial (4 perguntas).
Resultados: Dez estudos com 281 pacientes foram incluídos nesta revisão sistemática. – A diferença média do GCSI após o procedimento foi de 1,76 (IC 95%: [1,43, 2,08], I2 = 72%)
– Análise do subgrupo do GCSI pelo tempo de acompanhamento (3, 6, 12 e 18 meses), mostrou uma diferença média de 1,84 (IC 95%: [1,57, 2,12], I2 = 71%).
– A diferença média do GES após o procedimento foi de 26,28 (IC95%: [19,74, 32,83], I2 = 87%), correspondendo a uma queda significativa nos valores percentuais da cintilografia de retenção gástrica em quatro horas.
Discussão:
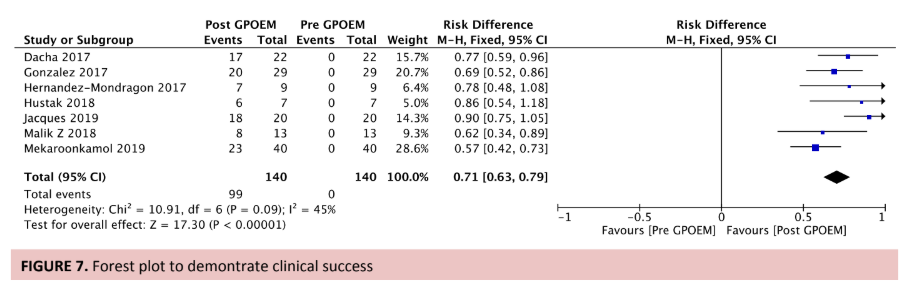
A taxa de sucesso clínico entre os trabalhos avaliados variou de 69% a 90%. Essa metanálise demonstrou melhora significativa dos sintomas, produzindo uma diferença média de sucesso clínico de 0,71 (IC 95%, [0,63, 0,79] I2 = 45%), conforme figura abaixo.
Apenas um estudo foi encontrado na literatura que comparava G-POEM com a piloroplastia laparoscópica (LP) e ambas as técnicas obtiveram melhora significativa nos índices GES e GCSI, sem diferenças desses resultados entre as intervenções. No entanto, o G-POEM parece ser superior à LP porque demonstrou menos morbidade perioperatória, incluindo tempo operatório, perda estimada de sangue e menor tempo de internação.
Quatro dos dez estudos analisaram as subclassificações do GCSI. Dois desses estudos mostraram melhora significativa em todas as subclassificações do GCSI (náusea/vômito, saciedade precoce e inchaço) aos 3 meses, enquanto a melhora sustentada até 12 meses, foi relatada em apenas no grupo de sintomas referentes à náusea/vômito e em um único estudo.
Diabetes e o sexo feminino foram associados a uma resposta ruim e falha terapêutica, enquanto as etiologias idiopática e pós-operatórias foram preditivas de sucesso.
A sonda de imagem luminal funcional endoscópica (Endo-FLIP) é um sistema que pode avaliar a disfunção pilórica em pacientes com gastroparesia. Foi utilizado em dois estudos, e observado que essa tecnologia pode desempenhar um papel quando realizada antes do G-POEM para definir quem se beneficiaria da intervenção pilórica, mas são necessários mais estudos para validar o seu uso.
Todos os estudos, exceto um, mostraram uma redução significativa do GCSI após o G-POEM. Isso se deve, provavelmente, ao fato dos valores basais do GCSI terem sido mais baixos nesse estudo. Pode-se observar, também, que pacientes com um GSCI inicial mais baixo e com sintomas menos graves apresentaram uma melhor resposta, sugerindo que a piloromiotomia deva ser realizada mais cedo no curso da doença para alcançar melhores resultados.
A melhora na cintilografia de 4h (GES) após o G-POEM foi significativa mas variável entre os estudos, e a sua normalização foi alcançada entre 70% e 100% dos casos. No entanto, o esvaziamento gástrico normal não parece ser necessário para se obter uma boa resposta clínica.
A cintilografia (GES), juntamente com o escore GSCI, foram os únicos dois parâmetros para medir o sucesso clínico na maioria dos estudos. Ainda não há consenso sobre como definir o sucesso terapêutico do tratamento da gastroparesia, foi proposto por um dos estudos que pacientes a serem submetidos ao G-POEM deveriam ter um GCSI basal de pelo menos 2.0 e uma taxa de retenção gástrica GES maior que 20% em 4 horas.
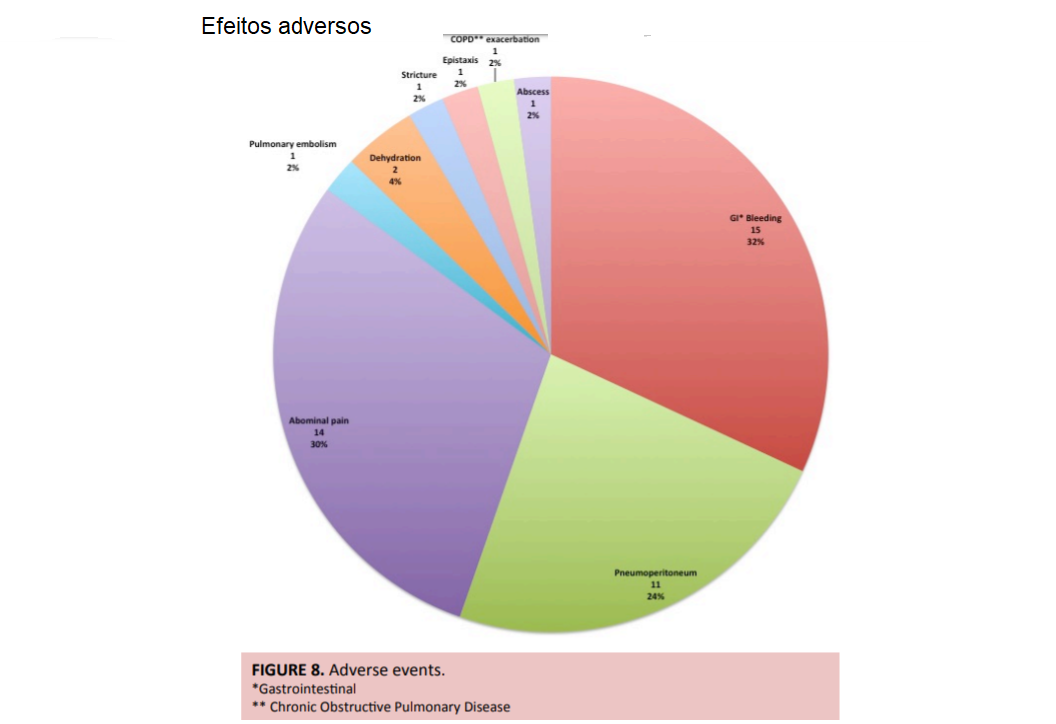
O sangramento gastrointestinal foi o evento adverso mais comum (32%), seguido de dor abdominal (30%) e pneumoperitônio (24%). Duas mortes foram relatadas, porém, relacionadas a eventos cardiovasculares. A figura abaixo se refere a todos os eventos adversos descritos.
Conclusão:
O G-POEM é eficaz, seguro, minimamente invasivo e mostra resultados promissores nos estudos. Esse procedimento deve estar no arsenal de opções de tratamento para gastroparesia refratária. Quando realizado por mãos experientes, mostra baixo risco de eventos adversos, contudo, estudos randomizados são necessários para prever quem responderá melhor a esse tratamento e estabelecer a eficácia a longo prazo dessa técnica.
Karime Lucas Uemura, Dalton Chaves, Wanderley M. Bernardo, Ricardo Sato Uemura, Diogo Turiani Hourneaux de Moura, Eduardo Guimarães Hourneaux de Moura. Peroral endoscopic pyloromyotomy for gastroparesis: a systematic review and meta-analysis. Endosc Int Open 2020; 08(07): E911-E923. DOI: 10.1055/a-1119-6616.