II Consenso Brasileiro de Ecoendoscopia
Sete anos após a publicação do I Consenso, a Sociedade Brasileira de Endoscopia Gastrointestinal (SOBED) encorajou a realização de um segundo encontro para reavaliar algumas das conclusões da 1ª edição e debater as indicações evolutivas da ecoendoscopia terapêutica.
O Núcleo de Ecoendoscopia da SOBED, coordenado pelo Prof. Dr. Fauze Maluf-Filho, reuniu-se com endoscopistas de todo o país durante o X Simpósio Internacional de Endoscopia Digestiva e no XV SBAD para formular o II Consenso Brasileiro de Ecoendoscopia, publicado na revista Endoscopic Ultrasound. Seguem abaixo as conclusões desse encontro:
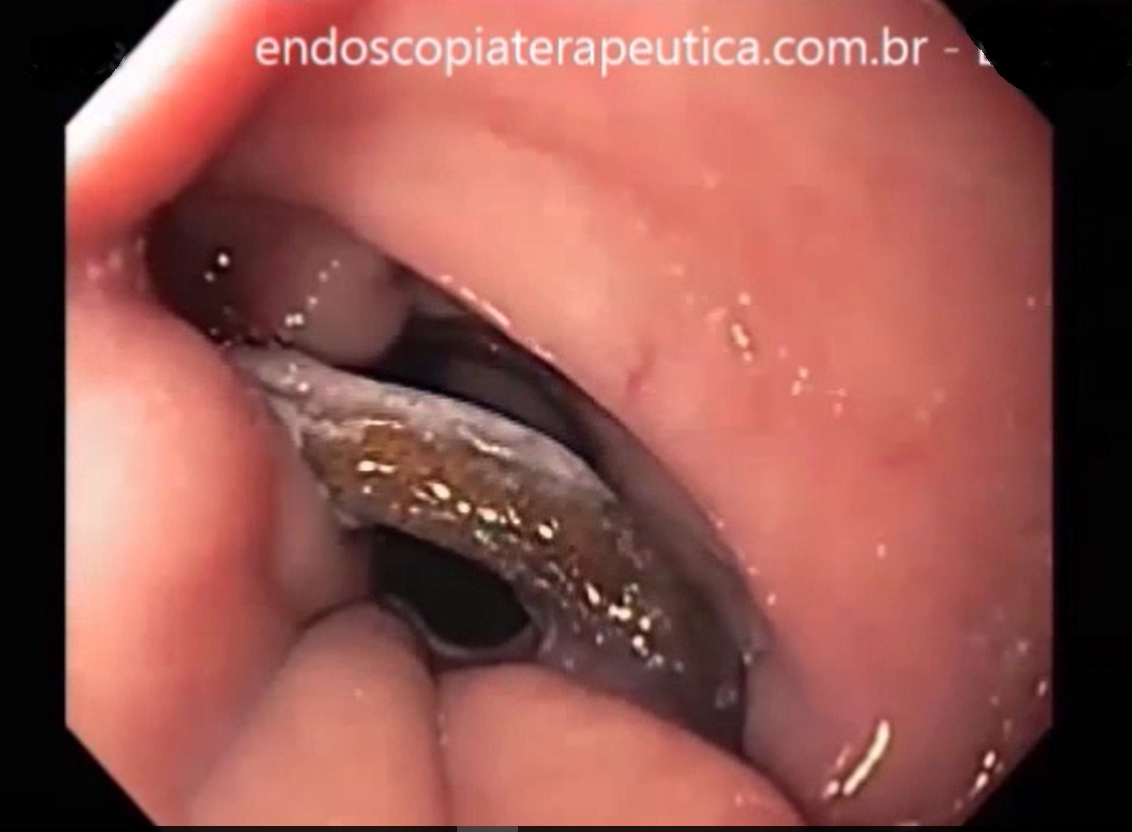
Ecoendoscopia no tratamento das varizes gástricas
A obliteração de varizes gástricas com uso do cianoacrilato é efetiva. Recomendação: B – 100% votos; Nível de evidência 2a
Ecoendoscopia (EUS) é útil na avaliação da erradicação das varizes gástricas em caso de dúvida. Recomendação: B – 100% votos; Nível de evidência 2a
O tratamento ecoendoscópico de varizes IGV 1 e GOV2 através da combinação de cianoacrilato e coil pode ser uma opção na falha do tratamento endoscópico convencional. Recomendação: C – 100% votos; Nível de evidência 3a
O tratamento ecoendoscópico das varizes de fundo gástrico apresenta eficácia semelhante ao tratamento convencional porém com menor taxa de complicações, especialmente embolia pulmonar (mesmo que assintomática). Recomendação: C – 100% votos; Nível de evidência 4
Ecoendoscopia no estadiamento de neoplasias pulmonares não pequenas células
É recomendada a punção ecoguiada (EUS-FNA e/ou EBUS-FNA) nos pacientes com aumento de linfonodos mediastinas visualizados no PET-TC ou TC. Recomendação: A – 100% votos; Nível de evidência 1a
A EUS-FNA e/ou EBUS-FNA é recomendadas nos pacientes sem linfonodomegalia mediastinal quando:
- tumor primário de localização central, ou
- tumor primário com baixa captação no PET-TC, ou
- presença de linfonodomegalia ipsilateral hilar (N1).
Recomendação: C e D – 100% votos; Nível de evidência 4 e 5
Complementação com estadiamento cirúrgico (mediastinoscopia ou outros métodos) é recomendado nos casos de punção ecoguiada não conclusiva. Recomendação: B – 100 % votos; Nível de evidência 2a
EUS-FNA e EBUS-FNA combinados é preferível à execução desses métodos individualmente. Recomendação: C – 100 % votos; Nível de evidência 4
Nos pacientes com suspeita de metástase na adrenal esquerda é sugerida a realização EUS-FNA para elucidação diagnóstica. Recomendação: C – 100 % votos; Nível de evidência 4
Nota: EBUS não é amplamente disponível em nosso país.
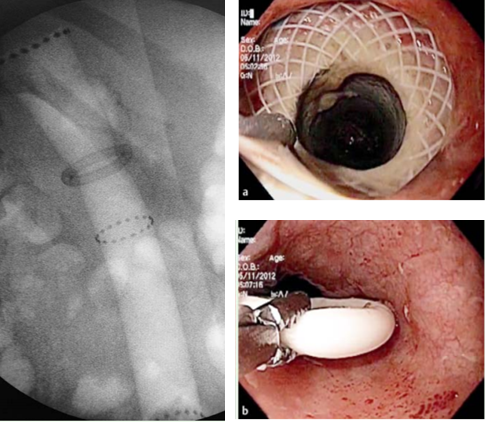
Drenagem biliar ecoguiada
Comparação da drenagem biliar ecoguiada (DBEC) vs transparietal (percuntânea) após falha da CPRE
O sucesso técnico e clínico são similares. Com relação aos eventos adversos apesar de diferentes, apresentam também taxas similares. A expertise local e disponibilidade devem ser levadas em conta na escolha entre as técnicas. Quando disponível a definição do acesso deve ser resultado de uma avaliação multidisciplinar. Recomendação: B – 85% votos; Nível de evidência: 2b
Acesso intra ou extra-hepático?
Na DBEC, seja pela técnica rendezvous ou transluminal, o acesso intra ou extra-hepáticos podem ser utilizados. Existem poucos estudos prospectivos comparando as duas técnicas. Evidencias atuais sugerem resultados similares porém com menores taxas de complicação no acesso extra-hepático. Recomendação: B – 95% votos; Nível de evidência: 2b
DBEC por rendezvous vs transluminal
Existem poucos estudos comparando as duas técnicas, porém eles sugerem resultados e segurança similares. Recomendação: B – 95% votos; Nível de evidência: 2b
Hepatogastrostomia vs Coledocoduodenostomia
Evidências atuais sugerem eficácias similares, porém menores taxas de complicações em favor da coledocoduodenostomia. Mais estudos de melhor nível de evidência são necessários. Recomendação: B – 100% votos; Nível de evidência: 2b
DBEC: Próteses plásticas vs metálicas
No estudo comparativo avaliado foram encontrados sucessos clínicos e técnicos similares apesar da maior taxa de fístula biliar com uso das plásticas. O grupo recomenda o uso de stents metálicos parcialmente ou totalmente recobertos. Recomendação: C – 100% votos; Nível de evidência: 4
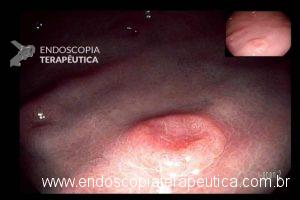
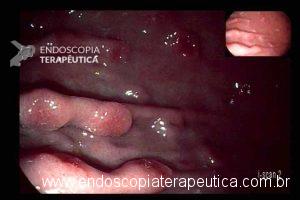
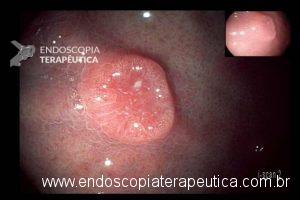
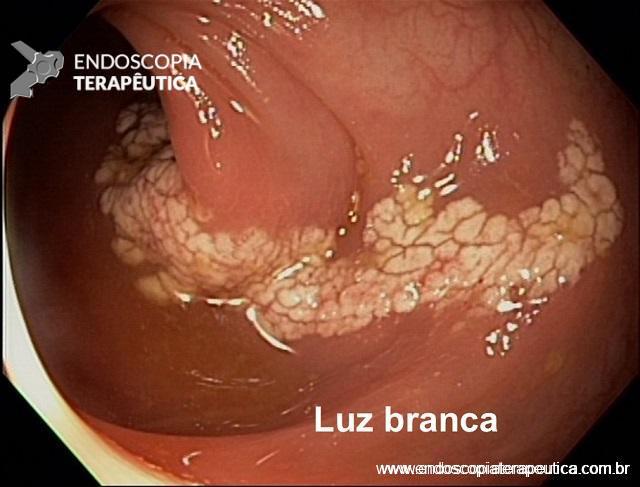
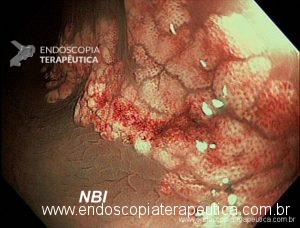
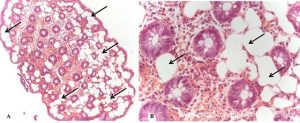
Lesões subepiteliais (LSE)
Quando a EUS-FNA é indicada nas LSE ?
É sugerida sua realização nas LSE da muscular própria do estômago, duodeno e reto maiores que 10 mm. LSE não puncionadas devem ser acompanhadas, porém não há consenso do intervalo. Recomendação: C – 95% votos; Nível de evidência: 4
O uso da elastografia e contraste de microbolhas são opções adicionais na seleção das LSE para punção. Recomendação: C – 100% votos; Nível de evidência: 4
Metade dos pacientes assintomáticos e sem indicação absoluta de punção se recusam a realizar o seguimento e dois terços recusam ressecção nos casos de aumento de dimensões da LSE. Esses fatos podem sugerir a realização de punção ecoguiada para definição precoce do diagnóstico. Recomendação: C – 95% votos; Nível de evidência: 4
LSE assintomáticas da muscular própria do esôfago e maiores que 3 cm devem ser puncionadas para diferenciar leiomiomas de outras lesões potencialmente malignas. Ausência de concordância – 40% votos; Nível de evidência: 4
Na suspeita das seguintes lesões, independentemente do tamanho da lesão, a confirmação histológica é necessária:
- GIST com indicação de terapia neoadjuvante;
- metástases intramurais;
- linfoma;
- tumores neuroendócrinos;
- neoplasias extrínsecas.
Recomendação: D – 100% votos; Nível de evidência: 5
Obtenção de material de LSE do trato digestivo: punção ecoguiada vs métodos alternativos.
Punção ecoguiada é o método mais seguro. Recomendação: A – 100% votos; Nível de evidência: 1b
O tipo de agulha ou calibre não altera a acurácia diagnóstica na punção de LSE. A escolha da agulha depende da localização e da preferência do endoscopista. Recomendação: B – 100% votos; Nível de evidência: 2b
Métodos alternativos como mucosectomia e “destelhamento” são melhores que a punção ecoguiada nas LSE menores que 20 mm. Na indisponibilidade da ecoendoscopia, estes podem ser utilizados apesar das significantes taxas de sangramento e perfuração. Recomendação: C – 95% votos; Nível de evidência: 4
Nas LSE acima da muscular própria e menores que 2 cm, onde a punção ecoguiada muitas vezes é insatisfatória, biópsia sobre biópsia, “destelhamento” ou ressecção endoscópica, seja por ligadura, mucosectomia ou ESD, são opções válidas. Recomendação: C – 100% votos; Nível de evidência: 4
Ressecções endoscópicas de LSE da muscular própria seja por ESD, tunelização ou ressecção transmural, ainda são técnicas sob avaliação e devem ser realizadas em centros de alta expertise. Recomendação: D – 95% votos; Nível de evidência: 5
Ecoendoscopia nas coleções fluidas peripancreáticas (CFP)
Ecoendoscopia na caracterização das CFP
Antes da indicação de drenagem, a ecoendoscopia pode ser usada no diagnóstico diferencial de cisto pancreático neoplásico e detecção de necrose. Recomendação: D – 100% votos; Nível de evidência: 5
Drenagem ecoguiada de pseudocistos pancreáticos: prótese plástica vs metálica
Taxas de resolução, eventos adversos e recorrências são similares: 85%, 20% e 10%, respectivamente. Recomendação: B – 100% votos; Nível de evidência: 3a
Drenagem ecoguiada de necrose pancreática delimitada (Walled-off Necrosis): prótese plástica vs metálica
Taxas de resolução, eventos adversos e recorrências são similares: 70-75%, 20% and 10%, respectivamente. Recomendação: B – 100% votos; Nível de evidência: 3a
Drenagem de CFP com próteses metálicas com aposição de lumens
Os resultados dessas próteses são promissores e podem melhorar os resultados obtidos. Recomendação: D – 100% votos; Nível de evidência: 5
Punção ecoguiada nas lesões sólidas pancreáticas
Quando indicar?
- Lesões ressecáveis: na suspeita de metástase, linfoma, tumor neuroendócrino ou pancreatite autoimune.
- Lesões irressecáveis: planejamento oncológico.
- Ressecabilidade duvidosa: complementação do estadiamento.
- Se o resultado da punção for negativo para neoplasia, mas a suspeita é alta, nova punção deverá ser realizada.
- Nos pacientes encaminhados para tratamento neoadjuvante.
Recomendação: B – 100% votos; Nível de evidência: 2a
Elastografia e contraste de microbolhas são métodos complementares que pretendem melhorar o valor preditivo negativo, melhorando o diagnóstico diferencial e guiando o melhor local para punção. Estes métodos não substituem a punção. Recomendação: B – 100% votos; Nível de evidência: 2b
Técnicas de punção ecoguiada para lesões sólidas pancreáticas
Os resultados na literatura são conflitantes na comparação dos diâmetros das agulhas. Recomendação: B – 100% votos; Nível de evidência: 2b
A agulha de 25 gauge parece ter uma vantagem diagnóstica nas punções transduodenais. Recomendação: B – 100% votos; Nível de evidência: 2b
Punções transduodenais não devem ser realizadas com agulha não flexível de 19 gauge devido às dificuldades técnicas. Recomendação: B – 100% votos; Nível de evidência: 2b
Não existem evidências disponíveis na literatura demonstrando superioridade entre as técnicas de aspiração, uso ou não do estilete e tração lenta (slow pull). Recomendação: B – 100% votos; Nível de evidência: 2b
A técnica fanning parece reduzir o número de punções para o diagnóstico definitivo. Recomendação: B – 100% votos; Nível de evidência: 2b
Neurólise do plexo celíaco
Injeção unilateral vs bilateral
Eficácias semelhantes. Recomendação: B – 100% votos; Nível de evidência: 1b
Neurólise do plexo celíaco vs neurólise do gânglio celíaco
Em pacientes com gânglio visível, sua neurólise parece obter um maior alívio da dor, sendo preferível utilizar esta técnica. Recomendação: B – 100% votos; Nível de evidência: 1b
Ecoendoscopia na avaliação de cistos pancreáticos incidentais
Quando é indicada?
Na avaliação dos cistos pancreáticos incidentais identificados e caracterizados preferencialmente por ressonância magnética, cujo resultado é um cisto pancreático de morfologia indeterminada. Recomendação: C – 100% votos; Nível de evidência: 4
Quando realizar a punção dos cistos pancreáticos incidentais?
Nos cistos de morfologia indeterminada:
– maiores 15mm;
– suspeita de nódulo ou vegetação;
– irregularidade ou espessamento da parede do cisto;
– mudança abrupta do calibre do ducto pancreático próximo ao cisto;
– ducto pancreático principal medindo entre 5 e 9mm
Recomendação: C – 100% votos; Nível de evidência: 4
Notas:
- a punção não é indicada quando a morfologia do cisto é característica de um cistadenoma seroso, independentemente de seu tamanho;
- o risco-benefício da punção deve ser ponderado em relação à presença de vasos, ducto pancreático principal ou mais de 10 mm de parênquima normal entre a agulha e a lesão
- a profilaxia antibiótica está indicada;
- o material aspirado deve ser enviado para dosagem de CEA, amilase, glicose e para citopatologia, dando preferência ao CEA;
- no futuro, a avaliação molecular do material aspirado estará disponível e provavelmente será útil para estratificação de risco de malignidade.
Link para o artigo original: http://www.eusjournal.com/article.asp?issn=2303-9027;year=2017;volume=6;issue=6;spage=359;epage=368;aulast=Maluf-Filho
Referência:
Maluf-Filho F, de Oliveira JF, Mendonça EQ, Carbonari A, Maciente BA, Salomão BC, Medrado BF, Dotti CM, Lopes CV, Braga CU, M Dutra DA, Retes F, Nakao F, de Sousa GB, de Paulo GA, Ardengh JC, Dos Santos JB, Sampaio LM, Okawa L, Rossini L, de Brito Cardoso MC, Ribeiro Camunha MA, Clarêncio M, Lera Dos Santos ME, Franco M, Schneider NC, Mascarenhas R, Roda R, Matuguma S, Guaraldi S, Figueiredo V. II Brazilian consensus statement on endoscopic ultrasonography. Endosc Ultrasound. 2017 Nov-Dec;6(6):359-368. doi: 10.4103/eus.eus_32_17. PubMed PMID: 29251269; PubMed Central PMCID: PMC5752757.