A Doença do Refluxo Gastroesofágico (DRGE) é de enorme importância na rotina do gastroenterologista e do endoscopista. Com uma prevalência de aproximadamente 31% da população (1), de acordo com recentes dados norte-americanos, ela é um dos principais motivos de consulta ao gastroenterologista. Destaca-se, ainda, que os portadores desta condição têm importante impacto em sua qualidade de vida, conforme estudos realizados em diferentes partes do mundo (2,3).
Notável também é o volume de recursos envolvidos na abordagem da DRGE. Estima-se que, só nos EUA, o gasto anual com a doença seja da ordem de 9 a 10 bilhões de dólares anuais (4), considerando-se exames diagnósticos e uso de medicamentos, particularmente os inibidores da bomba de prótons (IBP´s).
Estas drogas são as mais utilizadas no tratamento da doença, com ótimos resultados na maioria dos casos, porém as recentes preocupações com potenciais efeitos adversos com seu uso prolongado (5), amplamente divulgada pela mídia e já objeto de um outro post aqui no Endoscopia Terapêutica (clique nesse link para acessar), reforçam a necessidade de um diagnóstico mais preciso da DRGE, evitando-se, assim, uso desnecessário de medicamentos.
Neste contexto, uma publicação científica muito relevante é o Consenso de Lyon (6), que aborda o uso dos exames no moderno diagnóstico da DRGE.
O Consenso dá grande importância à manometria de alta resolução (MAR), com mais de 3 das 9 páginas da publicação referindo-se a ela.
Mas, devemos solicitar de rotina a manometria para pacientes com DRGE?
Em primeiro lugar, precisamos ressaltar os avanços representados pela nova tecnologia, a alta resolução, em comparação com a manometria convencional:
- Ela conta com um número muito maior de sensores (24 a 30), em geral espaçados a cada 1 ou 2 cm, em comparação com a tecnologia anterior.
- Isto permite uma avaliação muito mais detalhada da motilidade esofágica, inclusive com a introdução de novos parâmetros (métricas), que já são amplamente utilizados na literatura médica mundial.
- Destaca-se, ainda, uma interface gráfica mais amigável, com maior facilidade de aprendizado, maior acurácia diagnóstica para os distúrbios da motilidade esofágica e maior concordância inter-observadores (7).
- A única desvantagem potencial seria o custo mais elevado. Apesar disto, a alta resolução é tecnologia amplamente utilizada a nível mundial, suas métricas são as utilizadas nos mais recentes artigos publicados na literatura e, mesmo no Brasil, seu uso é crescente, contribuindo muito para isto a disponibilidade de equipamento de fabricação nacional, de ótima qualidade e com custo relativamente acessível.
Particularmente, na DRGE a MAR é fundamental para a localização do esfíncter esofágico inferior em pacientes que serão submetidos a pHmetria ou impedâncio-pHmetria, permitindo, assim, o adequado posicionamento dos sensores de pH. Ela possibilita também afastar diagnósticos alternativos, cujos sintomas podem se confundir com a DRGE, especialmente a acalasia.
Destaca-se ainda que a MAR permite a avaliação dos eventos essenciais na fisiopatologia da doença:
- Função de barreira da junção esôfago-gástrica (JEG)
- Peristalse do corpo esofágico.
1. FUNÇÃO DE BARREIRA DA JUNÇÃO ESÔFAGOGÁSTRICA
- Pressão da junção esofagogástrica (PR JEG) e integral de contratilidade da JEG (EGJ-CI): Estas são as duas métricas utilizadas para quantificar a função de barreira da JEG. A PR JEG é expressa em mmHg (8) e, mais recentemente, a integral de contratilidade da JEG (EGJ-CI), aferida em mmHg/cm (6) é considerada a medida mais promissora para avaliar a competência da junção, aferindo o seu vigor contrátil.
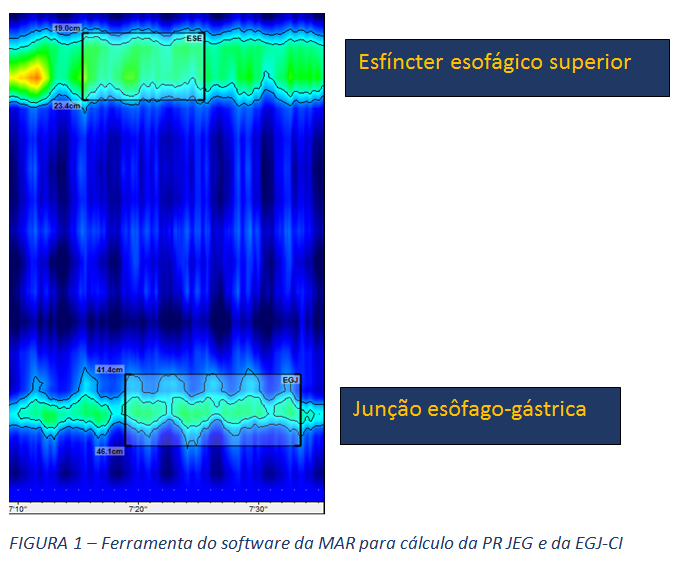
- Morfologia da JEG: A MAR permite, ainda, a avaliação da morfologia da JEG, através da análise da posição relativa do esfíncter esofágico inferior (EEI), propriamente dito, em relação à crura diafragmática. Assim, classifica-se esta morfologia em tipo I, quando o EEI e a crura estão em posição coincidente. Os tipos 2 e 3 representam ruptura anatômica da morfologia normal da JEG, como ocorre na hérnia hiatal, com separação entre os seus dois principais componentes, diferenciando-os a magnitude desta separação. O tipo 2 refere-se a uma separação menor que 3 cm, enquanto o tipo 3 descreve separação entre EEI e crura, maior ou igual a 3 cm.
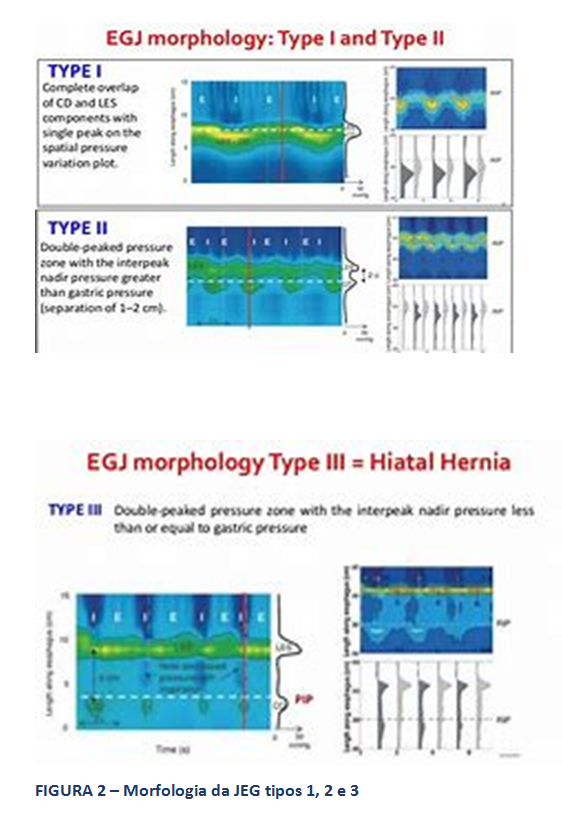
Type I: complete overlap of CD and LES components with single peak on the spatial pressure variation plot; Type II: double-peaked pressure zone with the interpeak nadir pressure grater than gastric pressure (separation of 1-2cm); Type III: double-peaked pressure zone with the interpeak nadir pressure less than or equal to gastric pressure
2. PERISTALSE DO CORPO ESOFÁGICO
A peristalse normal do corpo esofágico é mecanismo fundamental ao adequado clearance de qualquer material que possa ser refluído para o esôfago, representando importante mecanismo anti-refluxo. A principal métrica que avalia a peristalse na MAR é a integral de contratilidade distal do corpo esofágico, designada pela sigla DCI. Ela expressa o vigor da contração esofágica em sua zona pós transicional e é aferida em mmHg.s.cm. Contrações normais tem valor de DCI acima de 450 mmHg.s.cm. Valores entre 100 e 450 designam contrações classificadas como fracas. Já valores abaixo de 100 mmHg.s.cm classificam a contração como falha.
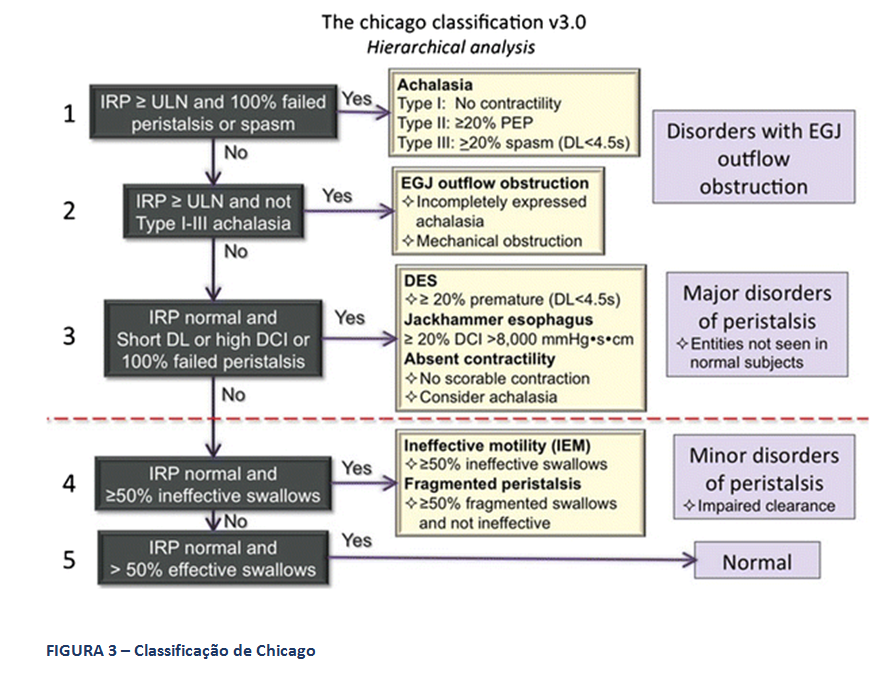
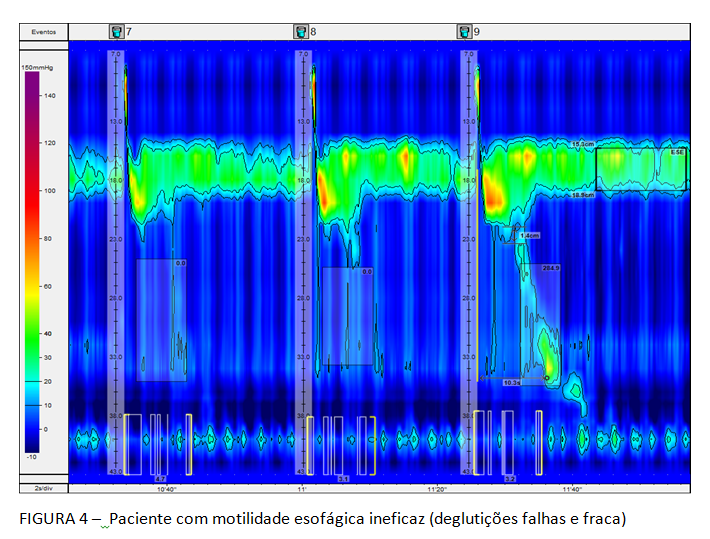
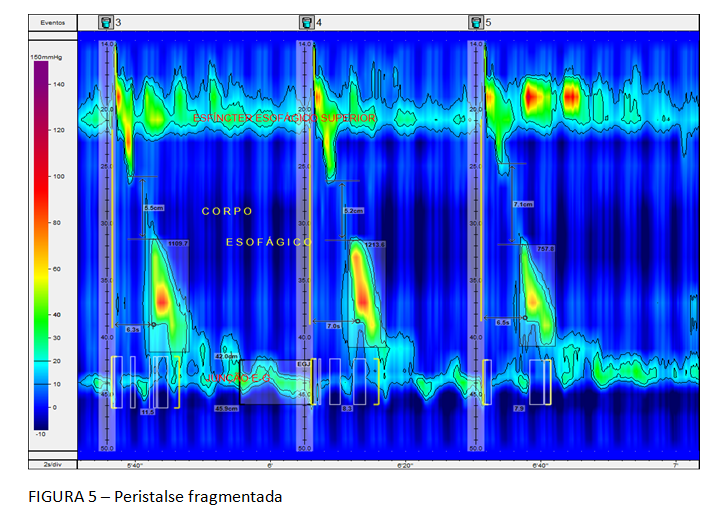
A Classificação hierarquizada de Chicago (figura 3), que rege a MAR, classifica como distúrbio maior da motilidade esofágica a ausência de peristalse, entre outros. Deve-se considerar a possibilidade de acalasia quando isto ocorre. Ela caracteriza, ainda, como distúrbio menor da peristalse, a motilidade esofágica ineficaz (MEI), quando se observa a presença de 50% ou mais de contrações falhas ou fracas, em qualquer proporção. Esta situação é frequente na DRGE (figura 4). Há na Classificação, também, a peristalse fragmentada, descrita quando ocorrem 50% ou mais de deglutições fragmentadas, com break maior que 5 cm (figura 5).
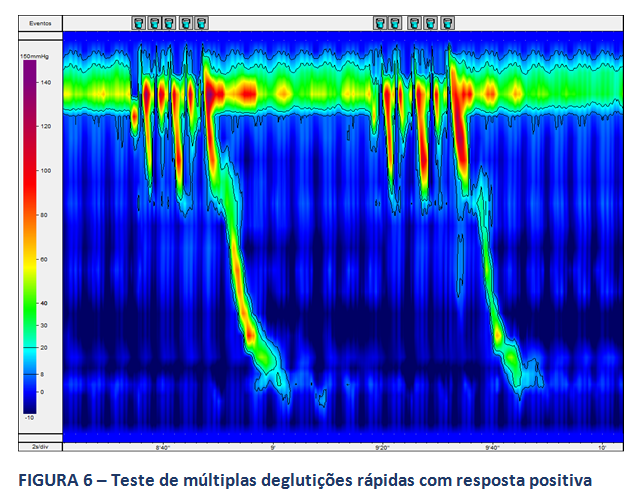
A MAR permite, ainda na avaliação da peristalse do corpo esofágico, a realização de testes provocativos, com o intuito de se avaliar a reserva peristáltica do corpo em pacientes com MEI ou peristalse ausente. O consenso de Lyon sugere a realização destes testes. Destaca-se, neste contexto, o teste de múltiplas deglutições rápidas (figuras 6 e 7), de mais fácil aplicação. A ausência de reserva peristáltica pode estar relacionada a maior incidência de disfagia no pós operatório em pacientes com DRGE (9).
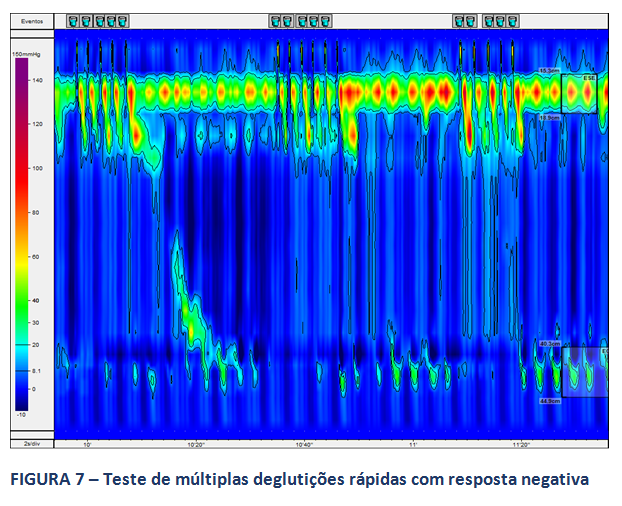
Considerando ainda a avaliação da disfagia no pós-operatório de cirurgia anti-refluxo, estudos mostram que um outro parâmetro da MAR, a integral de relaxamento da JEG (IRP), fundamental no diagnóstico da acalasia, apresenta-se mais elevado em pacientes operados que apresentam disfagia prolongada (10,11,12) e a sua avaliação pode auxiliar a discriminar pacientes que podem beneficiar-se da dilatação endoscópica com balão. No paciente operado, a presença de duas zonas de alta pressão separadas ao nível da JEG é forte preditor da recorrência do refluxo gastro-esofágico (12). Ainda, há relação inversa entre a integral de contratilidade do corpo distal (DCI) no pré-operatório e o risco de disfagia após a cirurgia (10), considerando-se risco mais elevado para valores médios de DCI abaixo de 1000 mmHg.s.cm.
Diversos estudos mostram que há forte associação entre refluxo ácido à pHmetria e alterações nos parâmetros da MAR, como redução da pressão da JEG, redução da EGJ-CI, alteração na morfologia da JEG (tipos 2 e 3) e motilidade esofágica ineficaz (MEI) ou peristalse fragmentada.
Na nossa casuística, que será apresentada no próximo DDW e publicada como abstract no Gastroenterology, comparando-se pacientes com refluxo bem estabelecido à pHmetria, de acordo com o Consenso de Lyon (exposição ácida esofágica > 6%, n= 156) com pacientes sem refluxo ácido (exposição ácida < 4%, n= 162), observamos diferença estatisticamente significativa entre os dois grupos em relação à pressão da JEG e EGJ-CI (p<0,001), morfologia alterada da JEG (p=0,003) e diagnóstico de MEI (p=0,008). A análise de regressão logística mostrou que a PR JEG foi o melhor preditor independente de refluxo patológico (OR=3.078, 95%CI=1,894-5.004; p<0.001). Assim, concluímos que as métricas da MAR utilizadas para a avaliação da função de barreira da JEG, bem como aquelas que avaliam a peristalse do corpo esofágico são úteis para diferenciar pacientes com refluxo patológico dos indivíduos com refluxo apenas fisiológico.
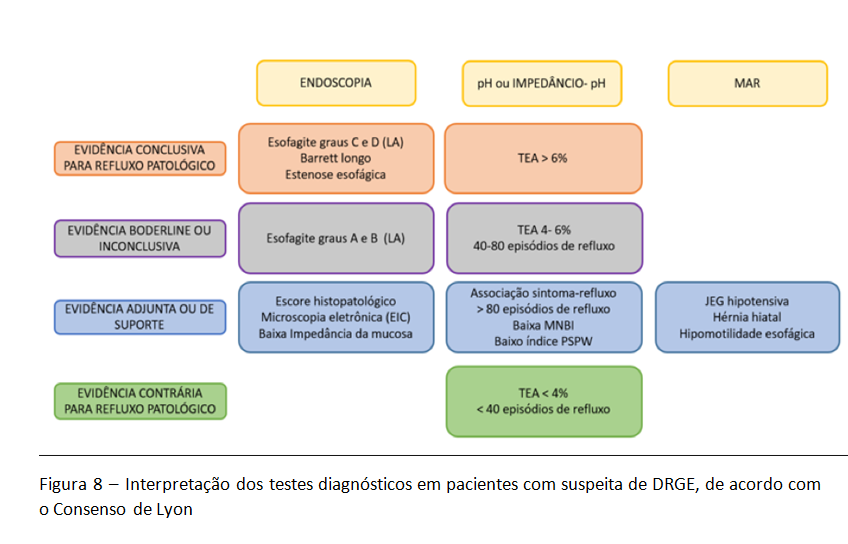
O consenso de Lyon estabelece um grupo de pacientes, classificado como indeterminado ou borderline para refluxo patológico. Utilizando-se os testes diagnósticos mais importantes, este grupo inclui pacientes com esofagite erosiva graus A e B na classificação de Los Angeles, além de pacientes com pHmetria indicando exposição esofágica ao ácido entre 4 e 6% do tempo (figura 8).
De acordo com o consenso, as alterações acima descritas na MAR podem ser usadas para ajudar na definição destes casos classificados como borderline. Os nossos dados reforçam o uso adjunto destas métricas neste grupo de pacientes.

Em conclusão, a MAR é ferramenta importante na avaliação da DRGE, embora ela não seja necessária em todos os pacientes. Ainda que ela não possibilite isoladamente o diagnóstico definitivo de refluxo ácido, ela permite excluir acalasia, auxiliar na adequação técnica da pHmetria, predizer risco aumentado de disfagia no pós operatório, avaliar sintomas no pós operatório e, também, auxiliar no diagnóstico de refluxo em pacientes classificados como borderline à pHmetria e/ou à endoscopia digestiva.
Referências:
- DELSHAD S D et al. Prevalence of Gastro-esophageal reflux disease and proton pump inhibitor refractory symptoms. Gastroenterology 2020; 158:1250–1261
- ELOUBEIDE M A, PROVENZALE D. Health-related quality of life and severity of symptoms in patients with Barrett’s esophagus and gastroesophageal reflux disease patients without Barrett’s esophagus. Am J gastroenterol 2000; 95(8):1881-7.
- MADISCH A et al. Impact of reflux disease on general and disease-related quality of life – evidence from a recent comparative methodological study in Germany. Z Gastorenterol 2003;41(12):1137-43
- SHAHEEN N J et al. The burden of gastrointestinal and liver diseases, 2006. Am J Gastroenterol 2006; 101:2128–38.
- VAEZI M. F. Complications of Proton Pump Inhibitor Therapy. Gastroenterology 2017; 153: 35–48
- GYAWALI CP et al – Modern diagnosis of GERD: The Lyon Consensus. Gut 2018; 67(7):1351-1362
- CARLSON D A et al – Diagnosis of esophageal motility disorders: esophageal pressure topographversus conventional line tracing. Am J Gastroenterol 2015; 110(7): 967-978
- JAIN M. Basal lower esophageal sphincter pressure in gastroesophageal reflux disease: Anignored metric in high–resolution esophageal manometry. Indian J Gastroenterol 2018; 37(5): 46-51
- STOIKES N et al. The value of multiple rapid swallows during preoperative esophageal manometry before laparoscopic antireflux surgery. Surg Endosc 2012; 26(12):3401-7.
- KAPADIA S et al. The role of preoperative high resolution manometry in predicting dysphagia after laparoscopic Nissen fundoplication. Surg Endosc. 2018; 32(5):2365-2372.
- MARJOUX S et al – Impaired postoperative EGJ relaxation as a determinant of post laparoscopic fundoplication dysphagia: a study with high–resolution manometry before and after surgery. Surg endosc 2012; 26(12):3642-9
- TATUM RP et al – High–resolution manometry in evaluation of factors responsible for fundoplication failure. Am Coll Surg. 2010; 210(5):611-7.
…………………………………………………………………………………………………….
Como citar esse artigo:
de Oliveira, RA. Devemos incluir a manometria esofágica de alta resolução na avaliação do paciente com doença do refluxo gastroesofágico? Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/devemos-incluir-manometria-esofagica-de-alta-resolucao-na-avaliacao-do-paciente-com-doenca-do-refluxo-gastro-esofagico/
Confira também: DRGE é fácil de ser diagnosticada?


 Medranda-Robles et al. Endoscopy. 2018 Nov;50(11):1059-1070.
Medranda-Robles et al. Endoscopy. 2018 Nov;50(11):1059-1070.