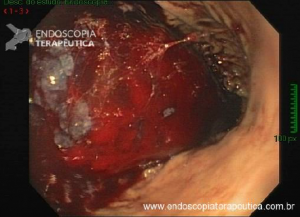
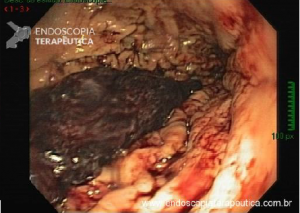
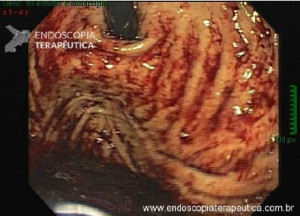
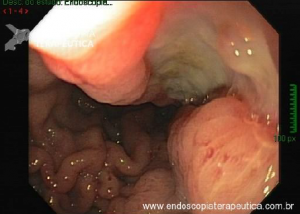
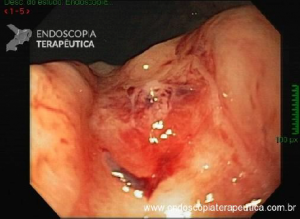
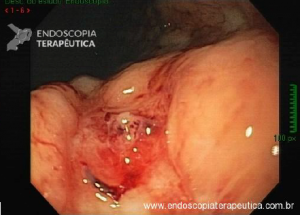
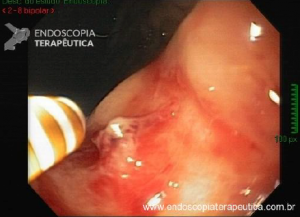
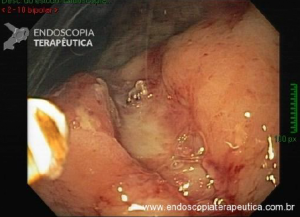
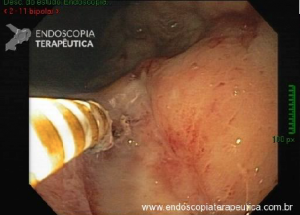
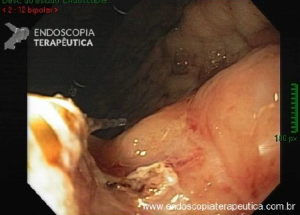
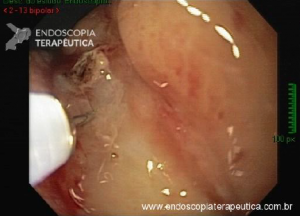
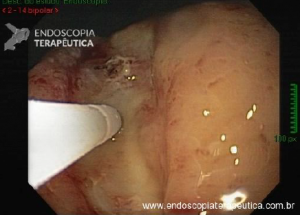
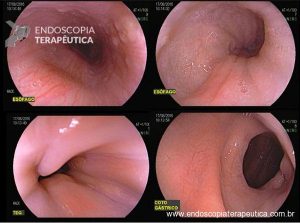
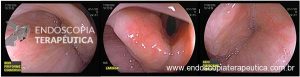
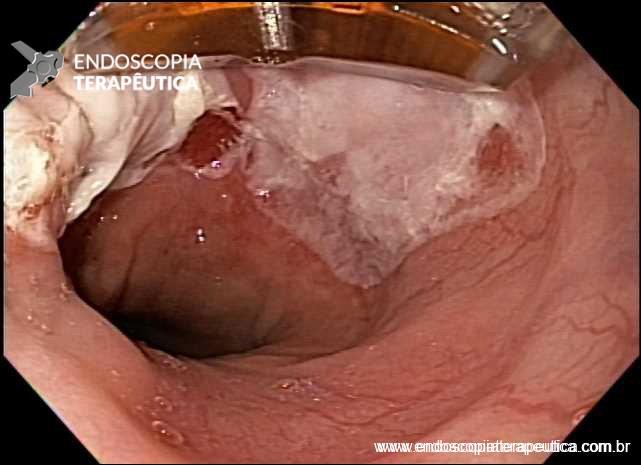
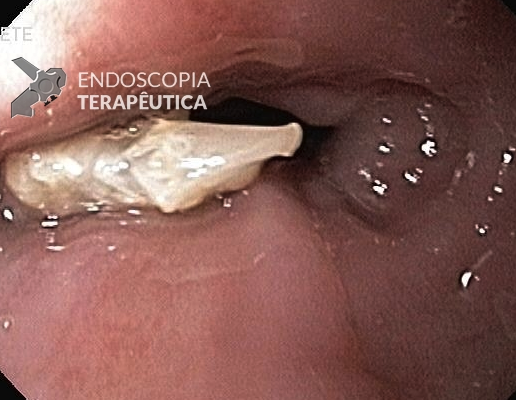
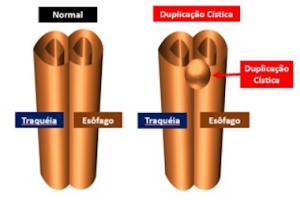
Esôfago de Barrett após gastrectomia vertical (Sleeve)
Artigo publicado na Gastrointestinal Endoscopy em fevereiro de 2021. Trata-se de uma revisão sistemática e metanálise sobre esôfago de Barrett após gastrectomia vertical (Sleeve).
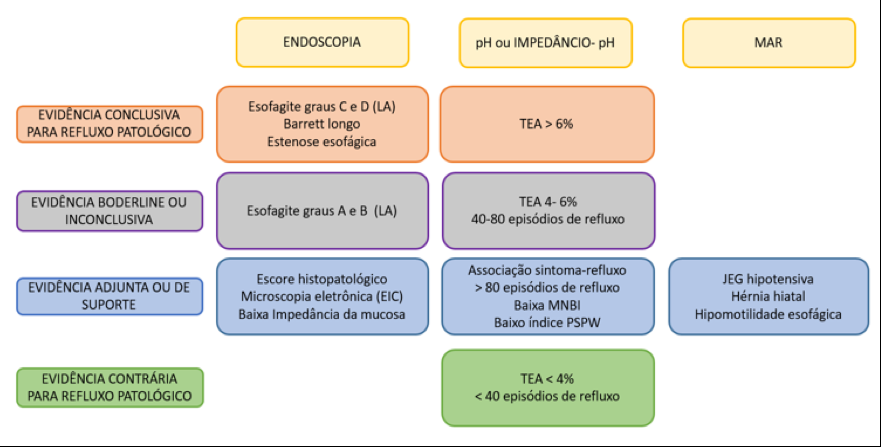
A Doença do Refluxo Gastroesofágico (DRGE) é uma das grandes preocupações em pacientes submetidos ao Sleeve. E a DRGE é o maior fator de risco para o esôfago de Barrett, que é sabidamente um precursor do adenocarcinoma de esôfago.
A prevalência de DRGE e hérnia de hiato é maior que o normal nos pacientes obesos, sendo, então, esperado um aumento do esôfago de Barrett nessa população. Apesar disso, uma metanálise de mais de 13.000 pacientes submetidos à endoscopia pré-cirurgia bariátrica relatou um baixo índice de esôfago de Barrett, menor que 1%. No entanto, se os pacientes pioram da DRGE pós-Sleeve, cria-se a hipótese que aumentaria o risco de desenvolver esôfago de Barrett.
De acordo com os guidelines, pacientes cuja prevalência esperada de Barrett é maior que 10% são considerados de alto risco para desenvolver essa condição e devem, portanto, ser rastreados. Avaliar o risco de esôfago de Barrett pós-Sleeve tem importantes implicações clínicas para endoscopistas que realizam endoscopia pré e pós-operatórias desses pacientes, cirurgiões bariátricos que realizam o procedimento, pacientes e clínicos que os acompanham.
Nessa metanálise, o resultado primário avaliado foi a proporção de pacientes que desenvolveram esôfago de Barrett pós-Sleeve, confirmado histologicamente. Eles também avaliaram a prevalência de DRGE e esofagite no seguimento.
Resultados
A pesquisa inicial identificou 4.389 estudos e, após avaliações e exclusões, foram incluídos 10 estudos, totalizando 680 pacientes.
Prevalência do esôfago de Barrett
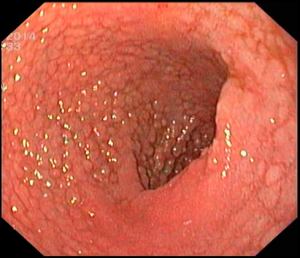
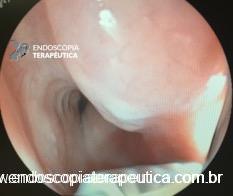
No geral, 54 dos 680 pacientes apresentaram esôfago de Barrett. Todos os casos foram sem displasia e de novo (sem Barrett na endoscopia pré-cirurgia). Além disso, todos os casos foram observados em estudos com seguimento longo (acima de 3 anos). A prevalência de esôfago de Barrett foi de 11,4 % (IC 95%, 7,7% -16,6%), p< 0,001.
Esôfago de Barrett e sintomas de DRGE
No total, 7 pacientes tinham esôfago de Barrett sem sintomas de DRGE no pós-operatório. A taxa agrupada na metanálise foi de 10,3% (IC 95%, 5%-20%, p< 0,001). A taxa agrupada de Barrett em pacientes com sintomas de DRGE foi 18,2% (IC 95%, 12,4%-26%). Não houve diferença significativa na probabilidade de ter Barrett baseado nos sintomas de DRGE (odds ratio 1,74; IC 95%, 0,52-5, 89; p=0,37).
Apenas 1 estudo relatou a taxa de projeção linear de epitélio colunar no esôfago (como vista endoscopicamente). Nesse estudo, a taxa de epitélio colunar foi alta (50%, n=10). Mas apenas 3 desses pacientes confirmaram por biópsias esôfago de Barrett.
Esofagite pós-Sleeve
Sete estudos relataram esofagite antes e após o Sleeve com vários intervalos de seguimento. Em cinco estudos de seguimento longo (maior que 3 anos), o aumento relativo da taxa de esofagite foi 86% (64%-109%), P < .001, I 2 = 47%, Q = 7.6 (P =0,107). Isso significa que há 86% de aumento no risco de esofagite pós-Sleeve em seguimento de longo prazo.
DRGE pós-Sleeve
Oito estudos relataram a taxa de DRGE pós-Sleeve. A definição de DRGE teve grande variação em cada estudo (consenso de Montreal, aplicação de questionários, presença de pirose, cintilografia, entre outros). Como resultado, foi observada uma heterogeneidade significativa na magnitude da DRGE pós-operatória. No entanto, todos os estudos mostraram estar na mesma direção: um significativo aumento da prevalência do DRGE no pós-operatório com odds rates variando de 1,6 a 49. Quatro estudos relataram DRGE de novo pós-Sleeve. Entre aqueles que não apresentavam sintomas de DRGE antes da cirurgia, a taxa de DRGE no pós-operatório foi de 45% (IC 95%, 35%-55%), p=0,106. Dois estudos relataram aumento do uso de inibidores de bomba de prótons no pós-operatório: de 22% para 76% e de 24% para 76%.
Discussão
Segundo os autores, essa metanálise incluiu todos os estudos existentes. Foi verificado que a prevalência do Barrett pós-Sleeve gástrico é de 11,6%. Além disso, foi visto que o aparecimento do Barrett não foi limitado aos pacientes com sintomas de DRGE somente. Barrett apareceu por volta de 3 anos após o procedimento e continuou a ser detectado 10 anos após a cirurgia.
Implicações clínicas
Há muitas implicações clinicas nesses achados. Primeiro, devido ao aumento de peso da população e da demanda pelo Sleeve, cirurgiões bariátricos, gastroenterologistas e demais médicos que acompanham os pacientes precisam estar cientes desses possíveis resultados. Esses dados justificam uma discussão com os pacientes em relação aos riscos e benefícios do rastreamento para esôfago de Barrett pós-Sleeve. De acordo com o guideline da ASGE, rastreamento para esôfago de Barrett deve ser indicado para os pacientes de uma população em que a prevalência de Barrett é maior que 10%. Observe que 11,6% dos casos foram Barrett de novo, nenhum dos pacientes submetidos ao Sleeve tinham Barrett na endoscopia pré-operatória. Os dados sugerem que o rastreio pode ser mais útil se iniciado cerca de 3 anos após o Sleeve. Mais dados sobre essa questão são necessários antes de tais recomendações serem adotadas em diretrizes clínicas.
Segundo, embora o Barrett possa levar anos para se desenvolver, o risco de esofagite parece aumentar 13% por ano baseado em regressão logística. Muitos pacientes com esôfago de Barrett e esofagite são assintomáticos. Embora esses resultados secundários requeiram investigações adicionais, o resultado da metanálise indica que supressão ácida precoce pós-Sleeve pode ser considerada para atenuar risco de DRGE e, portanto, o risco de esôfago de Barrett e adenocarcinoma de esôfago.
Terceiro, o aumento do risco de esôfago de Barrett devido ao Sleeve deve ser discutido com os pacientes candidatos à cirurgia. Pacientes com aumento do risco para Barrett devem receber a opção de ter um procedimento alternativo. Esses pacientes incluem aqueles com DRGE, esofagite documentada, história familiar de Barrett ou adenocarcinoma de esôfago, homens e fumantes.
Nenhum dos estudos relatou a taxa de progressão para displasia no esôfago de Barrett. Entretanto, não há razão para se presumir que o Barrett pós-Sleeve teria um comportamento diferente que o Barrett em outros pacientes.
Além disso, poderia haver implicações clínicas para gastroplastia endoscópica (endoscopic sleeve gastroplasty – ESG). Embora o ESG mimetize o Sleeve por cirurgia na sua técnica, o efeito do ESG na DRGE, esofagite erosiva e esôfago de Barrett, não está bem estudado. Um estudo retrospectivo com 83 pacientes submetidos à ESG e 54 ao Sleeve cirúrgico mostrou que o risco de refluxo foi menor no grupo ESG, porém o verdadeiro efeito do ESG na DRGE e esofagite erosiva não está bem estabelecido ainda.
Limitações
Uma das limitações do estudo é o relativo tamanho pequeno da amostra. Além disso, o resultado primário foi esôfago de Barrett. Portanto, muitos dos resultados secundários devem ser usados com cautela.
Conclusão
Pacientes submetidos à gastrectomia vertical têm risco aumentado de desenvolver esôfago de Barrett. Mais estudos são necessários para entender a fisiopatologia desse fenômeno. Gastroenterologistas, cirurgiões bariátricos e demais médicos devem estar atentos a esses dados. Uma clara discussão com os pacientes a respeito dos riscos após o procedimento e a avaliação do risco-benefício do rastreamento do esôfago de Barrett após o Sleeve devem ser consideradas.
Como citar este artigo
Arraes L. Esôfago de Barrett após gastrectomia vertical (Sleeve). Endoscopia Terapêutica; 2021. Disponível em: https://endoscopiaterapeutica.net/pt/artigoscomentados/esofago-de-barrett-apos-gastrectomia-vertical-sleeve/
Referência
Barrett esophagus after sleeve gastrectomy: a systematic review and meta-analysis. Bashar J. Qumseya et al. Gastointestinal Endoscopy. Volume 93, issue 2, P343-353.E2. February 01, 2021. DOI: https://doi.org/10.1016/j.gie.2020.08.008