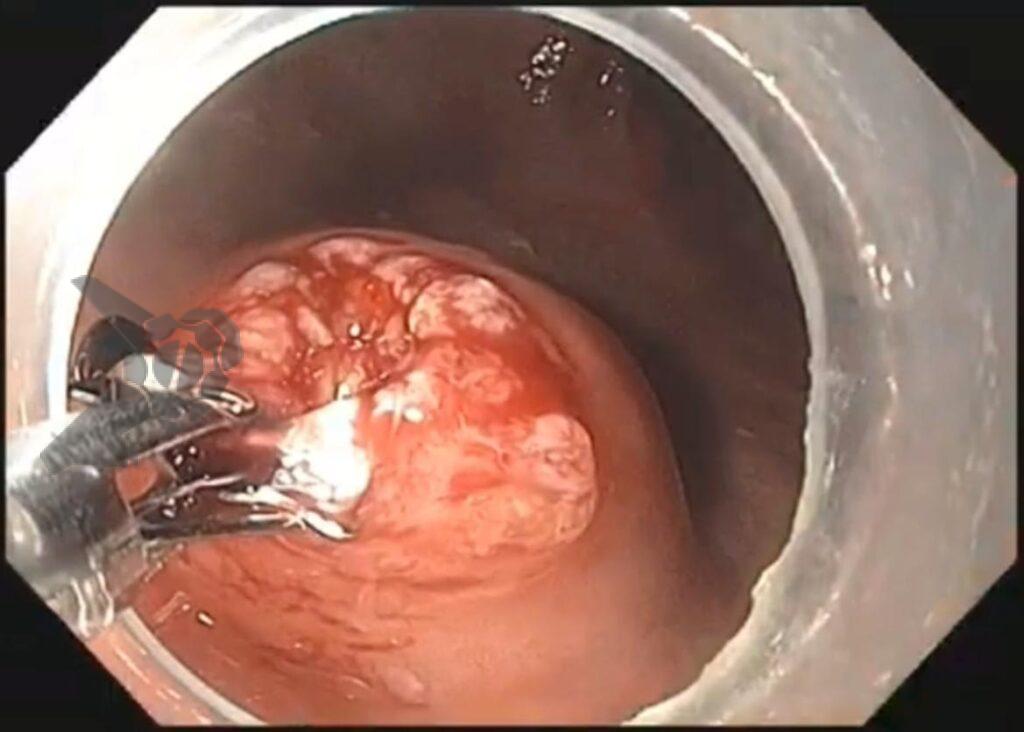
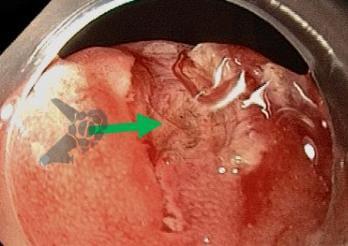
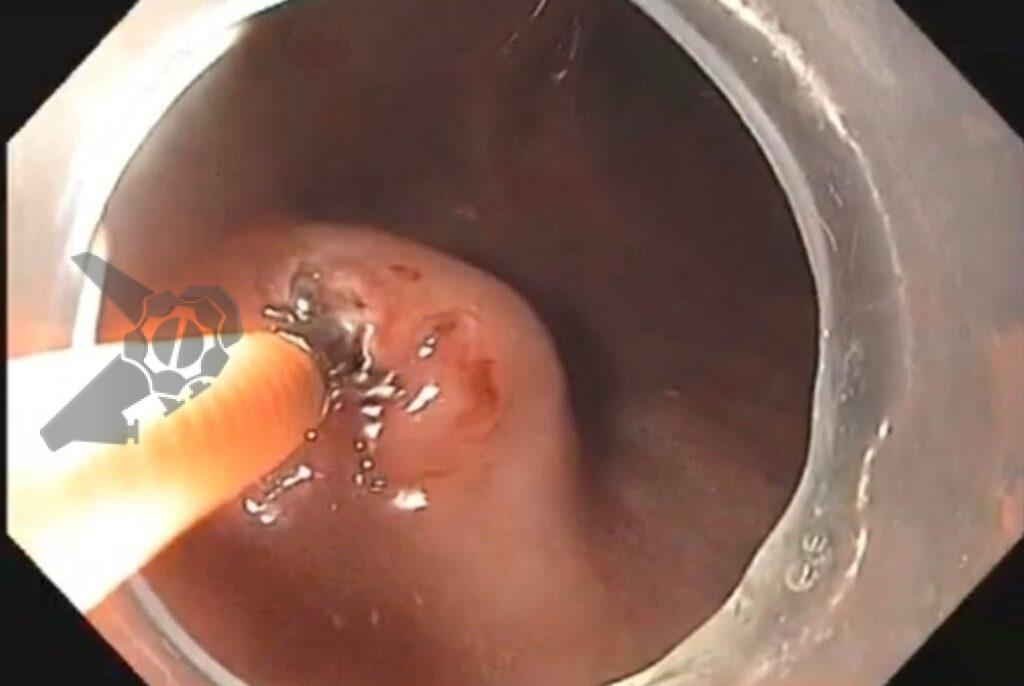
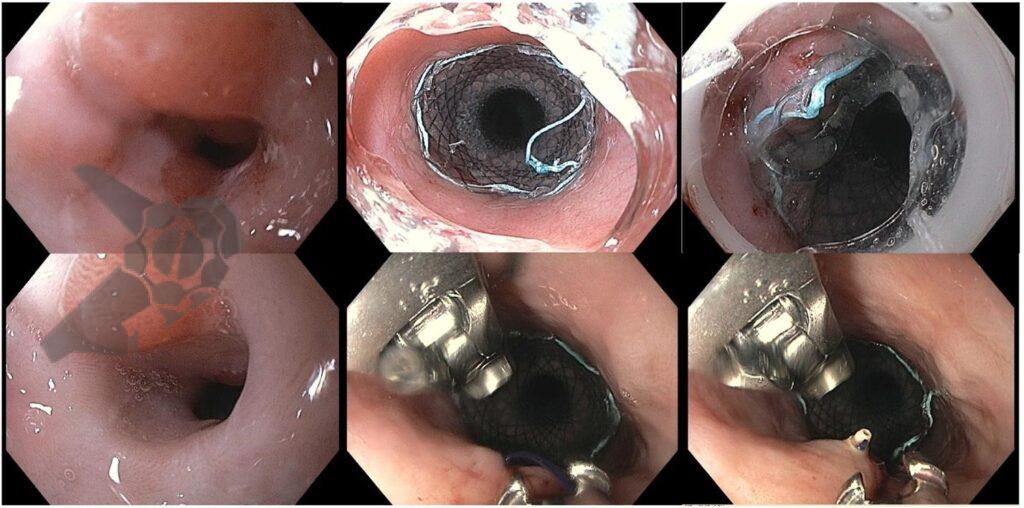
Ressecção endoscópica com alça a frio ou diatérmica de grandes pólipos colorretais não pediculados: Estudo randomizado CHRONICLE Trial
Resumo de Steinbrück I, Ebigbo A, Kuellmer A, et al. Cold Versus Hot Snare Endoscopic Resection of Large Nonpedunculated Colorectal Polyps: Randomized Controlled German CHRONICLE Trial. Gastroenterology. 2024 Sep;167(4):764-777. doi: 10.1053/j.gastro.2024.05.013. Epub 2024 May 23. PMID: 38795735.
Introdução
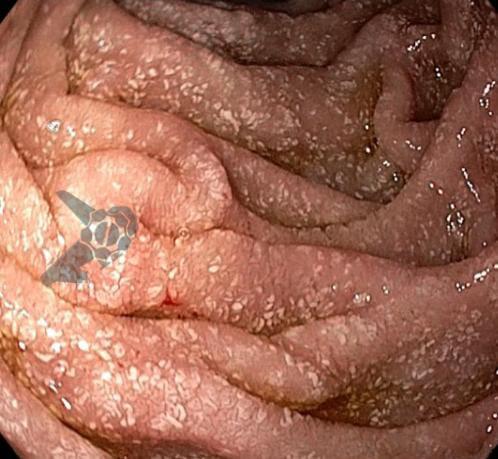
A ressecção de adenomas por colonoscopia reduz a mortalidade por neoplasia colorretal (1). Em geral, ressecções de lesões ≥ 2 cm são realizadas em mais de um fragmento (piecemeal). As mucosectomias (com alça quente) estão associadas a taxas não desprezíveis de eventos adversos/EA (perfuração 0,9-2,7%; sangramento 6,2-7%; síndrome pós-polipectomia 5%) (2-7). Por outro lado, as ressecções a frio aparentam um melhor perfil de segurança (índices próximos de zero para sangramento tardio e perfuração), mas maiores taxas de recidiva (8, 9). Este estudo randomizado compara a mucosectomia a frio (cold snare endoscopic mucosal resection – CEMR) com a convencional (hot snare HEMR) para lesões não pediculadas ≥ 2 cm.
Métodos
Trata-se de um estudo randomizado realizado em 19 centros alemães que incluiu pólipos/lesões não pediculadas ≥ 2 cm. Foram excluídas lesões recidivadas ou com suspeita/confirmação de malignidade.
Os procedimentos foram realizados conforme habitual para cada técnica, com adição de corante (índigo carmim) e solução de adrenalina na injeção submucosa variável em ambos braços do estudo, segundo a preferência do endoscopista.
O follow-up foi realizado em forma de contato telefônico após 4 semanas e com nova colonoscopia em 4 +/- 2 meses.
Desfecho primário: taxa total de EAs maiores durante e após o procedimento (perfuração, sangramento e síndrome pós-polipectomia).
Desfechos secundários: taxas individualizadas dos EAs citados acima, tempo de procedimento, recidiva/lesão residual e sucesso técnico.
A diferença esperada para o desfecho primário entre os grupos de 6,1% (2,1 x 8,2%), gerou o “n” de 428 pacientes (poder 80%, significância 5%, perdas 5%). Houve interrupção precoce do estudo após recrutar 363 pacientes, devido avaliação interina programada com 214 pacientes, que revelou a diferença de 7,9% entre os grupos na análise por intenção de tratamento.
Resultados
Um total de 396 lesões (363 pacientes) foram ressecadas, sendo 193 CEMR e 203 HEMR.
Dentre as características de base, só houve diferença entre os grupos no uso de antiplaquetários e/ou anticoagulantes (82 pacientes = 22,6%) com maior prevalência no grupo HEMR (p= 0,038). Entretanto, não houve correlação deste fato com a incidência de EA.
O tamanho médio das lesões foi de 3 +/- 1 cm (2-8 cm) e 70% eram localizadas no cólon direito.
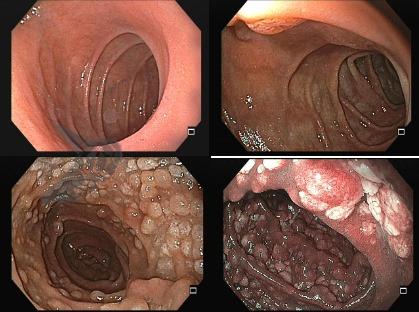
Houve maior sucesso técnico no grupo HEMR: 97.5% (n = 198/203) x 92.2% (n = 178/193), p = 0,022. Este dado demonstrou maior necessidade de mudança de estratégia (10% = 20/193 x 3% = 6/203) no grupo a frio (como crossover com uso de corrente elétrica), não que as lesões não tenham sido ressecadas.
No grupo HEMR, houve fechamento do leito com clipes (p < 0,001), coagulação profilática de vasos da base (p < 0,001) e das bordas/margens (p < 0,001) com maior frequência.
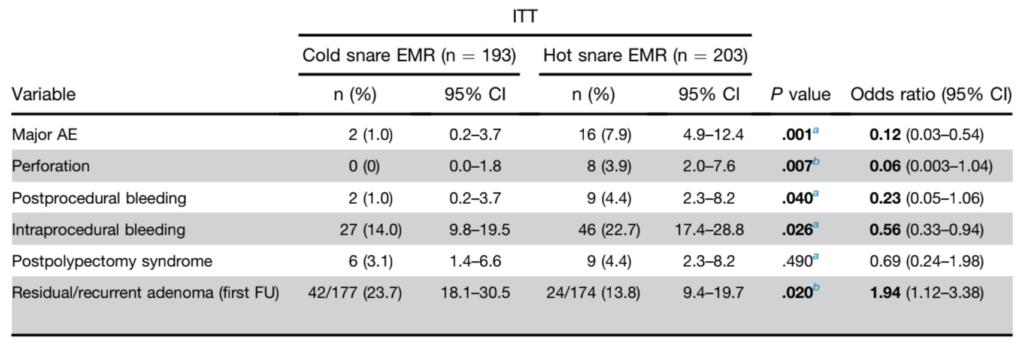
A tabela dos desfechos original do estudo está exposta abaixo (tabela 1). Em relação ao desfecho 1ário, houve mais EA maiores foi maior no grupo HEMR (16/203 = 7,9% x 2/193 = 1%). Adentrando os EA específicos (desfechos 2ários), perfuração (p 0,007), sangramento tardio (p 0,04), sangramento intra-procedimento (p 0,026) foram mais frequentes no braço HEMR. A incidência de síndrome pós-polipectomia foi similar entre os grupos (p 0,49).
Houve mais recidiva/lesão residual no grupo CEMR (23,7% x 13,8%, p 0,02). Destas, 13,6% foram diagnosticadas em biópsias de cicatrizes não suspeitas endoscopicamente. Exceto por 2 casos que foram operados pelo diagnóstico de adenocarcinoma, todas as recorrências foram resolvidas endoscopicamente no primeiro exame de follow-up.
Não houve óbitos relacionados ao procedimento ou necessidade de cirurgia em função dos EA.
O único fator independente relacionado aos EA (considerados como um todo), foi o tamanho da lesão ≥ 4 cm. Três fatores foram relacionados à lesão recorrente/residual: tamanho ≥ 4 cm, componente nodular (granular mista ou nodular) e AP com displasia de alto grau ou adenocarcinoma.
Discussão
As ressecções a frio (CEMR) tem se apresentado como uma ótima opção para diminuir a incidência de EA. Os achados deste trabalho corroboram com a literatura prévia, mostrando uma redução de 85% dos EA (de 7,9% para 1%). As taxas próximas de zero de EA com a CEMR dão mais força à chamada “Cold Revolution”, porém devemos considerar outros fatores, como exposto ao longo da discussão, não escolha da técnica.
O fato das ressecções a frio serem mais superficiais (51 vs 933 µm) certamente tem grande influência no sangramento tardio e nas perfurações (10). Ressecções mais profundas tendem a lesar mais estruturas vasculares e causar mais perfurações. Ademais, o dano térmico (HEMR) progride após a ressecção, podendo atingir e lesar vasos sanguíneos, mas sem a capacidade de coagulá-los, causando sangramentos tardios. Outro fator a ser considerado, é a maior identificação e consequente maior tratamento de vasos durante o procedimento a frio que, com a aplicação de corrente elétrica poderiam sangrar apenas tardiamente.
O outro lado da balança é a maior fragmentação e menor representação submucosa das lesões com a CEMR. Portanto, a maior taxa de lesão residual é algo que se deve ter em mente no momento da escolha da técnica. A impressão é que a avaliação do leito durante ressecções maiores é difícil (centro do leito e não bordas), de modo que a coagulação das bordas não seria eficaz para diminuir as lesões residuais. Isso pode tornar a CEMR menos adequada para lesões com suspeita de displasia de alto grau ou adenocarcinoma. Ademais, a necessidade de mudança de estratégia, como conversão de CEMR para HEMR, aumenta.
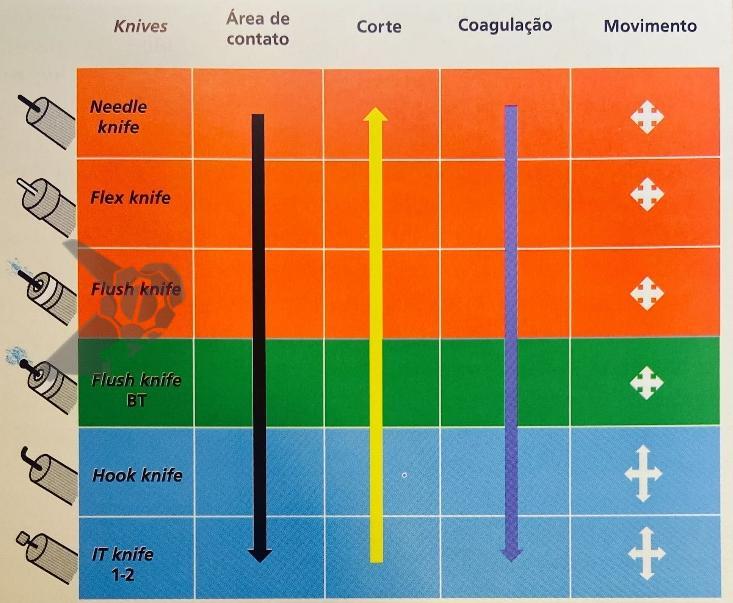
Uma vez conhecidas as vantagens e desvantagens de cada método, a escolha da melhor estratégia deve ser baseada na morfologia da lesão, expertise e disponibilidade de recursos. Deve-se recordar que as ressecções a frio habitualmente são feitas com alças dedicadas, com maior poder de corte quando comparadas às alças convencionais sem a corrente elétrica.
Lesões granulares homogêneas (em geral adenomatosas) e suspeitas para lesão serrilhada séssil são ótimas opções para as ressecções a frio. Por outro lado, o componente nodular (lesões granulares nodulares ou mistas) e com suspeita para displasia de alto grau/adenocarcinoma exigem ressecções com menor fragmentação. A dissecção submucosa (ESD) é uma alternativa, mas a HEMR pode ser empregada em casos selecionados, reforçando a importância de ressecar ao menos o componente nodular/suspeito para displasia/neoplasia em monobloco e com margens.
Outro ponto que merece atenção é que todos EA foram manejados endoscopicamente. Em 396 lesões complexas, não houve necessidade de abordagem cirúrgica por EA ou óbitos relacionados à intervenção endoscópica. Ademais, todas as recidivas foram resolvidas endoscopicamente. Como ouvimos habitualmente “só não tem complicação que não faz”, porém o importante é saber reconhecer o EA (sua possibilidade já era prevista de antemão) e aplicar o respectivo tratamento.
O trabalho exposto apresenta limitações como o envolvimento de centros de referência, que dificultam a aplicação dos resultados para centros de menor volume e complexidade. A inclusão de múltiplos centros também fez com que alguns centros incluíssem apenas um ou nenhum caso nos braços do estudo. O follow-up médio de 4,35 meses pode ter aumentado a incidência de recidivas em cicatrizes não suspeitas (13,6% neste estudo x 6,4-6,7% em outras casuísticas) (11, 12). A grande variabilidade técnica nestas ressecções também é de difícil avaliação.
Destaca-se uma limitação recorrente nestes trabalhos, que é a não discriminação do tipo de corrente elétrica empregada. Se estamos falando de efeitos deletérios do dano térmico na parede colorretal, utilizar corte puro ou correntes mistas com efeito elevado ou até coagulação pura (pedal azul) entre os cortes (pedal amarelo) apresenta grande diferença e impacto na incidência de EA. Apesar das limitações, a seleção de casos (apenas 2% de adenocarcinoma entre os casos incluídos), resolutividade de lesões de alta complexidade e manejo de EA foram muito bons, produzindo resultados substanciais.
Concluímos que as ressecções a frio apresentam baixíssimas taxas de EA, porém mais lesões residuais. A escolha do método deve basear-se ainda, na morfologia da lesão e suspeita de displasia de alto grau/adenocarcinoma, como previamente exposto.
Para mais informações, clique em Até onde vamos com as ressecções “à frio”? • Endoscopia Terapeutica
Referências
- Zauber AG, Winawer SJ, O’Brien MJ, Lansdorp-Vogelaar I, van Ballegooijen M, Hankey BF, Shi W, Bond JH, Schapiro M, Panish JF, Stewart ET, Waye JD. Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths. N Engl J Med. 2012 Feb 23;366(8):687-96. doi: 10.1056/NEJMoa1100370.
- Bar-Yishay I, Shahidi N, Gupta S, Vosko S, van Hattem WA, Schoeman S, Sidhu M, Tate DJ, Hourigan LF, Singh R, Moss A, Raftopoulos SC, Brown G, Zanati S, Heitman SJ, Lee EYT, Burgess N, Williams SJ, Byth K, Bourke MJ. Outcomes of Deep Mural Injury After Endoscopic Resection: An International Cohort of 3717 Large Non-Pedunculated Colorectal Polyps. Clin Gastroenterol Hepatol. 2022 Feb;20(2):e139-e147. doi: 10.1016/j.cgh.2021.01.007.
- Arezzo A, Passera R, Marchese N, Galloro G, Manta R, Cirocchi R. Systematic review and meta-analysis of endoscopic submucosal dissection vs endoscopic mucosal resection for colorectal lesions. United European Gastroenterol J. 2016 Feb;4(1):18-29. doi: 10.1177/2050640615585470.
- Kothari ST, Huang RJ, Shaukat A, Agrawal D, Buxbaum JL, Abbas Fehmi SM, Fishman DS, Gurudu SR, Khashab MA, Jamil LH, Jue TL, Law JK, Lee JK, Naveed M, Qumseya BJ, Sawhney MS, Thosani N, Yang J, DeWitt JM, Wani S; ASGE Standards of Practice Committee Chair. ASGE review of adverse events in colonoscopy. Gastrointest Endosc. 2019 Dec;90(6):863-876.e33. doi: 10.1016/j.gie.2019.07.033.
- Elliott TR, Tsiamoulos ZP, Thomas-Gibson S, Suzuki N, Bourikas LA, Hart A, Bassett P, Saunders BP. Factors associated with delayed bleeding after resection of large nonpedunculated colorectal polyps. Endoscopy. 2018 Aug;50(8):790-799. doi: 10.1055/a-0577-3206.
- Metz AJ, Bourke MJ, Moss A, Williams SJ, Swan MP, Byth K. Factors that predict bleeding following endoscopic mucosal resection of large colonic lesions. Endoscopy. 2011;43(6):506-511. doi:10.1055/s-0030-1256346.
- Burgess NG, Metz AJ, Williams SJ, et al. Risk factors for intraprocedural and clinically significant delayed bleeding after wide-field endoscopic mucosal resection of large colonic lesions. Clin Gastroenterol Hepatol. 2014;12(4):651-61.e613. doi:10.1016/j.cgh.2013.09.049.
- van Hattem WA, Shahidi N, Vosko S, et al. Piecemeal cold snare polypectomy versus conventional endoscopic mucosal resection for large sessile serrated lesions: a retrospective comparison across two successive periods. Gut. 2021;70(9):1691-1697. doi:10.1136/gutjnl-2020-321753.
- Muniraj T, Sahakian A, Ciarleglio MM, Deng Y, Aslanian HR. Cold snare polypectomy for large sessile colonic polyps: a single-center experience. Gastroenterol Res Pract. 2015;2015:175959. doi:10.1155/2015/175959.
- Suzuki S, Gotoda T, Kusano C, et al. Width and depth of resection for small colorectal polyps: hot versus cold snare polypectomy. Gastrointest Endosc 2018; 87:1095–1103.
- Kandel P, Brand EC, Pelt J, Ball CT, Chen WC, Bouras EP, Gomez V, Raimondo M, Woodward TA, Wallace MB; EMR SCAR Group. Endoscopic scar assessment after colorectal endoscopic mucosal resection scars: when is biopsy necessary (EMR Scar Assessment Project for Endoscope (ESCAPE) trial). Gut. 2019 Sep;68(9):1633-1641. doi: 10.1136/gutjnl-2018-316574.
- Desomer L, Tutticci N, Tate DJ, Williams SJ, McLeod D, Bourke MJ. A standardized imaging protocol is accurate in detecting recurrence after EMR. Gastrointest Endosc. 2017 Mar;85(3):518-526. doi: 10.1016/j.gie.2016.06.031. Epub 2016 Jun 22.
Como citar este artigo
Funari MP. Cold Versus Hot Snare Endoscopic Resection of Large Nonpedunculated Colorectal Polyps: Randomized Controlled German CHRONICLE Trial. Endoscopia Terapeutica 2025 Vol I. Disponível em: