Quem pode auxiliar o endoscopista na realização de biópsias?
Quanto ao parecer do CFM 30/2017:
Nos últimos anos, o número de procedimentos endoscópicos diagnósticos e terapêuticos aumentou consideravelmente.
Tais procedimentos são, em sua maioria, realizados sob sedação, para conforto do paciente e redução das respostas hemodinâmicas, além de proporcionar ao endoscopista melhores condições para realização do exame.
A sedação pode ser leve, moderada ou profunda, dependendo da resposta do paciente a estímulos dolorosos, permeabilidade das vias aéras e estabilidade hemodinâmica. As drogas anestésicas mais comumente utilizadas para a sedação são os benzodiazepínicos e opióides, além do propofol.
Entre os BDZ, o midazolam é a droga mais utilizada. Sua meia vida mais curta (1 a 4 h) e propriedade de produzir algum grau de amnésia são fatores que influenciam sua escolha. Doses baixas (menores de 3 mg) dispensam o uso de antagonistas (flumazenil).
Nos últimos anos, o Propofol tem sido cada vez mais utilizado, por seu rápido início de ação e curta duração. Deve ser administrada com cuidado, podendo causar depressão respiratória e hipotensão, especialmente em pacientes idosos e desidratados (pelo preparo da colonoscopia). Cuidado especial também com o uso em pacientes cardiopatas. Por sua capacidade em produzir apnéia, deve ser utilizado com cautela e por médicos endoscopistas com treinamento no manejo das vias aéreas. A dor a injeção endovenosa do propofol pode ser reduzida através do uso de lidocaína ou pequenas doses de opióides.
Para diminuir a dor e os reflexos autonomicos, as drogas utilizadas são os opioides (fentanil, meperidina, alfentanil ou morfina). Agem em receptores do SNC e podem apresentar como efeitos colaterias náuseas, prurido e depressão respiratória. Se usados em doses baixas, são consideradas seguras e não necessitam de antagonistas. Por esse motivo o sedativo da endoscopia é perigoso apenas quando ocorre a manipulação incorreta das doses.
Outras drogas que podem ser utilizadas durante o exame são os anticolinérgicos, como a atropina e escopolamina. Produzem aumento da frequencia cardiaca, relaxamento da musculatura lisa, broncodilatacão e diminuição da salivação.
A fim de reduzir os riscos relacionados ao preparo e a sedação, algumas considerações devem ser observadas:
a avaliação médica inicial, antes do preparo, é fundamental para identificar doenças associadas e estratificar os pacientes de acordo com os riscos anestésico-cirúrgicos, através dos critérios da American Society of Anesthesiology:
Classificação ASA/ Condição Física do Paciente
1: Normal, Saudável
2: Doença Sistêmica Compensada
3: Doença Sistêmica Descompensada (Não Incapacitante)
4: Doença Incapacitante/Risco de Vida
5: Moribundo/Risco de Morte ≤24hs
De acordo com a Resolução CFM 1886/2008, somente pacientes ASA 1 e 2 devem ser atendidos em ambiente ambulatorial. Os demais pacientes devem ser atendidos em regime hospitalar. É obrigatória a presença de acompanhante adulto para realização do procedimento sob sedação.
É obrigatória a monitorização do paciente durante o exame, através de oximetria de pulso, cardioscopia e pressão arterial não invasiva (isso é lei!). Se for realizada anestesia geral, a capnografia deve ser incluida.
a pré-oxigenação antes do início da sedação émuito importante para evitar hipoxemia. Mesmo que o paciente passe por um período de apneia após a indução, ele ainda tem uma “reserva”de oxigênio que pode evitar ou pelo menos, atenuar um episódio de hipoxemia.
aguarde o tempo de ação dos sedativos. É comum ficarmos muito ansiosos e apressados na correria da nossa rotina, mas nunca devemos acelerar essa etapa durante a sedação. Aguarde o tempo de ação de cada anestésico, especialmente em pacientes idosos e cardiopatas, nos quais o débito cardíaco é menor e as drogas circulam mais lentamente.
as complicações decorrentes da sedação incluem: depressão respiratória, laringoespasmo, instabilidade hemodinâmicas, reações alérgicas e aspiracão de conteúdo gástrico.
– A depressão respiratória ocorre por ação das drogas anestésicas, e pode ser facilmente revertida através do uso da ventilação com pressão positiva (mascara-ambu).
Fatores como IMC> 26, ausência de dentes, presença de barba, história de roncos, apneia do sono e uso de CPAP podem ser indicativos de dificuldade a ventilacão.
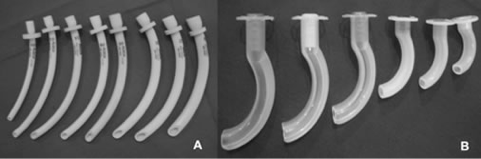
– A obstrucão das vias aéreas ocorre por queda da língua no momento da sedação. O uso das cânulas de Guedel e manobras como “ jaw thrust” ou “ chin lift” são efetivas na manutençao da permeabilidade das vias aérea.
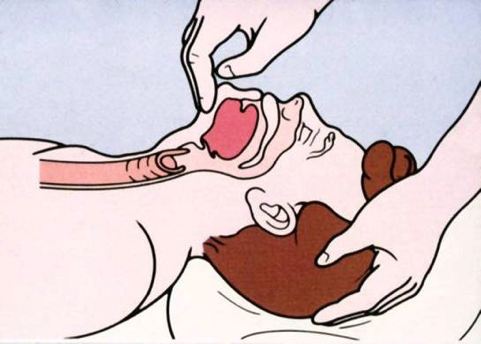
– O laringoespasmo ocorre por hiperreatividade das vias aéras, quando manipuladas em pacientes em plano anestésico superficial. Pode ocorrer queda rápida da saturação de oxigênio, estridores e dificuldade a ventilação. Para reversão do quadro, devemos proceder ao aprofundamento do plano anestésico (propofol) e ventilação com pressão positiva.
– Em caso de reações alérgicas, identificar e suspender o agente desencadeante. Se necessário, oxigenoterapia, hidratação, corticóides e medicações de suporte estão indicadas.
– A aspiração de conteúdo gástrico ocorre com maior frequência em pacientes submetidos a colonoscopia. Não existe consenso em relação ao tempo de jejum após o manitol. Sendo assim, o endoscopista e o anestesista devem estar preparados para evitar a broncoaspiração, através de um sistema de sucção eficiente, além de evitar ventilação com pressão positiva. Pacientes obesos, gestantes, portadores de hérnia de hiato e doenças que levam a retardo do esvaziamento gástrico como diabetes e hipotireoidismo constituem maior risco a aspiração.
após o procedimento, o paciente pode receber alta da unidade. Para tanto, alguns critérios devem ser obedecidos:
– orientação temporo-espacial
– estabilidade dos sinais vitais por pelo menos 60 min
– ausência de dificuldade respiratória
– capacidade de ingerir líquidos
– ausência de náuseas ou vômitos
– ausência de dor ou sangramento
Lembrar que a avaliação pós-anestésica deve estar documentada no prontuário de todos os pacientes.
é importante orientar os pacientes quanto aos cuidados pós-alta, de preferência, por escrito. Nas 24 h subsequentes ao procedimento, para segurança, orientamos não dirigir, operar máquinas e/ou ingerir bebidas alcoolicas.
NOTA: Um importante cuidado para os paciente que serão submetidos a colonoscopia é iniciar reposição volêmica precoce com soluções isotônicas ao plasma ( SF, ringer simples ou ringer lactato). Essa medida é fundamental para evitar instabilidade hemodinâmica e distúrbios hidroeletroliticos, como hipopotassemia. Atenção especial aos idosos e pacientes com doenças renais e cardiopatias.

Recentemente, a manometria de alta resolução (MAR) tornou-se disponível para a avaliação da motilidade esofágica. O cateter da MAR é composto por vários sensores de pressão estreitamente espaçados (≤1 cm de intervalo nas regiões do esfíncter e 1 a 2 cm de intervalo nas regiões do corpo esofágico), registrando a pressão esofágica sem lacunas significativas dos dados ao longo do comprimento de todo o esôfago. As pressões obtidas são representadas graficamente e depois transformadas em imagens espaço-temporais das pressões esofágicas codificadas por cores (“Clouse plots”) (Fig. 1). A MAR aumentou substancialmente a resolução espacial comparada à manometria convencional com 8 sensores de pressão. Além disso, a apresentação dos dados manométricos através das “Clouse plots” revela a anatomia funcional da junção esofagogástrica (JEG) de maneira visualmente intuitiva (Fig. 2).
Figura 1. À esquerda, observa-se a disposição do cateter de MAR ao longo do comprimento do esôfago. No centro, nota-se a representação gráfica das curvas pressão x tempo. À direita, nota-se a representação espaço-temporal dos traçados da manometria de alta resolução codificada por cores (“Clouse plots”)
Figura 2. Identificação dos marcos anatômicos através da MAR: esfíncter superior do esôfago (ESE), ponto de inversão da pressão (PIP) e esfíncter inferior do esôfago (EEI)
As principais vantagens da MAR em relação à manometria convencional são:
– Permite localização mais fácil e imediata de marcos anatômicos como os esfíncteres superior e inferior;
– É possível aquisição simultânea de dados referentes ao esfíncter superior, corpo esofágico e esfíncter inferior do esôfago;
– Proporciona maior conforto ao paciente devido ao tempo reduzido de exame e pela ausência de necessidade de tração do cateter a cada centímetro;
– Não sofre influência de artefatos de movimento.
– Identificação de fenótipos clinicamente relevantes, como os subtipos de acalásia, que possuem respostas terapêuticas distintas. (Fig. 3)
Figura 3. Subtipos de acalásia. Em A, tipo I, com ausência de contratilidade; em B, tipo II, com panpressurização esofágica e, em C, tipo III, com contrações prematuras. Nos três casos, observa-se prejuízo do relaxamento da JEG.
A avaliação da peristalse esofágica e do relaxamento do esfíncter inferior do esôfago (EIE) é feita através da identificação de diferentes variáveis, conforme proposto pela Classificação de Chicago. Este sistema foi desenvolvido para facilitar a interpretação dos estudos de alta resolução, concomitante à adoção generalizada desta tecnologia para prática clínica. No último ano, o Grupo de Trabalho Internacional em MAR publicou a terceira versão da classificação (CC v.3.0). As principais medidas consideradas são demonstradas a seguir (Tab. 1).
Tabela 1. Medidas utilizadas na Classificação de Chicago v. 3.0

De acordo com os achados manométricos, são inferidos os distúrbios funcionais e os respectivos diagnósticos clínicos. Esta etapa deve obedecer a um fluxograma hierárquico, que classifica as desordens sequencialmente por ordem de prioridade, a saber (Fig. 4):
1) Desordens que obstruem o fluxo da JEG: caracterizadas por IRP acima do limite superior de normalidade. Dividem-se entre os subtipos de acalásia (I, II e III) e obstrução da via de saída da JEG.
2) Desordens maiores da peristalse: nunca encontradas em indivíduos sadios. Compreendem peristalse ausente, espasmo esofageano distal e Jackhammer esophagus.
3) Desordens menores da peristalse: caracterizadas por prejuízo da depuração esofágica. Incluem a motilidade esofágica ineficaz e a peristalse fragmentada.
Figura 4. Análise hierárquica da motilidade esofágica: CC v 3.0. As desordens que obstruem o fluxo da JEG estão representadas em vermelho, as desordens maiores da peristalse em laranja e as desordens menores da peristalse em amarelo.
Referências
https://endoscopiaterapeutica.net/pt/foruns/topico/desinfeccao-de-endoscopios/#post-5983
Endoscopia
A localização intraoperatória de lesões detectadas por métodos endoscópicos é sabidamente imprecisa quando se baseia somente em marcos anatômicos com até 14% dos tumores cólon, por exemplo, sendo identificados cirurgicamente em sítio diverso ao descrito na colonoscopia. Particularmente, a abordagem laparoscópica dificulta a identificação de lesões menores que poderiam ser palpadas em técnicas cirúrgicas abertas, levando em último caso, a não ressecção do segmento apropriado.
Uma outra situação que demanda adequada determinação do sítio de lesão, é o segmento endoscópico pós ressecção de lesões. Após a remoção, por exemplo, de uma lesão de cólon em mais de uma fragmento (“piecemeal”), para se assegurar da completa ressecção em exames de controle, se torna essencial saber a localização exata da lesão retirada.
Portanto, com intuito principal de localizar pré-operatoriamente uma lesão do trato gastrointestinal, ou mesmo definir uma área a ser acompanhada endoscopicamente, algumas técnicas foram desenvolvidas. Entre elas, a tatuagem endoscópica é a mais comumente utilizada e mais facilmente reprodutível e será detalhada no texto. Outras técnicas disponíveis podem ser citadas como:
TATUAGEM ENDOSCÓPICA
Dentre todos os métodos, a tatuagem endoscópica se demonstra claramente como a principal técnica de marcação endoscópica de lesões. Cita-se como vantagens principais a facilidade de execução e a produção de uma marca que habitualmente é acessível ao cirurgião tanto em procedimentos laparoscópicos, quanto em técnicas cirúrgicas abertas. Para a realização da mesma, devem ser utilizados:
Múltiplos corantes podem ser utilizados em endoscopia, contudo, em sua maioria, possuem altas taxas de absorção. Azul de metileno e índigo cármin, por exemplo, costumam ser absorvidas em até 24 h, não deixando marcas residuais. Dentre os corantes com maior durabilidade cita-se a tinta da India e a indocianina verde, sendo a tinta da India a mais comumente utilizada. A tinta da India consiste de uma solução de partículas de carbono e pode permanecer no tecido corado por tempo estimado de até 10 anos, permitindo a visualização de tumores marcados endoscopicamente em até 97% dos casos. Usualmente utilizada em soluções 1:50 – 1:100.
Produto tradicionalmente disponível para a injeção de outras soluções como de adrenalina ou ethamolin. Introduzido pelo canal de trabalho do aparelho, tem calibre ideal entre 23 – 25 G, com ponta de 3 – 5 mm.
TÉCNICA DE TATUAGEM ENDOSCÓPICA
Após localização da área a ser tatuada, a agulha do cateter injetor é exposta e penetra a mucosa de forma angulada, de modo que a aplicação do conteúdo injetado acesse a submucosa. Quando da penetração de forma perpendicular, há maior chance da agulha atravessar completamente a parede do órgão e dispensar a solução injetada no peritônio.
Em relação ao modo de injeção, duas variações técnicas principais são propostas:
A tinta da índia é injetada diretamente no tecido em alíquotas de 0,5 – 1 ml
A técnica de teste com solução salina consiste da formação de uma bolha submucosa com 1 – 3 ml de solução salina previamente a injeção da tinta da índia, evitando assim, a penetração transmural da tinta. Após a injeção de cerca de 1 ml da tinta, 2 ml de solução salina é usada para dispensar o resíduo de tinta possivelmente retido no cateter. Quando comparada a técnica tradicional, o teste com solução salina parece ser mais efetiva, permitindo maior número de identificações intraoperatórias de lesões.
ONDE TATUAR
A realização da tatuagem, principalmente quando de fins pré-operatório, como comentado anteriormente, deve ser realizada em locais de difícil identificação cirúrgica. Lesões em válvula ileocecal, ceco, cólon ascendente proximal e em reto, de modo geral, não necessitam ser tatuadas.
Diversas são as técnicas propostas na literatura em relação ao número de tatuagens e sobre a marcação proximal, distal ou ambas em relação a lesão, principalmente no que se refere ao cólon. Como princípios essenciais utilizados na decisão da melhor forma de tatuar é importante salientar:
Como sugerimos:
SEGURANÇA DA TÉCNICA
Raras são as complicações descritas com a tatuagem endoscópica pela técnica de teste com solução salina. Entre as complicações descritas, principalmente com uso da técnica de injeção direta, cita-se:
É possível evitar boa parte das potenciais complicações utilizando-se sempre de tinta da índia estéril, realizando injeções em pequenas alíquotas e evitando injeções profundas.
Veja também: Vídeo sobre tatuagem endoscópica
Referências:
Pohl, J. Endoscopic Tattooing.Video Journal and Encyclopedia of GI Endoscopy , Volume 1 , Issue 2 , 355 – 356
ASGE Technology Committee, Kethu SR, Banerjee S, Desilets D, Diehl DL, Farraye FA, Kaul V, Kwon RS, Mamula P, Pedrosa MC, Rodriguez SA, Wong Kee Song LM, Tierney WM. Gastrointest Endosc. 2010 Oct;72(4):681-5.
Fu KI, Fujii T, Kato S, Sano Y, Koba I, Mera K, Saito H, Yoshino T, Sugito M, Yoshida S. A new endoscopic tattooing technique for identifying the location of colonic lesions during laparoscopic surgery: a comparison with the conventional technique. Endoscopy. 2001;33:687–691
Contamos com o auxílio da cromoendoscopia para melhor visualização de estruturas, definir limite de lesões, auxiliar a visualizar lesões precoces entre outras. O uso de substancias para este fim já são clássicas e bem difundidas em nosso meio. Porém, para serem realizadas, necessitam de materiais específicos para sua aplicação, não são disponíveis em todos os centros, e podem levar a danos no aparelho utilizado.
Visando manter os benefícios da cromoendoscopia, porém, sem os aspectos negativos, as grandes empresas fabricantes de aparelhos de endoscopia, desenvolveram sistemas de cromoscopia, baseados em alterações computadorizadas das imagens geradas pelo endoscópio, ou através de filtros adicionados as fontes de luz dos mesmos, tentando assim reproduzir os benefícios da cromoendoscopia habitual.
Três são os métodos chamados de cromoscopia virtual computadorizada (ou óptica): o NBI, FICE e o i-SCAN
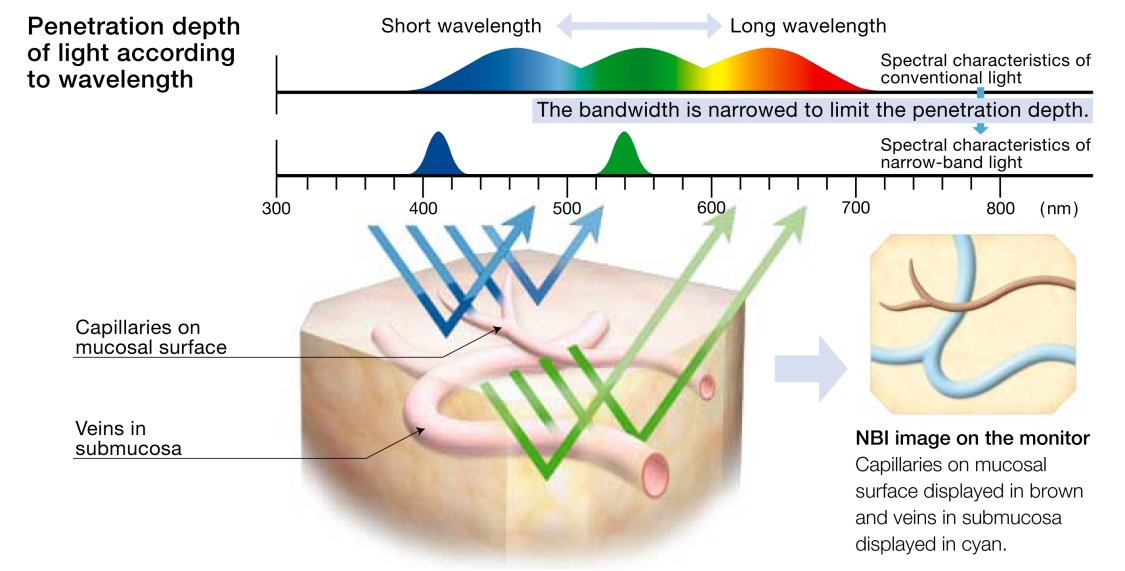
A luz branca natural visível, produzida pelo endoscópio tem um comprimento de onda entre 300 a 700nm, estando contido neste espectro, todas as cores, que juntas, compõe a luz branca. Quanto maior a onda, mais ela penetra nas estruturas da mucosa, formando assim a imagem do aparelho.
O NBI baseia-se no uso de um filtro, junto a fonte de luz branca xenom do aparelho, que permite apenas a passagem de espectro da ondas, com 415 e 540 nm . Estes dois espectros da luz, coincidem com a absorção de luz da hemoglobina, mais superficial no feixe de 415nm , e mais profunda no feixe de 540nm . Na prática, a imagem formada, realça em um tom acinzentado os vasos mais superficiais, e em um tom mais azul-esverdeado, os vasos mais profundos, em contraste com as áreas circunvizinhas, avasculares, mais escurecidas.
Para utilizar o recurso de NBI, basta apertar um botão na manopla do aparelho, que aciona e desliga o sistema de filtros da fonte.
Como serve para caracterizar os vasos da mucosa e submucosa, o NBI tem seu uso em lesões que alteram a vasculatura habitual, sendo seu uso acoplado a magnificação , importante em determinar áreas de displasia em regiões de Barret, caracterizar casos de refluxo com poucas alterações mucosas, avaliar o potencial malignos de pólipos e lesões de crescimento lateral entre outras.
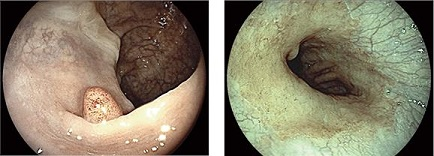
A Fujinon, trabalha com uma metodologia digital de tratamento da imagem. Após a imagem com luz branca ser obtida pelo aparelho, a processadora de imagem realizada cálculos matemáticos na mesma, conseguindo então separar os comprimentos de onda adquiridos, reforçando aquele de interesse (alterando sua cor).
Como a imagem é tratada, e não por meio de filtros de luz, pode-se obter vários tipos de recomposição da mesma, gerando contraste maior entre as estruturas visualizadas, facilitando assim a sua interpretação, ou alterando a imagem de forma a melhor visualização de vasos mucosos. Também é acionado por um simples comando na manopla do aparelho, dispondo de vários “presets”, cada um com uma melhor aplicabilidade (melhor visualização de criptas em pólipos, alterações vasculares ou lesões displásicas em áreas de Barret).
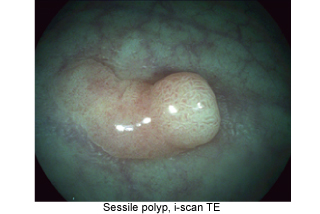
Como metodologia de tratamento de imagem por software, o i-scan é muito semelhante ao sistema FICE, também gerando imagens trabalhadas, onde é possível melhor avaliação de superfícies mucosas, limites e alterações capilares, através de imagens aprimoradas.
Possui três tipos (i-scan 1,2 e 3), sendo o subtipo1 mais utilizado para aumentar o constraste entre as estruturas da mucosa (melhor definição de margens por exemplo), o subtipo 2, além do melhor contraste, também gera maior individulização de vasos mucosos e o subtipo3, gera melhor avaliação de estruturas um pouco mais distantes (não e necessária muita aproximação do local a ser estudado, maior campo pode ser explorado).
Muitos estudos tem sido publicados sobre tais tecnologias, principalmente, com o uso do NBI, porém deve ser ressaltado, que o uso de tais metodologias ainda não substituem o uso da cromoendoscopia tradicional, e principalmente o treinamento exaustivo do endoscopista e um exame bem realizado.
Em especial, em nosso país, os aparelhos com esta tecnologia, tem um custo elevado, o seu uso, assim como o uso de corantes tradicionais, não são pagos por alguns convênios, o que dificulta seu uso indiscriminado.
Pessoalmente, uso aparelho equipado com FICE, que uso de rotina em avaliação de pacientes com Barret e em acompanhamento de doenças inflamatórias de longa data (screening para tumores). Ressalto, que além da tecnologia já descrita acima, estes aparelhos por serem mais modernos, em geral possuem melhor imagem (em High Definition), fator já associado a um exame de maior qualidade (detecção de lesões).
Bibliografia (também para visualizar ótimas imagens) :
1 : Subramanian V, Ragunath K. Advanced endoscopic imaging: a review of commercially available technologies. Clin Gastroenterol Hepatol. 2014 Mar;12(3):368-76.e1. doi: 10.1016/j.cgh.2013.06.015
2 : ASGE Technology Committee, Manfredi MA, Abu Dayyeh BK, Bhat YM, Chauhan SS, Gottlieb KT, Hwang JH, Komanduri S, Konda V, Lo SK, Maple JT, Murad FM, Siddiqui UD, Wallace MB, Banerjee S. Electronic chromoendoscopy. Gastrointest Endosc. 2015 Feb;81(2):249-61. doi: 10.1016/j.gie.2014.06.020
Veja também :
Como realizar cromoscopia no rastreamento de displasia em casos de doença inflamatória intestinal?
A hipertensão portal é a condição hemodinâmica associada às complicações mais graves de cirrose hepática, incluindo ascite, encefalopatia hepática e sangramento de varizes gastroesofágicas. O sangramento de varizes é uma emergência médica associada a elevadas taxas de mortalidade, alcançando níveis entre 10-20% no período de 6 semanas, apesar de todos os avanços terapêuticos atuais. A avaliação de ferramentas de diagnóstico e a realização de bons ensaios clínicos para o tratamento da hipertensão portal sempre foram temas difíceis e desafiadores e, por este motivo, desde 1986, estudiosos sobre o tema se reúnem em Baveno, Itália, para discutir diretrizes baseadas em elevado rigor científico e traçar metas de pesquisa científica.
Em abril de 2015 ocorreu o último workshop intitulado ”Estratificação de risco e individualização do cuidado da hipertensão portal ”, onde foram traçadas as diretrizes do Baveno VI. Os principais pontos de discussão foram o uso de métodos invasivos e não invasivos para o rastreio e vigilância das varizes gastroesofágicas e da hipertensão portal, o impacto do tratamento do fator etiológico na cirrose, prevenção primária da descompensação, manejo do episódio de sangramento agudo, prevenção de recorrência de hemorragia, outros eventos de descompensação hepática e doenças vasculares do fígado.
A primeira modificação proposta neste novo consenso tratou sobre a introdução do termo “doença hepática crônica avançada compensada”(cACLD). Acredita-se que, após introdução de novos métodos não invasivos de avaliação de fibrose hepática, como a elastografia transitória (TE), seja possível a identificação da doença hepática avançada em fases mais precoces e assintomáticas (1b; A). A proposta do termo doença hepática crônica avançada compensada foi proposto por acreditar que refletiria de forma mais abrangente o espectro dinâmico do processo de evolução entre a fibrose avançada e cirrose (5;D).
Segundo diretrizes do Baveno VI, a elastografia hepática transitória seria suficiente para suspeitar de cACLD, desde que em pacientes assintomáticos e com etiologia da doença hepática conhecida. Definiu-se como pontos de corte para validação da TE:
Foi recomendado, a fim de aumentar a confiabilidade do método, realização sempre de duas medidas da TE, em dias diferentes e em jejum, a despeito de não ser recomendação consensual para este procedimento. Os métodos invasivos deverão ser aplicados apenas quando o diagnóstico da doença hepática crônica for duvidoso ou em caso de necessidade de testes confirmatórios, sendo eles: endoscopia digestiva alta com pesquisa de varizes (1b;A), biópsia hepática (1a;A), quantificação de colágeno por histologia(2b;B) e medida do gradiente de pressão da veia hepática (GPVH)> 5mmHg (1b;A).
Define-se por hipertensão portal clinicamente significante (HPCS) níveis de GPVH superiores a 10mmHg, ponto de corte também para formação de varizes esofágicas. Mais uma vez, o método não invasivo ganhou espaço, podendo, a elastografia hepática, ser utilizada para inferir HPCS em pacientes com hepatites crônicas virais, identificando o grupo sob risco de apresentar varizes na endoscopia digestiva alta (EDA)(2b;B). Em pacientes com cACLD e resistência hepática ≤ 20 KPa associada a níveis de plaquetas ≥ 150.000, perfil com baixo risco de apresentar varizes com indicação de tratamento endoscópico, pode-se evitar screening endoscópico de varizes com segurança (1b;A). Estes pacientes precisam ser seguidos anualmente com elastografia transitória e contagem de plaquetas (5;D), caso a resistência hepática aumente ou contagem de plaquetas reduza, os pacientes deverão ser submetidos a endoscopia digestiva alta (5;D).
Entre os cenários apresentados no Baveno VI, destacou-se o impacto do tratamento etiológico da cirrose hepática, na intenção de prevenir hipertensão portal clinicamente significante, reduzindo níveis de pressão do sistema porta, e prevenindo descompensação da doença hepática (1b;A). Cofatores associados a progressão da doença hepática também foram pontuados, sendo encorajada abstinência alcoólica em todos os pacientes independente da etiologia (2b;B). O Baveno VI destacou o papel do estado nutricional dos indivíduos como fator prognóstico associado a doença hepática, chamando atenção para obesidade como marcador de agravamento de doença hepática avançada de qualquer etiologia. Recomendou-se, assim, mudança de estilo de vida baseada em dieta e exercício e, especialmente, redução de peso com objetivo de levar ao decréscimo do GPVH em pacientes obesos com cirrose hepática(2b;B). A desnutrição, por sua vez, tem impacto na sobrevida e desenvolvimento de ascite, encefalopatia e infecção de pacientes cirróticos (1b;A), sendo sugerido como pauta de novos estudos, a avaliação do impacto de tratamentos para melhorar o status nutricional no prognóstico e mortalidade de pacientes com cirrose hepática avançada(5;D).
Os betabloqueadores não seletivos (nadolol ou propranolol) ou tratamento endoscópico (ligadura elástica) permaneceram como recomendação de profilaxia primária de sangramento digestivo proveniente de varizes esofágicas de médio e grosso calibres (1a;B), sendo a escolha do método baseada na expertise do local (5;D). A novidade foi a introdução do carvedilol como opção de tratamento de primeira linha para profilaxia primária, considerado opção mais eficaz para este fim, a despeito da carência de mais estudos comparativos (1b;A).
No manejo do sangramento digestivo agudo varicoso, no momento pré-endoscopia, foi consenso uso de eritromicina intravenosa (250mg IV 30-120min antes da EDA), com objetivo de aumentar a visibilidade durante a endoscopia e reduzir a necessidade da realização de segundo exame para conclusão diagnóstica/terapêutica(1b;A). Mantiveram-se as orientações relacionadas às drogas vasoativas(1B), optando-se entre terlipressina, octreoctide ou somatostatina com igual eficácia para controle do sangramento agudo quando associado ao tratamento endoscópico. O Baveno VI orienta monitorar hiponatremia em pacientes em uso de terlipressina, especialmente aqueles com função hepática preservada.
Antibioticoprofilaxia deve ser iniciada na admissão hospitalar(1a;A), sendo optado pela ceftriaxona 1g/24h intravenosa em pacientes com doença hepática avançada (1b;A), em hospitais com elevada prevalência de resistência a quinolonas ou em uso de profilaxia prévia (5;D). As características do paciente e do local devem ser avaliadas para determinar a melhor profilaxia (5;D). Atualmente, rediscute-se a indicação de profilaxia de infecções em pacientes Child A, pois admite-se baixo risco de infecção neste grupo; porém, estudos ainda necessitam ser realizados (2b;B). O Baveno VI embasou a recomendação do tratamento profilático de encefalopatia hepática em pacientes com sangramento digestivo varicoso, sendo sugerido uso de rifaximina e lactulose para este fim (1b;A), baseando-se, também, em diretrizes da European Association for the Study of the Liver.
No manejo do sangramento agudo, a sequencia que inclui estabilização hemodinâmica e realização de endoscopia nas primeiras 12h da apresentação não foi alterada:
Neste item, merece destaque a recomendação de prevenção do ressangramento por VG, com injeção adicional de cola após 2 a 4 semanas após o episódio inicial, podendo, alternativamente, ser introduzido BBNS ou ambos tratamentos combinados ou TIPS (5;D). Em pacientes Child C<14 ou Child B com sangramento ativo por VE, GOV1 e GOV2, considerados com alto risco para falha de tratamento ao tratamento farmacológico e endoscópico inicial, foi reforçada indicação do TIPS precoce nas primeiras 72h, idealmente nas primeiras 24h, mas os critérios de alto risco ainda precisam ser refinados.
Em sangramentos agudos refratários, o stent metálico esofágico coberto autoexpansível foi apontado como opção mais segura e eficaz (4;C). Já o balão tamponado não foi contraindicado, entretanto, as chances de complicações foram destacadas, além da necessidade de monitoramento intensivo (5;D). Técnicas como hemospray, BRTO (balloon-occluded retrograde transvenous obliteration) e coil foram discutidos, contudo ainda não haviam evidências que sustentassem recomendações neste consenso.
No tocante a profilaxia secundária de ressangramento, a primeira linha de tratamento permaneceu a combinação de terapêutica endoscópica e medicamentosa(1a;A). Ratificou-se que BBNS podem ser utilizados como monoterapia em pacientes com cirrose inaptos ao tratamento com LE (1a;A), contudo LE não deve ser considerada como monoterapia, a menos em caso de intolerância ou contraindicações para os BBNS (1a;A). O carvedilol não foi recomendado para profilaxia secundária de sangramento varicoso (5;D), por falta de evidências científicas. O TIPS é o tratamento de escolha para pacientes que falharam ao esquema terapêutico de primeira linha (LE+BBNS) (2b;B).
Baseado em ressalvas dos últimos guidelines internacionais, os quais demonstraram aumento de mortalidade associado ao uso de betabloqueadores em pacientes cirróticos com doença avançada e descompensada, ponderou-se a recomendação de uso. A indicação de BBNS para profilaxia primária de sangramento digestivo varicoso em caso de ascite refratária e/ou diagnóstico de peritonite bacteriana deve ser feita com prudência, sendo a medicação descontinuada na presença de hipotensão (2b;B). Porém, uma vez interrompido o uso de BBNS, a ligadura elástica deve ser o método de escolha.
Em pacientes com ascite refratária e indicação de profilaxia secundária de sangramento varicoso, orienta-se uso de BBNS de forma cautelosa, monitorando dados laboratoriais e hemodinâmicos (4;C). Os BBNS devem ter a dose reduzida ou ser descontinuados caso os pacientes desenvolvam hipotensão sistólica (PAS<90mmHg), insuficiência renal aguda ou hiponatremia (Na<130mEq/L) (5;D). Entretanto, as consequências da descontinuação do BBNS na profilaxia secundaria são desconhecidas. Em caso de intolerância persistente aos BBNS, o TIPS deverá ser considerado. Ao se identificar um evento claramente precipitante da descompensação hepática, p. ex. peritonite bacteriana espontânea, após resolução desta condição, o BBNS poderá ser reiniciado em doses tituladas (5; D). Salientou-se a necessidade de novos estudos avaliando a segurança de BBNS no contexto da doença avançada descompensada.
O Baveno VI revisou o tópico sobre doenças vasculares do fígado na síndrome de hipertensão portal de etiologia cirrótica e não cirrótica, as orientações sobre anticoagulação e uso de drogas antiplaquetárias. Chama atenção neste item os dados que corroboram com uso de heparina de baixo peso molecular e antagonistas da vitamina K, medicamentos largamente aceitos e utilizados em tromboses primárias do sistema venoso portal (1b;A) e em pacientes com cACLD. Além disso, devido número limitado de dados na literatura, nenhuma indicação pôde ser feita para o uso de novos anticoagulantes orais e drogas antiplaquetárias para pacientes com doença crônica avançada do fígado(5;A). Descreveu-se, também, a definição de critérios diagnósticos para hipertensão portal idiopática ou fibrose portal não-cirrótica e orientações de manejo, incluindo doppler a cada 6 meses (5;D) e início de anticoagulação em caso de trombose de veia porta (5;D).
O consenso foi publicado no Journal of Hepatology e pode ser acessado gratuitamente aqui.
Referência:
de Franchis R; Baveno VI Faculty. Expanding consensus in portal hypertension: Report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension. J Hepatol. 2015 Sep;63(3):743-52. doi: 10.1016/j.jhep.2015.05.022
http://www.journal-of-hepatology.eu/article/S0168-8278(15)00349-9/fulltext