A fístula enterocutânea é definida como uma comunicação do trato gastrointestinal com a pele ou em ferida aberta (fístula enteroatmosférica). Em mais de 2/3 dos casos, elas decorrem de manipulação cirúrgica prévia (recentemente também associada a procedimentos endoscópicos terapêuticos), com mortalidade global de 15-25% [1]. É uma condição de alta morbidade, usualmente necessitando de internação prolongada. O tratamento das fístulas gastrointestinais requer um manejo multidisciplinar, indo desde o diagnóstico (clínico ou por imagem), controle de infecção, nutrição, avaliação para necessidade de drenagem de coleções até a escolha do melhor método de intervenção para o seu fechamento.
As fístulas enterocutâneas podem ser classificadas em superficiais (trajeto curto-menores que 2 cm de extensão ou labiadas) ou profundas (trajeto longo) e com alto (acima de 500 mL/24 horas) ou baixo débito (abaixo de 200 mL/24 horas). Fatores como obstrução distal, presença de coleções/cavitações com abscesso, desnutrição importante, neoplasia e irradiação prévia estão associados a menor chance de fechamento da fístula.
Sempre que possível, o tratamento minimamente invasivo é a primeira escolha, mas, em casos de fístulas com contaminação grosseira de cavidades, septicemia e/ou instabilidade hemodinâmica ou fístulas atmosféricas labiadas (intestino exposto com evisceração), a abordagem cirúrgica deve ser considerada. Para fístulas com orifício interno pequeno (abaixo de 5 mm) e baixo débito, o uso de selantes deve ser considerado como primeira alternativa.
O uso de selante injetado por meio endoscópico foi descrito pela primeira vez em 1990, quando Eleftheriadis et al reportaram o uso de cola de fibrina para tratamento de fístulas enterocutâneas [3].
Desde então, várias técnicas de tratamento de fístulas gastrointestinais foram desenvolvidas, com ótimos resultados no manejo dessas complicações. Em 2015, o mesmo grupo grego publicou série de 25 anos de experiência do uso de selantes (fibrina e cianoacrilato) em 63 pacientes, com sucesso clínico e técnico de 96,8%, a maior série institucional reportada até o momento [4].
O uso de selantes para o fechamento de fístulas gastrointestinais consiste na injeção de uma substância líquida biocompatível com capacidade de solidificação dentro do trajeto fistuloso. Essa técnica requer, portanto, o uso de um cateter fino dentro do trajeto fistuloso, este usualmente inserido com auxílio de fio-guia. A injeção pode ocorrer a partir do orifício interno (endoscópico) e externo (percutâneo). A injeção de selantes por cateter no trajeto fistuloso é uma técnica muito segura com risco muito baixo, usualmente relacionados à reação ao agente selante (ex. aprotinina bovina – cola de fibrina) ou ao risco anestésico do próprio ato endoscópico. Os raros relatos de embolia aérea estão relacionados ao uso concomitante de fistuloscopia (introdução do endoscópio por dentro do trajeto fistuloso e insuflação aérea). O uso de cianoacrilato em grande quantidade no trajeto fistuloso pode teoricamente originar infecção e reação de corpo estranho, como visto em uso para colagem de tela sintética para tratamento de hérnias inguinais.
Para a aplicação dos selantes, recomenda-se realizar escarificação do trajeto fistuloso com intuito de aumentar a resposta inflamatória e consequente retração cicatricial. Isso pode ser feito com uso de uma escova de citologia biliar e coagulação com plasma de argônio em baixa potência. O uso de selantes pode ser combinado com próteses digestivas ou sutura endoscópica [5], para garantir selamento ou mesmo telas biológicas servindo como matriz/ancoragem [6].
O cianoacrilato e a cola de fibrina se destacam entre os selantes tissulares comercialmente disponíveis no Brasil, com características biológicas distintas. Existem outros materiais utilizados como selantes cirúrgicos, como a mistura de albumina/gluraldeído, cujos resultados preliminares na utilização em fechamento de fístulas perianais foram associados à sepse perineal [7].
A cola de fibrina possui a vantagem de ser facilmente reabsorvível, porém, mediante contato de secreções digestivas, ela pode se dissolver precocemente antes que ocorra a cicatrização do trajeto. Os dois componentes principais da cola de fibrina são o fibrinogênio humano reconstituído com aprotinina bovina sintética e a trombina reconstituída com cloridrato cálcio, que, quando misturados, formam um coágulo de fibrina (em um processo semelhante à coagulação sanguínea). O mecanismo de ação da cola de fibrina é bloquear a passagem do conteúdo gastrointestinal e promover reparo cicatricial através de migração celular local e angiogênese com proliferação fibroblástica e de queratinócitos. A cola de fibrina possui também propriedades hemostáticas, sendo utilizada em tratamento de hemorragia digestiva por injeção direta [7].
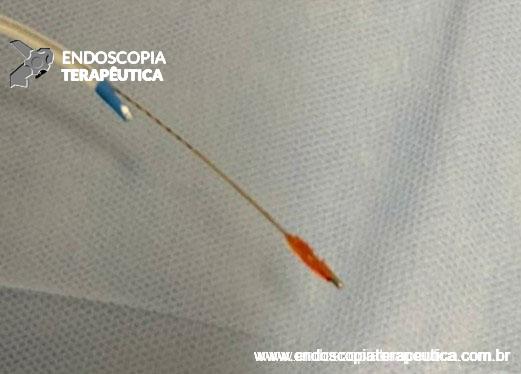
Para aplicação de cola de fibrina no trajeto fistuloso, idealmente deve-se realizar infusão através de mecanismo de dupla seringa para evitar solidificação do mesmo no trajeto. Os kits comerciais disponíveis no Brasil possuem um conector em Y junto à saída da seringa e um cateter lúmen único curto com finalidade para injeção em campo cirúrgico ou percutâneo. O uso de fibrina por via endoscópica requer um cateter longo, sendo necessária a utilização de um cateter coaxial com lúmen bipartido ou duplo-lúmen em paralelo (este fabricado de forma caseira como alternativa) para que a mistura dos componentes ocorra em sua extremidade, evitando-se a solidificação da mesma no trajeto (FIGURA 1). O cateter com lúmen bipartido possui um calibre menor (existem modelos comerciais a partir de 1.9 mm, não disponíveis no Brasil) comparado ao alinhamento caseiro de 2 cateteres. Outra dificuldade na utilização de um cateter longo é a extrusão de todo o componente retido no cateter, visto que o volume utilizado é pequeno – lembramos que uma agulha de 23G (1.9Fr) com 180 cm de comprimento pode reter mais de 2 mL de líquido em seu interior. A diferença de viscosidade das duas soluções pode levar a velocidades de infusão diferentes; deve-se atentar ao tipo de seringa utilizado com intuito de se atingir a proporção de injeção de 1:1. O uso de gás carbônico facilita a extrusão do material.

Figura 1 – cateter fibrina corte longitudinal e transversal
Figura 3 – Dispositivo para injeção de gás carbônico a ser utilizado para injeção de cola de fibrina (extraído de www.nordsonmedical.com) O uso de cola de fibrina humana autóloga com a centrifugação do soro do próprio paciente para obtenção de cola de fibrina foi utilizado em 2 casos de fístula esofágica, com sucesso [8]. Nesses casos, a injeção é realizada na submucosa ao redor da fístula com agulha. No Brasil, não dispomos de cateter duplo-lúmen coaxial endoscópico para uso comercial. Para fabricar de forma caseira um cateter duplo-lúmen, podem-se utilizar 2 cateteres de colangiografia finos (a partir de 4Fr) ou 2 bainhas de cateter de injeção endoscópica de 23G (retiradas as agulhas e remontado o cateter), alinhados paralelamente (FIGURA 2). Essa última opção tem sido nossa preferência devido ao custo (FIGURA 3). Deve-se atentar ao calibre obtido, pois o seu uso requer um canal de trabalho terapêutico (a partir de 3.8 mm). Na falta de um cateter duplo-lúmen, outra opção descrita é realizar a injeção sequencial através de um cateter com lúmen único. O uso de cateter de colangiografia duplo lúmen de troca rápida não deve ser utilizado pelo risco de vazamento lateral [9].
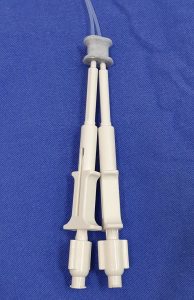
Figura 2 – Cateter injetor para cola de fibrina fabricado a partir de bainha de agulha injetora para endoscopia, dispostos paralelamente
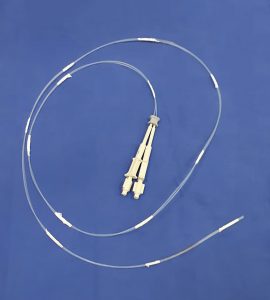
Figura 3 – Cateter injetor para cola de fibrina fabricado a partir de bainha de agulha injetora para endoscopia, dispostos paralelamente. Detalhe – fixador de cateter
Para uso em endoscopia, o cianoacrilato apresenta-se em 2 fórmulas [10]: o N-butil 2-cianoacrilato, também conhecido como embucrilato e comercializado no Brasil como Histoacryl (B. Braun Medical, Bethlehem, PA). O ocrilato, por sua vez, possui 8 carbonos em sua fórmula (2-octyl cyanoacrylate) e é comercializado no Brasil como Dermabond (Johnson & Johnson, New Bruns- wick, NJ). O Glubran 2 (GEM, Viareggio, Italy) contém metacriloxi sulfalano, o qual aumenta o tempo de polimerização e reduz a produção de calor reacional. O lipiodol é recomendado para utilização de mistura com enbucrilato na proporção de 1:1 a 1:1.6, com a vantagem de reduzir o tempo de polimerização e permitir visualização radiológica. Após injeção, a lavagem do cateter deve ser feita com água destilada. Ambas as versões farmacológicas de ocrilato não requerem uso de lipiodol e podem ser lavadas com solução salina fisiológica. As técnicas de injeção são as mesmas recomendadas para tratamento de varizes gástricas, com a diferença de a injeção ser por meio de um cateter dentro do trajeto da fístula.
Descrevemos um caso em que foi usada terapia a vácuo e colagem de fibrina por via endoscópica com sucesso como modalidade terapêutica para fístula traqueoesofágica pós esofagectomia.
O desenvolvimento de fístula traqueoesofágica (TE) é uma rara complicação associada a uma alta mortalidade em pacientes submetidos à esofagectomia. Estudos mostram que, caso a fístula TE não tenha cicatrização dentro de um período de 4 a 6 semanas, o tratamento conservador deve ser abandonado. Opções de tratamento hoje dependem de condições, como vascularização do conduto gástrico, a gravidade da pneumonia aspirativa e o volume do vazamento de ar, e usualmente podem incluir tanto intervenção cirúrgica com uso de retalhos como endoscópica com colocação de prótese intraluminal. Em outubro 2019, um indivíduo do sexo masculino de 53 anos com quadro de disfagia, astenia e emagrecimento apresentou diagnóstico de carcinoma escamocelular em esôfago distal, moderadamente diferenciado, invasor (EC III). Entre novembro e dezembro de 2019, fez tratamento neoadjuvante com quimioterapia e radioterapia (cross trial). Após exames de re-estadiamento, foi optado por esofagectomia total em 3 campos com acesso torácico por videocirurgia e reconstrução utilizando tubo gástrico em janeiro de 2020.
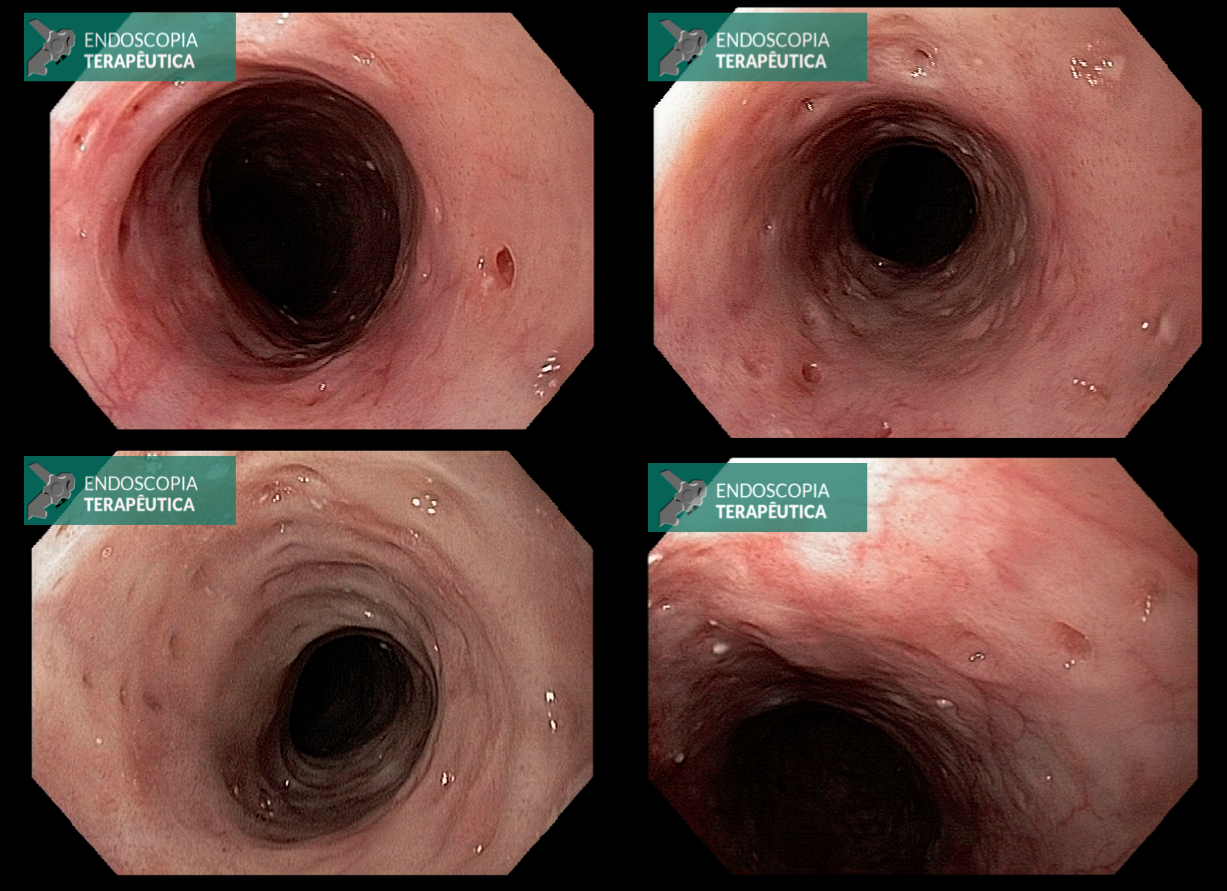
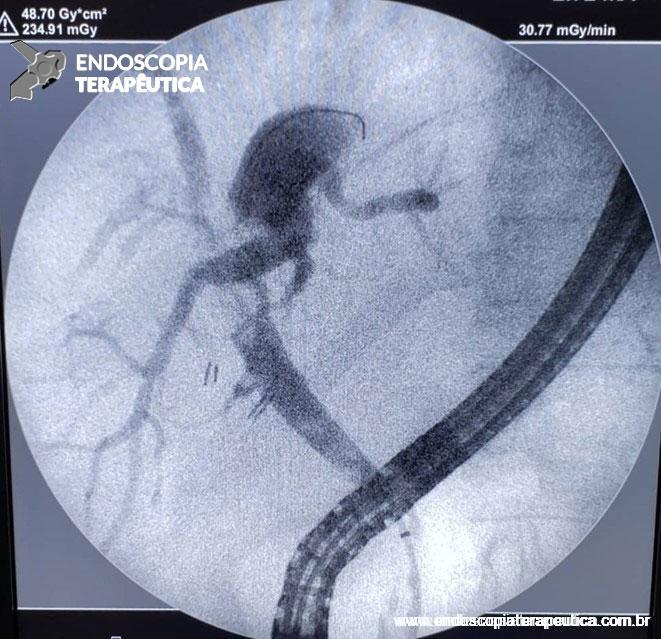
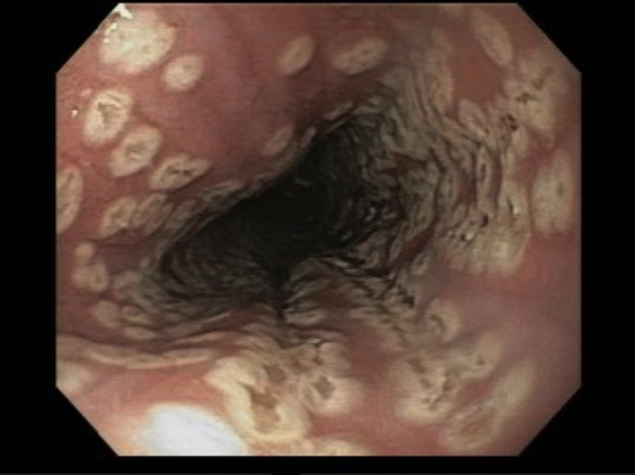
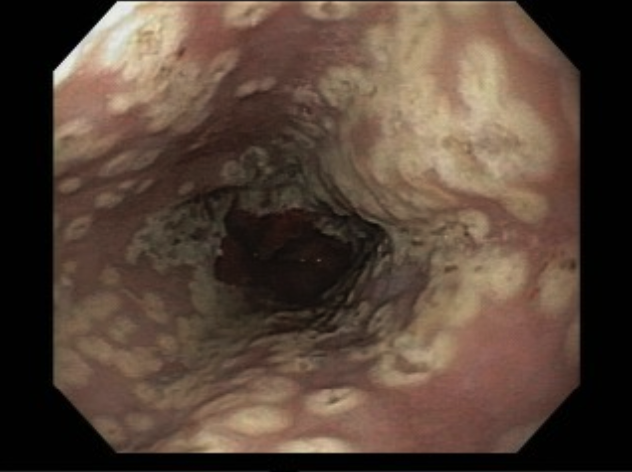
O pós-operatório (PO) se deu em UTI, sem necessidade de ventilação mecânica e em boas condições hemodinâmicas, com uso de baixas doses de drogas vasoativas. No 4º dia PO, o dreno em região cervical demonstrou alto débito de aspecto bilioso, sendo indicada tomografia de tórax, que visualizou uma coleção pequena entre tubo gástrico e traqueia com pequena quantidade de ar, derrame pleural à esquerda com focos de consolidação e pequeno pneumotórax. No 12º PO, iniciou com instabilidade hemodinâmica associada a desconforto respiratório e saída de ar pela ferida cervical, com necessidade de intubação orotraqueal e estabilização em UTI. Uma fibrobroncoscopia diagnóstica revelou traqueobronquite aguda leve com secreção purulenta abundante à esquerda e presença de fístula traqueomediastinal em traqueia distal, sendo realizada reabordagem cirúrgica com enxerto bovino para fechamento da mesma, sem sucesso. Após tratamento conservador com jejum e nutrição parenteral por 18 dias, sem melhora significativa do quadro, foi optado por intervenção endoscópica com terapia a vácuo. Realizou tratamento endoscópico por terapia utilizando pressão negativa (vácuo) intraluminal esofágico por 3 semanas, com trocas e reavaliações periódicas (a cada 5 dias), até redução significativa do orifício fistuloso (FIGURA 4). Em abril de 2020, realizou exame contrastado deglutido, o qual evidenciou pequeno trajeto fistuloso. Foi submetido à nova abordagem endoscópica com injeção de cola de fibrina (FIGURA 5), recebendo alta 1 semana após. Em retorno em agosto de 2021, o paciente referiu melhora clínica, sem queixas de disfagia ou respiratórias, e exames contrastado e endoscópico revelaram fechamento completo da fístula (FIGURA 6).
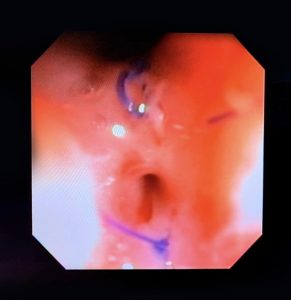
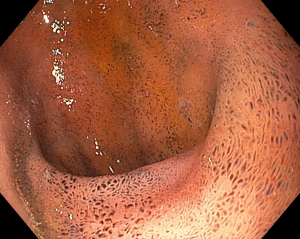
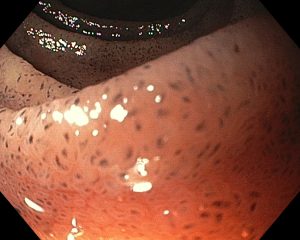
Figura 4 – Orifício fistuloso em anastomose esôfago-gástrica puntiforme, com comunicação traqueal
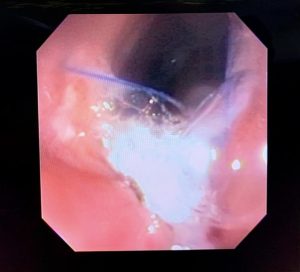
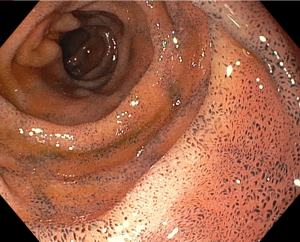
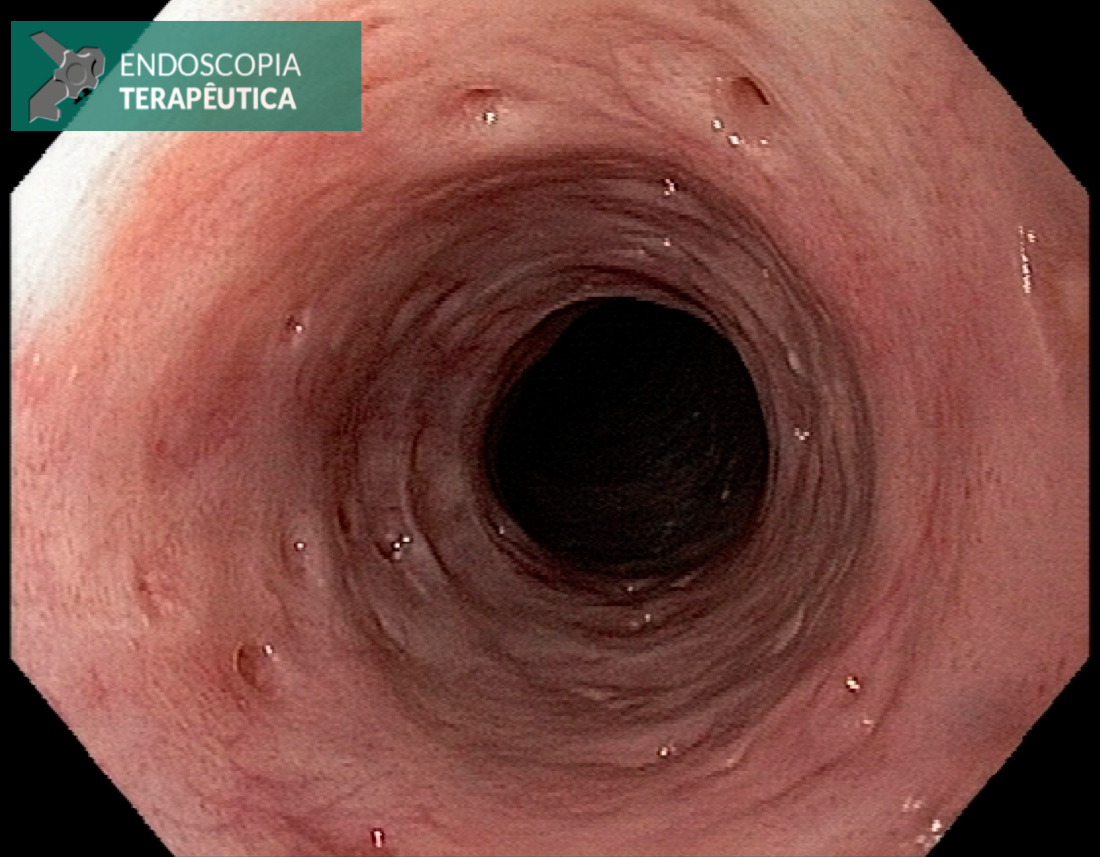
Figura 5 – Orifício fistuloso em anastomose esôfago-gástrica após injeção de cola de fibrina
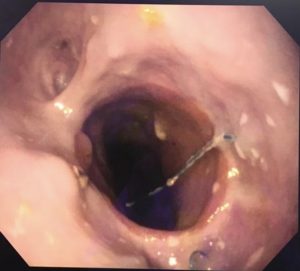
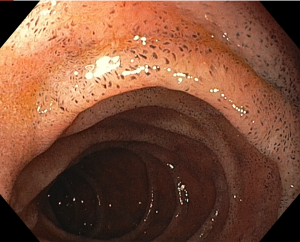
Figura 6 – Anastomose esôfago-gástrica prévia e ampla, sem solução de continuidade
Autores
Eduardo A. Bonin*
Larissa M. S. Gomide*
Bruno Verschoor*
Ricardo S. de Bem*
Leticia Rosevics*
Bruna S. Fossati*
* Serviço de Endoscopia Digestiva, Hospital de Clínicas (UFPR)
Ilustrações
Rodrigo R. Tonan
Como citar este artigo
Bonin EA, Gomide LMS, Verschoor B, Bem RS, Rosevics L, Fossati BS. Uso de adesivos tissulares para fechamento de fístulas do trato digestivo. Endoscopia Terapêutica; 2021. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/uso-de-adesivos-tissulares-para-fechamento-de-fistulas-do-trato-digestivo/
Referências
- Management Approaches for Enterocutaneous Fistulas. Heimroth J, Chen E, Sutton E. Am Surg. 2018 Mar 1;84(3):326-333.
- Bhurwal A, Mutneja H, Tawadross A, Pioppo L, Brahmbhatt B. Gastrointestinal fistula endoscopic closure techniques. Ann Gastroenterol. 2020;33(6):554-562.
- Eleftheriadis E, Tzartinoglou E, Kotzampassi K, Aletras H. Early endoscopic fibrin sealing of high-output postoperative enterocutaneous fistulas. Acta Chir Scand. 1990 Sep;156(9):625-8.
- Kotzampassi K, Eleftheriadis E. Tissue sealants in endoscopic applications for anastomotic leakage during a 25-year period. Surgery. 2015 Jan;157(1):79-86.
- Bonin EA, Wong Kee Song LM, Gostout ZS, Bingener J, Gostout CJ. Closure of a persistent esophagopleural fistula assisted by a novel endoscopic suturing system. Endoscopy. 2012;44 Suppl 2 UCTN:E8-9.
- Abbas MA, Tejirian T. Bioglue for the treatment of anal fistula is associated with acute anal sepsis. Dis Colon Rectum. 2008 Jul;51(7):1155; author reply 1156.
- Böhm G, Mossdorf A, Klink C, Klinge U, Jansen M, Schumpelick V, Truong S. Treatment algorithm for postoperative upper gastrointestinal fistulas and leaks using combined vicryl plug and fibrin glue. Endoscopy. 2010 Jul;42(7):599-602. doi: 10.1055/s-0029-1244165.
- Iwase H, Kusugamf K, Tuzuki T, Suga S, Furuta R, Nakamura M, Funaki Y, Honjyo T, Kojima K, Maeda O. Endoscopic Fibrin Glue Injection with Coaxial Double Lumen Needle for Severe Upper Gastrointestinal Bleeding. Dig Endosc. 1998 Oct;10(4):335-342.
- Lucas M, Seeber P. Use of autologous fibringlue for endoscopic treatment of esophageal lesions. Endosc Int Open. 2015;3(5): E405-E408.
- Kumar N, Larsen MC, Thompson CC. Endoscopic Management of Gastrointestinal Fistulae. Gastroenterol Hepatol (N Y). 2014;10(8):495-452.
- Cameron R, Binmoeller KF. Cyanoacrylate applications in the GI tract. Gastrointest Endosc. 2013 Jun;77(6):846-57.
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!