Baveno VII: O que há de novo (entre 2015 e 2021)?
Histórico :
A condução da hipertensão portal (HP) é a motivação principal para reuniões sequenciais, desde 1986, na Holanda e, desde 1990, em Baveno, Itália (Baveno I). Em 2016, formou-se a Cooperação Baveno, com objetivo de expandir a colaboração com especialistas e pesquisadores do tema e, em 2019, a parceria entre Associação Europeia para o Estudo do Fígado (EASL) apoiou como consórcio oficial da EASL. É notório que as reuniões têm ampliado cada vez mais as perspectivas do cuidado ao paciente com síndrome de hipertensão portal, definindo eventos-chave, revisando rigorosamente as evidências científicas sobre a história natural, diagnóstico, prognóstico e terapêutica, gerando recomendações para orientar o manejo de pacientes, além de agenda de estudos científicos. No Baveno VI, o conceito de doença hepática crônica avançada compensada foi sugerido com base em testes não invasivos, uma vez que o termo “cirrose” poderia limitar o espectro da avaliação da patologia. Extrapolando essa análise, o Baveno VII, intitulado “Cuidados Personalizados da Hipertensão Portal”, versou sobre pacientes com doença hepática crônica avançada e os dois estágios possíveis, com e sem hipertensão portal clinicamente significante (HPCS)(1). O conceito de (re)compensação e seus parâmetros foram, pela primeira vez, introduzidos na discussão, baseados em critérios clínicos e parâmetros não-invasivos.
Medida da Hipertensão Portal e definições:
A medida do gradiente de pressão portal foi ratificada como padrão-ouro para avaliar HP, sendo o melhor parâmetro a medida do gradiente de pressão da veia hepática (GPVH). Parâmetros para realização da medida invasiva do GPVH foram estabelecidos, buscando minimizar erros. Foi orientado uso de cateter de oclusão de balão compatível com orifício na extremidade ao invés de cateter reto convencional, para reduzir o erro aleatório das medições da pressão da veia hepática em cunha (A.1); sugeriu-se injetar pequeno volume de contraste ao inflar o balão de oclusão para confirmar a posição e afastar a presença de shunts, os quais levariam a subestimar medidas do gradiente de pressão (A.1). A sedação leve e consciente também foi recomendada, no intuito de impedir medidas subestimadas de pressão portal associadas à sedação profunda (B.1); com sugestão de uso de Midazolam em baixa dose (0,02 mg/kg) por não modificar o HVPG (B.1).
Orientações para mensurar a pressão de oclusão da veia hepática foram feitas, recomendando-se período de estabilização mínima de um minuto, além de registro em triplicata (D,1). Quanto à pressão da veia hepática livre (FHVP), recomendou-se medida na veia hepática (VH), dentro de 2-3 cm da confluência VH-veia cava inferior (VCI). Se a FHVP estiver mais de 2 mmHg acima das pressões da VCI, a presença de obstrução do fluxo da veia hepática deve ser descartada com a injeção de uma pequena quantidade de meio de contraste (A.1). Estas e outras orientações para padronizar métodos e ajudar a reduzir erros foram abordadas e fazem sentido discutir com equipes de hemodinâmica.
A HPCS é definida como GPVH ≥10 mmHg (A.1), porém, em caso de pacientes com colangite biliar primária, com componente pré-sinusoidal adicional, o GPVH pode subestimar gravidade da HP (B.1). Já em cirrose por NASH, chamou-se atenção que os sinais de HPCS também podem estar presentes em uma pequena proporção de pacientes com valores inferiores a 10mmHg (C.2) e, sempre que for observado doença hepática crônica e sinais clínicos de hipertensão portal, mas com GPVH <10 mmHg, a doença vascular porto-sinusoidal deve ser descartada (B.1).
Embora o conceito de HPCS seja orientado por medidas invasivas, os testes não-invasivos têm sido apontados como suficientemente precisos para estimá-la na prática clínica (A.1), sobretudo se associados às manifestações clínicas e laboratoriais. Na tabela 1 seguem recomendações para estimativas de HPCS baseada em medida da rigidez hepática (LSM) por elastografia transitória (TE) e nível sérico de plaquetas. A medida da elastografia esplênica foi recomendada, quando possível, como ferramenta para identificar risco de HPCS e varizes com risco de hemorragia digestiva alta (HDA, em pacientes com hepatites B e C).

Tabela 1
Neste consenso, a LSM (independentemente da técnica utilizada) é identificada como ferramenta de avaliação de prognóstico e seguimento em pacientes com doença crônica hepática avançada (A.1). Sugere-se utilizar a “regra dos cinco”, baseada na elastografia transitória (LSM-TE) para identificar riscos relativos de descompensação e morte, independentemente da etiologia da doença hepática crônica (B.1) (Figura 1). Nesta regra, LSM < 5kPa é considerada normal, se menor de 10kPa exclui doença crônica avançada; LSM < 15kPA e plaquetas > 150mil exclui HPCS; bem como persiste válido o critério do Baveno VI para postergar a endoscopia, com níveis de plaquetas superiores a 150mil associado a LSM < 20kPa.
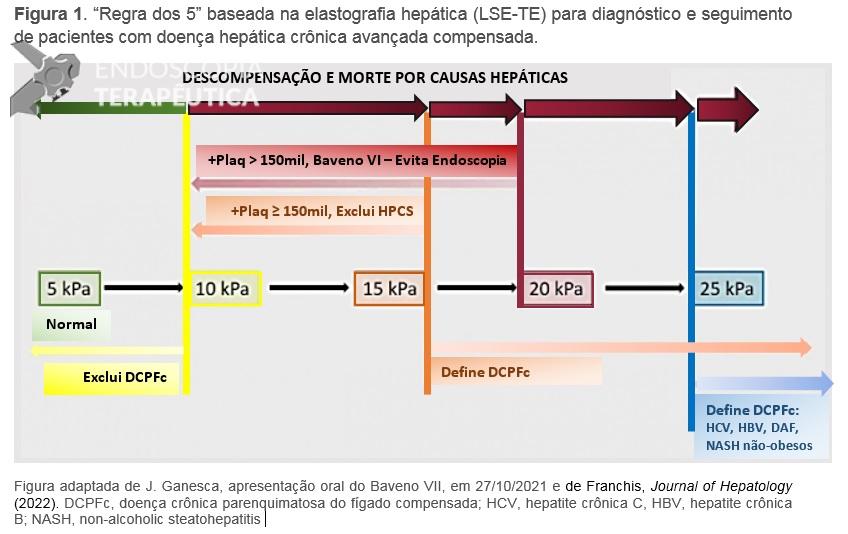
Figura 1
Um ponto interessante foi o monitoramento de pacientes utilizando o LSM-TE, onde sugere-se que pacientes com valores entre 7-10 kPa sejam monitorados quanto às alterações que indiquem progressão da doença crônica parenquimatosa do fígado (DCPF) (C.2). O TE pode ter resultados falso-positivos, portanto LSM ≥10 kPa deve ser repetido em jejum ou associados aos marcadores séricos de fibrose (FIB-4 ≥2,67, ELF ≥9,8, FibroTest ≥ 0,58 para álcool/vírus, FibroTest≥0,48 para NAFLD) para ratificar seus achados (B.2). No geral, recomenda-se checar LSM anualmente para seguimento da DCPF e, se detectada diminuição clinicamente significativa nos valores (redução ≥20% em pacientes com LSM <20 kPa ou qualquer diminuição para LSM <10 kPa), tem-se um risco reduzido de descompensação e morte (C.2).
O Baveno VII introduziu a possibilidade da elastografia esplênica (SSM) como instrumento para identificar HPCS e varizes esofágicas com risco de sangramento em pacientes com hepatites B e C. Aqueles que não preenchem critérios do Baveno VI para evitar a endoscopia digestiva, checar se SSM<40kPa por TE é uma possibilidade, a fim de identificar aqueles com de baixa probabilidade de varizes com risco e postergar a EDA (C;2). Este tópico merece discussão, dado que a medida da elastografia do baço requer mais evidências, além de estabelecer qual melhor técnica e os pontos de corte a serem utilizados. Contudo, progredirmos com exames de imagem multiparamétricos, com associando informações úteis sobre diagnóstico e prognóstico parece ser algo interessante e que pode aumentar a precisão dos métodos.
Ainda sobre prognóstico, muito pouco se falou sobre o risco cirúrgico em pacientes com HPCS no Baveno VII, a despeito de algumas evidências obtidas ao longo dos anos. Considerou-se que HPCS (GPVH ≥10 mmHg ou evidências clínicas) está associada a maior risco de descompensação e mortalidade em pacientes com DCPF submetidos à ressecção hepática devido carcinoma hepatocelular (A.1) e que, em candidatos à cirurgia abdominal não-hepática, o GPVH ≥16 mmHg está associado ao aumento do risco de mortalidade a curto prazo no pós-operatório (C.1). Critérios prognósticos como Child-Pugh ou MELD não foram considerados nestas afirmações, nem o tipo de complexidade de outros procedimentos cirúrgicos.
Impacto do tratamento etiológico na HPCS:
Após os antivirais de ação direta no tratamento da hepatite C, foi possível avaliar melhor o impacto da ausência de fatores etiológicos em pacientes com doença hepática crônica. Conforme o Baveno, pacientes com DCPF induzida por HCV que atingiram RVS e mostraram melhora, pós-tratamento, consistentes com valores de LSM <12kPa e plaquetas >150mil poderiam receber alta da vigilância da hipertensão portal (LSM e endoscopia), por não apresentarem HPCS e risco baixíssimo de descompensação; contudo, a vigilância do carcinoma hepatocelular permaneceria até mais dados disponíveis (B.1). Acrescenta-se ainda que, em pacientes com DCPF compensada e em terapia com betabloqueadores não-seletivos (BBNS) e sem HPCS (LSM <25kPa), após a remoção/supressão do fator etiológico primário, a endoscopia deveria ser repetida após 1-2 anos; e, na ausência de varizes, a terapia com BBNS seria descontinuada (C.2). Ao longo dos últimos anos aprendemos que os BBNS não só estavam associados às menores chances de sangramento varicoso, mas também a menos descompensação das doenças hepáticas. Com evidência C.2, será que estamos seguros para suspender o BBNS baseado nas evidências atuais? O Baveno coloca uma agenda de pesquisa onde o impacto da remoção dos fatores etiológicos primários não-virais e estratificação de risco em longo prazo seja avaliado, o que pode nos trazer algumas respostas.
Em revisão sistemática e metanálise, o uso de estatinas reduziu em 46% o risco de descompensação hepática e mortalidade por todas as causas, além de 27% menos risco de progressão de hipertensão portal.(2) Baseado em dados como estes, o uso de estatinas foi incentivado em pacientes com indicação formal além da com HPCS, devido ação na redução da pressão portal (A.1) e melhora na sobrevida global (B.1). Em pacientes com cirrose Child-Pugh B e C, as estatinas devem ser usadas em dose mais baixa (sinvastatina no máximo 20mg/d) e os pacientes devem ser acompanhados de perto para toxicidade muscular e hepática (A,1). Na cirrose Child-Pugh C, o benefício das estatinas ainda não foi comprovado (D.1).
Existe razão inversa entre o risco de carcinoma hepatocelular (CHC), mortalidade e a duração do uso de Aspirina: 31% menor risco de CHC, 27% menos mortalidade entre os usuários de Aspirina e sem aumento do risco de sangramento gastrointestinal (7.8% AAS e sem-AAS 6.9%)(3). Conforme recomendações do Baveno VII, o uso da Aspirina não deve ser desencorajado em pacientes com cirrose e indicação aprovada para aspirina, pois pode reduzir o risco de carcinoma hepatocelular, complicações relacionadas ao fígado e morte (B.2). Estudos apontam que aspirina pós-TIPS aumenta sobrevida pós-transplante.
A profilaxia antibiótica primária é recomendada em pacientes selecionados com alto risco de peritonite bacteriana espontânea (hemorragia GI, Child-Pugh C com proteína baixa no liquido ascítico) (B.1). A profilaxia antibiótica secundária é indicada em pacientes com peritonite bacteriana espontânea (PBE) prévia (A.1) O perfil de resistência local deve ser considerado para escolher o antibiótico, a despeito da recomendação usual de cefalosporina de terceira geração.
A rifaximina, na dose de 550mg, via oral, 2 vezes ao dia, é indicada para a profilaxia secundária da encefalopatia hepática (A,1) e deve ser considerada para profilaxia e tratamento de encefalopatia hepática em pacientes submetidos a TIPS (B.2). A rifaximina não é indicada para profilaxia primária ou secundária de PBE. (C.1)
Um tema controverso foi a administração de albumina a longo prazo em pacientes com cirrose descompensada. Estudo demostrou redução de 38% na mortalidade no grupo que usou albumina prolongada e redução das complicações; contudo trials com objetivos similares apresentaram resultados negativos, também com número e perfil de pacientes selecionados diferentes, além de posologias e tempo de seguimento também não comparáveis. Mesmo assim, albumina prolongada foi recomendada, acreditando-se na redução de complicações e melhora da sobrevida livre de transplante hepático em pacientes com ascite não complicada, a despeito de necessitar de mais dados para avaliação (B.2). A administração de albumina em curto prazo persiste indicada para PBE (A,1), Lesão Renal Aguda > estágio 1A (C.1), paracentese de grande volume (A.1) e Síndrome Hepatorrenal-LRA (combinado com terlipressina) (B.1).
Prevenção da primeira descompensação:
O objetivo do tratamento na doença crônica avançada compensada é prevenir as complicações que definem a descompensação. (A.1) A definição de descompensação foi esclarecida neste consenso, sendo os eventos que marcam a sua presença: ascite evidente (ou derrame pleural com GASA aumentado (> 1,1 g/dL), encefalopatia hepática (West Haven≥ 2) e sangramento de varizes (B.1); devendo ser consideradas condições como ACLF, carcinoma hepatocelular (B1), infecções bacterianas e cirurgia de grande porte (B.1).
Ainda são necessárias evidências para definir se quantidade mínima de ascite detectada apenas em procedimentos de imagem, encefalopatia hepática mínima e sangramento oculto de gastroenteropatia hipertensiva portal podem ser considerados como descompensação (D.1). Outro ponto de discussão foi se icterícia isoladamente, em etiologias não colestáticas, poderia ser considerada primeira como descompensação ou se refletiria lesão hepática/ACLF sobreposta na cirrose compensada, informação que requer mais pesquisas (D.1).
Chama atenção que o BBNS vem como indicação de prevenir descompensação em pacientes com HPCS, inferência realizada baseada em medicas clínicas e métodos não-invasivos, e não apenas na prevenção de hemorragia varicosa. Não há evidências de que terapias endoscópicas como ligadura elástica ou cola tissular possam prevenir ascite ou encefalopatia hepática (D.1), logo pacientes com cirrose compensada em uso de BBNS para prevenção de descompensação não precisam de endoscopia de triagem para detecção de varizes, pois a endoscopia não mudará o manejo (B.2).
Prevenção do Primeiro Sangramento Digestivo Varicoso:
Tratamento com BBNS (Propranolol, Nadolol ou Carvedilol) deve ser considerado para prevenir descompensação em pacientes com HPCS (A1), sendo o Carvedilol preferido em DCPF compensada, por ser mais efetivo em reduzir o GPVH (A1), ser melhor tolerado e impactar na sobrevida (B1). Atribui-se a melhor eficácia do Carvedilol, bloqueador de terceira geração, não-seletivo dos receptores alfa1, beta1 e beta2 adrenérgicos, devido incremento de ação associada ao bloqueio dos receptores alfa1, levando a vasodilatação periférica e redução da resistência vascular periférica.
Na profilaxia do primeiro sangramento, único estudo sugeriu que a injeção de cianoacrilato pode ser mais eficaz que o propranolol na prevenção do primeiro sangramento na presença de grandes varizes GOV tipo 2 ou IGV tipo 1, a despeito de não haver diferença na sobrevida. Mais estudos são necessários nesses pacientes usando novas abordagens terapêuticas além de BBNS. (D.1) Procedimentos de radiologia intervencionista como BRTO/BATO/BARTO/TIPS não são indicados na profilaxia primária de sangramento de varizes gástricas em pacientes compensados (D.1).
Sangramento Digestivo Varicoso Agudo:
Interessante perceber como dados que parecem óbvios podem impactar na prática clínica quando ratificados em uma diretriz como o Baveno, mesmo com níveis de evidências de menor impacto. Neste tópico, recomendou-se que a intubação orotraqueal, antes da endoscopia seja realizada apenas em pacientes com rebaixamento de nível de consciência e/ou com vômito de sangue ativo, para proteção de vias aéreas (5; D), não adotando este procedimento como uma rotina; devendo, a extubação, ocorrer o mais rápido possível após o procedimento (5; D) devido risco de infecção respiratória. O uso de sonda nasogástrica também deve ser pensado com cautela, pelo mesmo risco (5; D). Outra orientação que deve entrar na rotina é a realização de exames de imagem abdominal, em momento oportuno, preferencialmente com contraste (TC ou RM) para excluir trombose venosa esplâncnica, carcinoma hepatocelular e para mapear colaterais porto-sistêmicas (D.1).
Estudos apontam maior chance de encefalopatia hepática e menor sobrevida em pacientes com DCPF em uso de inibidores de bomba de prótons (IBP)(4,5). Assim, quando iniciados antes da endoscopia, estes devem ser interrompidos imediatamente após o procedimento, a menos que realmente indicados (D.2). Quanto aos vasoconstrictores esplâncnicos, devem ser iniciados o quanto antes, ainda na unidade de emergência, e continuados entre 2 a 5 dias (1b; A). Desnutrição aumenta o risco de evento adverso em pacientes com DCPF e HDA; devendo a dieta oral ser reiniciada o mais breve (5;D) e a EH deve ser tratada preferencialmente com lactulose (oral/enema) durante a HDA-varicosa, por auxiliar na eliminação do sangue intestinal (D.1).
Quanto à terapêutica endoscópica, a ligadura elástica e adesivos tissulares permanecem como terapêutica de escolha, a depender do tipo de variz. Acrescentou-se que a terapia endoscópica para sangramento por gastropatia hipertensiva portal (GHP) pode ser feita com coagulação por plasma de argônio, ablação por radiofrequência ou ligadura elástica na GHP-GAVE (C.2). Mas, o pó hemostático (Hemospray®) ainda não foi recomendado como primeira linha de tratamento endoscópico para sangramento agudo varicoso (D.1).
A estratificação de risco e indicação de TIPS (transjugular intrahepatic portosystemic shunt) preemptivo, possivelmente, foi a principal recomendação nos últimos anos no algoritmo de tratamento de pacientes com hemorragia digestiva aguda varicosa (Figura 2). O TIPS recoberto com PTFE, dentro de 72 horas, idealmente <24 horas, após terapêutica endoscópica eficaz, é indicado em pacientes com sangramento de varizes esôfago-gástricas que atendem a qualquer um dos seguintes critérios: Child-Pugh C <14 pontos ou Child-Pugh B >7 com sangramento ativo na endoscopia inicial ou GPVH > 20 mmHg (A.1). Acute-on-chronic liver failure, encefalopatia hepática ou hiperbilirrubinemia na admissão não devem ser considerados como contraindicações ao TIPS (B.1), devendo ser avaliado cada caso com cuidado. Contudo, o TIPS pode ser uma conduta fútil no caso de Child-Pugh ≥14 ou MELD >30 e lactato >12 mmol/L, a menos que o transplante hepático seja previsto em curto prazo (B.1), sendo a decisão de realizar o procedimento tomada caso a caso (D.1).
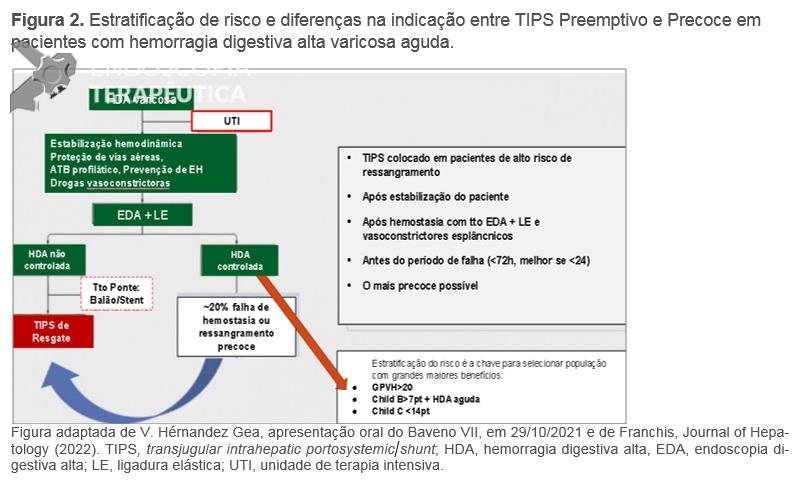
Figura 2
Novas discussões terapêuticas foram consideradas como possíveis no Baveno VII, a despeito de necessitarem de mais evidências e expertise. Em pacientes com GOV2, IGV1 e varizes ectópicas, o BRTO (Balloon-occluded retrograde transvenous obliteration) pode ser considerado uma alternativa ao tratamento endoscópico ou TIPS, desde que seja tecnicamente e localmente viável (D.2). O TIPS pode ser combinado com embolização para controlar o sangramento ou reduzir o risco de sangramento recorrente por varizes gástricas ou ectópicas, particularmente nos casos em que, apesar da diminuição do GPVH, o fluxo portal permanece desviado para colaterais (D.2).
No tópico sobre coagulopatia do paciente com doença hepática crônica em vigência de sangramento agudo varicoso, persistem importantes dúvidas sobre o tema, mas ratificou-se o conhecimento adquirido, especialmente sobre o que não funciona. O Baveno VII inicia o tópico confirmando que, em sangramento de varizes devido à HP, o objetivo deve ser focado na redução da pressão portal em vez de corrigir as anormalidades da coagulação (B.1). Os testes convencionais de coagulação, como tempo de protrombina (TP/RNI) e tempo de tromboplastina parcial ativada (TTPa), não refletem com precisão o estado hemostático de pacientes com doenças hepáticas avançadas (B.1), correspondendo a pequena porcentagem das reações de coagulação. Na prática clínica, quando disponíveis, teste como tromboelastometria parece interessante para guiar casos graves associados a sangramentos recorrentes/refratários, por avaliar a qualidade da formação do trombo e guiar a transfusão de hemocomponentes, porém não foi citado no consenso.
No episódio de sangramento agudo por varizes, a transfusão de plasma fresco congelado não é recomendada, pois não corrige a coagulopatia e pode levar a sobrecarga volêmica e agravamento da hipertensão portal, com chances de precipitar novos sangramentos (B.1); assim, na prática, dá-se preferência aos crioprecipitados. Neste cenário, também não há evidências de que a contagem de plaquetas e os níveis de fibrinogênio estejam correlacionados com falha no controle do sangramento ou ressangramento; no entanto, em caso de sangramento persistente, a decisão de corrigir as anormalidades hemostáticas deve ser considerada caso-a-caso (D.2). Fator VIIa recombinante e ácido tranexâmico não são recomendados no sangramento agudo de varizes (A.1).
Em pacientes com DCPF com sangramento agudo e que estejam em uso de anticoagulantes, estes devem ser temporariamente descontinuados até que a hemorragia esteja controlada. A duração da descontinuação deve ser individualizada com base na indicação da anticoagulação (D.2). Em pacientes com trombose de veia porta (TVP), o manejo do sangramento é prioritário e deve ser realizado conforme as diretrizes gerais. (D.1)
Na profilaxia secundária de sangramento varicoso, BBNS em combinação com terapêutica endoscópica são primeira escolha. Em pacientes que não toleram a terapia combinada, qualquer uma dessas terapias pode ser mantida isoladamente (A1). TIPS deve ser considerado em pacientes com ascite recorrente (B.1) ou sangramento a despeito da profilaxia.
Prevenção de descompensação adicional:
Uma novidade do Baveno VII foi o conceito de descompensação adicional na cirrose. Segundo a diretriz, representa um estágio prognóstico associado a uma mortalidade ainda maior do que a associada à primeira descompensação, que seria definida por eventos específicos (B.1): a) desenvolvimento de um segundo evento descompensador causado por hipertensão portal (ascite, hemorragia varicosa ou encefalopatia hepática) e/ou icterícia; b)sangramento recorrente por varizes, ascite recorrente (necessidade de ≥3 paracenteses de grande volume em um ano), encefalopatia recorrente, desenvolvimento de peritonite bacteriana espontânea (PBE) e/ou síndrome hepatorrenal (SHR-LRA); c) e, em pacientes que apresentam apenas sangramento, desenvolvimento de ascite, encefalopatia ou icterícia após a recuperação do sangramento, mas não se esses eventos ocorrerem na época do sangramento. Dentre todas as recomendações, destacam-se a indicação de rastreamento de infecção bacteriana para casos de descompensação adicional (A.1) e encaminhamento de pacientes para transplante de fígado (A.1).
Fragilidade, desnutrição e sarcopenia foram considerados de forma tímida, mas também pela primeira vez no Baveno, como variáveis que impactam na sobrevida de pacientes com cirrose descompensada, sendo recomendada avaliação e orientações relacionadas em todos os casos (B.1).
A (re)compensação da doença hepática é um conceito trazido no Baveno VII. A compensação implica na regressão parcial de alterações estruturais e funcionais relacionadas à DCPF, especialmente após a retirada a etiologia da cirrose (A.1). Clinicamente, a definição de compensação é baseada em consenso de especialistas e requer o cumprimento de todos os critérios que seguem (C.2): a) supressão/cura da etiologia primária da cirrose (eliminação da hepatite C, supressão viral para hepatite B, abstinência alcoólica sustentada para cirrose induzida por álcool); b) resolução da ascite (sem diuréticos), encefalopatia (sem lactulose/rifaximina) e ausência de hemorragia recorrente por varizes (por pelo menos 12 meses) e c) melhora significativa dos testes de função hepática (albumina, RNI, bilirrubina).
Como a HPCS pode persistir apesar da compensação clínica, o BBNS não deve ser descontinuado a menos que a HPCS se resolva (B.1). Resolução da ascite (em uso de diuréticos ou após TIPS) e/ou ausência de hemorragia varicosa recorrente (em uso de BBNS/Carvedilol + LE ou após TIPS) sem remoção do fator etiológico primário e sem melhora da função hepática, não são considerados critério de compensação clínica (B.1).
Trombose venosa e uso de anticoagulantes em pacientes com doença hepática:
Anticoagulação não deve ser desencorajada, no caso de indicação formal, em pacientes com diagnóstico de DCPF, uma vez que pode reduzir os desfechos negativos relacionados à doença hepática, com e sem trombose da veia porta, além de melhorar a sobrevida global (B.1). Heparina de Baixo Peso Molecular e Antagonistas da Vitamina K são amplamente aceitos e utilizados na trombose primária do sistema venoso portal ou vias de saída da veia hepática (A.1).
A triagem para trombose de veia porta (TVP) é recomendada em todos os pacientes que são potenciais candidatos ao transplante de fígado (D.2). A anticoagulação é recomendada em pacientes com cirrose e (i) trombose recente (<6 meses) total ou parcialmente oclusiva (>50%) do tronco da veia porta com ou sem extensão para a veia mesentérica superior, ou (ii) trombose da veia porta sintomática, independentemente da extensão, ou (iii) trombose da veia porta em potenciais candidatos a transplante hepático, independentemente do grau de oclusão e extensão (C.2). Nos potenciais candidatos a transplante de fígado, o objetivo da anticoagulação é prevenir a formação de novos trombos ou progressão do trombo, para facilitar a anastomose portal adequada e reduzir a morbidade e mortalidade pós-transplante (C.1). A anticoagulação deve ser considerada em pacientes com cirrose e trombose minimamente oclusiva (<50%) do tronco da veia porta que (i) progride em seguimento de curto prazo (1-3 meses) ou (ii) compromete a veia mesentérica superior (C.2). A anticoagulação deve ser (i) mantida até a recanalização da veia porta ou por um período mínimo de 6 meses, (ii) continuada após a recanalização em pacientes que aguardam transplante de fígado e (iii) considerada continuada após a recanalização em todos os outros, equilibrando os benefícios na prevenção recorrência e aumento da sobrevida e do risco de sangramento (C.1).
A anticoagulação é preferencialmente iniciada e mantida com Heparina de Baixo Peso Molecular (HBPM) e Antagonistas da Vitamina K (AVK) ou Anticoagulantes Orais Diretos (DOAC). A vantagens da HBPM é o número de evidências na população com doença hepática e mais conhecimento sobre a medicação e seu comportamento na população com DCPF. O AVK traz desafios no que diz respeito ao monitoramento do RNI em pacientes com cirrose. A vantagem dos DOAC está associada à facilidade do manejo, mas há menos dados disponíveis (C.1). Varfarina (AVK) e DOAC foram associados à redução da mortalidade por todas as causas; varfarina foi associada a mais sangramento em comparação com nenhum anticoagulante. DOAC tiveram incidência menor de sangramento em comparação com a varfarina em análises exploratórias. Dados atualmente disponíveis sugerem que não há grandes preocupações de segurança para os DOAC em pacientes com cirrose Child-Pugh A, porém devido a possibilidade de ação cumulativa, os DOAC devem ser usados com cautela em pacientes Child-Pugh B, bem como em pacientes com clearance de creatinina abaixo de 30 mL/min. O uso de DOAC em pacientes Child-Pugh C não é recomendado fora dos protocolos do estudo (B.2). Os DOAC provavelmente têm perfis de segurança-eficácia diferentes em pacientes com cirrose, embora, no momento, nenhuma recomendação possa ser feita em favor de um DOAC específico neste cenário (D.2).
Distúrbio vascular porto-sinusoidal (DVPS)
A doença vascular porto-sinusoidal é uma ampla entidade clínico-patológica que engloba fibrose portal não-cirrótica, hipertensão portal idiopática ou hipertensão portal intra-hepática não-cirrótica e vários padrões histológicos sobrepostos, incluindo hiperplasia nodular regenerativa, venopatia portal obliterativa, esclerose hepatoportal, cirrose septal incompleta (B.1). Ausência de hipertensão portal não exclui DVPS; a presença de causas comuns de doença hepática não exclui DVPS, e ambos podem coexistir; a presença de trombose da veia porta não exclui DVPS, e ambas podem coexistir (B.1). A DVPS deve ser consideradA nas seguintes situações: (i) sinais de hipertensão portal contrastando com características atípicas de cirrose; ou (ii) anormalidades nos exames de sangue do fígado ou hipertensão portal em um paciente com uma condição conhecida por estar associada a DVPS; ou (iii) anormalidades inexplicáveis nos exames de sangue do fígado, mesmo sem sinais de hipertensão portal. (B.1).
O diagnóstico de distúrbio vascular porto-sinusoidal pode ser observado na ausência de características clínicas, laboratoriais ou de imagem da hipertensão portal (B.1); amostra de biópsia hepática de tamanho adequado (> 20 mm) e de fragmentação mínima – ou de outra forma considerada adequada para interpretação por um patologista especialista – é necessária para o diagnóstico de PSVD (C.1). O diagnóstico de PSVD requer a exclusão de cirrose e de outras causas de hipertensão portal (B.1), juntamente com um dos três critérios a seguir (C.2): (i) pelo menos uma característica específica para hipertensão portal; ou (ii) pelo menos uma lesão histológica específica para PSVD; ou (iii) pelo menos uma característica não específica para hipertensão portal juntamente com pelo menos uma lesão histológica compatível embora não específica para PSVD.
Outras orientações para investigação etiológica e manejo na trombose primária do sistema venoso portal não cirrótica e Síndrome de Budd-Chiari (SBC) foram atualizados. Em pacientes com SBC, p. exemplo, apresentando insuficiência hepática aguda, o transplante hepático urgente deve ser considerado e o TIPS de emergência deve ser realizado, se possível, independentemente da listagem para transplante de fígado (C.1).
Assim, observamos que a “visão para além das varizes” do Baveno na condução do paciente com síndrome de hipertensão portal vem tomando proporções cada vez mais amplas de cuidado e abordando possibilidades em formatos também mais flexíveis. Nos próximos anos, vamos aguardar dispositivos de ultrassom endoscópico e outros métodos menos invasivos para avaliar gradiente de pressão portal e prognóstico de doenças hepáticas, papel da microbiota intestinal no tratamento das complicações da HPCS, impacto de terapêuticas mais eficazes no tratamento do NASH e desfechos, talvez, da COVID-19 na doença hepática.
Referencias
- Franchis R de, Bosch J, Garcia-Tsao G, Reiberger T, Ripoll C, Abraldes JG, et al. BAVENO VII – RENEWING CONSENSUS IN PORTAL HYPERTENSION: Report of the Baveno VII Consensus Workshop: personalized care in portal hypertension. J Hepatol [Internet]. 2021 Dec [cited 2022 Jan 29];0(0). Available from: http://www.journal-of-hepatology.eu/article/S0168827821022996/fulltext
- Kim RG, Loomba R, Prokop LJ, Singh S. Statin Use and Risk of Cirrhosis and Related Complications in Patients With Chronic Liver Diseases: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol [Internet]. 2017 Oct 1 [cited 2022 Jan 29];15(10):1521-1530.e8. Available from: https://pubmed.ncbi.nlm.nih.gov/28479502/
- Simon TG, Duberg A-S, Aleman S, Chung RT, Chan AT, Ludvigsson JF. Association of Aspirin with Hepatocellular Carcinoma and Liver-Related Mortality. N Engl J Med [Internet]. 2020 Mar 12 [cited 2022 Jan 29];382(11):1018–28. Available from: https://pubmed.ncbi.nlm.nih.gov/32160663/
- Nardelli S, Gioia S, Ridola L, Farcomeni A, Merli M, Riggio O. Proton Pump Inhibitors Are Associated With Minimal and Overt Hepatic Encephalopathy and Increased Mortality in Patients With Cirrhosis. Hepatology [Internet]. 2019 Aug 1 [cited 2022 Jan 29];70(2):640–9. Available from: https://pubmed.ncbi.nlm.nih.gov/30289992/
- De Roza MA, Kai L, Kam JW, Chan YH, Kwek A, Ang TL, et al. Proton pump inhibitor use increases mortality and hepatic decompensation in liver cirrhosis. World J Gastroenterol [Internet]. 2019 Sep 7 [cited 2022 Jan 29];25(33):4933–44. Available from: https://pubmed.ncbi.nlm.nih.gov/31543684/