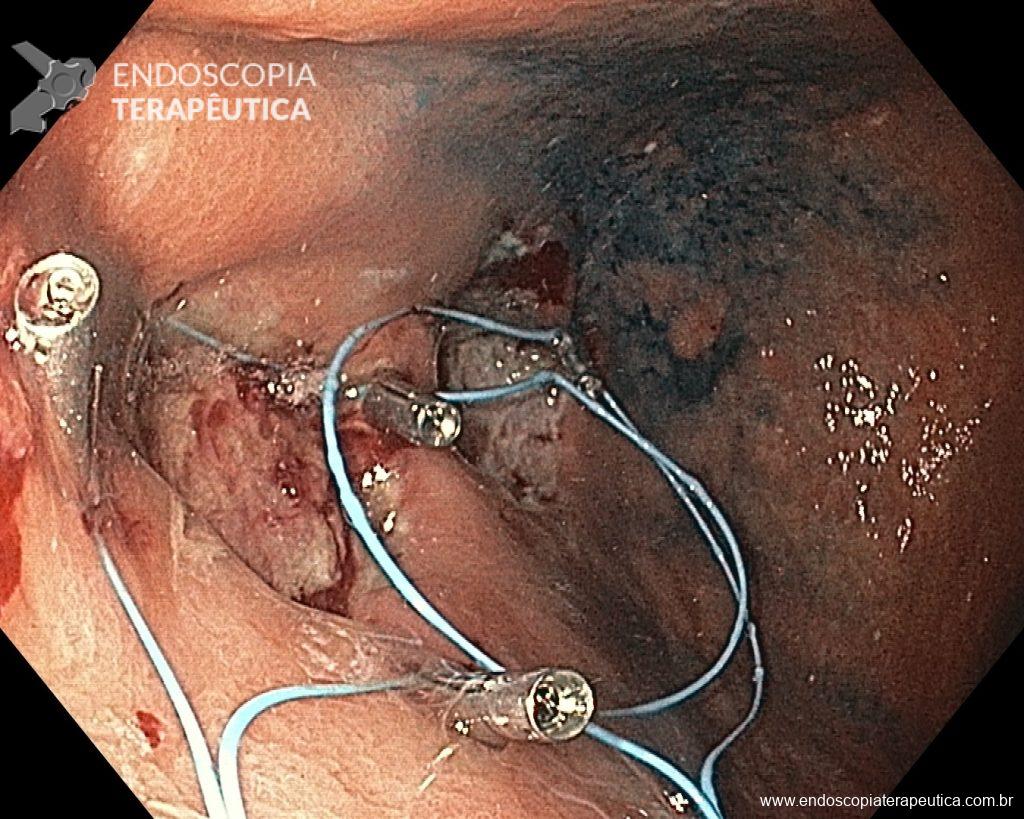
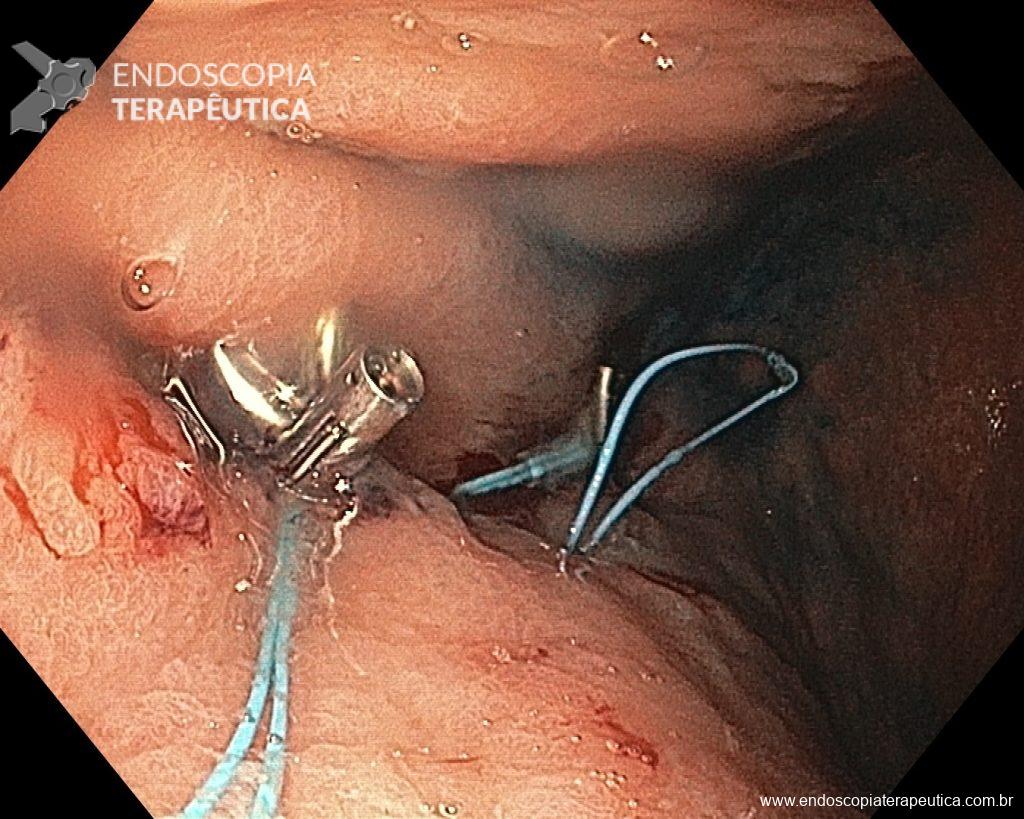
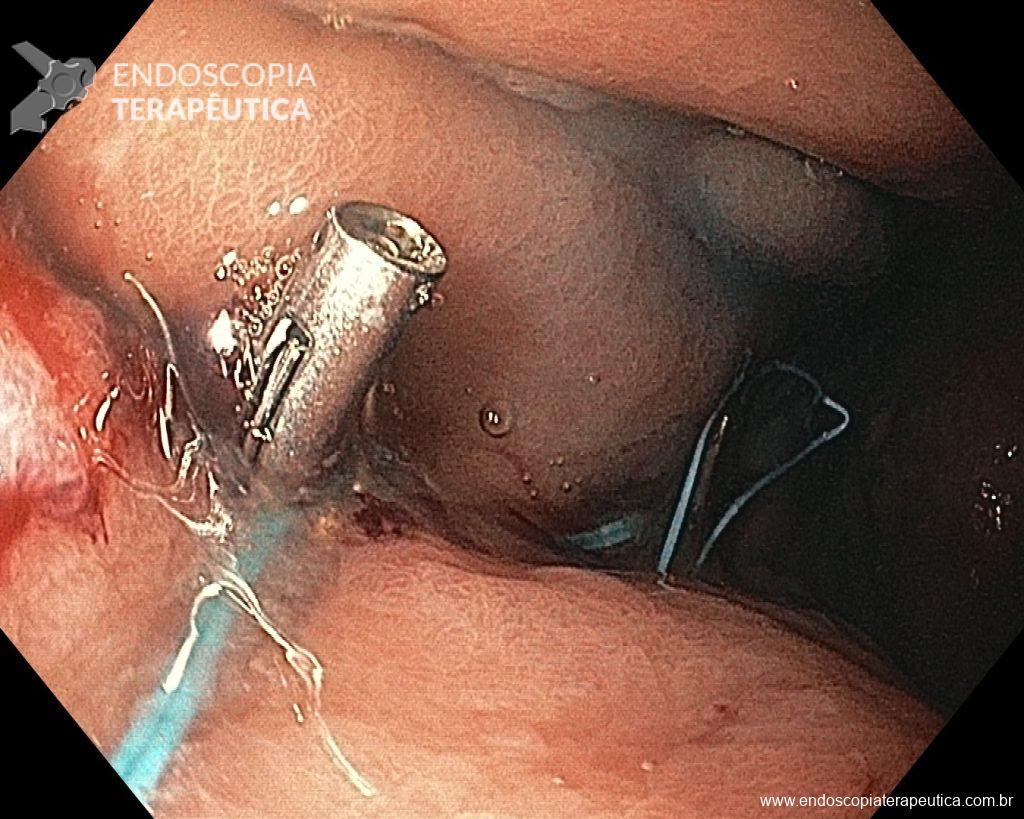
METAPLASIA INTESTINAL EM ENDOSCOPIA DE ROTINA: Tem importância? Preciso seguir?
O câncer gástrico é a terceira maior causa de morte por câncer no mundo.
O seu subtipo mais comum é o câncer gástrico não cárdico do tipo intestinal, que passaremos a chamar aqui genericamente de câncer gástrico (CG). Tem como principal fator de risco a infecção crônica pelo H. pylori, respondendo por cerca de 80% da incidência global de câncer gástrico.
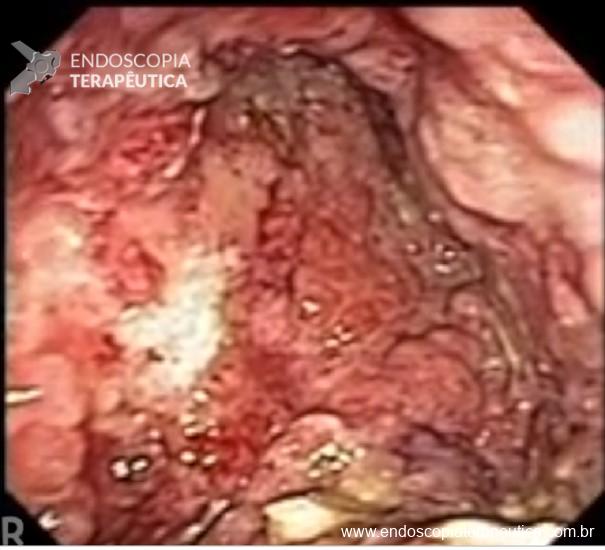
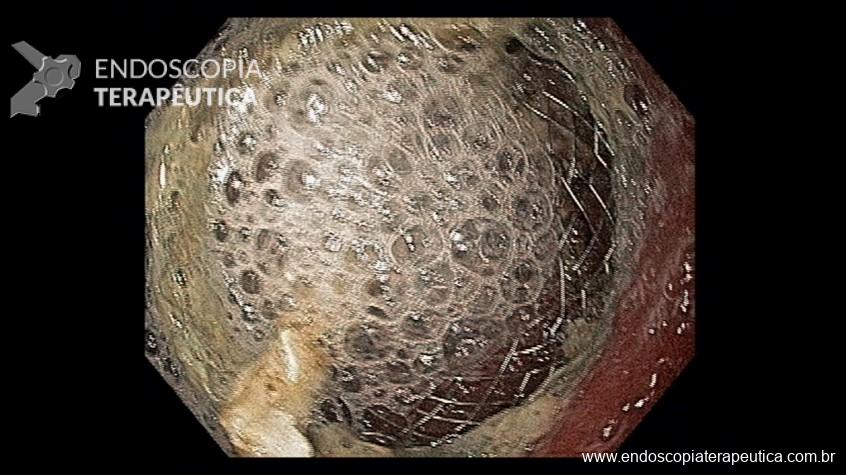
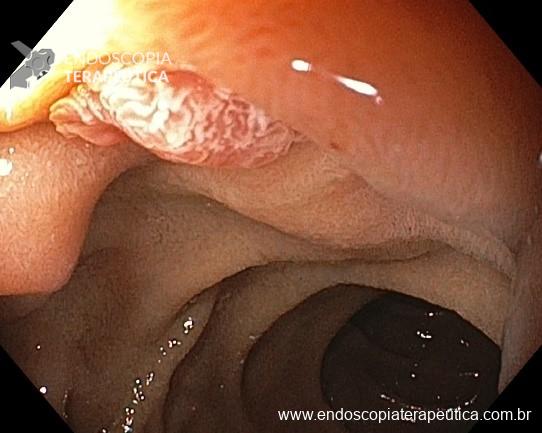
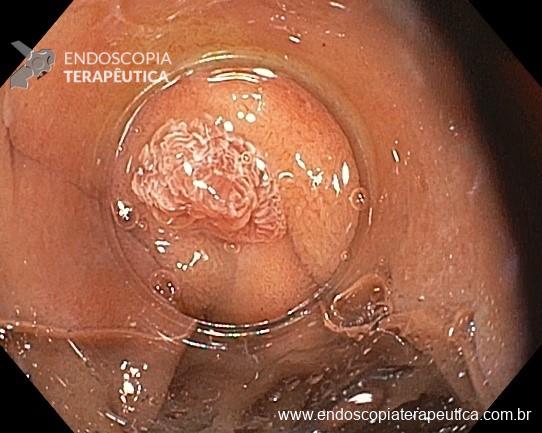
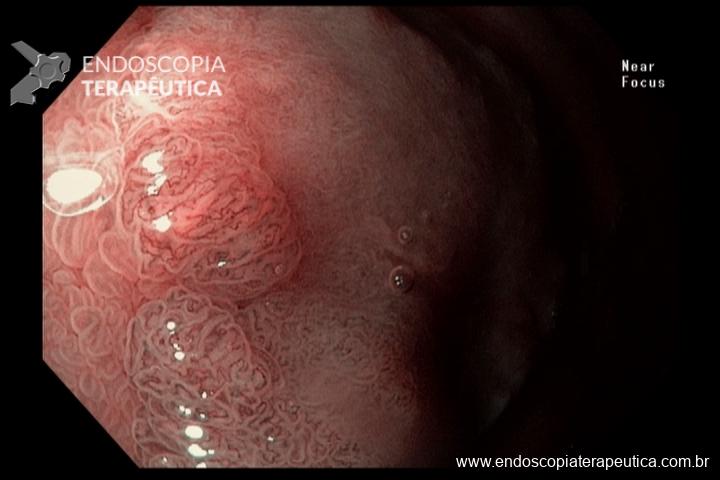
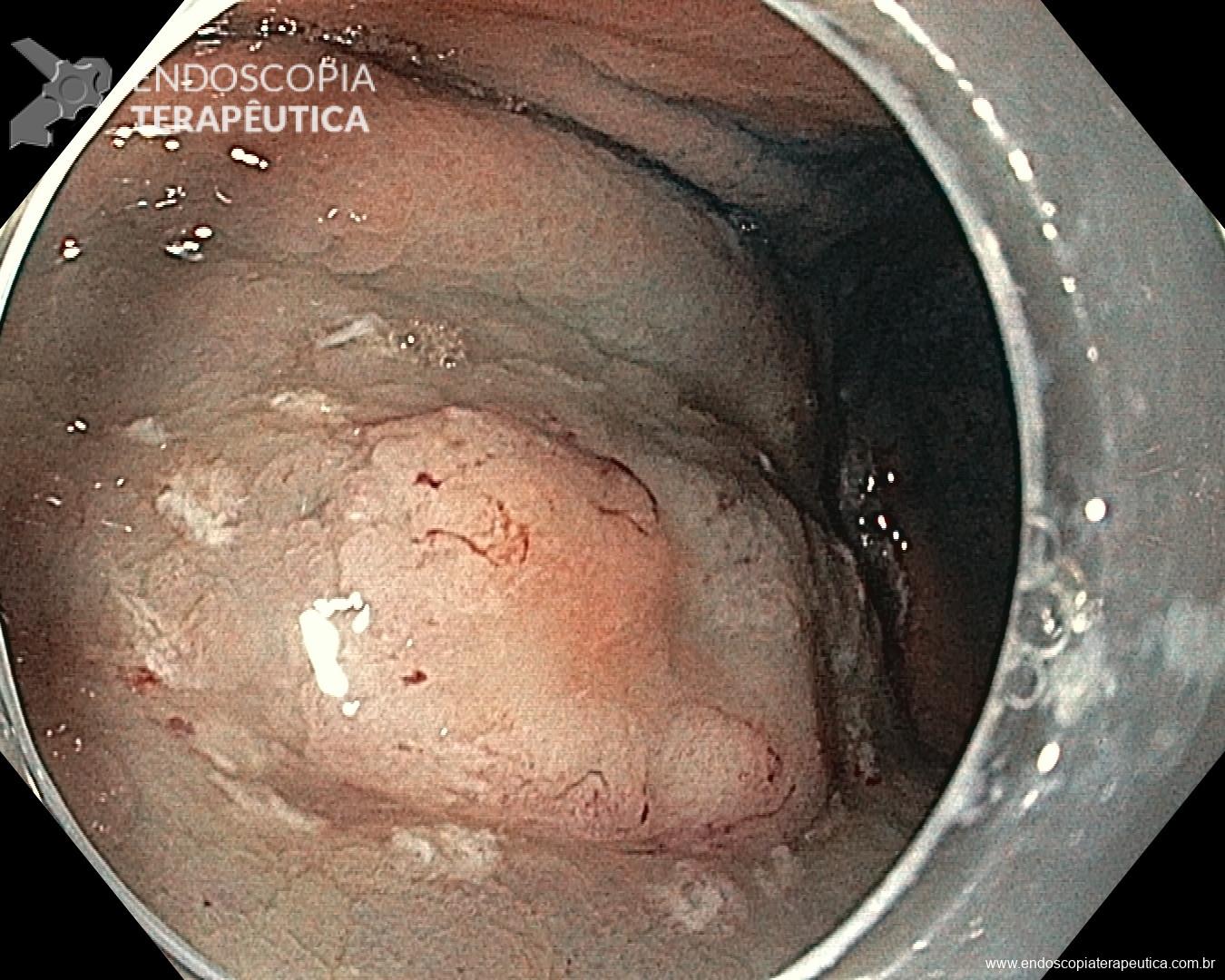
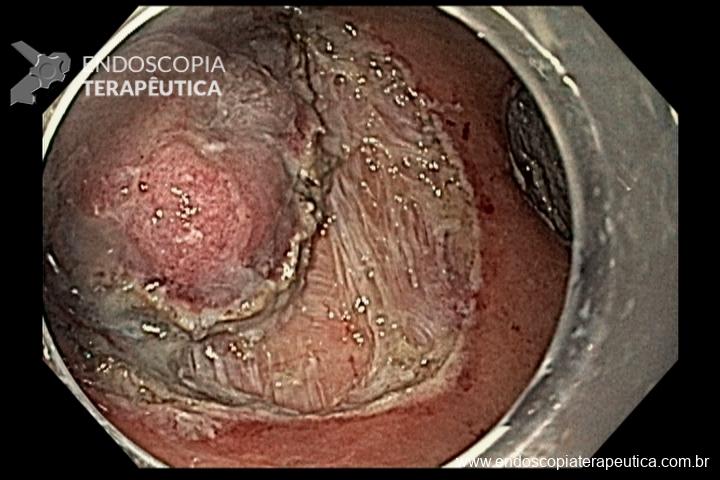
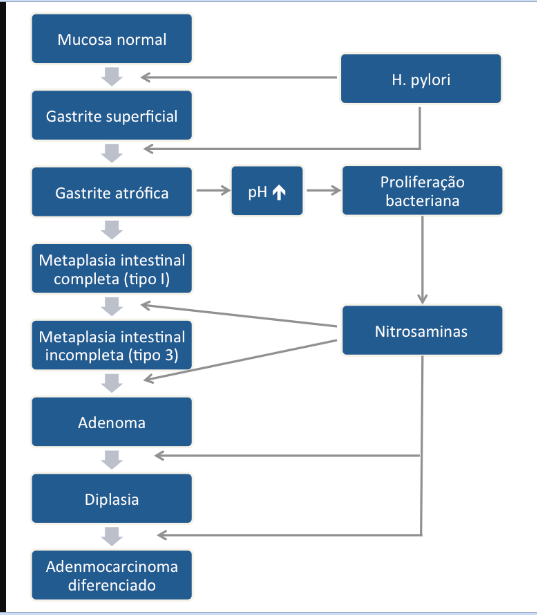
Este subtipo de câncer gástrico emerge a partir de alterações histopatológicas progressivas na mucosa gástrica, conhecidas como sequência ou cascata de Pelayo Correa, que tem na infecção pelo H. pylori o seu principal gatilho. Essa sequência se inicia com a mucosa normal, passa pela gastrite não atrófica crônica, gastrite atrófica crônica, metaplasia intestinal, displasia e finalmente chega à transformação maligna.
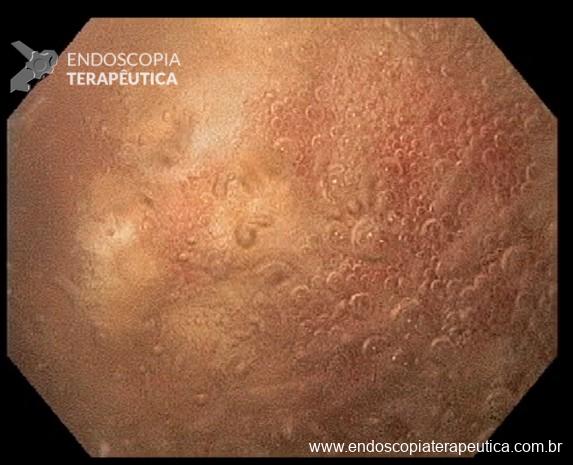
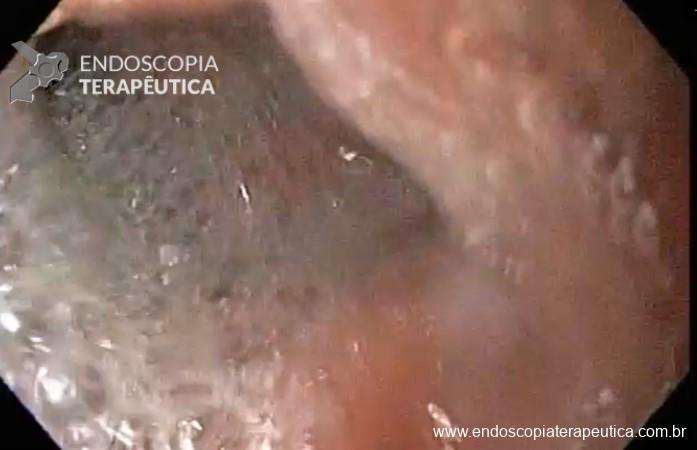
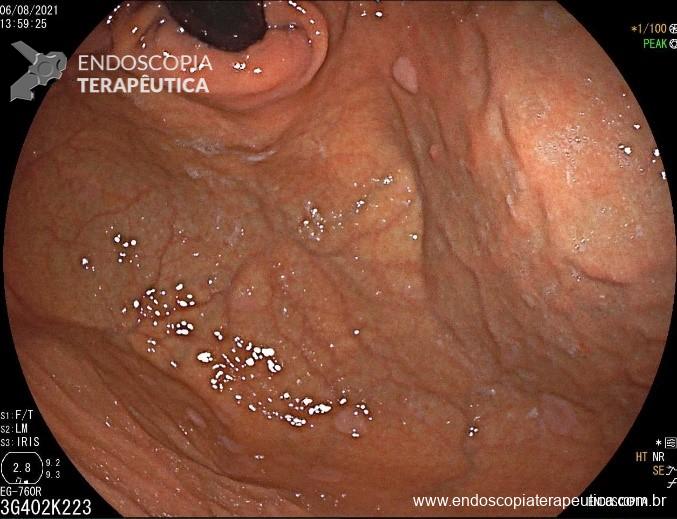
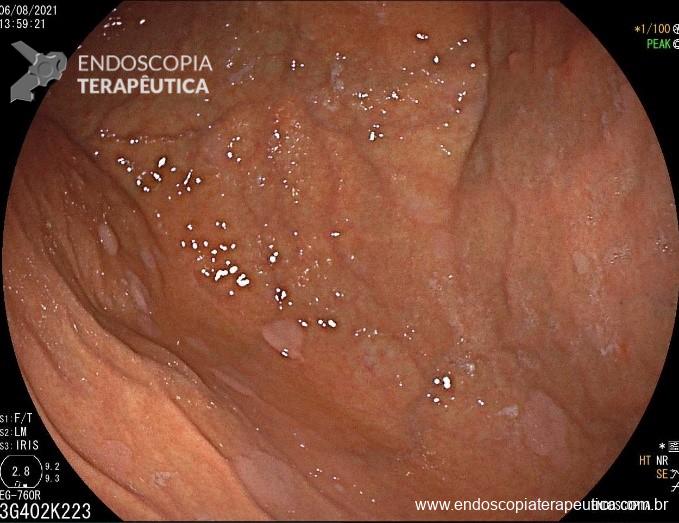
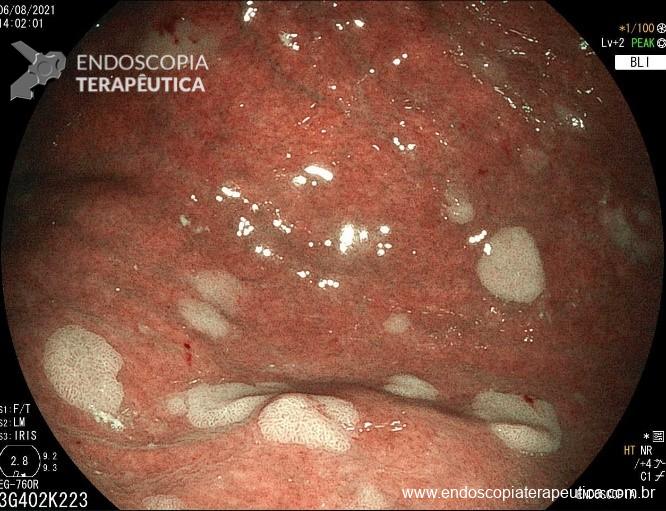
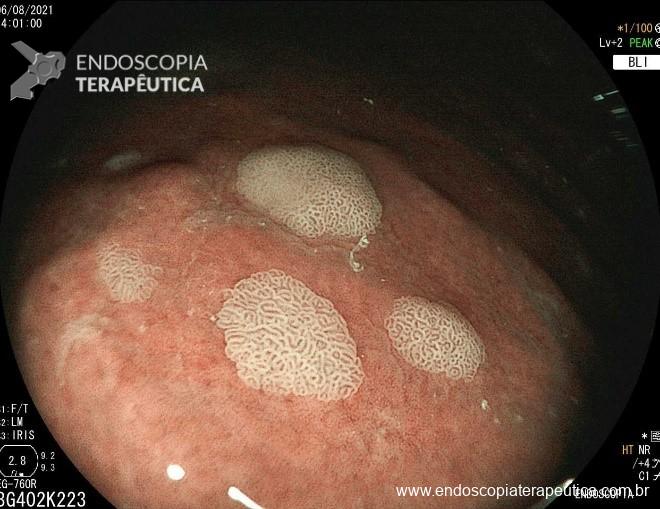
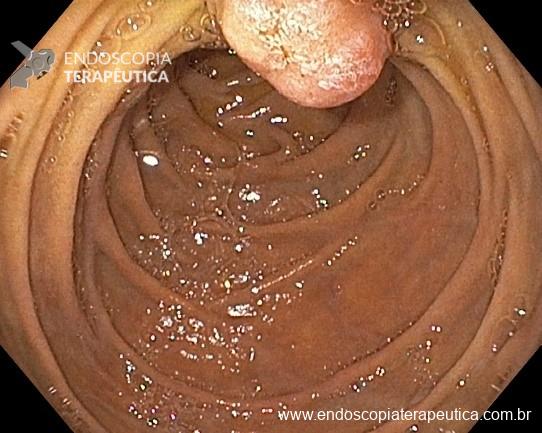
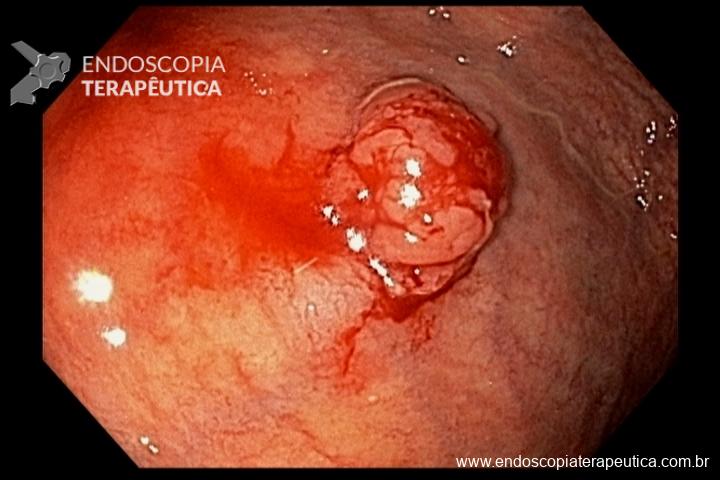
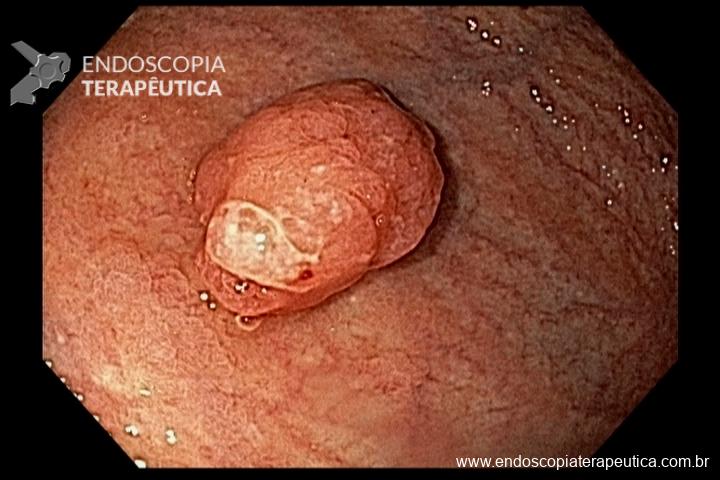
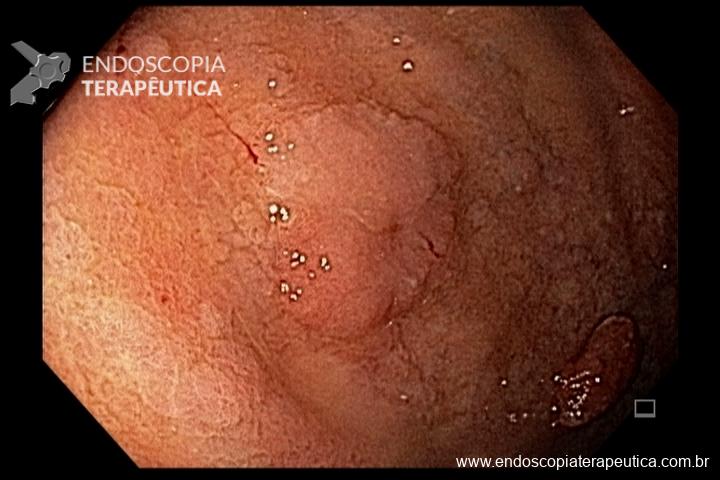
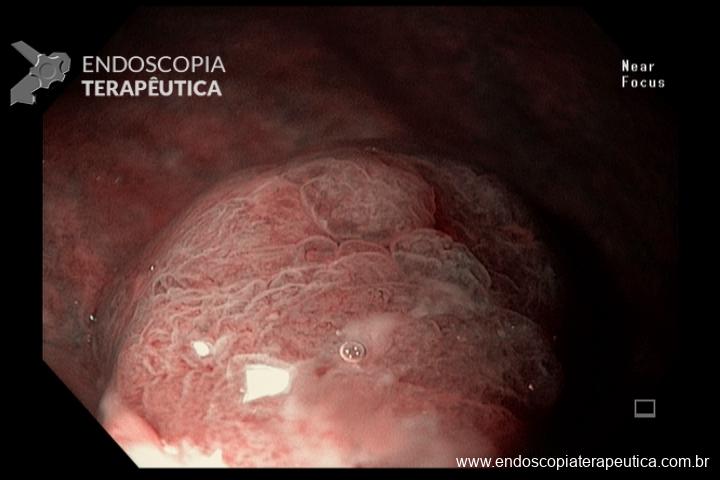
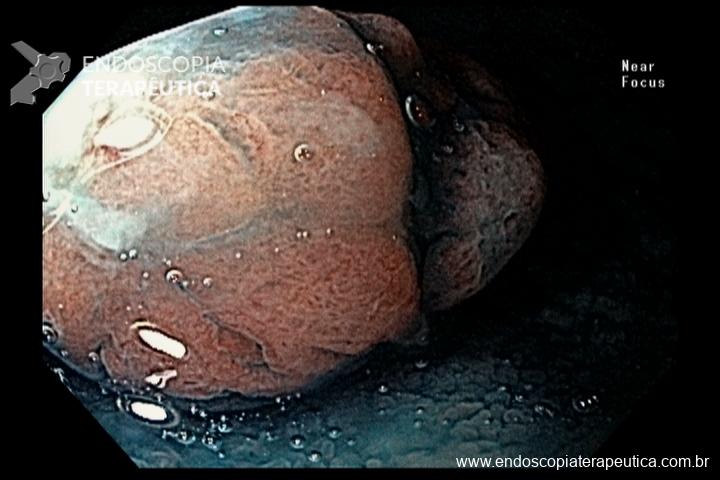
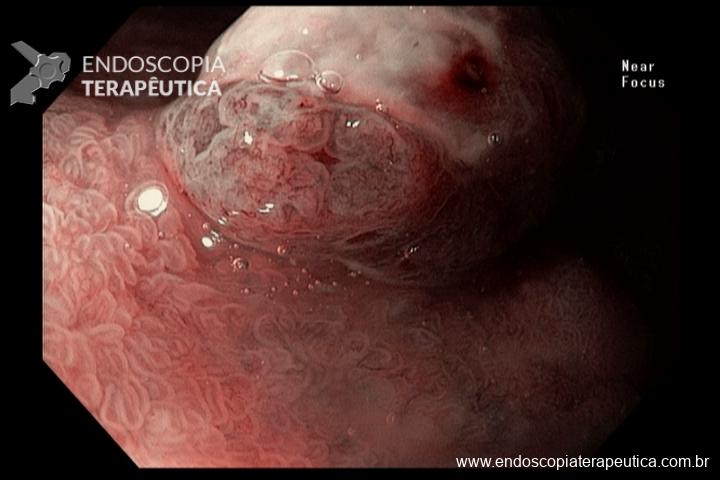
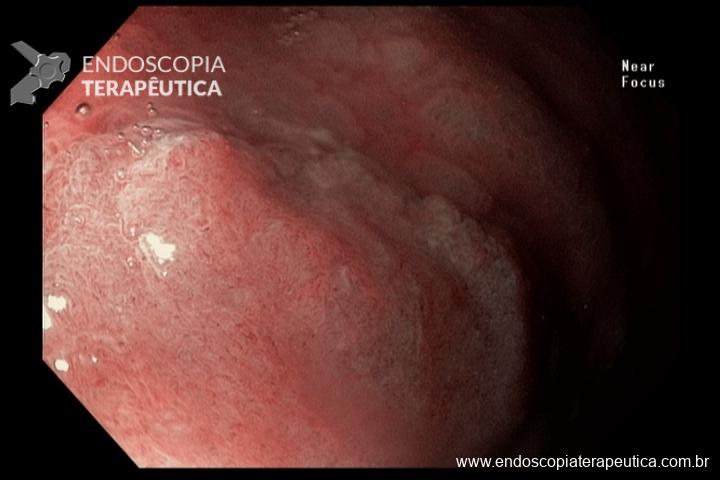
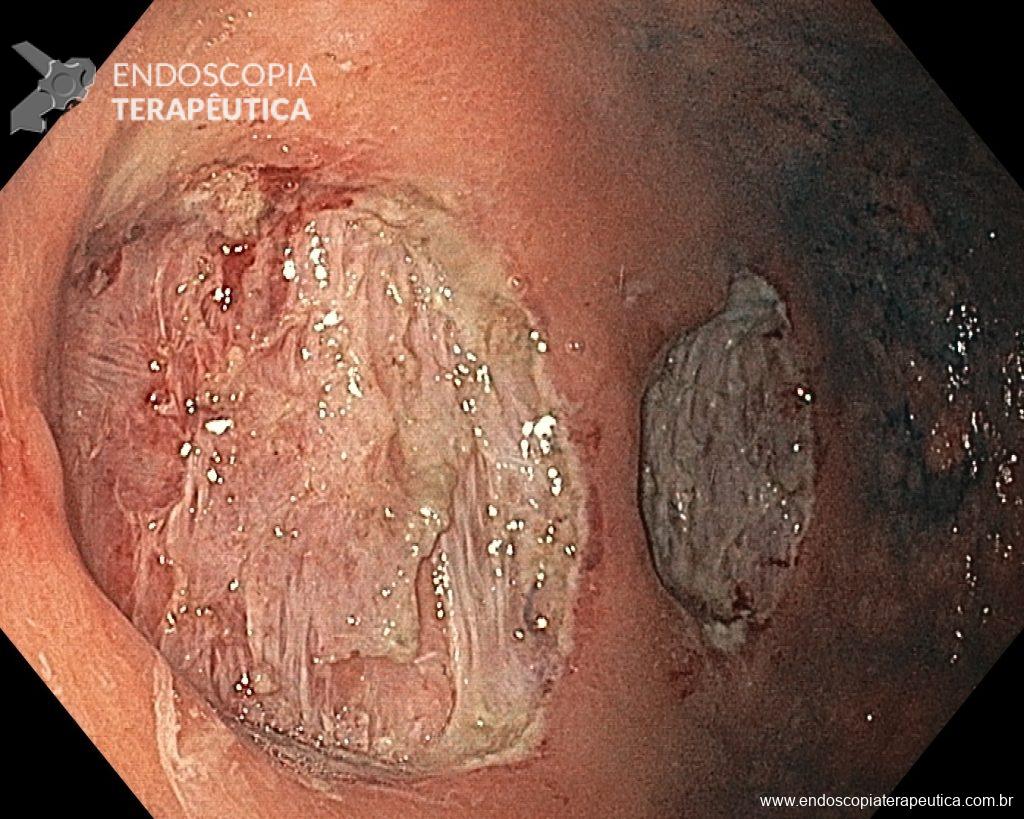
A metaplasia intestinal gástrica (MIG) é encontrada frequentemente em exames de rotina e diversas incertezas e desconhecimentos sobre sua importância, aliados à pobre informação sobre o risco individual de câncer gástrico do paciente, geram múltiplas abordagens no manejo desse achado, mesmo entre especialistas atentos ao assunto.
Recentemente, a American Gastroenterological Association (AGA) publicou recomendações baseadas em evidências com o intuito de guiar o manejo da metaplasia intestinal na ausência de neoplasia gástrica (câncer ou displasia). O que fazer em casos de MIG?
A publicação traz as seguintes perguntas chave:
- Pesquisar e tratar H. pylori alteram desfechos importantes em pacientes com MIG?
- Em paciente com MIG e classificados como de baixo risco, o seguimento endoscópico altera desfechos importantes versus nenhum seguimento?
- E em pacientes de alto risco?
- Em pacientes sem displasia, o seguimento precoce (< 1 ano) com biópsias para determinar a extensão da MIG altera desfechos relevantes?
Desfechos relevantes bons:
- Detecção precoce de CG
- Redução de morbi/mortalidade
Desfechos relevantes ruins:
- Potenciais complicações da endoscopia
- Efeitos psicológicos ligados à ansiedade gerada pelo seguimento
- Consumo de recursos
Pesquisar e tratar H. pylori alteram desfechos importantes em pacientes com MIG?
Recomendação 1: Em pacientes com metaplasia intestinal gástrica, a AGA recomenda pesquisa de H. pylori seguida de erradicação. Recomendação forte, qualidade de evidência moderada.
A erradicação de H. pylori em paciente com ou sem MIG foi associada a redução de 32% no risco relativo de incidência de CG e 33% no risco relativo de mortalidade por CG, quando comparada a placebo. Os dados não foram suficientes para avaliar o impacto da erradicação de H. pylori na mortalidade por CG em pacientes com MIG confirmada. A confirmação da erradicação após o tratamento é recomendada, pela a possibilidade de falha terapêutica, mas o documento não aborda a melhor estratégia de confirmação a ser empregada.
Em paciente com MIG, classificados como de baixo risco, o seguimento endoscópico altera desfechos importantes versus nenhum seguimento?
Recomendação 2: Em pacientes com metaplasia intestinal gástrica, a AGA se posiciona contrária ao seguimento endoscópico de rotina. Recomendação condicional, evidência de muito baixa qualidade.
Comentário: pacientes com metaplasia intestinal com risco aumentado de CG que acreditem numa redução na mortalidade pelo câncer (incerta) e não valorizem eventuais riscos de exames recorrentes podem aderir ao seguimento endoscópico.
Pacientes com risco aumentado incluem:
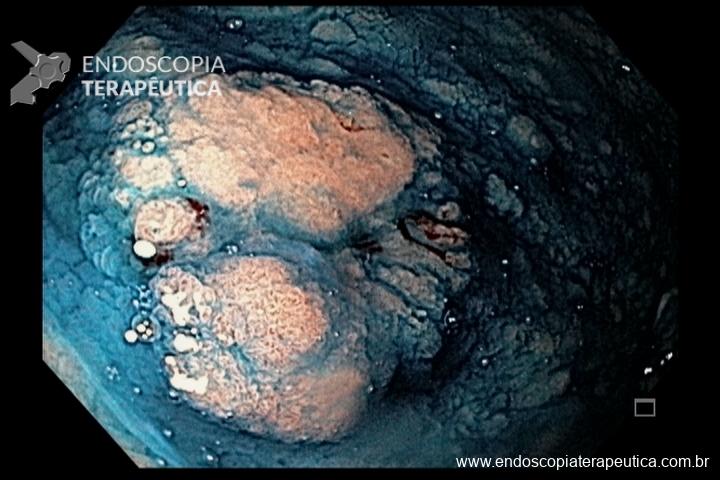
- MIG incompleta;
- MIG extensa (que acometa corpo gástrico);
- Minorias étnicas;
- Imigrantes de áreas de alta incidência.
Recomendação 3: em pacientes com metaplasia intestinal gástrica, a AGA se posiciona contrária à endoscopia precoce (< 1 ano) para estratificação de risco. Recomendação condicional, evidência de muito baixa qualidade.
Sobre a não recomendação de seguimento endoscópico em pacientes com MIG, pesaram alguns pontos. A prevalência estimada de MIG é de 4,8%, fazendo com que qualquer recomendação de seguimento endoscópico traga grande impacto a uma grande proporção de pacientes. Além disso, a taxa anual de progressão para CG em indivíduos com MIG é de 0,16%, número inferior aos 0,33% ao ano estimados na progressão para adenocarcinoma esofágico em pacientes com esôfago de Barrett.
O estudo não encontrou ensaios randomizados controlados, estudos de cohort ou caso-controle avaliando o impacto do seguimento endoscópico sobre os riscos de CG em pacientes com MIG. Em razão disso, a AGA recomenda a decisão compartilhada quanto à adesão ou não a seguimento endoscópico.
Pacientes com MIG considerados com risco aumentado para CG incluem aqueles com metaplasia intestinal incompleta (3,3 x RR versus MIG completa, evidência de baixa qualidade); história familiar de CG (4,5 x RR, evidência de muito baixa qualidade) e MIG extensa (corpo gástrico + antro ou incisura) versus MIG limitada – antro e ou incisura- (2,1 x RR, com evidência de muito baixa qualidade).
O artigo menciona que, nos Estados Unidos, raramente os laudos histológicos relatam se a MIG é completa ou incompleta e o mesmo ocorre em boa parte no nosso meio. Isso limitaria a viabilidade da adoção desse critério na definição do seguimento. O entendimento da extensão da MIG depende da prática de obtenção de amostras em frascos separados nos diferentes seguimentos gástricos, outra prática pouco comum.
Pacientes com MIG com risco comum ou de alto risco, que apostem na redução do risco de CG, (mesmo na ausência de evidências diretas que a suportem) e minimizem potenciais riscos do seguimento endoscópico podem optar por aderir ao seguimento na tomada de decisão.
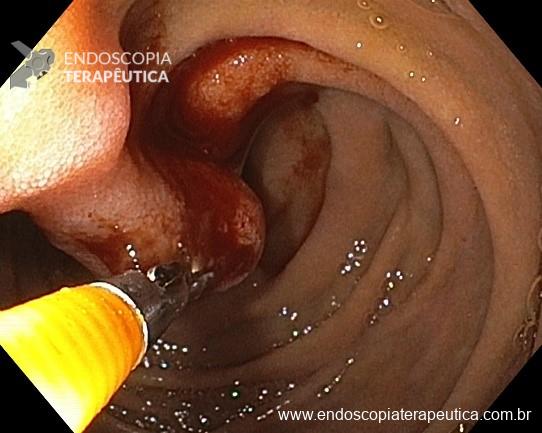
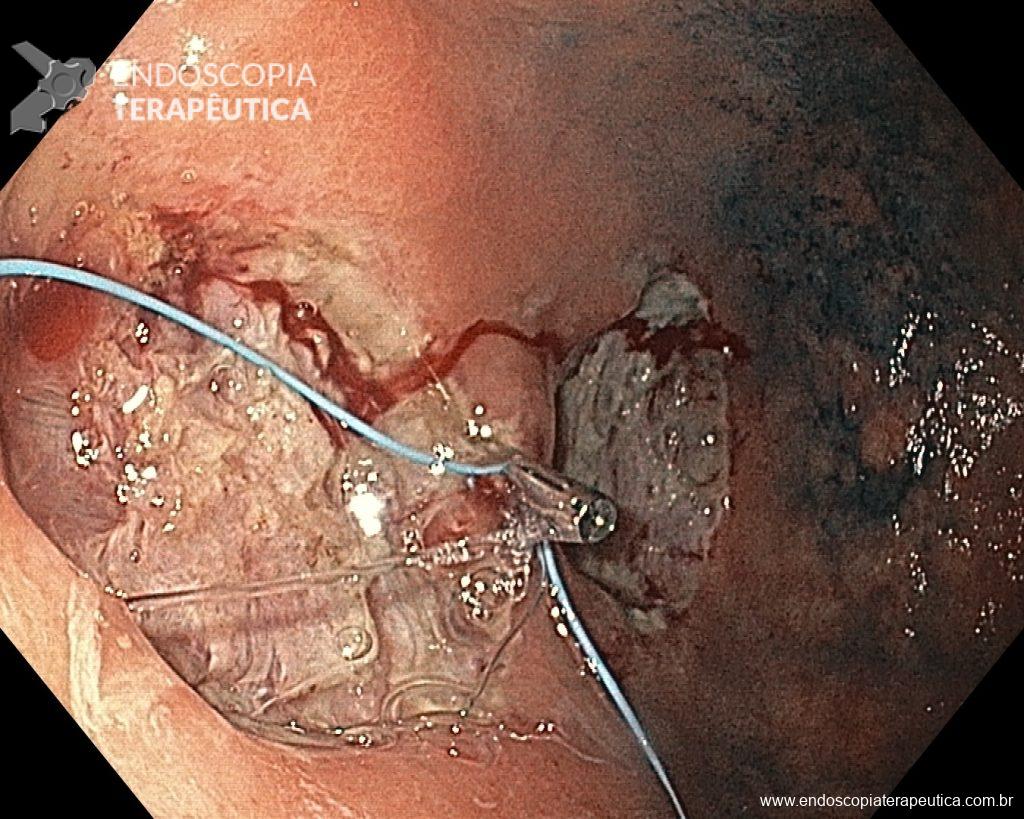
Não existem dados suficientes para definir o intervalo ideal entre exames no seguimento endoscópico. Com base em evidências indiretas, considerando risco cumulativo de CG em pacientes com MIG, a avaliação endoscópica pode ser feita a cada 3 a 5 anos, com estudo cuidadoso da mucosa, incluindo biópsias do corpo e antro, além de qualquer lesão suspeita.
Pacientes com risco aumentado que optem pelo seguimento endoscópico poderiam ser elegíveis para uma endoscopia precoce (< 1 ano) com o intuito de assegurar maior qualidade na endoscopia índice, revendo a extensão da MIG, obtendo amostras separadas, ou identificando outras áreas suspeitas. No entanto, a revisão técnica não encontrou evidências que suportem essa conduta.
De maneira geral, as recomendações da AGA estão alinhadas e diferem pouco das previamente publicadas pela ASGE e ESGE em pacientes com MIG. A ASGE, no entanto, recomenda o seguimento para pacientes de risco aumentado por etnia ou história familiar. Recomenda ainda a suspensão do seguimento caso haja dois exames consecutivos sem displasia. A ESGE recomenda seguimento endoscópico a cada 3 anos em pacientes com gastrite atrófica avançada ou que tenham MIG em antro e corpo, e/ou OLGA III/IV. Sugere ainda àqueles que tenham história familiar associada a esses achados que considerem redução do intervalo para 1 ou 2 anos (recomendação fraca, evidências de baixa qualidade).
Como se vê, as recomendações atuais nesse tema são muitas vezes imprecisas e dependem de fatores que dificultam a aplicação de regras uniformes e que tenham fortes evidências que as suportem. Nesse cenário, a visão individualizada e o exame cuidadoso ganham importância ainda maior na seleção dos pacientes que merecem cuidados especiais. Estar atento a dados clínicos, como a história familiar, e achados endoscópicos muitas vezes não valorizados em exames de rotina pode fazer a diferença na vida desses pacientes.
Referências
- AGA Clinical Practice Guidelines on Management of Gastric Intestinal Metaplasia. Samir Gupta, Dan Li, Hashem B. El Serag, Perica Davitkov, Osama Altayar, Shahnaz Sultan, Yngve Falck-Ytter, Reem A. Mustafa. Gastroenterology. 2020 Feb; 158(3): 693–702. doi: 10.1053/j.gastro.2019.12.003
- Gastric Cancer: overview. Correa, P. Gastroenterol Clin N Am 42 (2013) 211–217. doi: 10.1016/j.gtc.2013.01.002