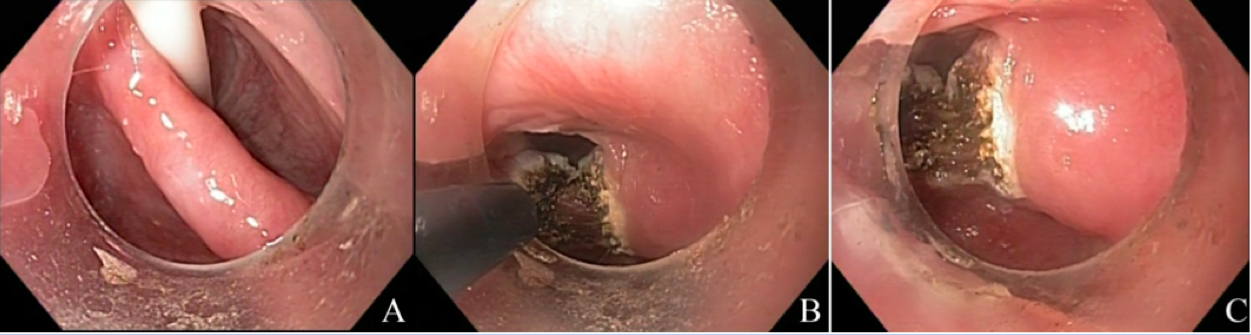
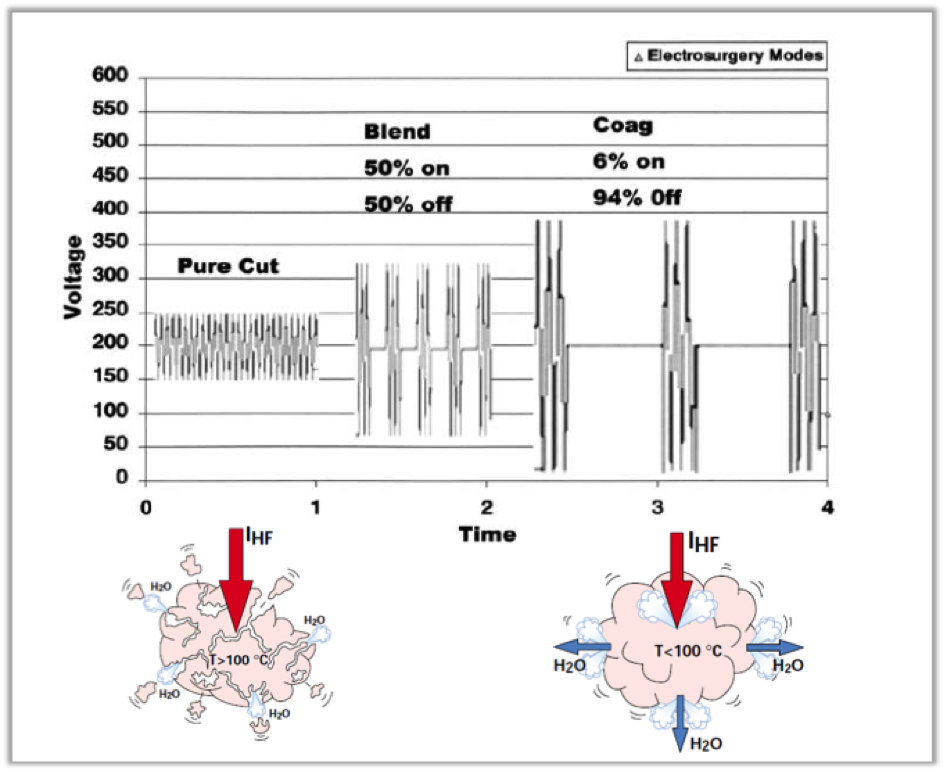
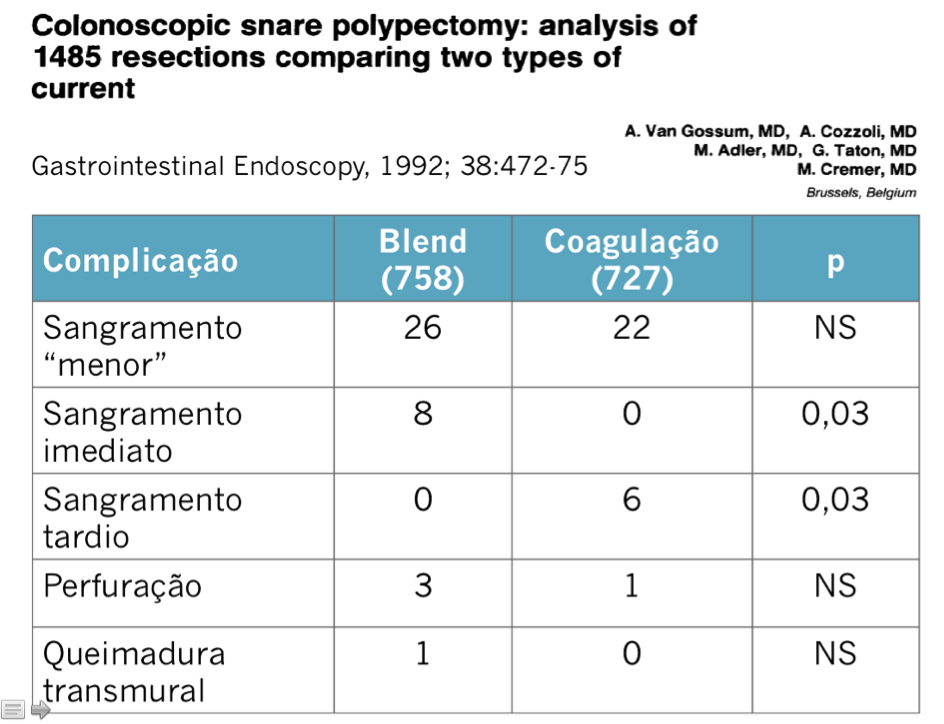
O Helicobacter pylori, é uma bactéria gram negativa, em formato de espiral, adaptado a sobrevivência no estômago humano. É a infecção bacteriana crônica mais comum do ser humano, sendo sugerido que cerca de 50% da população esteja colonizada. É adquirida durante a infância, principalmente em ambientes de baixas condições sócio econômicas (higiênicas), acúmulo de pessoas ou saneamento básico. ¹
A infecção por H. pylori e reconhecida como potencial causa para gastrites (cônicas e agudas), doença ulcerosa e neoplasias gástricas (carcinógeno Tipo I pela Agência Internacional de Pesquisa em Câncer).¹
Assim, reveste-se de importância a pesquisa e tratamento do H. pylori. Para tanto, em 2013, foi publicado o Terceiro Consenso Brasileiro em Helicobacter pylori. ² .
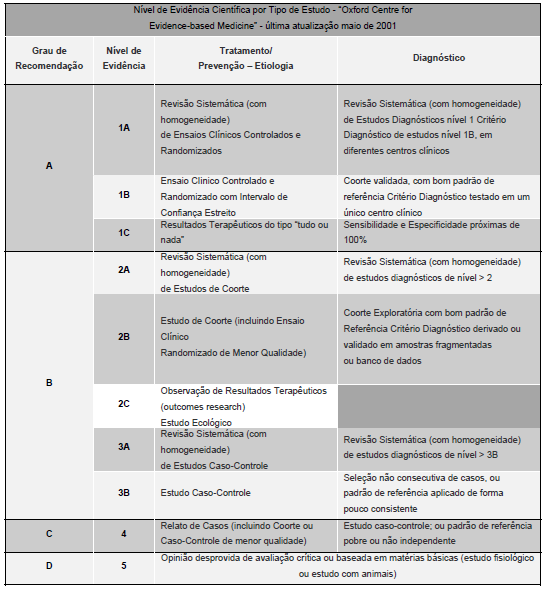
Realizado pelo Núcleo Brasileiro de H. pylori (braço da Federação Brasileira de Gastroenterologia), em Bento Gonçalves (abril – 2011) contou com presença de 31 especialista no assunto, criando-se o consenso atual. Assim, as orientações seguem os Graus de recomendação e Níveis de evidência, conforme convenção estabelecida pela medicina baseada em evidência.
Para a realização do atual Consenso, durante as reuniões, foram criados vários grupos, que debateram determinado assunto (tratamento, retratamento, relação com câncer, etc), criando a recomendação do subgrupo de especialistas, e esta recomendação então era levada em plenário, onde a concordância de mais de 70% dos presentes levava a criação da então, a recomendação consensual.
Abaixo, reproduzimos de forma sintética as recomendações, facilitando então a leitura e futura procura pela informação.
GRUPO 1 – H. pylori : Dispepsia e diagnóstico :
Declaração 1 : O diagnóstico de dispepsia funcional em nosso meio dever seguir os critérios do III Consenso de Roma, além de pesquisa de parasitas nas fezes ou uso empírico de antiparasitários : Concordância : 100%, Recomendação : D, Nível de evidência : C
Declaração 2 : Quando disponível, o teste respiratório com carbono marcado é o método não invasivo de escolha para diagnóstico e controle de erradicação : Concordância : 100%, Recomendação : A, Nível de evidência :1A
No Brasil o teste ainda não está totalmente difundido, e devido aos baixos custos da Endoscopia Digestiva, acaba sendo a escolha em nosso país.
Declaração 3 : Para realizar o teste respiratório, o uso de antibióticos e de inibidores de bomba protrônica – IBP), deve ser descontinuado por cerca de 2 a 4 semanas antes do exame. Concordância : 100%, Recomendação : A, Nível de evidência : 1A
Declaração 4 : Se o teste respiratório não é disponível, a pesquisa do antígeno nas fezes é o método de escolha para diagnóstico e controle de tratamento do H. pylori, quando usado um anticorpo monoclonal. Concordância : 100%, Recomendação : A, Nível de evidência : 1A
Declaração 5: Testes sorológicos devem ser reservados para estudos epidemiológicos, sempre com validação local : Concordância : 100%, Recomendação : A, Nível de evidência : 2
Declaração 6 : Endoscopia digestiva alta em pacientes dispépticos, quando indicada, deve ser acompanhada de coleta de pelo menos um fragmento de antro e corpo, para urease ou avaliação histológica para identificação do H. pylori. Se possível, IBP e antimicrobianos devem ser suspensos por 2 a 4 semanas , respectivamente, antes do exame : Concordância : 93 a 100%, Recomendação : A, Nível de evidência :1A-1B
Declaração 7 : Erradicação do H. pylori está indicado para pacientes com dispepsia : Concordância : 100%, Recomendação : A, Nível de evidência : 1A
Declaração 8: Erradicação do H. pylori é a primeira alternativa terapêutica na dispepsia funcional : Concordância : 86,2 %, Recomendação : A, Nível de evidência :1 A
Declaração 9 : A estratégia de avaliação-tratamento, utilizando testes não invasivos, e tratando infectados, pode ser indicada em indivíduos com idade menor de 35 anos, sem sinais de alarme ou antecedentes familiares de câncer gástrico : Concordância : 100%, Recomendação : A, Nível de evidência : 1B
Declaração 10 : O controle de erradicação deve ser feito com pelo menos após quatro semanas do tratamento: Concordância : 100%, Recomendação : B, Nível de evidência : 2B
Declaração 11: O controle de erradicação deve ser realizado em paciente com úlcera gastroduodenal, linfoma MALT, após ressecção de câncer gástrico precoce e em pacientes com sintomas persistentes após tratamento baseado em teste não invasivo : Concordância : 100%, Recomendação : D, Nível de evidência : 5
GRUPO 2 : H. pylori : Adenocarcinoma gástrico e Linfoma MALT
Declaração 12 : H. pylori é o fator de risco mais relevante para adenocarcinoma gástrico e linfoma MALT. Concordância : 100%, Recomendação : A, Nível de evidência : 1ª
Declaração 13 : A erradicação do H. pylori reduz o risco de desenvolvimento de lesões precursoras do câncer gástrico. Gastrite crônica ativa é revertida pela erradicação do H. pylori, ao passo que paralisa a cascata carcinogênica de Pelayo Correa: Concordância : 100%, Recomendação : A, Nível de evidência : 1 A
Declaração 14 : A erradicação do H. pylori reduz/regride lesões precursoras de câncer gástrico ? SIM, para gastrite atrófica do corpo : Concordância : 100%, Recomendação : B, Nível de evidência : 2A
Declaração 15 : A erradicação do H. pylori reduz/regride lesões precursoras de câncer gástrico ? NÃO, para gastrite atrófica do antro : Concordância : 100%, Recomendação : B, Nível de evidência : 2B
Declaração 16 : A erradicação do H. pylori reduz/regride lesões precursoras de câncer gástrico ? NÃO, para metaplasia intestinal. Concordância : 100%, Recomendação : B, Nível de evidência : 2A
Declaração 17 : O tempo ideal de erradicação do H. pylori, é antes do aparecimento de lesões pré neoplásicas (gastrite atrófica e metaplasia intestinal). Concordância : 100%, Recomendação : A, Nível de evidência : 1ª
Declaração 18 : Na presença de lesões pré neoplásicas, a erradicação do H. pylori reduz o risco de câncer gástrico : Concordância : 100%, Recomendação : A, Nível de evidência : 1C
Declaração 19: No Brasil, vigilância e tratamento da população, como medida de prevenção do câncer gástrico não é recomendada. Concordância : 100%, Recomendação : D, Nível de evidência : 4
Declaração 20 : Indicações de erradicação de H. pylori:
Parentes em primeiro grau de portadores de câncer gástrico : Concordância : 100%, Recomendação : A, Nível de evidência : 1B
Após ressecção gástrica , ou endoscópica de câncer gástrico : Concordância : 100%, Recomendação : A, Nível de evidência : 1B
Pacientes com pangastrite intensa, gastrite atrófica/metaplasia intestinal : Concordância : 100%, Recomendação : B, Nível de evidência : 1B
Declaração 21 : Após a erradicação do H. pylori, o acompanhamento de portadores de condições pré malignas deve ser :
Exame endoscópico com coleta de dois fragmentos do antro e corpo : Concordância : 100%, Recomendação : C, Nível de evidência : 2B
Intervalo de 3 anos entre as endoscopias para pacientes com atrofia e/ou metaplasia intestinal extensa no antro e corpo : Concordância : 100%, Recomendação : D, Nível de evidência : 4
GRUPO 3 : H. pylori e outras alterações associadas
Declaração 22 : Estudos epidemiológicos e animais sugerem relação negativa entre a infecção por H. pylori e asma brônquica ou atopias : Concordância : 100%, Recomendação : B, Nível de evidência : 2B
Declaração 23 : No sangramento gastrointestinal alto secundária a úlcera péptica, a erradicação do H. pylori é mais efetiva que apenas o tratamento com IBP (com ou sem manutenção) na prevenção da úlcera : Concordância : 100%, Recomendação : A, Nível de evidência : 1 A
Declaração 24 : Sobre a relação do H. pylori e sangramento gastrointestinal em usuários de antinflamatórios não horminais (AINES) OU ASPIRINA (AAS):
Erradicação de H. pylori reduz o risco de úlceras e sangramentos em usuários crônicos de AINES OU AAS : Concordância : 100%, Recomendação : A, Nível de evidência : 2 A.
Em usuários crônicos de AINES, a simples erradicação do H. pylori é suficiente para prevenir a recorrência de úlceras ou sangramentos : Concordância : 100%, Recomendação : A, Nível de evidência : 1B
Testes para H. pylori e tratamento são indicados antes do tratamento crônico com AAS em pacientes de risco para doenças ulcerosas: Concordância : 100%, Recomendação : A, Nível de evidência : 2B
Erradicação do H. pylori reduz o risco de recorrência de sangramento em pacientes em uso de AAS, com antecedente de sangramento em úlcera gastrointestinal : Concordância : 100%, Recomendação : B, Nível de evidência : 1B
Declaração 25: H. pylori deve ser erradicado em pacientes com púrpura trombocitopênica idiopática : Concordância : 100%, Recomendação : B, Nível de evidência : 3 A
Declaração 26: Infecção por H. pylori pode ser fator de risco anemia, baixo nível de ferritina e anemia por deficiência de ferro : Concordância : 100%, Recomendação : b, Nível de evidência : 2 A
Declaração 27: Erradicação do H. pylori não favorece o aparecimento de DRGE : Concordância : 100%, Recomendação : B, Nível de evidência : 1B
Declaração 28: A terapia tripla convencional (IBP em dose standard, 1 grama de amoxacilina, 500mg de claritromicina, duas vezes ao dia por 7 dias) é a primeira opção de tratamento. : Concordância : 100%, Recomendação : A, Nível de evidência : 1 A
Declaração 29 : Devido a falta de validação nacional, esquemas alternativos de primeira opção para erradicação do H. pylori, como as terapias sequenciais, esquema concomitante sem bismuto, ou aqueles com sias de bismuto ou levofloxacino não são recomendados para uso rotineiro no Brasil. Em situações especiais, esquema com furazolidona pode ser usado.: Concordância : 86-89%, Recomendação : D, Nível de evidência : 5
Declaração 30 : Esquemas triplos com IBP, levofloxacino e amoxacilina por 10 dias, ou IBP, furazolidona e levofloxacino por 7 a 10 dias, ou esquema quádruplo com IBP, bismuto, tetraciclina e furazolidona por 10 a 14 dias, são recomendados como terapias de secunda e terceira linhas. Concordância : 89%, Recomendação : A/B, Nível de evidência : 1 A/2C.
Basicamente as orientações seguem as mesmas premissas do consenso anterior, porém, alguns pontos importantes foram modificados nesta edição, e o principal, e mais controverso, é a orientação de tratamento do Helicobacter pylori em todos os pacientes com dispepsia funcional, orientação que não é consenso nos guidelines de associações internacionais. Outro ponto interessante, é a orientação de pesquisa da bactéria em todos os pacientes que realizam endoscopia (afinal , a maioria tem algum sintoma dispéptico que justifica o exame). Por fim, a declaração de que erradicação não favorece o aparecimento de Doença do Refluxo.
Bibliografia:
1- UpToDate online (2015)
2- COELHO, Luiz Gonzaga et al . 3rd BRAZILIAN CONSENSUS ON Helicobacter pylori. Arq.Gastroenterol., São Paulo , v. 50, n. 2, p. 81-96, June 2013 . Available from http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0004-28032013000200081&lng=en&nrm=iso>. access on 24 Apr. 2015. Epub Apr 19, 2013. http://dx.doi.org/10.1590/S0004-28032013005000001.
link : http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0004-28032013005000113
Saiba mais: Pangastrite enantematosa leve