Incidência de câncer gástrico em pacientes com lesões gástricas pré-neoplásicas
Estudo publicado em Julho 2015 na BMJ, mostra uma clara associação entre as lesões pré-neoplásicas de estômago e o risco de câncer gástrico, salientando a importância da vigilância nesta população.
Pacientes com mínimas alterações da mucosa apresentam um risco 1,8x maior de desenvolver câncer gástrico dentro de 20 anos em comparação com aqueles que apresentam mucosa normal. Esse risco aumenta para até 11x nos pacientes com displasia.
Estes achados confirmam a teoria da cascata de Correa, que demonstra a progressão histológica da mucosa normal para o câncer gástrico. A cascata se inicia com a infecção pelo Helicobacter pylori perpetuando uma gastrite crônica, que evolui para gastrite atrófica –> metaplasia intestinal –> displasia –> câncer.
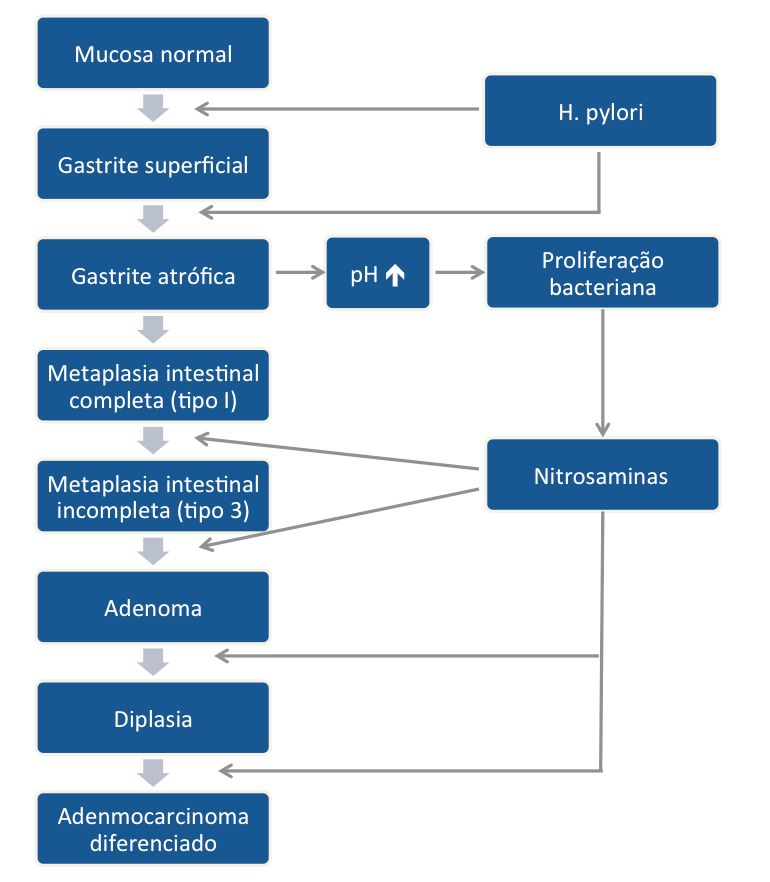
Figura 1: cascata de Correa demonstrando a progressão histológica da mucosa normal ao adenocarcinoma gástrico diferenciado (Lancet, 1975)
Detalhes do Estudo
Para determinar a incidência de CG nos pacientes com lesões pré-neoplásicas gástricas, os pesquisadores conduziram um estudo populacional utilizando dados de 405.211 pacientes do registro nacional da Suécia, que foram submetidos a biópsias gástricas entre 1979 e 2011.
Foram identificados 1599 casos de CG durante um seguimento médio de 10 anos.
Eles calcularam que a incidência anual de CG foi de 20 x 10−5 para o grupo com mucosa normal, 42 x 10−5 para pacientes com alterações mínimas da mucosa, 100 x 10−5 para gastrite atrófica, 129 x 10−5 para o grupo com metaplasia intestinal e 263 x 10−5 para aqueles com displasia.
Isso se traduziu nos seguintes riscos relativos em relação a população geral
- 2.6 x para gastrite crônica
- 4.5 x em pacientes com gastrite atrófica
- 6.2 x para aqueles com metaplasia intestinal
- 10.9 x para displasia
De acordo com este estudo, o risco de desenvolver CG nos próximos 20 anos foi o seguinte:
- 1 em 256 pacientes com mucosa gástrica normal
- 1 em 85 pacientes com gastrite crônica
- 1 em 50 pacientes com gastrite atrófica
- 1 em 40 pacientes com metaplasia intestinal
- 1 em 20 pacientes com displasia
Discussão
O guideline da ESGE (Sociedade Europeia de Endoscopia) já recomenda vigilância para os pacientes com áreas extensas de gastrite atrófica e metaplasia intestinal (EDA a cada 3 anos).
O mesmo guideline também enfatiza a necessidade de associar biópsias (2 de corpo e 2 de antro) para estudo histopatológico nos pacientes com gastrite crônica pois a endoscopia é pouco certeira no diagnóstico da atrofia e metaplasia intestinal.
Já o guideline da ASGE (Sociedade Americana de Endoscopia) não recomenda essa vigilância visto que a incidência de CG, embora aumentada nesta população, ainda assim é muito baixa e não há estudos demonstrando que a vigilância proteja contra o risco de desenvolver ou morrer por CG.
Para saber mais sobre este tema, acesse o site Gastropedia clicando aqui!
Artigo original:
Song H, Ekheden IG, Zheng Z, Ericsson J, Nyrén O, Ye W. Incidence of gastric cancer among patients with gastric precancerous lesions: observational cohort study in a low risk Western population. BMJ 2015;351:h3867 – clique aqui
Artigos relacionados
Imagens de ESD de câncer gástrico precoce
Terceiro consenso brasileiro de H pylori