Ressecções endoscópicas
O plano terapêutico, a técnica a ser utilizada, os materiais a serem usados e a forma de realização das ressecções endoscópicas estão diretamente ligados ao tipo de lesão a ser ressecada.
Definições das lesões do trato gastrointestinal
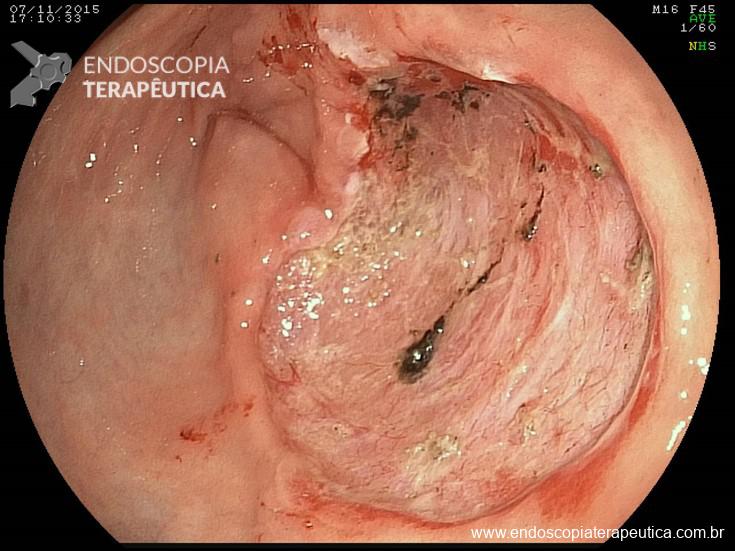
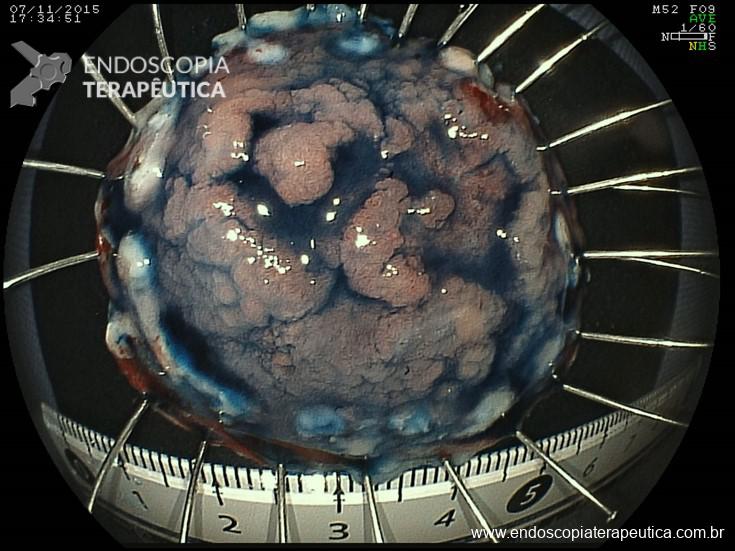
- Pólipos (séssil, subpediculado, pediculado)
- Lesões planas (plano-elevadas, planas, plano-deprimidas)
- Lesão plana maior que 10 mm de circunferência = Lesão de crescimento lateral (LST)
Ver mais em: Classificação de Yamada e Classificação Japonesa das lesões do trato gastrointestinal
O primeiro aspecto a ser avaliado antes de uma ressecção é o tamanho da lesão, sendo que quando menores que 5 mm podem ser ressecadas com pinça de biópsia. Lesões de até 7 mm, em casos selecionados, podem ser ressecadas com alça sem corrente de coagulação (“a frio”). Clique aqui para ver mais sobre o assunto
Lesões maiores que 7 mm geralmente são tratadas com corrente de coagualação e conforme a característica de cada lesão:
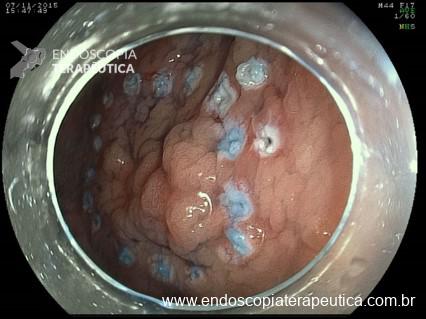
Pólipos pediculados
Do ponto de vista terapêutico, os pólipos pediculados são tratados com ressecção com alça diatérmica. Geralmente usa-se corrente mais de coagulação do que de corte, solicitando que o auxiliar feche a alça com calma e algumas vezes deixando esta fechada por um bom tempo para estrangular o pedículo e assim prevenir sangramento pós-polipectomia.
Quanto maior e mais grosso o pedículo maior a chance de sangramento e por isto algumas medidas podem ser realizadas, como a utilização somente de corrente de coagulação, colocação de endoloop previamente, clipagem com endoclipe antes ou depois da polipectomia e até mesmo a injeção de solução de adrenalina no pedículo. Todas estas técnicas tem suas vantagens e desvantagens sendo a decisão tomada conforme cada situação.
A colocação de endoloop às vezes é inviável em pólipo muito grande principalmente pelo fato do laço ser muito maleável o que dificulta a laçada. Nestes casos pode-se optar por clipar o pedículo, antes ou após a polipectomia. Se for optado pela clipagem prévia deve-se ter cuidado para que alça não entre em contato com o clipe e assim transmita corrente podendo causar danos ao tecido normal. Se a opção for a clipagem após ressecção, o clipe já deve estar montado e rapidamente acessível pra uso caso ocorra um sangramento imediatamente após a ressecção. Uma opção para evitar, ou ao menos diminuir, o sagramento pós-polipectomia é a injeção solução de adrenalina no pedículo, e após a ressecção pode-se ou não realizar a colocação do clipe. Alguns autores argumentam que o efeito da adrenalina na contenção do sangramento é efêmero, podendo resultar em sangramento tardio e contra-indicam o seu uso isolado como método de prevenção de sangramento.
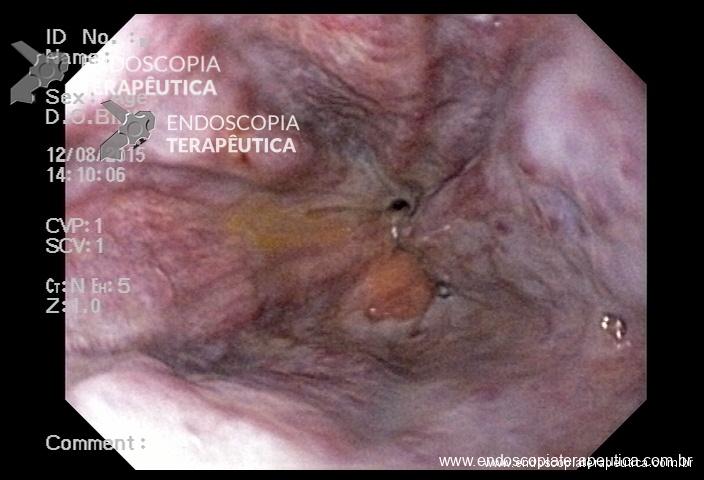
Pólipos subpediculados
Nos pólipos subpediculados a base da lesão deve ser avaliada. Se o componente que forma o “subpediculo” tiver a mesma característica que a lesão, sugere-se a realização de injeção submucosa antes da ressecção. Isto garante que todo o componente adenomatoso ou anormal seja ressecado. Se a base da lesão tiver a mesma caracterísca do cólon normal a polipectomia simples sem injeção na submucosa pode ser realizada.
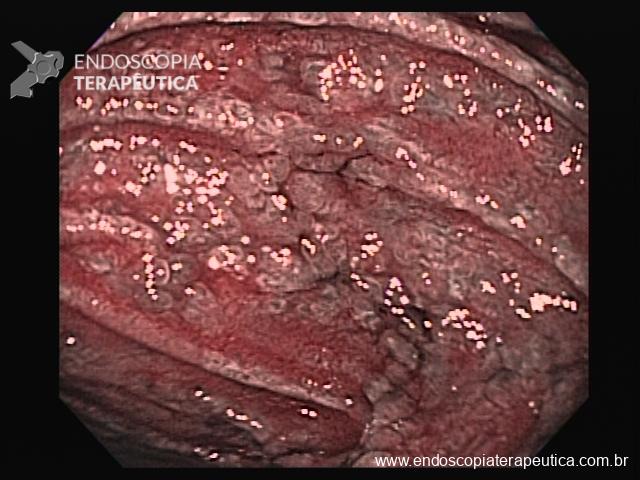
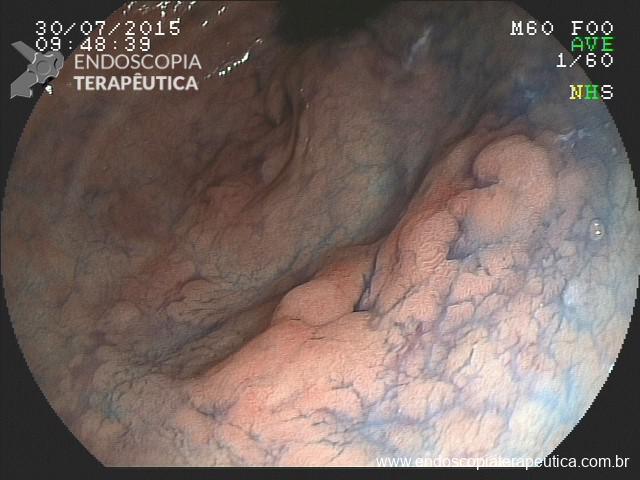
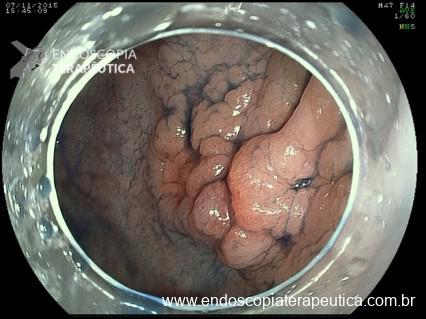
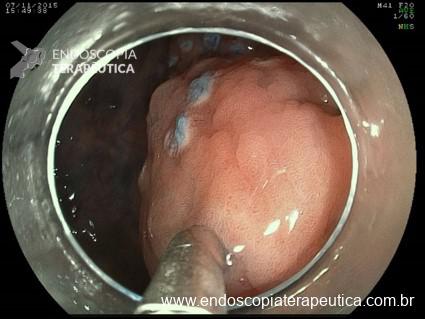
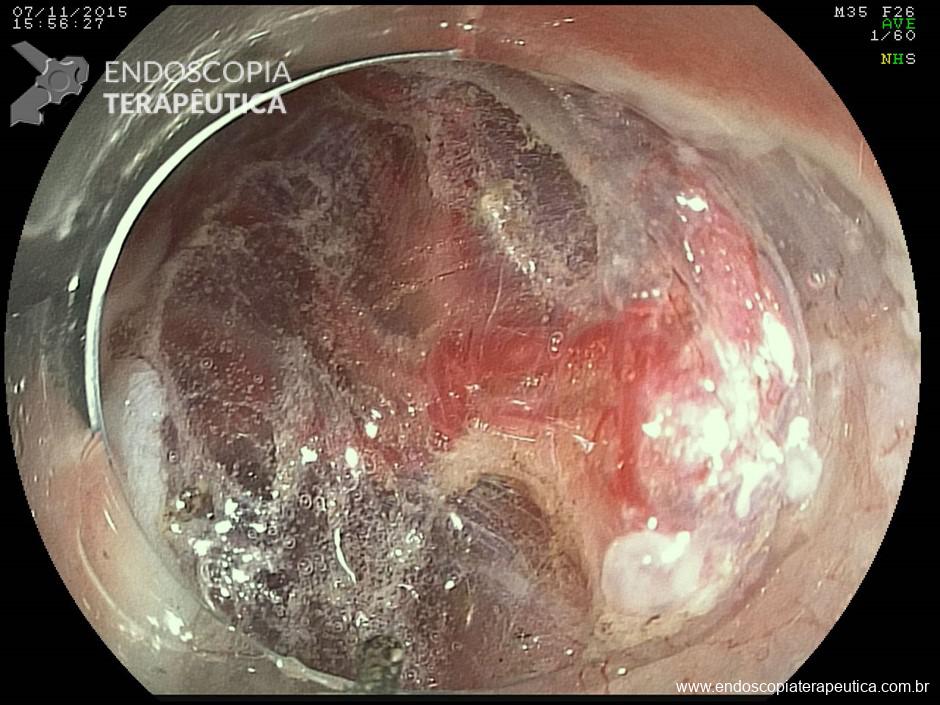
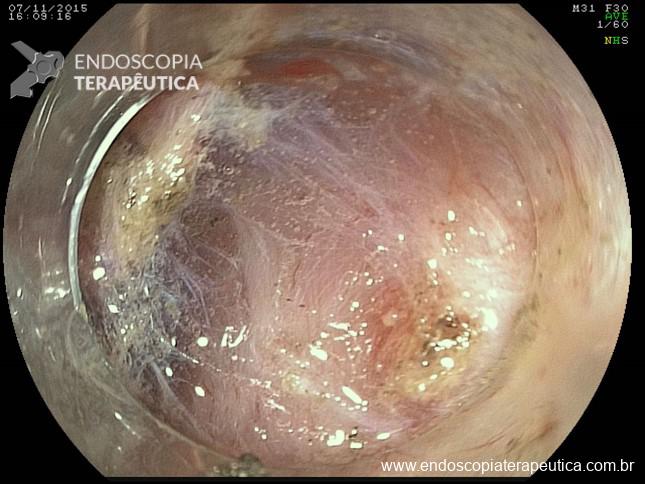
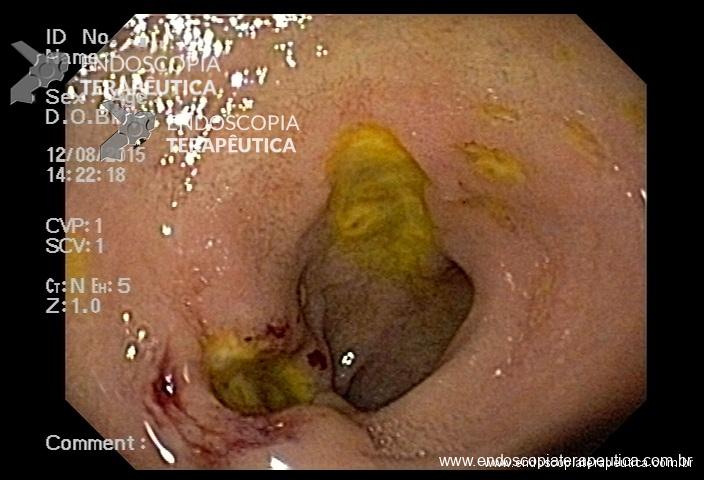
Lesões planas
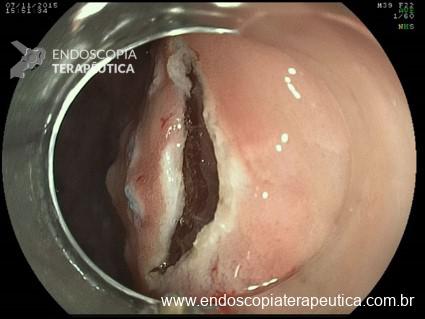
As lesões planas devem ser ressecadas sempre após a injeção submucosa de alguma solução (mucosectomia), para afastar a lesão da muscular própria do órgão e assim evitar uma perfuração. Como nas lesões planas o risco de perfuração é maior do que o de sangramento, geralmente usa-se mais corrente de corte do que de coagulação. Deve-se sempre que possível tentar a ressecção da peça em monobloco. Lesões até 2 cm podem ser ressecadas em fragmentos (piecemeal). Segundo a classificação de Gotoda, lesões planas maiores que 2 cm não devem ser ressecadas com alça, sendo estes casos reservados para dissecção endoscópica da submucosa (ESD).
Para a realização de ressecções com sucesso, além do conhecimento teórico e habilidade técnica deve-se possuir e conhecer os instrumentos de trabalho.
Eletrocautério
- Dispositivo que usa alta frequência (300-1000Hz) para não estimular os tecidos neuromusculares do organismo.
- Voltagem é a força de “empurrar” a corrente. Corrente pode ser contínua ou oscilar.
- Potência (watts) é o trabalho realizado pela corrente elétrica em um determinado intervalo de tempo. Fixada pelo operador e constante no cautérios tradicionais.
- Corte puro: alta temperatura em curto espaço de tempo, com corrente contínua, o que leva a explosão celular e “efeito corte”.
- Coagulação: a corrente oscila, com tempo para o tecido não esquentar tão rapidamente, assim desidrata as células, produz dano tecidual mais profundo e “efeito coagulação”.
A passagem da corrente depende:
- Área de tecido a ser seccionada (maior área = maior voltagem ou maior tempo necessário)
- Impedância do tecido (maior impedância = maior voltagem ou maior tempo necessário)
Eletrocautérios que oscilam sua potência conforme a impedância do tecido são conhecidos como tendo a função endocut:
- Ajuste é feito da potência máxima do ciclo que oscila, por isto recomenda-se usar o dobro da potência usada nos eletrocautérios de potência fixa
- Deve-se manter o pedal pisado constantemente durante todo o procedimento para que o aparelho consiga ir ajustando a potência ideal
Ver mais em: Corte ou Coagulação? Que corrente utilizar?
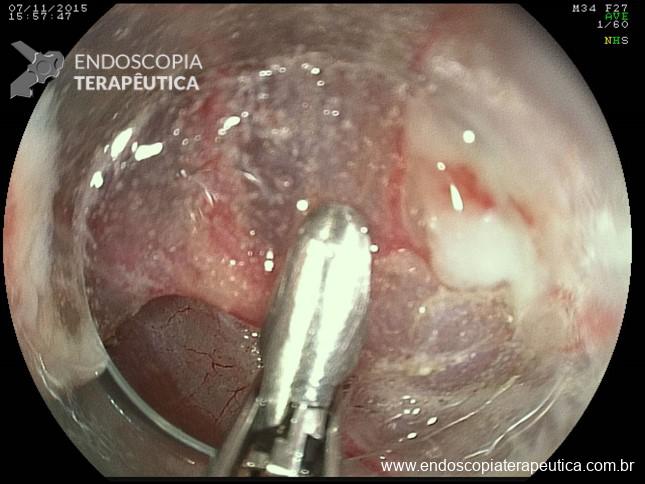
Alças de polipectomia
- Multifilamentar: alça padrão, com tamanho e formatos diferentes para cada caso específico.
- Monofilamentar: alça de um único filamento rígido que por isto tem mais força pra pressionar a mucosa e realizar ressecções mais profundas. Possui também um corte muito rápido, tipo “navalha”, dessa forma o auxiliar deve fechá-la mais lentamente. Usa-se geralmente apenas corrente de coaugulação tendo em vista que o efeito de corte da-se pela própria alça.
Técnicas de ressecção profunda
Usadas em casos específicos onde é necessária a ressecção da mucosa e da submucosa, geralmente em lesões que se originam da mucosa profunda, que são denominadas subepiteliais, porém não submucosas (ex: tumores neuroendócrinos, tumor de células granulares).
As três principais técnicas de ressecção endoscópica profunda são:
- Ressecção com alça monofilamentar
- Ligadura elástica da lesão seguida de resseção com alça
- Dissecção endoscópica da submucosa (ESD). Clique aqui para ver mais sobre o assunto
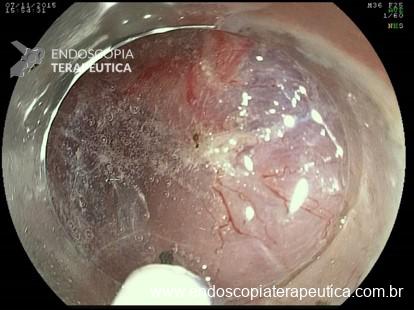
Ressecção underwater
- Estudos com ecoendoscopia comprovam que após preencher o órgão com água ocorre um afastamento da mucosa em relação a muscular própria. Assim através deste método algumas lesões podem ser ressecadas com segurança sem a necessidade de injeção submucosa.
ASSISTA ALGUNS VÍDEOS DE RESSECÇÕES ENDOSCÓPICAS
Polipectomia com profilaxia primária com endoloop
[ddownload id=”4964″]
Mucosectomia
[ddownload id=”4963″]
Ressecção em piecemeal e profilaxia secundária com endoclipe
[ddownload id=”5577″]
Ressecção underwater
[ddownload id=”4954″]
Ressecção profunda com alça monofilamentar
[ddownload id=”4960″]
Ressecção profunda com ligadura
[ddownload id=”4957″]
Ressecção profunda com alça monofilamentar underwater
[ddownload id=”4971″]