Qualidade em Endoscopia – Como diagnosticar o câncer gástrico precoce?
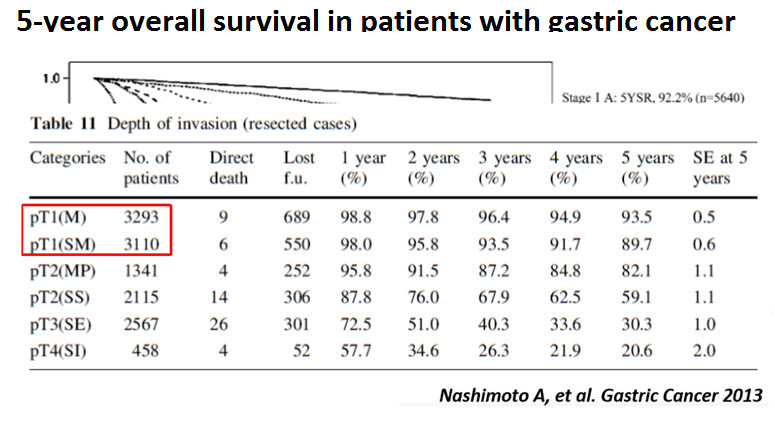
Quanto mais cedo for realizado o diagnóstico do câncer gástrico, melhor o prognóstico e a qualidade de vida dos pacientes. Lesões diagnosticadas e tratadas quando ainda estão restritas à mucosa ou submucosa e sem comprometimento linfonodal (estadio I) apresentam sobrevida média em 5 anos acima de 90%. No Japão, metade dos cânceres gástricos são diagnosticados nesta fase. Esta é uma realidade muito diferente da brasileira. Por aqui, o diagnóstico no estadio I está bem abaixo dos 10% com grande variação entre os trabalhos e a sobrevida média em 5 anos é em torno de 20% (1).
Tabela 1. (Clique para ampliar) Sobrevida média em 5 anos de pacientes com câncer gástrico. Nashimoto A, et al. Gastric Cancer 2013.
A pergunta que fica é: O que nós podemos fazer para melhorar nosso diagnóstico? Neste post tentaremos responder essa pergunta através de dicas para melhorar a técnica endoscópica, caracterizar melhor as alterações endoscópicas sugestivas de neoplasia precoce e discutir sobre como descrever corretamente estas lesões. Este artigo é baseado na conferência da ESGE “Quality in Endoscopy – Upper GI endoscopy and neoplasia”, realizada em Berlin na Alemanha no mês de abril deste ano. Todas as aulas desta conferência estão disponíveis no link http://www.quality-in-endoscopy.org/meeting-presentations-qie9.html.
O exame endoscópico
Para melhorar o diagnóstico precisamos melhorar a nossa técnica de avaliação. Muitas vezes, devido à falta de tempo, baixa remuneração ou grande número de pacientes para fazer exame, deixamos de observar algumas coisas de extrema importância.
- Preparo
A presença de saliva, bolhas e muco durante o exame pode impedir a identificação de lesões discretas. Além disso, os movimentos peristálticos ou a hipercontratilidade do órgão também podem prejudicar a avaliação. Para reduzir estes problemas algumas medidas podem ser utilizadas:
- Administrar alguns minutos antes do exame:
- Pronase 20.000 U ou 2 ml de Acetilcisteína (Fluimucil) para diminuir o muco.
- Simeticona – 2 ml diluídos em 50 ml de água para reduzir as bolhas.
- Logo antes de iniciar o procedimento:
- Administrar Buscopan 10 mg por via endovenosa para reduzir o peristaltismo.
- Após a introdução do aparelho:
- Aspirar todo o líquido e se ainda houverem bolhas ou muco, realizar a lavagem com simeticona diluída em água até a limpeza completa.
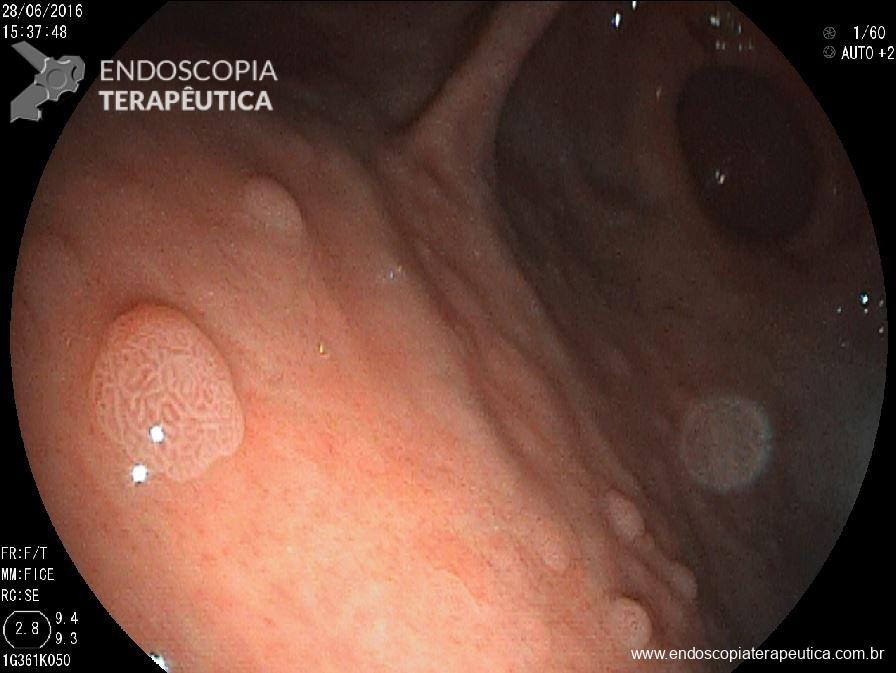
Figura 1. (Clique para ampliar) Estômago com grande quantidade de saliva e bolhas, prejudicando a avaliação. Lesão deprimida identificada após a limpeza, insuflação e cromoscopia com índigo carmin. Imagem da aula “What we can learn with the japanese” de Akido Ono, apresentada na conferência “Quality in Endoscopy – Upper GI endoscopy and neoplasia” da ESGE.
2. Insuflação
A falta de uma insuflação adequada muitas vezes impede a avaliação completa do órgão. O endoscopista deve insuflar completamente o estômago até as pregas se afastarem permitindo a avaliação da mucosa entre elas. Se o paciente tem um esfíncter esofágico inferior muito frouxo, com escape de ar impedido a adequada insuflação, a manobra de Sellick (compressão suave da cartilagem crico-tireóidea colabando o esôfago) pode ser utilizada para obter uma boa insuflação.
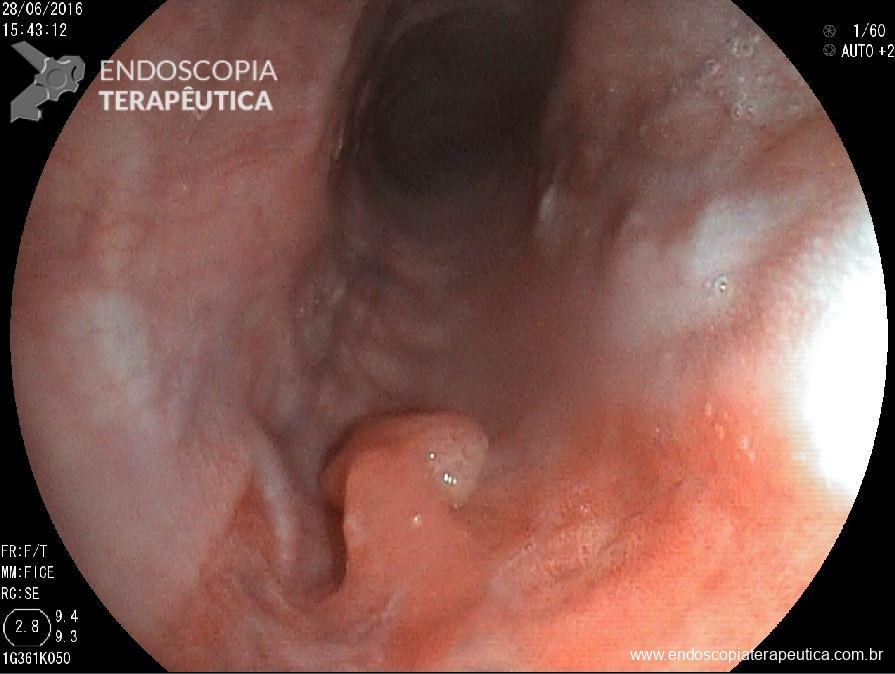
Figura 2. (Clique para ampliar) Estômago mal insulflado. Lesão deprimida com retração de pregas identificada após a adequada insuflação. Imagem da aula “What we can learn with the japanese” de Akido Ono, apresentada na conferência “Quality in Endoscopy – Upper GI endoscopy and neoplasia” da ESGE.
3. Exame cuidadoso
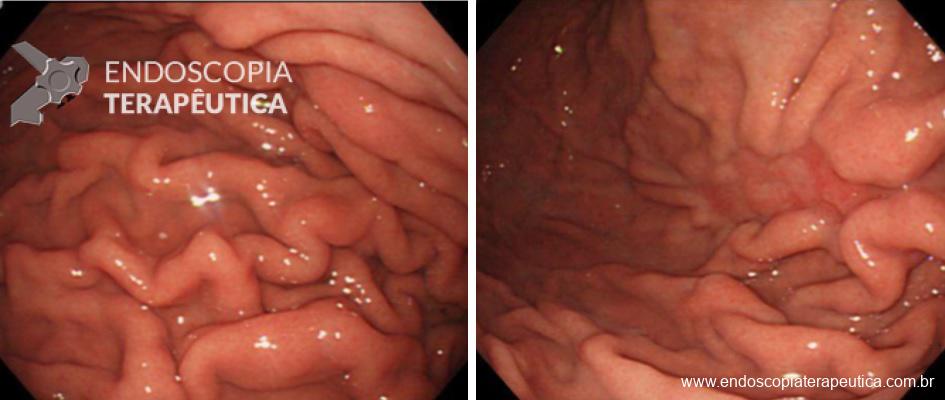
Para diagnosticar alterações discretas é necessário procurar com cuidado. Todas as paredes do órgão devem ser avaliadas e de preferência mais de uma vez, utilizando níveis diferentes de insuflação. Também é necessário dedicar tempo ao exame. Quanto maior o tempo de exame, maior a chance de identificar uma lesão precoce. Utilizando um valor de corte de 7 minutos é observada uma taxa de detecção 2 x maior de lesões de alto risco (atrofia, metaplasia intestinal e displasia gástrica) e 3 x maior no diagnóstico de displasia e câncer gástrico (2).
Reconhecendo as lesões
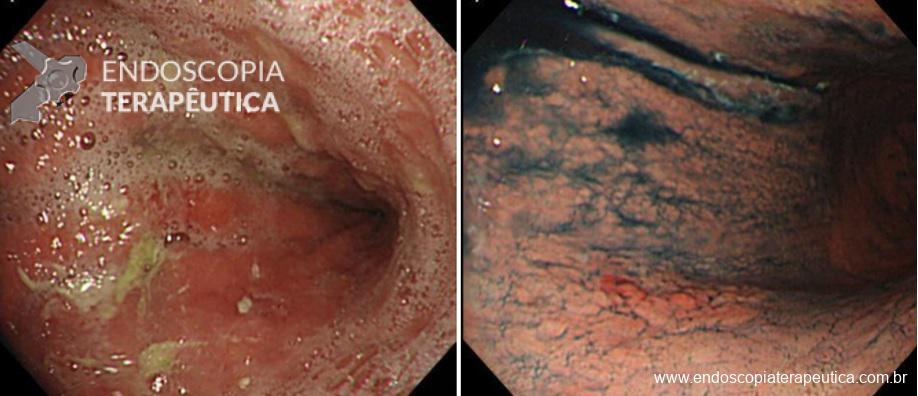
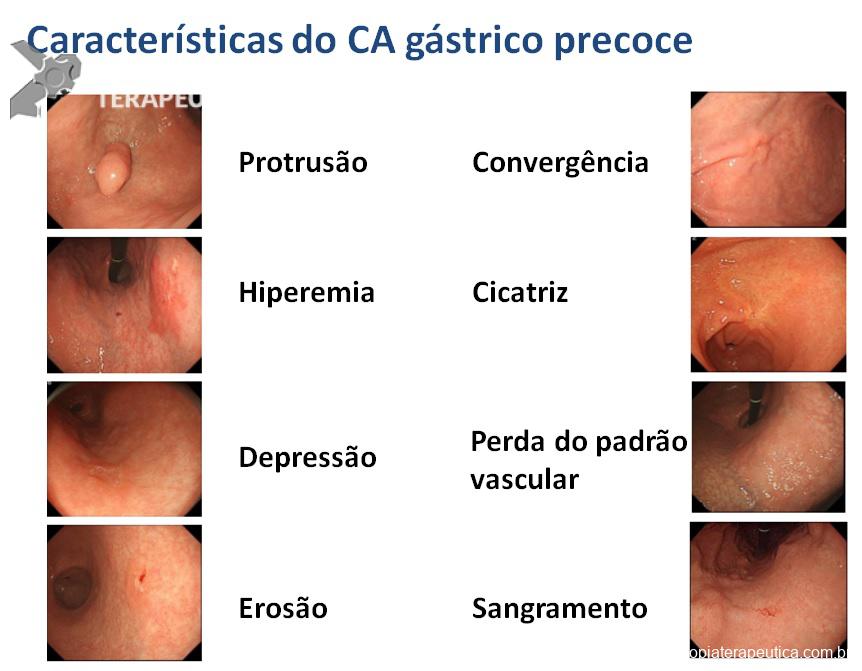
As lesões precoces muitas vezes apresentam alterações muito sutis que podem inclusive ser confundidas com mucosa normal ou trauma causado pelo aparelho. A utilização de um equipamento com alta definição e a utilização de corantes pode ajudar muito no diagnóstico. Sempre que uma área suspeita é identificada, ela deve ser avaliada com cuidado. Todo o muco e saliva devem ser removidos, o estômago deve ser bem distendido e a cromoscopia eletrônica (NBI, Fice, I-Scan) ou com corantes (Índigo Carmin) devem ser utilizadas para caracterizar melhor a lesão.
Figura 3. (Clique para ampliar) Características endoscópicas das lesões precoces. Figura editada utilizando imagens da aula “What we can learn with the japanese” de Akido Ono, apresentada na conferência “Quality in Endoscopy – Upper GI endoscopy and neoplasia” da ESGE.
Descrevendo as lesões
A descrição das lesões é muito importante. O laudo deve descrever todos os detalhes da lesão. Isto é fundamental para a decisão terapêutica e também para reduzir a repetição desnecessária do exame endoscópico.
Deve ser descrita a localização, distância de áreas de referência (cárdia, TEG, piloro, incisura angularis), tamanho e extensão da lesão, número, morfologia e suspeita clínica. Também, se aplicável, deve ser descrita a presença de sinais de hemorragia, cirurgias prévias, presença de estenose, se a lesão é transponível ou não e também as técnicas endoscópicas utilizadas (cromoscopia, magnificação, biópsias, ressecções). A documentação fotográfica ou em vídeo também é importante para a avaliação da lesão pela equipe que vai decidir a conduta terapêutica.
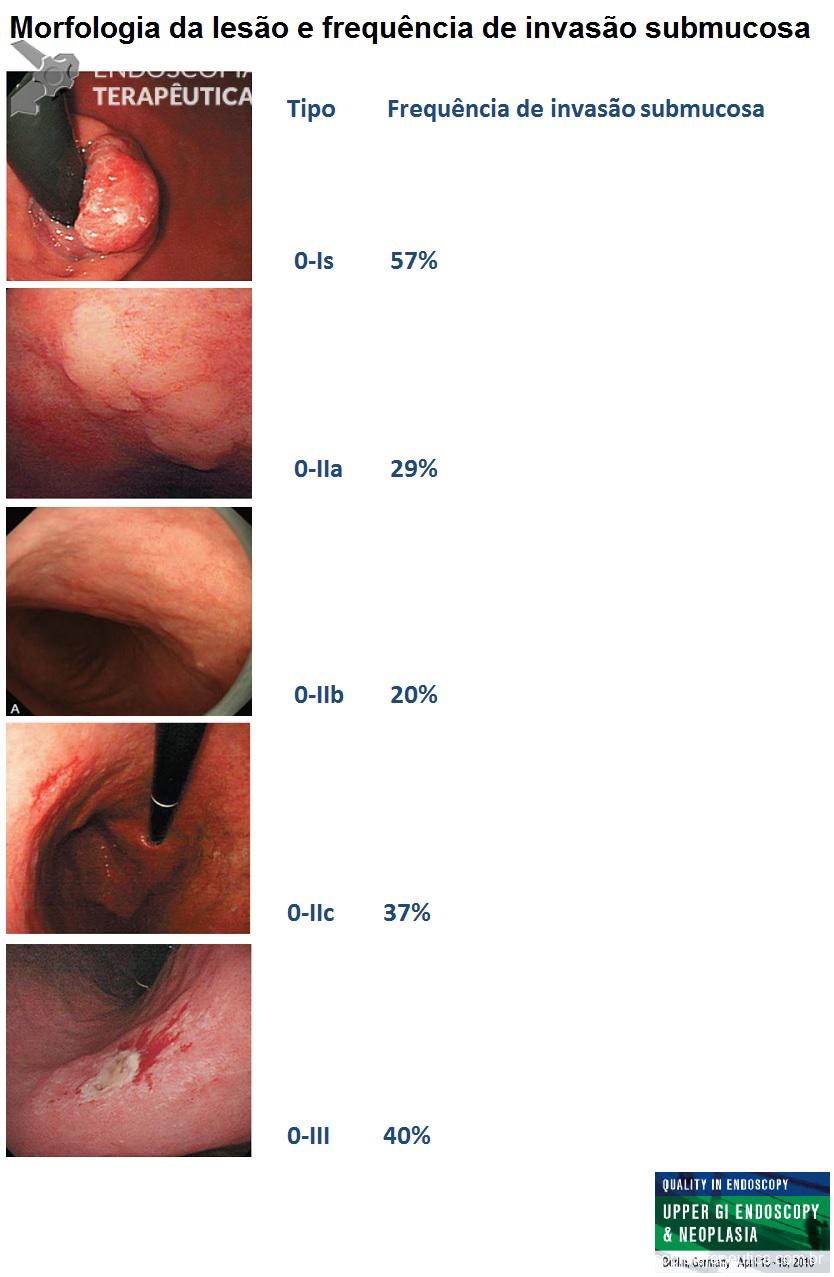
Para a descrição morfológica das lesões é importante utilizarmos classificações validadas. Isso permite uma comunicação eficiente entre o endoscopista e qualquer outro médico que avaliar o laudo. A mais indicada é a classificação Japonesa do câncer gástrico precoce. Utilizando esta classificação é possível estimar o risco de invasão submucosa.
Classificação Japonesa do Câncer Gástrico precoce: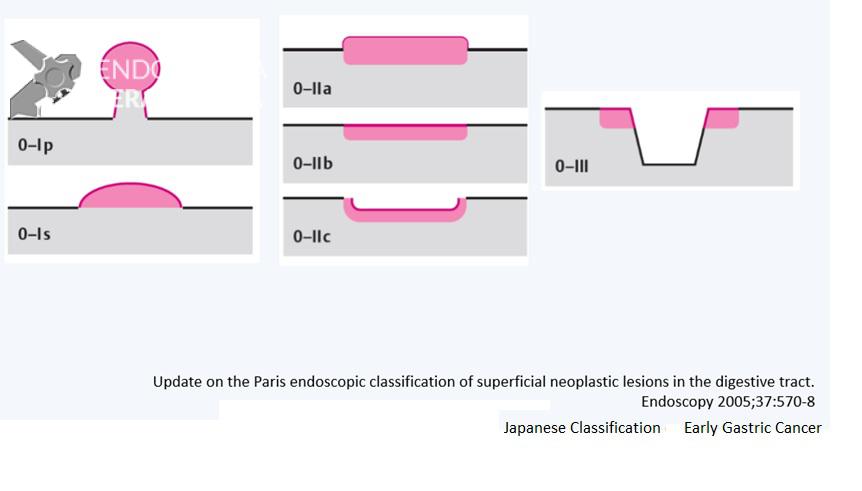
Figura 4. Clique para ampliar.
Figura 5. (Clique para ampliar) Classificação endoscópica e correlação com risco de invasão submucosa. Figura editada utilizando imagens da aula “What we can learn with the japanese” de Akido Ono, apresentada na conferência “Quality in Endoscopy – Upper GI endoscopy and neoplasia” da ESGE.
Conclusão
No Brasil, o câncer gástrico é o quarto mais comum entre os homens e o sexto mais comum entre as mulheres. A mortalidade desta doença no nosso país continua bastante alta. Ainda vai demorar muito para nos aproximarmos das taxas de sobrevida japonesas, pois, não temos um programa de rastreamento (que provavelmente não seria custo-efetivo devido à nossa incidência), não temos a mesma tecnologia de imagem e muitos de nós, também não tem o tempo (ou a remuneração adequada) para um exame tão detalhado. Porém, nós podemos tentar melhorar um pouco esta situação nos pacientes que passam por nós, através da aplicação das medidas descritas anteriormente. Podemos também, selecionar os pacientes que tem um risco aumentado e nestes casos, dedicar um pouco mais de tempo. Pacientes acima de 50 anos que realizam o exame pela primeira vez, pacientes com HP positivo e principalmente os pacientes portadores de atrofia gástrica com metaplasia intestinal, tem um risco aumentado. Realizando um exame dedicado nestes pacientes podemos aumentar significativamente a taxa de identificação de câncer gástrico precoce.
Referências
1.Bruno Zilberstein; Carlos Malheiros; Laercio Gomes Lourenço; Paulo Kassab; Carlos Eduardo Jacob; Antonio Carlos Weston; Cláudio José Caldas Bresciani; Osvaldo Castro; Joaquim Gama-Rodrigues e Grupo do Consenso. Consenso brasileiro sobre câncer gástrico: diretrizes para o câncer gástrico no Brasil. Arq Bras Cir Dig; 26 (1); 2013
2. Teh JL, Tan JR et al. Longer examination time improves detection of gastric cancer during diagnostic upper gastrointestinal endoscopy. Clin Gastroenterol Hepatol. 2015.
3. ESGE “Quality in Endoscopy – Upper GI endoscopy and neoplasia”, conferência realizada em Berlin na Alemanha no mês de abril deste ano. Todas as aulas desta conferência estão disponíveis no link http://www.quality-in-endoscopy.org/meeting-presentations-qie9.html.
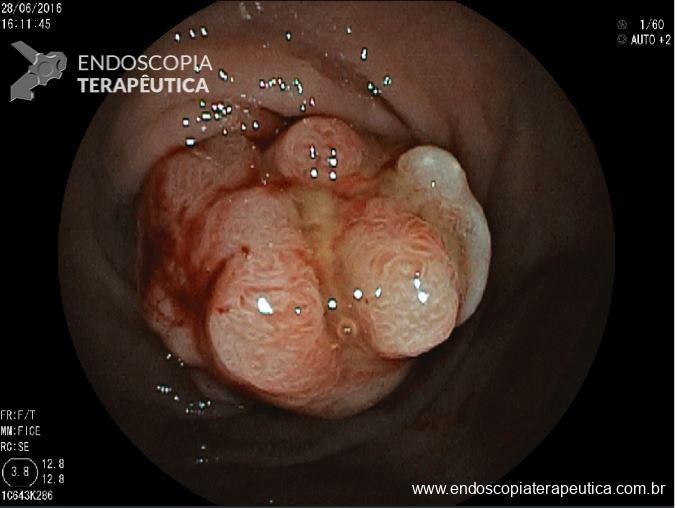
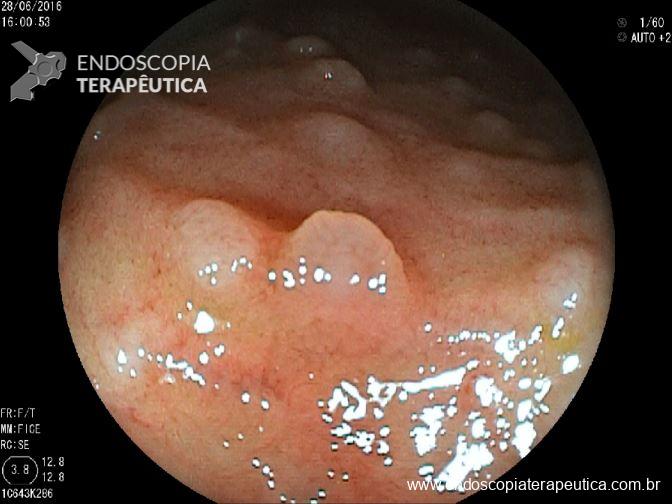
QUIZ! Síndrome de Peutz Jeghers
Como você classificaria o achado endoscópico ?
Ressecção de tumor neuroendócrino duodenal
- Os tumores neuroendócrinos (TNE) de duodeno são raros, correspondendo a 15% de todos os TNE do trato gastrointestinal1.
- Como as células enterocromafins, que dão origem a este tumor, localizam-se na mucosa profunda, ele rapidamente invade a submucosa.
- Portanto, quando fazemos a ressecção endoscópica destas lesões, existe preocupação quanto a ressecção adequada da margem profunda, mesmo em lesões < 10 mm.
- Segundo o consenso europeu de TNE2, a ressecção endoscópica pode ser realizada nas lesões:
- de até 10 mm de diâmetro;
- confinados à submucosa;
- sem acometimento linfonodal e sem metástases à distância;
- No entanto, a literatura demonstra ausência de recorrência na ressecção de tumores neuroendócrino duodenais de até 20 mm3.
Técnicas de ressecção endoscópica
- Mucosectomia (EMR): a grande dificuldade da mucosectomia clássica é a apreensão da lesão após a injeção submucosa. Muitas vezes ocorre maior elevação da mucosa adjacente do que da lesão, tornando-a plana e dificultando a apreensão (ver figura). Na ressecção por EMR há maior risco de comprometimento de margem profunda (ressecção incompleta)4.
- Mucosectomia com alça monofilamentar: uma alternativa à mucosectomia clássica seria a apreensão da lesão com alça monofilamentar, sem injeção submucosa. No entanto, o risco de resseção incompleta persiste.
- Dissecção endoscópica submucosa (ESD): a ressecção por ESD permite segurança da margem lateral e profunda. Porém é tecnicamente difícil, além do alto risco de perfuração devido a espessura do duodeno5.
- Ressecção endoscópica submucosa com auxílio de banda elástica (ESMR-L): esta técnica já é bem estabelecida na ressecção de TNE de reto. Recentemente foi publicada uma série de casos utilizando a mesma técnica para o tratamento de TNE de duodeno que demonstrou 100% de ressecção em monobloco e ausência de perfurações6.
Na ressecção de nosso vídeo, paciente sob sedação foi submetido inicialmente a uma ecoendoscopia para avaliar a profundida da lesão. Confirmado a ausência de acometimento da muscular própria, o ecoendocópio foi trocado por um endoscópio padrão e realizada injeção submucosa com solução salina. Em seguida foi acoplado um kit de ligadura elástica, a lesão foi então aspirada para o interior do cap e liberada uma banda elástica. Realizada a ressecção com alça diatérmica (endocut) abaixo da banda elástica com ressecção completa da lesão. À revisão do leito foi optado pela complementação da hemostasia com plasma de argônio sem intercorrências. O resultado do anatomopatológico demonstrou margens livres e imuno-histoquímica compatível com tumor neuroendócrino bem diferenciado grau I (KI 67 < 2%).
Em suma a ressecção endoscópica submucosa com auxílio de banda elástica (ESMR-L) é uma técnica factível, efetiva e segura para a ressecção de TNE duodenais de até 10 mm, limitados a submucosa.
[ddownload id=”6029″]
Referências:
- Soga J (2005) Early-stage carcinoids of the gastrointestinal tract: an analysis of 1914 reported cases. Cancer 103(8):1587–1595. doi:10.1002/cncr.20939
- Delle Fave G, Kwekkeboom DJ, Van Cutsem E, Rindi G, KosKudla B, Knigge U, Sasano H, Tomassetti P, Salazar R, Ruszniewski P (2012) ENETS Consensus Guidelines for the management of patients with gastroduodenal neoplasms. Neuroendocrinology 95(2):74–87. doi:10.1159/000335595
- Zyromski NJ, Kendrick ML, Nagorney DM, Grant CS, Donohue JH, Farnell MB, Thompson GB, Farley DR, Sarr MG (2001). Duodenal carcinoid tumors: how aggressive should we be? J Gastrointest Surg 5(6):588–593
- Kim GH, Kim JI, Jeon SW, Moon JS, Chung IK, Jee SR, Kim HU, Seo GS, Baik GH, Lee YC (2014) Endoscopic resection for duodenal carcinoid tumors: a multicenter, retrospective study. J Gastroenterol Hepatol 29(2):318–324. doi:10.1111/jgh.12390
- Matsumoto S, Miyatani H, Yoshida Y, Nokubi M (2011) Duodenal carcinoid tumors: 5 cases treated by endoscopic submucosal dissection. Gastrointest Endosc 74(5):1152–1156. doi:10. 1016/j.gie.2011.07.029
- Osera S, Oono Y, Ikematsu H, Yano T, Kaneko K. Endoscopic submucosal resection with a ligation device for the treatment of duodenal neuroendocrine tumors. Surg Endosc. 2015 Dec 16. [Epub ahead of print] PubMed PMID: 26675937.
ARTIGO COMENTADO – História natural e manejo de estenoses benignas de esôfago refratárias
Bases do estudo:
Estenoses benignas de esôfago possuem múltiplas etiologias, incluindo: cáustica, péptica, pós cirúrgica, por esofagite eosinofílica, pós ablação e ressecção endoscópica e pós radioterapia. As estenoses potencialmente possuem um impacto negativo significativo na qualidade de vida dos pacientes levando, não só a disfagia, mas também a desnutrição, perda de peso e risco de broncoaspiração. A maioria das estenoses benignas são tratadas com dilatação por sonda (“bougie”) ou balão, com resolução após 1 ou somente poucas sessões. Contudo 30% – 40% das estenoses possuem recorrência em longo prazo. Em um grupo de pacientes (<10%), pelo menos 5 dilatações para, pelo menos, 14 mm não conseguem estabelecer adequada e persistente passagem do bolo alimentar. Esses casos são definidos como estenose esofagiana benígna refratária (RBES)
Algumas alternativas técnicas podem ser utilizadas para se evitar o tratamento cirúrgico, ou mesmo a necessidade de suporte nutricional via gastrostomia, entre elas cita-se: dilatação associada a injeção de esteroides no sítio de lesão, uso de próteses auto expansíveis plásticas ou metálicas, e mesmo auto dilatação. Tais técnicas possuem resultado ainda não bem estabelecido na literatura, com dados incertos sobre sua eficácia e pequeno tempo de seguimento dos pacientes.
Objetivo:
Avaliar o resultado do seguimento de longo prazo em pacientes com estenose esofagiana benigna refratária (> 6 meses)
Pacientes e método:
Análise retrospectiva de prontuários dos últimos 15 anos em dois centros terciários acadêmicos (Humanitas Research Hospital, Milan, Italy, e Hospital of the University of Pennsylvania, Philadelphia, Pennsylvania, USA). Selecionados pacientes com diagnóstico de estenose esofagiana recorrente ou refratária, definidos como a persistência ou recorrência de disfagia apesar do tratamento por, ao menos, 5 sessões de dilatação.
Foram realizadas sessões de dilatações com vários tipos de aparelhos, de diferentes marcas e diâmetro, com uso ou não de radioscopia, de acordo com a disponibilidade local de instrumentos, as características da estenose e o tipo de tratamento aplicado. O tratamento incluiu dilatação com sonda (“bougie”) ou balão, injeção de esteroides, colocação de próteses, realização de gastrostomia e cirurgia.
Foram extraídos de prontuário: dados clínicos e demográficos de cada paciente, incluindo sexo, idade do diagnóstico, etiologia, local e extensão da estenose, tipo e números de tratamentos aplicados, tempo livre de disfagia entre os tratamentos, resultados finais e eventos adversos.
O resultado primário avaliado foi a resolução clínica de disfagia definida por: manutenção do status livre de disfagia por, ao menos, 6 meses, sem necessidade de abordagem adicional no seguimento. Resultado desfavorável foi definido como a necessidade de abordagem adicional com tratamento endoscópico, gastrostomia ou cirurgia nesse intervalo.
Resultados:
- Selecionados 70 pacientes com RBES (46 homens; média de idade de 60 anos
- Seguimento médio de 43.9 meses (3.7-157 meses)
- Etiologia:
- Cáustica – 7 (10%)
- Pós radioterapia – 10 (14,3%)
- Cirúrgica – 22 (31,4%)
- Mista – 28 (40%)
- Pós inflamatória – 3 (4,3%)
- Localização da estenose:
- Cervical – 29 (41.4%)
- Esôfago médio – 8 (11.4%)
- Esôfago distal – 29 (41.4%).
- Múltipla – 4 (5.8%)
- Extensão da estenose:
- < 2 cm – 15 (21.4%)
- Entre 2 – 5 cm – 14 (20%)
- > 5 cm – 7 (10%)
- Informação não disponível – 34 (48.6%).
- Todos os pacientes foram submetidos a sessões sequenciais de dilatação pneumática ou por sonda – média de 15.5 sessões por pacientes
- Injeção de esteroide foi usada em 20 pacientes (28.6%), média de 1.65 sessões por paciente (1-7 sessões).
- Stents
- Metálico auto expansível (SEMSs) – 18 (25.7%) pacientes
- Biodegradável – 14 (20%) pacientes
- Eventos adversos:
- Perfuração – 3 pacientes (4.3%)
- Fistula – 4 (5.7%) – 2 em casos de dilatação e 2 em colocação de stent
- Duas mortes (3%) foram relacionadas a RBES
- A resolução dos casos RBES foi alcançada em somente 22 dos 70 (31.4%) pacientes.
- A taxa de sucesso foi menor nos pacientes que foram tratados também com stents ( [OR] 3.7; 95% [CI], 1.01-18.0).
- O tempo médio livre de disfagia foi de 3.3 meses (95% CI, 2.4-4.1) para pacientes tratados com dilatação e 2.4 meses (95% CI, 1.2-3.6) para pacientes tratados com stent (P = .062).
- Ao longo do tempo, o tempo total livre de disfagia aumentou em uma taxa de 4.1 dias (95% CI, 1.7-6.4) por dilatação.
Conclusões:
O estudo apresentado demonstrou um resultado desapontador no seguimento a longo prazo das estenoses esofagianas benígnas refratárias, com resolução clínica alcançada somente em 1 a cada 3 pacientes. O tempo livre de disfagia foi relativamente pequeno, afetando a qualidade de vida. Stents não parecem afetar o resultado o tratamento dos pacientes com RBES.
Comentários:
O presente estudo constitui-se em uma das grandes séries da literatura que abordam pacientes com estenose esofagiana benígna refratária e apresentam dados de grande valor na avaliação e seguimento de tais casos. Assim como outras séries, percebe-se a complexidade no manejo dos pacientes com estenose refratária e baixa percentagem de resolução clínicas de tais casos.
Ao se analisar os dados detalhadamente, percebe-se que a maioria das estenoses refratárias descritas são de conhecido díficil manejo, como as de localização cervical (41.4% dos casos) e de maior tamanho (>2 cm em 21/36 – 58.3% – de tamanho conhecido), e que portanto, necessitam de abordagens em centros terciários especializados.
Chama atenção ainda, a incapacidade dos stents atualmente disponíveis em melhorar o resultado endoscópico final de tais pacientes. Novos stents específicos para tais lesões são necessários.
O fato do trabalho ser retrospectivo, não randomizado, não usar algorítmos definidos no tratamento e não usar escores de disfagia na avaliação traz limitações, sem dúvida. Estudos prospectivos e com desenho específico serão bem vindos.
Natural history and management of refractory benign esophageal strictures
DOI: http://dx.doi.org/10.1016/j.gie.2016.01.053
Alessandro Repici, Aaron J. Small, Aaron Mendelson, Manol Jovani, Loredana Correale, Cesare Hassan, Lorenzo Ridola, Andrea Anderloni, Elisa Chiara Ferrara,Michael L. Kochman.
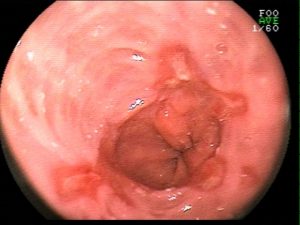
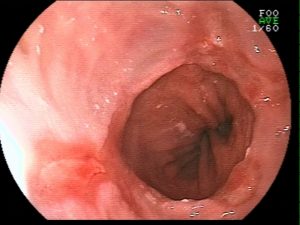
QUIZ! Qual a principal suspeita diagnóstica diante do quadro apresentado?
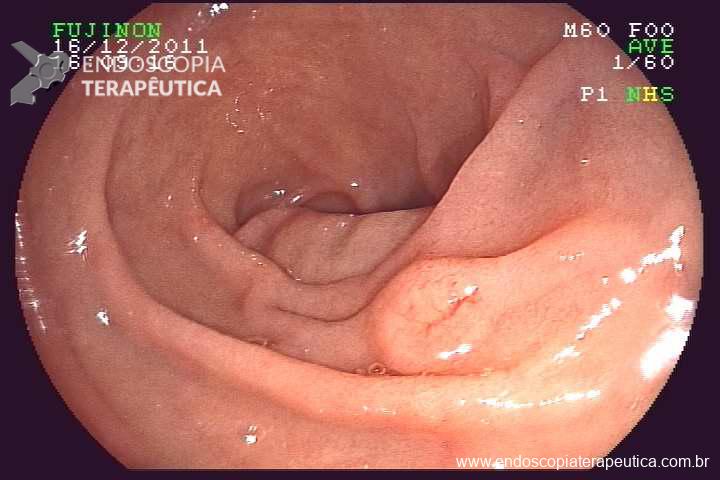
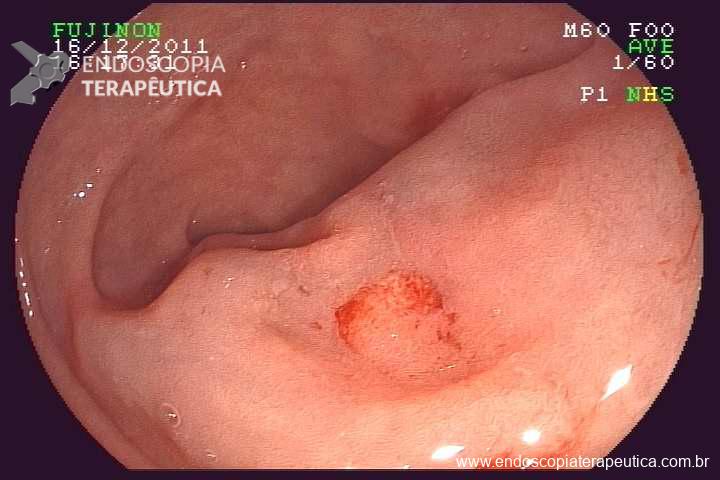
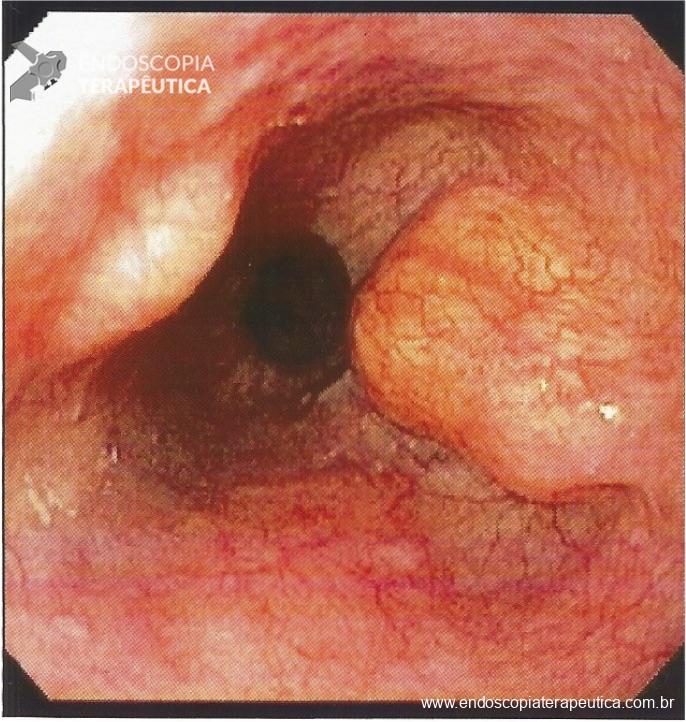
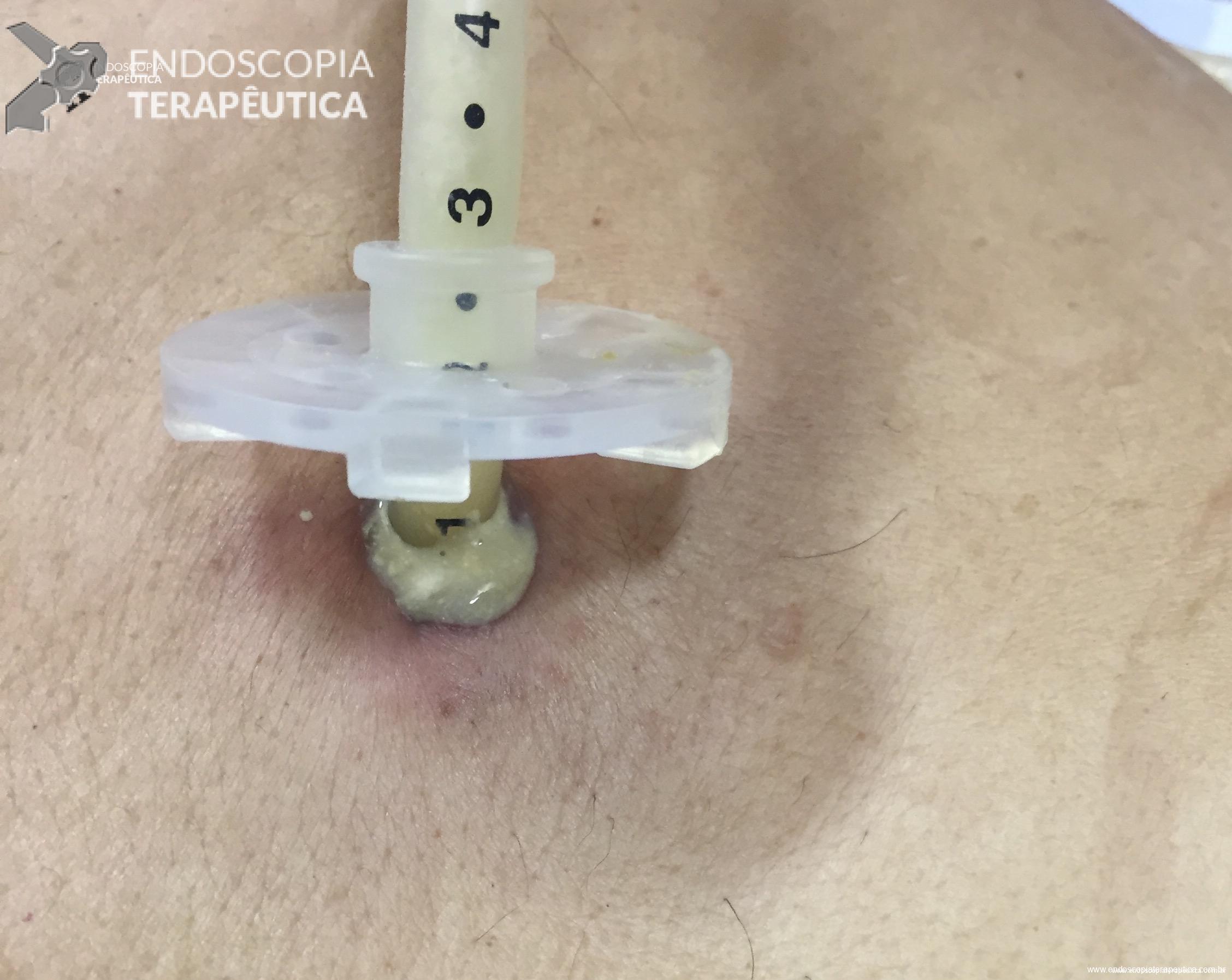
Paciente 58 anos, em programação de tratamento oncológico devido a neoplasia de hipofaringe, tendo sido submetido há cerca de 2 meses a gastrostomia endoscópica percutânea. Há 5 dias vem evoluindo com relato de dificuldade para infusão da dieta via gastrostomia, associado a vazamento da mesma.
Ao exame físico foi evidenciado:
Qual a sua principal suspeita diagnóstica?