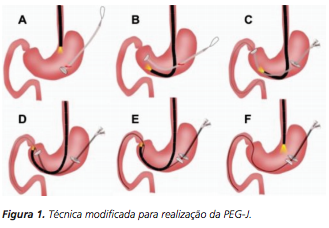
Técnica modificada para realização da gastro-jejunostomia endoscópica percutânea
Modified technique for percutaneous endoscopic gastrojejunostomy placement
Rev. Col. Bras. Cir. 2017; 44(4): 413-415
INTRODUÇÃO
A realização da gastrostomia endoscópica percutânea (PEG) proporciona nutrição enteral segura e a longo prazo em pacientes com disfagia ou ingestão oral insuficiente(1).
No entanto, as complicações relacionadas à nutrição gástrica, como pneumonia por aspiração e vazamento periostomal grave, podem impedir o uso da PEG. A nutrição jejunal pode superar essas complicações com o fornecimento de dieta após o piloro(2) .
A alimentação jejunal é comumente obtida colocando-se uma extensão jejunal através de um tubo de PEG existente. Este procedimento é referido como gastrojejunostomia endoscópica percutânea (PEG-J). A PEG-J tem algumas indicações frequentes como (3):
- gastroparesia grave
- obstrução pilórica
- pacientes com gastrostomia, mas com refluxo gastroesofágico grave, e aspirações pulmonares de repetição
Diversas técnicas para realização da PEG-J já foram relatadas na literatura, com significativas variações técnicas entre elas e diferentes impactos na taxa de sucesso do procedimento. Neste artigo sugerimos modificações à técnica inicialmente descrita por Sibille et al. 4 , para minimizar o risco de uma de suas principais complicações: a migração da extensão jejunal de volta para o estômago.
RELATO TÉCNICO
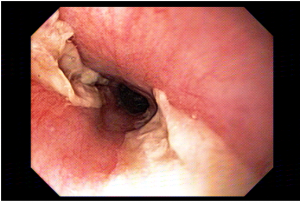
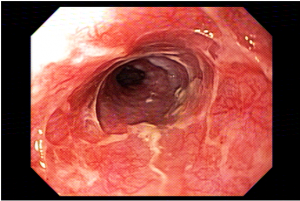
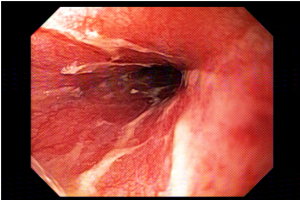
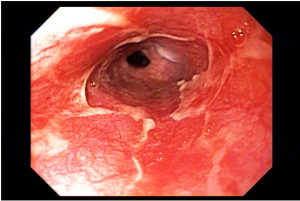
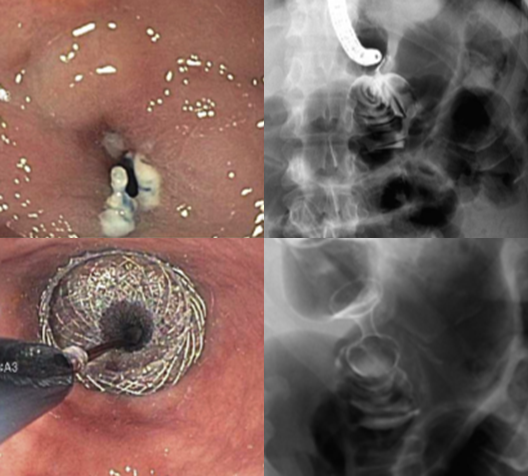
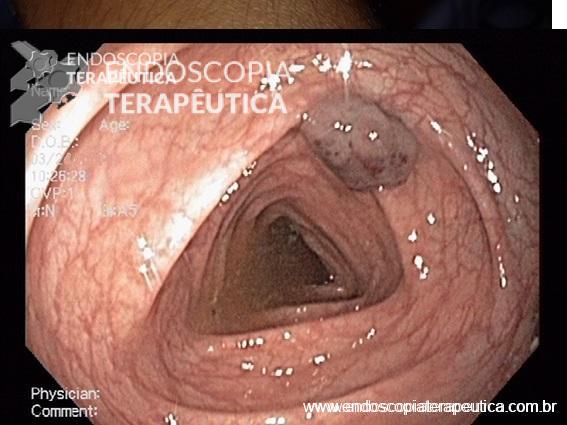
A técnica modificada que estamos sugerindo deve ser realizada por um endoscopista juntamente com outro médico ou um auxiliar. Após a realização da gastrostomia endoscópica percutânea (PEG) como descrito por Gauderer, Ponsky e Izant com uma sonda de 24 Fr, o gastroscópio deve ser reintroduzido no estômago e posicionado logo abaixo da junção gastroesofágica (Figura 1). O estômago deve ser mantido insuflado enquanto o auxiliar avança o anteparo interno da sonda de gastrostomia em direção ao piloro. Eventualmente pode ser necessário usar a ponta do endoscópio para guiar a direção correta do anteparo e, se esta manobra falhar, um pinça de corpo estranho pode ser usada para carregar o anteparo interno da sonda em direção ao piloro, conforme descrito por Sibille et al. 4. Uma vez que o anteparo interno estiver posicionado na região pré-pilórica, a sonda de gastrostomia deve ter seu lúmen bem lubrificado com gel. Em seguida, o auxiliar avança suavemente a extensão jejunal através do lúmen da sonda de gastrostomia para passar o piloro em direção ao intestino delgado (a extensão jejunal atravessará diretamente o piloro sem o uso de um fio-guia). Neste ponto, o auxiliar puxa ligeiramente de volta a sonda de gastrostomia apenas para permitir que o endoscopista possa apreender a extensão jejunal com uma pinça de corpo estranho. Esta manobra irá assegurar a posição da extensão jejunal até o final do procedimento. Sob controle da visão endoscópica, o auxiliar novamente puxa a sonda de gastrostomia de volta em direção à parede gástrica até sentir resistência, o que indica que o anteparo interno está em contato novamente com a parede gástrica. Finalmente, a extremidade proximal da extensão jejunal deve ser conectada à sonda de gastrostomia e tanto a pinça como o gastroscópio são então removidos.
DISCUSSÃO
Os pacientes em condições críticas e geriátricos frequentemente necessitam de nutrição enteral, que é preferível à parenteral. No entanto, o esvaziamento gástrico é comumente prejudicado por gastroparesia, particularmente em pacientes com diabetes ou com comorbidades graves(4,6). Para permitir um fluxo adequado da dieta enteral para o intestino delgado e diminuir a regurgitação ou aspiração, a dieta deve ser fornecida após o ângulo de Treitz. Assim, a PEG-J ainda é a melhor opção para esses pacientes. Além disso, a PEG-J possibilita a sucção gástrica para reduzir a regurgitação.
O procedimento de colocação de uma PEG-J, entretanto, é muitas vezes um desafio técnico. Neste artigo demonstramos uma técnica modificada para a colocação da PEG-J com objetivo de evitar a principal dificuldade do procedimento: formação de alça na extensão jejunal dentro do estômago.
Fluoroscopia e fio-guia não são necessários com o uso desta técnica. Na verdade, o fio-guia em si não impede a possibilidade de formação de alça enquanto se avança a extensão jejunal. E a visão endoscópica após o posicionamento da extensão jejunal no intestino delgado torna a fluoroscopia desnecessária.
Além disso, não foi adotada a técnica de passagem inicial de um fio-guia, conforme descrito por DeLegge et al. (7), pois em alguns casos esta abordagem tornou a extensão jejunal mais rígida, e impediu a passagem da extensão do bulbo para o segunda porção duodenal.
CONCLUSÕES
O passo chave na nossa técnica modificada é o posicionamento da sonda de gastrostomia junto ao piloro enquanto a extensão jejunal é avançada através do duodeno. Esta simples manobra, realizada sob controle visual, evitou a formação de alça dentro do estômago na extensão jejunal, que muitas vezes pode complicar o procedimento e torná-lo mais demorado.
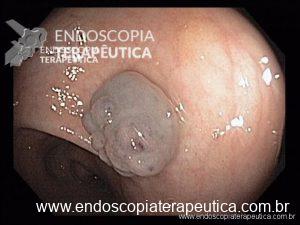
Após a realização de diversos casos, tive dificuldade em posicionar alguns anteparos na região pré-pilórica devido à desvios do piloro, fato que por vezes impediu o sucesso do procedimento. Portanto, comecei “intubar” o piloro com anteparo interno posicioná-lo no bulbo duodenal (sempre com auxílio de uma pinça; de corpo estranho se possível). Veja foto abaixo. Com essa manobra observei que a taxa de sucesso aumentou consideravelmente.
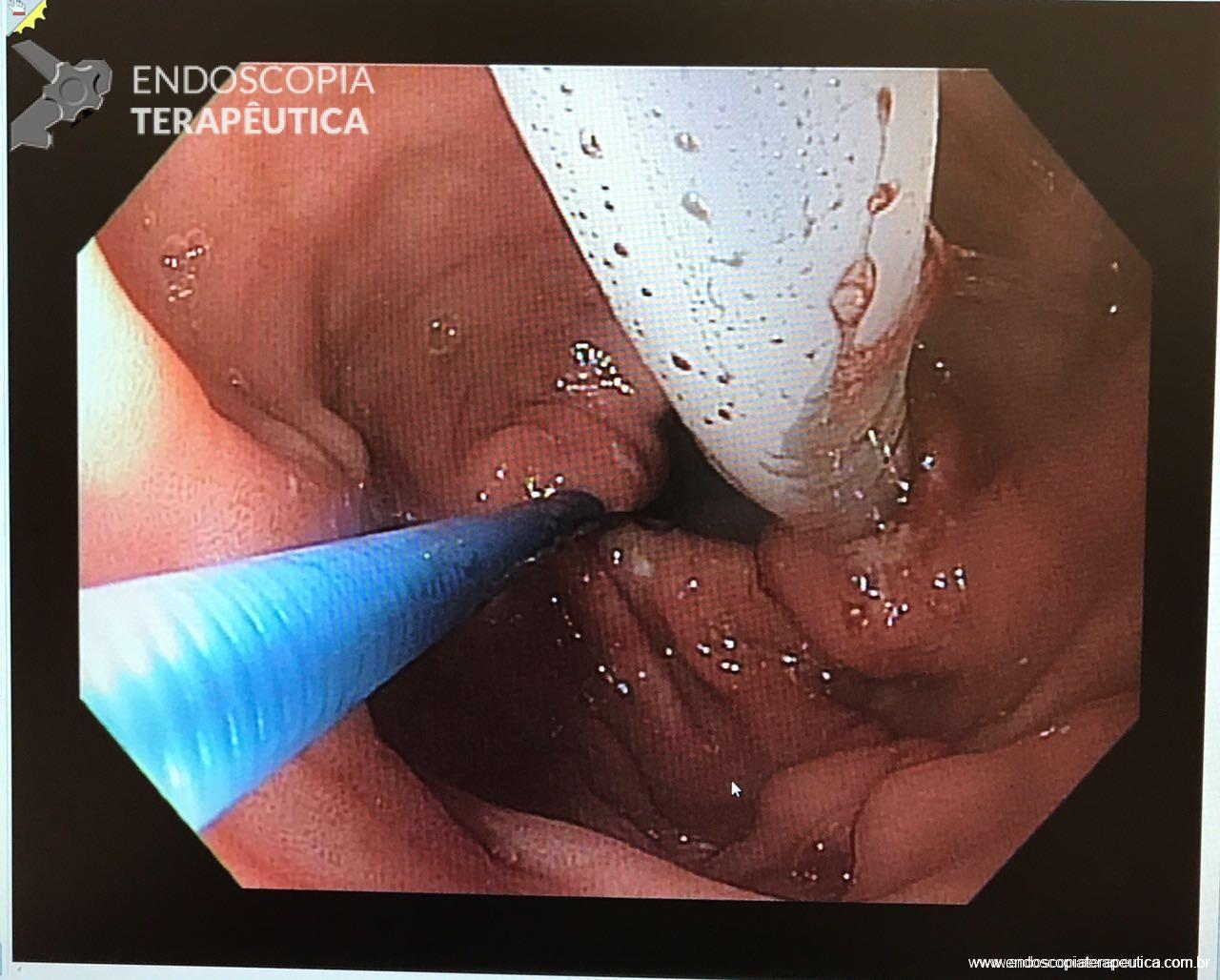
E você ? Também já sofreu para passar uma sonda dessas ? Relate sua experiência para nós. Assim todos poderemos aprender juntos !
REFERÊNCIAS
1. Toh Yoon EW, Yoneda K, Nakamura S, Nishihara K. Percutaneous endoscopic transgastric jejunostomy (PEG- -J): a retrospective analysis on its utility in maintaining enteral nutrition after unsuccessful gastric feeding. BMJ open Gastroenterol. 2016;3(1):e000098. Erratum in: BMJ Open Gastroenterol. 2016;3(1):e000098corr1.
2. Zhang Z, Xu X, Ding J, Ni H. Comparison of postpyloric tube feeding and gastric tube feeding in intensive care unit patients: a meta-analysis. Nutr Clin Pract. 2013;28(3):371-80.
3. DiSario JA. Endoscopic approaches to enteral nutritional support. Best Pract Res Clin Gastroenterol. 2006;20(3):605-30.
4. Sibille A, Glorieux D, Fauville JP, Warzée P. An easier method for percutaneous endoscopic gastrojejunostomy tube placement. Gastrointest Endosc. 1998;48(5):514-7.
5. Gauderer MW, Ponsky JL, Izant RJ Jr. Gastrostomy without laparotomy: a percutaneous endoscopic technique. J Pediatr Surg. 1980;15(6):872-5. 6. Heyland D, Cook DJ, Winder B, Brylowski L, Van deMark H, Guyatt G. Enteral nutrition in the critically ill patient: a prospective survey. Crit Care Med. 1995;23(6):1055-60. 7. DeLegge MH, Patrick P, Gibbs R. Percutaneous endoscopic gastrojejunostomy with a tapered tip, nonweighted jejunal feeding tube: improved placement success. Am J Gastroenterol. 1996;91(6):1130-4