QUIZ – ENDOSCOPIA PEDIÁTRICA
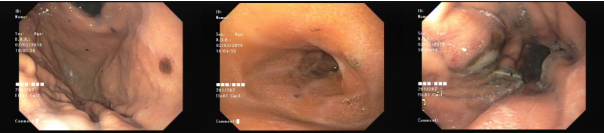
Em se tratando da população pediátrica, é sabido que a realização de biópsias em áreas macroscopicamente normais à endoscopia aumenta sobremaneira o diagnóstico de muitas doenças.
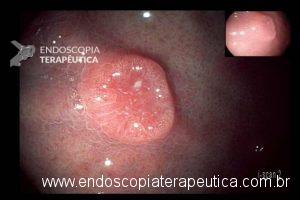
QUIZ! Achado em antro gástrico. Você acerta esta aqui?
Artigos comentados – Julho 2018
Apresentamos os artigos considerados de maior relevância na área de endoscopia que foram publicados recentemente.
Peroral Endoscopic Pyloromyotomy Is Efficacious and Safe for Refractory Gastroparesis: Prospective Trial With Assessment of Pyloric Function
J Jacques, L Pagnon, F Hure, R Legros, S Crepin, AL Fauchais, S Palat, P Ducrotté, B Marin, S Fontaine, NE Boubaddi, MP Clement, D Sautereau, V Loustaud-Ratti, G Gourcerol, J Monteil. Endoscopy 2018 Jun 12.
Em um estudo prospectivo e em centro único francês, foi avaliado a viabilidade, segurança e eficácia da piloromiotomia endoscópica perioral (G-POEM) para o tratamento de pacientes com gastroparesia refratária. Foram incluídos 20 pacientes (10 diabéticos e 10 não diabéticos). Os pacientes foram submetidos pré e pós procedimento a avaliação extensiva da função pilórica, tempo de esvaziamento gástrico e escores de sintomas e qualidade de vida. O sucesso técnico do G-POEM foi alcançado em 100% dos pacientes com significante melhora dos sintomas, da qualidade de vida e o tempo de esvaziamento gástrico. Entre outras intercorrências, foram relatados três casos de perfuração com manejo clínico e um caso de perfuração onde foi necessária laparoscopia diagnóstica devido a intesa dor abdominal.
Apesar das intercorrências relatadas, elas foram manejadas predominantemente de modo clínico, sem mortalidade associada. Esse estudo demonstra portanto que G-POEM é potencialmente seguro e eficaz no tratamento da gastroparesia refratária. Novos estudos, preferencialmente multicêntricos e randomizados, seriam ideais para o pleno estabelecimento da técnica.
Non-Superiority of Lumen-Apposing Metal Stents Over Plastic Stents for Drainage of Walled-Off Necrosis in a Randomised Trial
JY Bang, U Navaneethan, MK Hasan, B Sutton, R Hawes, S Varadarajulu. Gut 2018 Jun 01.
Outros estudos que valem a leitura:
Screening for Dysplasia With Lugol Chromoendoscopy in Longstanding Idiopathic Achalasia
FA Ponds, A Moonen, AJPM Smout, WOA Rohof, J Tack, S van Gool, R Bisschops, AJ Bredenoord, GE Boeckxstaens. Am. J. Gastroenterol 2018 May 11.
Deep Learning Localizes and Identifies Polyps in Real Time with 96% Accuracy in Screening Colonoscopy
G Urban, P Tripathi, T Alkayali, M Mittal, F Jalali, W Karnes, P Baldi. Gastroenterology 2018 Jun 18.
Colorectal Cancer Screening for Average-Risk Adults: 2018 Guideline Update From the American Cancer Society
AMD Wolf, ETH Fontham, TR Church, CR Flowers, CE Guerra, SJ LaMonte, R Etzioni, MT McKenna, KC Oeffinger, YT Shih, LC Walter, KS Andrews, OW Brawley, D Brooks, SA Fedewa, D Manassaram-Baptiste, RL Siegel, RC Wender, RA Smith. CA Cancer J Clin 2018 May 30.
No Superiority of Stents vs Balloon Dilatation for Dominant Strictures in Patients With Primary Sclerosing Cholangitis
CY Ponsioen, U Arnelo, A Bergquist, EA Rauws, V Paulsen, P Cantú, I Parzanese, EM De Vries, KN Van Munster, K Said, O Chazouillères, B Desaint, A Kemgang, M Färkkilä, S Van der Merwe, W Van Steenbergen, HU Marschall, PO Stotzer, D Thorburn, SP Pereira, L Aabakken. Gastroenterology 2018 May 24.
QUIZ! Técnicas de cirurgia bariátrica
QUIZ !!! Teste seus conhecimentos !!!
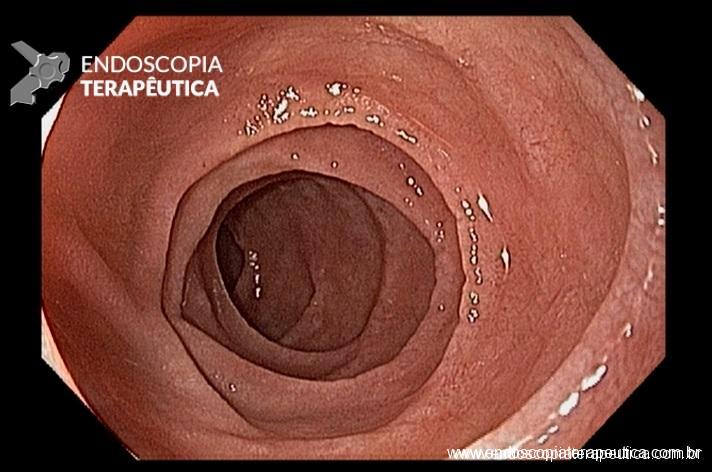
Paciente sexo feminino, 64 anos de idade, portadora de sintomas dispépticos, submetida a EDA com os seguintes achados. Qual é o diagnóstico dessas alterações em segunda porção duodenal?
METÁSTASE GÁSTRICA DE MELANOMA
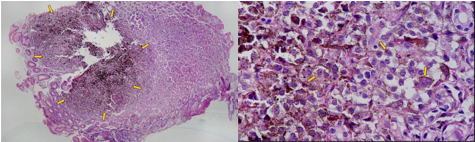
Metástases gástricas de melanoma
Metástase de melanoma pigmentado constituída de células epitelióides pleomórficas; coloração de hematoxilina e eosina, 40x.
O melanoma maligno é uma das doenças malignas mais comuns que metastatizam para o tubo digestivo. A metástase pode ocorrer no momento do diagnóstico primário ou décadas após, como primeiro sinal de recorrência. Os sítios mais comuns de metástases de melanoma maligno são o intestino delgado (50%), cólon (31,3%), estômago (20%) e ânus e reto (25%)(1).
Já melanoma maligno primário do gastrointestinal pode surgir em várias áreas do trato digestivo: 33% estão localizados na nasofaringe, 5,9% no esôfago, 2,7% no estômago, 2,3% no intestino delgado, 1,4% na vesícula biliar, 9% no cólon, 22% no reto e 31% na região anal (2, 3).
Os pacientes com metástases de melanoma para o TGI podem apresentar sintomas como dor abdominal, disfagia, obstrução do intestino delgado, diarreia, hematêmese e melena (1), mas frequentemente são inespecíficos, e a indicação de realizar a endoscopia normalmente é investigação de anemia crônica por deficiência de ferro (2).
Endoscopicamente, as metástases gástricas do melanoma podem apresentar-se como úlceras pigmentadas enegrecidas, pigmentos enegrecidos difusos na mucosa, múltiplos diminutos nódulos na mucosa ou submucosa, lesões polipoides ou massas extrínsecas. Essas lesões são frequentemente pigmentadas, porém podem apresentar-se de forma não-pigmentadas, mimetizando outras neoplasias epiteliais e linfoma MALT. Portanto, as biópsias são mandatórias em pacientes com história de melanoma submetidos à endoscopia, mesmo em lesões não-pigmentadas. A cápsula endoscópica ou enteroscopia são úteis quando há suspeita de lesão no delgado. O PET-CT tem alta sensibilidade para detectar metástases de melanoma, entretanto não é capaz de detectar metástases gástricas (2).
A intervenção cirúrgica pode ser realizada especialmente em pacientes sintomáticos, para alívio da dor e melhora da qualidade de vida. Médicos oncologistas escolhem imunoterapia sistêmica com o anticorpo monoclonal anti-CTLA4 ipilimumab, que tem sido provada como tratamento efetivo para melanoma metastático (2).
O prognóstico é ruim, com sobrevida média de 4 a 6 meses.
Referência
1. Pommer B et al. Gastric metastases from malignat melanoma. Endoscopy 2008; 40: E30-E31
2. Genova, Pietro; Sorce, Maria; Gabibi, Daniela; Genova, Gaspare; Gebbbia, Vittorio; Galanti, Daniela; Ancona, Chiara; Valerio, Maria Rosaria. Gastric and Retal Metastases From Malignant Melanoma Presenting With Anemia
Hipocrômica e Tratada com Imunoterapia. Case Report In Oncological Medicine. 2017
3. Rai MP et al. BMJ Case Rep 2018. Doi: 10.116/bcr-2018-224914
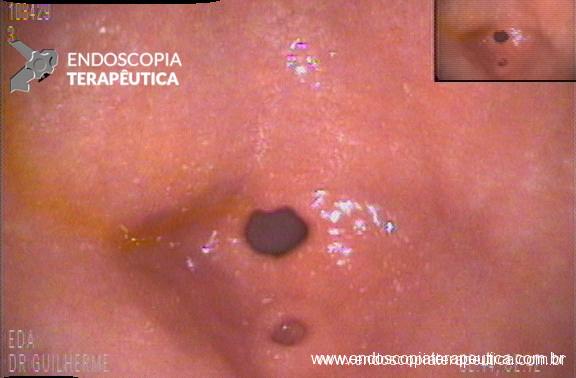
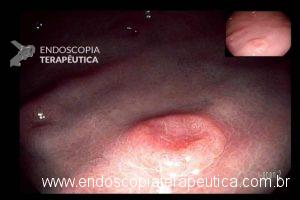
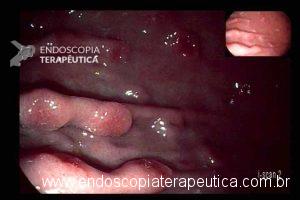
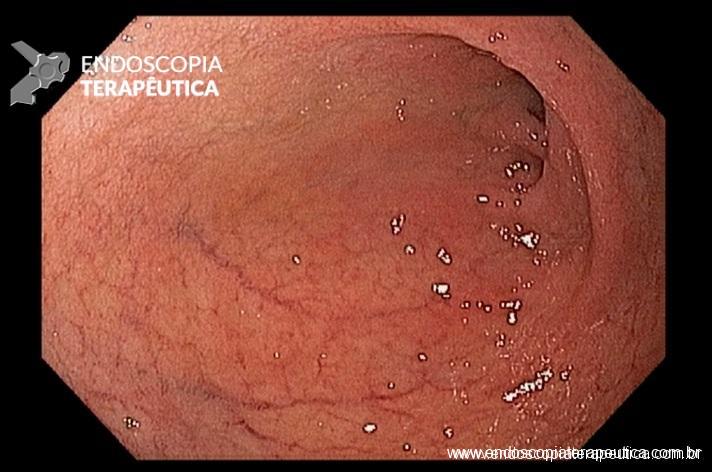
QUIZ! – Qual sua hipótese sobre essas lesões elevadas gástricas?
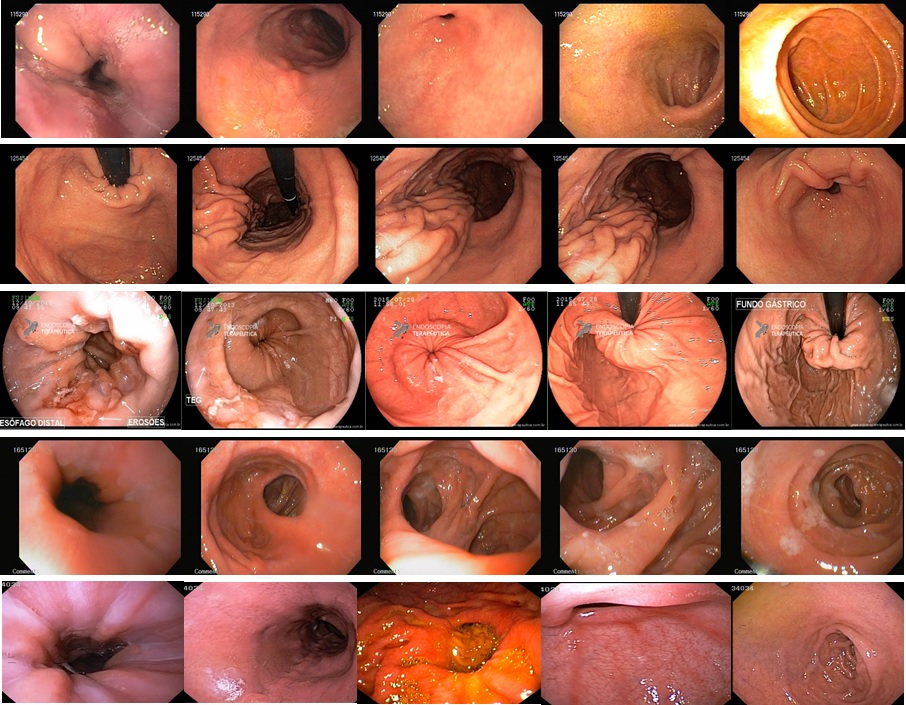
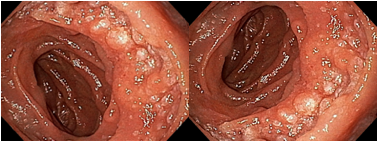
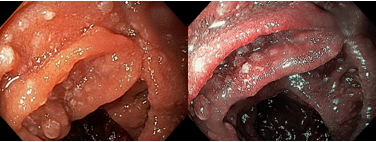
Esôfago negro
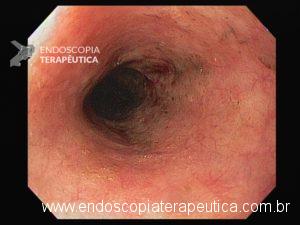
Esôfago proximal
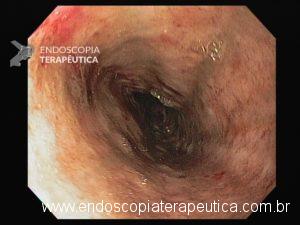
Esôfago proximal/médio
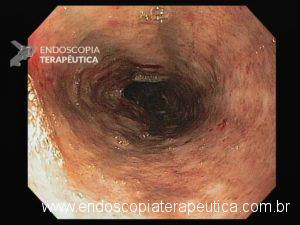
Esôfago médio
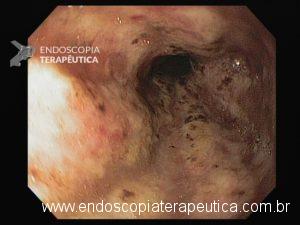
Esôfago distal
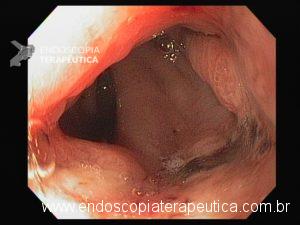
Esôfago distal
INTRODUÇÃO
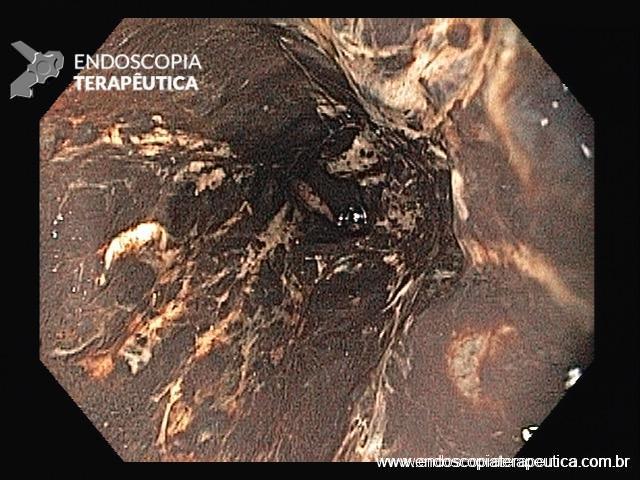
A necrose esofágica aguda (NEA), também conhecida como esôfago negro ou esofagite necrotizante, é uma síndrome rara caracterizada por uma aparência escurecida da mucosa, com comprometimento circunferencial difuso, que afeta principalmente os dois terços distais interrompendo-se abruptamente na junção gastroesofágica (a mucosa gástrica mantém-se normal).
EPIDEMIOLOGIA
A necrose esofágica aguda é uma condição rara com uma prevalência estimada de até 0,2 % em séries de autópsia. Em algumas séries de endoscopia, a prevalência da NEA variou de 0,001 a 0,2% dos casos. A incidência parece ser mais do que quatro vezes maior nos homens em comparação com as mulheres e os pacientes têm uma idade média de 68 anos no diagnóstico.
ETIOLOGIA E PATOGÊNESE
A etiologia da necrose esofágica aguda não é clara, mas a isquemia e a obstrução da saída gástrica podem ser eventos desencadeantes. Em alguns relatos tem sido associada ao uso de antibióticos de amplo espectro, infecções (por exemplo, candida albicans, citomegalovírus, vírus do herpes e klebsiella pneumoniae), volvo gástrico, hérnia paraesofágica, hiperglicemia, cetoacidose diabética, síndrome de Stevens-Johnson, vômitos intensos e prolongados, hepatite alcoólica, acidose lática e até dissecção aórtica. Ou seja, em geral são pacientes com quadro clínico bastante debilitado e com risco de comprometimento circulatório.
Outra hipótese para sua etiologia seria a presença de dois eventos associados, onde o inicial, um estado vascular de baixo fluxo, predisporia a mucosa à uma lesão intensa e o segundo causaria uma obstrução da saída gástrica levando à um acúmulo de líquido no estômago, o que promoveria um refluxo gastresofágico, resultando em lesão direta, e por fim, necrose. O que fortalece tal hipótese é que a redução temporária do fluxo sanguíneo esofágico pode resultar em necrose esofágica extensa que se resolve rapidamente quando o fluxo é reestabelecido. Além disso, a necrose esofágica aguda tende a ocorrer no terço distal do esôfago, que é relativamente hipovascularizado em comparação com outros segmentos esofágicos. A necrose da mucosa esofágica e submucosa, com trombose microscópica e recuperação rápida após o reestabelecimento do fluxo são eventos semelhantes aos ocorridos na colite isquêmica.
MANIFESTAÇÕES CLÍNICAS
Aproximadamente 70% dos pacientes com necrose esofágica aguda apresentam hemorragia digestiva alta com hematêmese e melena. Os sintomas podem aparecer rapidamente após um evento desencadeante. Outros sintomas gastrointestinais incluem: disfagia, dor epigástrica e dor torácica. Os pacientes também podem ter sintomas relacionados à patologia subjacente a qual predispôs ao evento desencadeante inicial e apresentarem-se com sinais de sepse, incluindo taquicardia e hipotensão.
ACHADOS LABORATORIAIS
Os achados laboratoriais não são específicos e frequentemente são devidos à doença subjacente. Eles incluem: acidose lática, hipoalbuminemia, anemia, insuficiência renal e hiperglicemia.
DIAGNÓTICO
A necrose esofágica aguda é habitualmente diagnosticada incidentalmente em pacientes submetidos à endoscopia digestiva alta para avaliação de sangramento gastrointestinal. Embora a aparência endoscópica seja sugestiva, são necessárias biópsias esofágicas para excluir outras etiologias e estabelecer o diagnóstico.
Endoscopia e biópsia – Na endoscopia, é caracterizada por descoloração periférica circunferencial com tecido hemorrágico friável subjacente associado a diminutos pontos enegrecidos, e também por uma delimitação precisa entre a mucosa esofágica e a gástrica, a qual tem aparência normal distalmente à junção gastroesofágica.
Geralmente envolve o terço distal do esôfago, embora o envolvimento proximal tenha sido descrito. À medida que a doença progride, o esôfago pode ficar parcialmente coberto com exsudatos brancos espessos que são descolados facilmente revelando um tecido de granulação rosa. Esses exsudatos provavelmente representam células mucosas espalhadas.
As biópsias servem para diferenciar a necrose de outras condições nas quais a mucosa também pode estar escurecida e também para descartar causas infecciosas, como por exemplo, candida albicans, citomegalovírus, vírus herpes simples e klebsiella pneumoniae.
Na histologia, há necrose extensa comprometendo a mucosa e a submucosa. Inflamação e destruição parcial de fibras musculares adjacentes podem ocasionalmente ser observadas, e os vasos sanguíneos às vezes são trombosados e/ou ocluídos.
DIAGNÓSTICO DIFERENCIAL
O diagnóstico diferencial inclui outras condições em que a mucosa esofágica também pode estar escurecida. A necrose esofágica aguda pode ser diferenciada destas condições pela história clínica e pela biópsia.
- Melanose – melanose esofágica tem sido descrita em pacientes com esofagite crônica subjacente. É mais comumente observada no esôfago distal. Em contraste com a necrose esofágica aguda, a descoloração é frequentemente focal. As biópsias revelam melanócitos com características de coloração de pigmento semelhantes à melanina.
- Pseudomelanose – A pseudomelanose é devida à deposição de tecido de pseudomelanina, um pigmento derivado da degradação lisossômica. Na histologia, um pigmento marrom composto por lipofuscina e melanina pode ser visualizado dentro dos macrófagos.
- Melanoma – O melanoma primário do esôfago é raro. Geralmente se origina no esôfago médio e distal e tem uma aparência polipoide. O diagnóstico é feito pela presença de atividade melanocítica juncional na avaliação histológica da mucosa esofágica.
- Acantose nigricans – é caracterizada por placas de aspecto aveludado, verrucoso e hiperpigmentado. Embora possa ser benigno, também pode ser um fenômeno paraneoplásico comumente associado a neoplasias malignas intra-abdominais.
- Resíduo de carvão – O pó de carvão ou o carbono é o pigmento exógeno mais comum a ser depositado nos tecidos do corpo humano. O mecanismo pelo qual o pó de carvão é depositado no esôfago não está claro.
- Ingestão cáustica – O dano esofágico grave causado pela ingestão de agentes corrosivos pode provocar desprendimento da mucosa e uma pigmentação preta da parede esofágica. Tais pacientes podem apresentar um histórico de ingestão cáustica e podem ter queimaduras orofaríngeas associadas.
- Esofagite Pseudomembranosa – geralmente é relatada em associação com graves doenças sistêmicas. Uma membrana concêntrica, fina, amarela ou preta, recobre os terços distais e, menos comumente, o esôfago inteiro. Pode ser desalojada da parede, revelando uma mucosa subjacente friável. Na histologia, a pseudomembrana não tem membrana basal e é composta por exsudato fibrinoso e células inflamatórias misturadas.
TRATAMENTO
Existem dados limitados para orientar o manejo da necrose esofágica aguda, e o gerenciamento de tal condição é amplamente baseado na experiência clínica.
A terapêutica inicial consiste em expansão de volume com fluidos intravenosos e tratamento da doença de base. A supressão do acidez gástrica com inibidores de bomba de prótons deve ser adotada para reduzir a lesão péptica adicional. A ingestão oral deve ser evitada por pelo menos 24 horas. O uso da suspensão de sucralfato deve ser considerado pelo seu papel na prevenção de lesão esofágica péptica associada.
As sondas nasogástricas ou nasoenterais devem ser evitadas, a menos que sejam usadas afim de descomprimir uma obstrução da saída gástrica ou se houver vômito persistente. Uma decisão sobre o uso de antimicrobiano e/ou antifúngico deve ser feita individualmente, especialmente na configuração de pacientes que estão criticamente doentes ou parecem estar sépticos.
HISTÓRIA NATURAL
Com cuidados de suporte, a resolução dos achados endoscópicos ocorre na maioria dos pacientes. No entanto, as taxas de mortalidade em pacientes com necrose esofágica aguda variam de 13 a 35%. A mortalidade é em grande parte devido à doença de base, sendo que apenas 6% das mortes são diretamente atribuíveis à complicações da NEA.
COMPLICAÇÕES
- Perfuração esofágica – A perfuração esofágica é uma complicação aguda da necrose esofágica que ocorre em menos de 7% dos pacientes, mas requer intervenção urgente dada a alta mortalidade associada. A presença de dor retroesternal ou lombar severa persistente pode indicar seu aparecimento. Pacientes com perfuração esofágica podem ter crepitação à palpação da parede torácica devido à presença de enfisema subcutâneo.
- Estenose esofágica – As estenoses esofágicas são complicações à longo prazo da necrose esofágica aguda e ocorrem em 25 a 40 % dos pacientes. Os pacientes com estenoses geralmente apresentam disfagia gradualmente progressiva e habitualmente requerem dilatação endoscópica.
VEJA MAIS IMAGENS ABAIXO
(clique para ampliá-las)
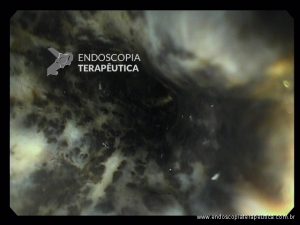
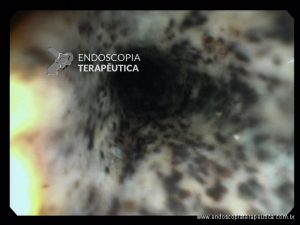
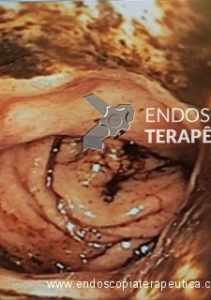

Confira também: Esofagite por cândida – Kodsi

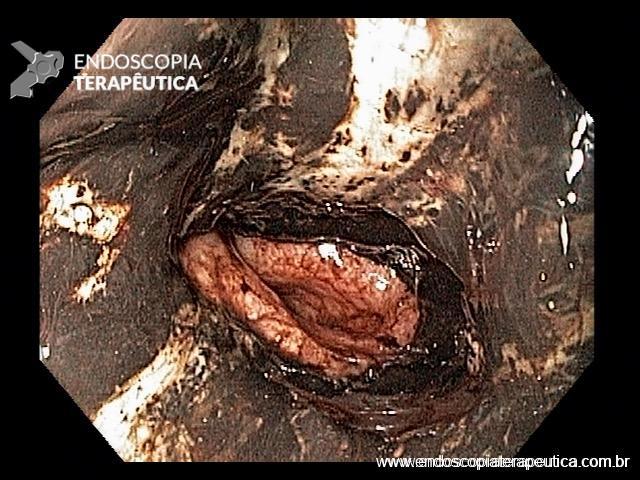
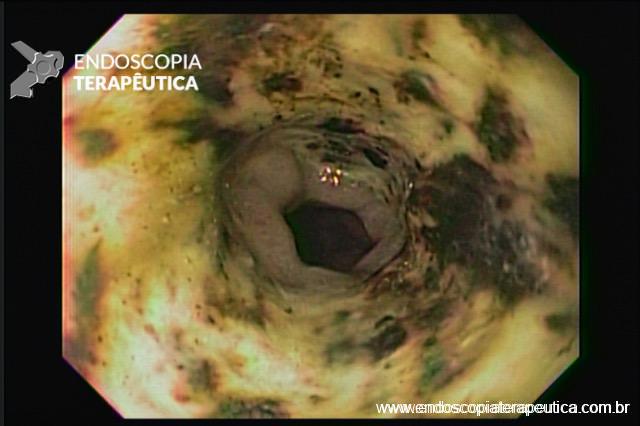
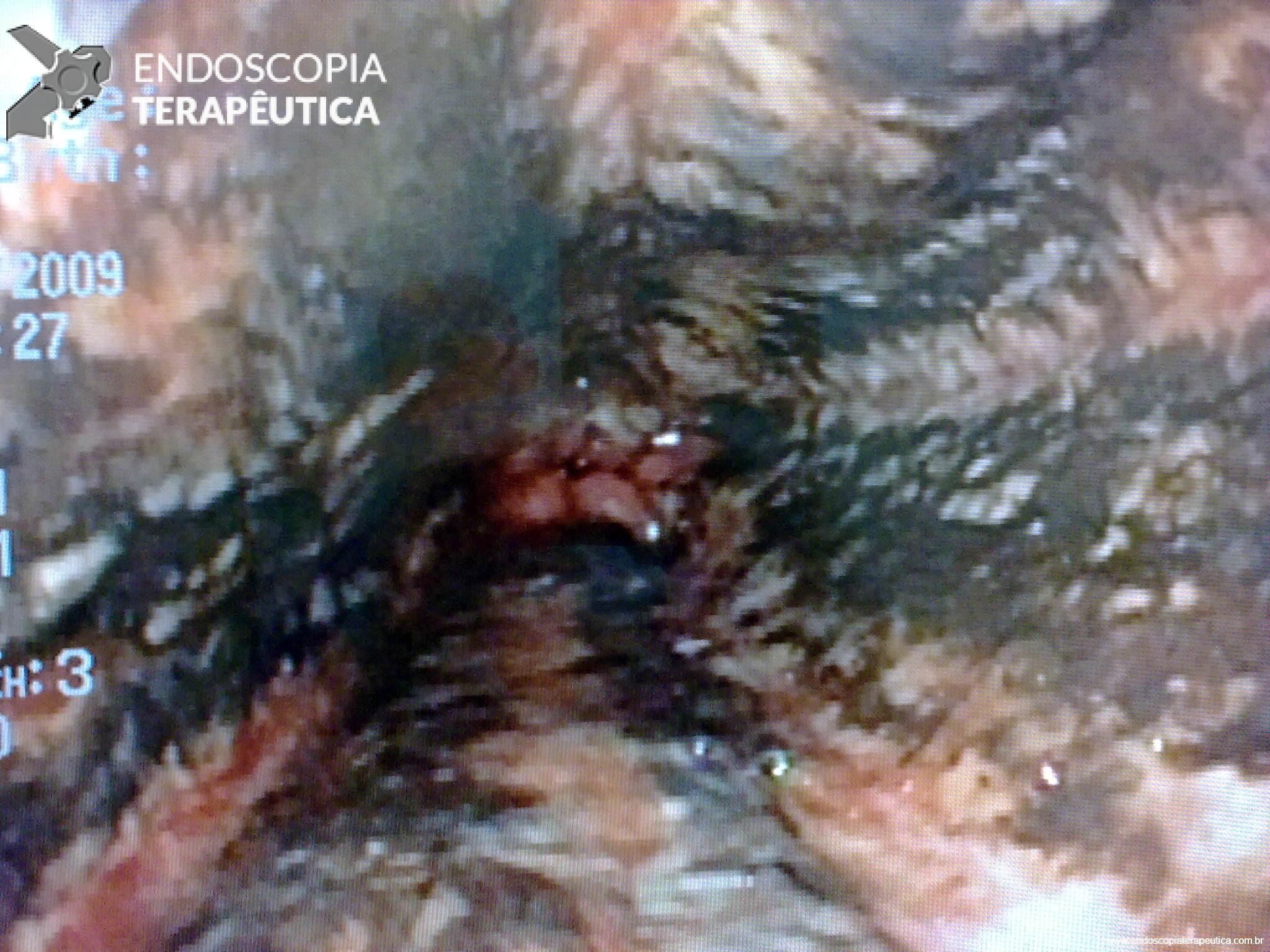
Em um estudo de centro único, prospectivo e randomizado, Bang e col. avaliaram os resultados da drenagem ecoendoscópica de “walled-off necrosis” (WON) usando “lumen-apposing metal stents” (LAMS) ou stent plástico duplo pigtail (DPPS). Um total de 60 pacientes foram submetidos a drenagem com LAMS (n= 31) ou DPPS ( n= 29). Os resultados apresentados demonstraram que não houve diferença significativa no sucesso clínico, número de procedimentos necessários para atingir o sucesso no tratamento, eventos clínicos adversos, readmissões, tempo de estadia hospitalar e custo geral do tratamento entre os grupos.
Apesar do menor tempo de procedimento com uso de próteses metálicas, o uso de LAMS esteve associado com uma taxa significativamente maior de eventos adversos relacionados ao stent e maior custo do procedimento. Eventos graves relacionados a LAMS foram descritos em tempo de até 3 semanas após o seu implante.
Apesar de haver sido realizado em centro único, o estudo apresenta dados robustos que podem levar a mudança de conduta no uso de próteses metálicas, com preferência ao uso de plásticas duplo pigtail (menor custo de procedimento e menores complicações), ou mesmo quando do uso de LAMS, procurar efetivar a sua remoção precoce (antes de 3 semanas).
Over the Scope Clips Are More Effective Than Standard Endoscopic Therapy for Patients With Recurrent Bleeding of Peptic Ulcers
A Schmidt, S Gölder, M Goetz, A Meining, J Lau, S von Delius, M Escher, A Hoffmann, R Wiest, H Messmann, T Kratt, B Walter, D Bettinger, K Caca. Gastroenterology 2018 May 24.
Em estudo multicêntrico, randomizado e controlado comparando o uso de hemoclipe “over-the-scope” (OTSC) com hemostasia padrão (hemoclipe tradicional, injeção) para o retratamento de sangramento ulceroso péptico recorrente grave, foi evidenciado que o uso de OTSC levou a uma redução significativa nas taxas de ressangramento sem agregar risco adicional ao procedimento.
É sabido que os hemoclipes mais modernos com estrutura “over-the-scope” poderiam proporcionar uma maior capacidade de hemostasia devido a sua maior robustez e maior área de contato com a superfície em sangramentos não varicosos. No trabalho apontado, foi possível provar a eficiência dos mesmos em casos de ressangramento ulceroso. Não seria de se estranhar porém, que eles pudessem ser a melhor primeira estratégia hemostática. Alguns outros pontos deveriam ser levados em consideração, incluindo custos, mas poderemos ver em breve mudanças no algorítmos de tratamento de sangramentos não varicosos, incluindo definitivamente o uso dessa nova tecnologia.