Artigos comentados – Março 2019
Bom dia a todos! Vamos iniciar o mês de março com uma pequena seleção de artigos científicos publicados recentemente que acredito ser de interesse de muitos colegas. Foi difícil filtrar e escolher apenas 3 artigos dentro de vários interessantes que saíram ultimamente. Boa leitura!
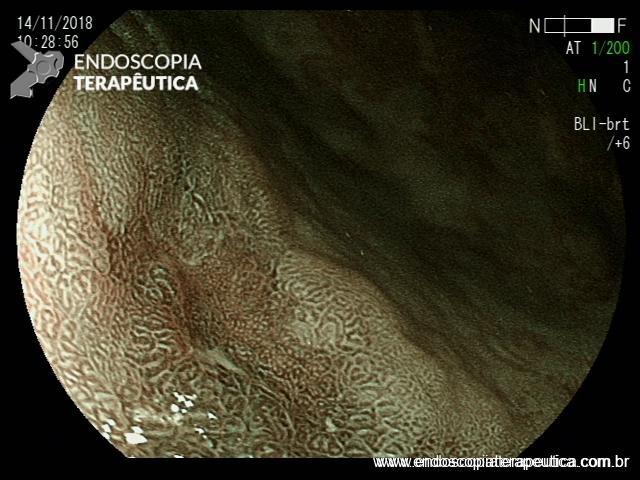
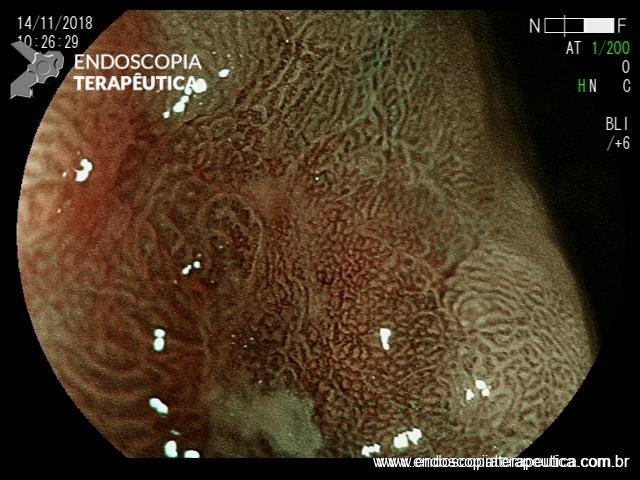
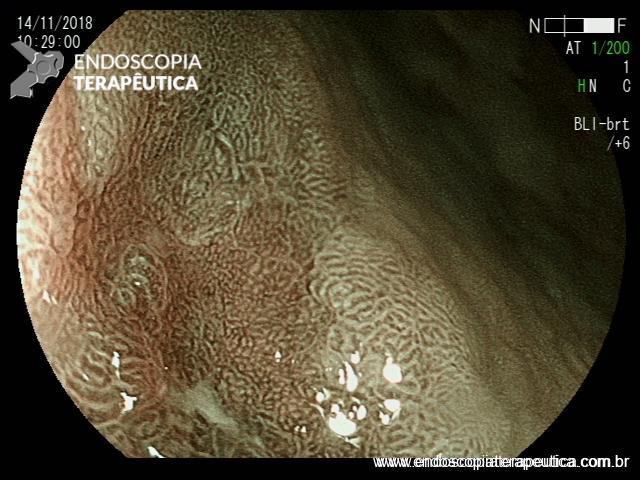
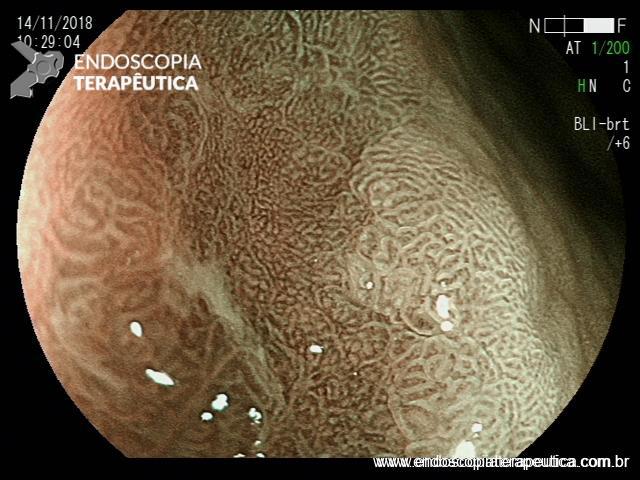
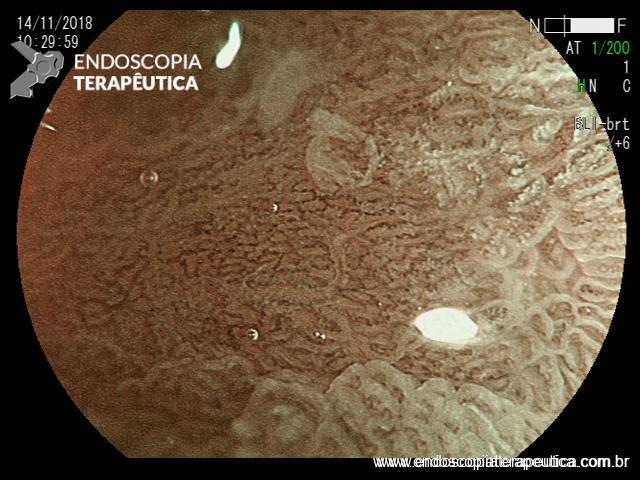
ARTIGO 1: Erradicação completa do Barrett deve ser o objetivo da terapia endoscópica
A Terapia Endoscópica de Barrett é cada vez mais utilizada para o tratamento de displasia e adenocarcinoma intramucoso. O tratamento ideal é a ressecção endoscópica (mucosectomia ou ESD) podendo ser combinada com ablação por radiofrequência ou APC-híbrido do epitélio remanescente.
Embora o objetivo seja alcançar a erradicação completa da metaplasia intestinal (ER-MI), a terapia endoscópica, algumas vezes, só é capaz de alcançar a erradicação completa da displasia (EC-D), permanecendo ainda focos de MI no epitélio remanescente.
Nesta meta-análise de 40 estudos (n = 4410) com 12.976 pacientes-anos de acompanhamento total, Sawas et al avaliaram o risco de recorrência de displasia após EC-D versus após ER-MI.
A recidiva de displasia foi relatada em 274/4061 (5%) dos pacientes que obtiveram ER-MI versus 58/349 pacientes (12%) daqueles que atingiram EC-D (RR 2,8).
Da mesma forma, a recorrência de HGD / câncer foi significativamente maior naqueles pacientes que alcançaram apenas EC-D (6%) versus ER-MI (3%; IC95%: 2-4%) (RR 3,6). Nos estudos que relataram a localização anatômica das recidivas, a maioria deles (77%) localizava-se na região da junção gastroesofágica.
Comentário: A erradicação completa de todo o esôfago de Barrett deve ser o objetivo da terapia endoscópica. Qualquer metaplasia intestinal residual que persista tem o potencial de progressão neoplásica. A maioria das recidivas ocorre na região da junção gastroesofágica, e esta área deve ser cuidadosamente examinada durante a endoscopia de vigilância pós ressecção/ablação endoscópica.
Sawas T, Alsawas M, Bazerbachi F, et al. Persistent intestinal metaplasia after endoscopic eradication therapy of neoplastic Barrett’s esophagus increases the risk of dysplasia recurrence: meta-analysis. Gastrointest Endosc 2018 Dec 7. (clique no link: https://doi.org/10.1016/j.gie.2018.11.035)
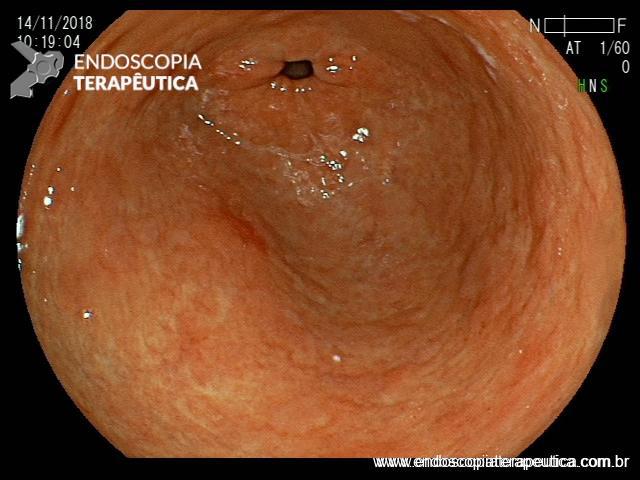
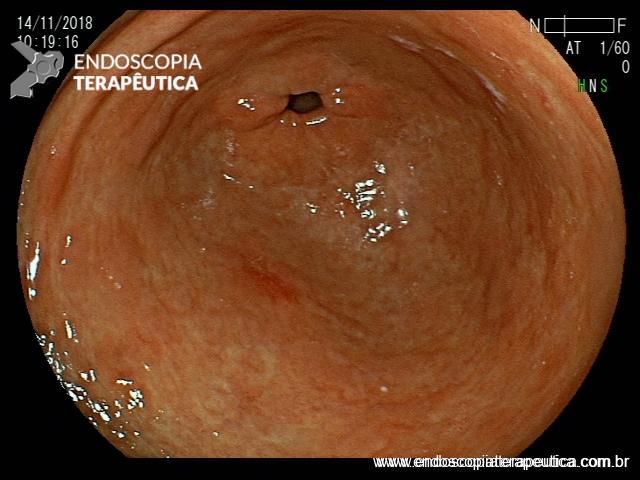
ARTIGO 2: Retrovisão no cólon ascendente versus segundo exame na visão frontal: resultados de uma meta-análise
- Lesões no cólon direito são frequentemente perdidas durante o exame padrão de colonoscopia.
- Estudos mostraram que a retrovisão no cólon ascendente pode aumentar a taxa de detecção de adenomas. Outros estudo mostraram que um segundo exame na visão frontal também é capaz de aumentar esses índices.
- O objetivo desta meta-análise foi comparar as taxas de perda de adenoma e as taxas de detcção de adenoma entre os dois métodos.
- Foram selecionados 4 estudos com 1882 pacientes.
- As taxas de perda de adenoma no cólon direito variaram de 8-13% e não houve diferença entre as duas técnicas com relação a essa taxa.
- O segundo exame de visão frontal no cólon direito aumentou a TDA em 10% (p<.01)
- A retrovisão no cólon ascendente aumentou a TDA em 6% (p<.01)
Comentários: O exame cuidadoso do cólon direito é fundamental para não deixar passar desapercebido lesões sésseis neste segmento. Em especial, os adenomas serrilhados são lesões difíceis de diagnosticar devido sua natureza plana e muito semelhante à mucosa normal adjacente. Limpar as secreções, tirar as bolhas com simeticona, olhar atrás das pregas e finalmente, associar uma destas duas técnicas (ou ambas) pode aumentar sua taxa de detecção de adenomas.
Increasing adenoma detection rates in the right side of the colon comparing retroflexion with a second forward view: a systematic review. Madhav Desai, Mohammad Bilal, Nour Hamade, et al. Gastrointest Endosc 2019, Mar .(Clique no link: https://doi.org/10.1016/j.gie.2018.09.006)
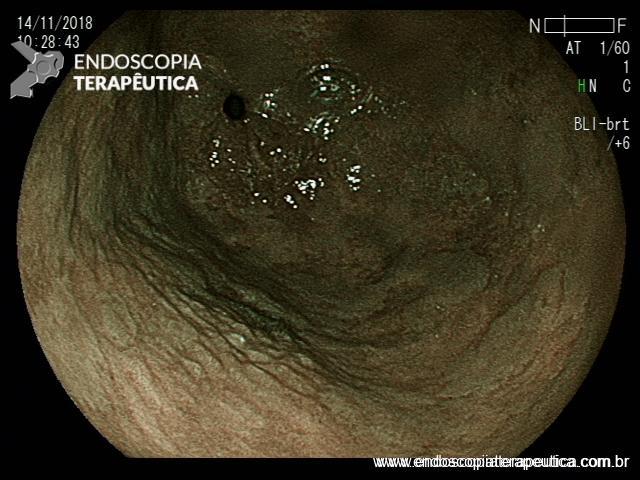
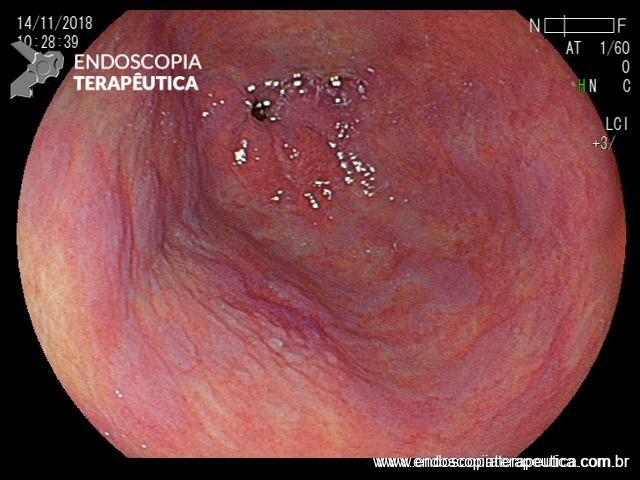
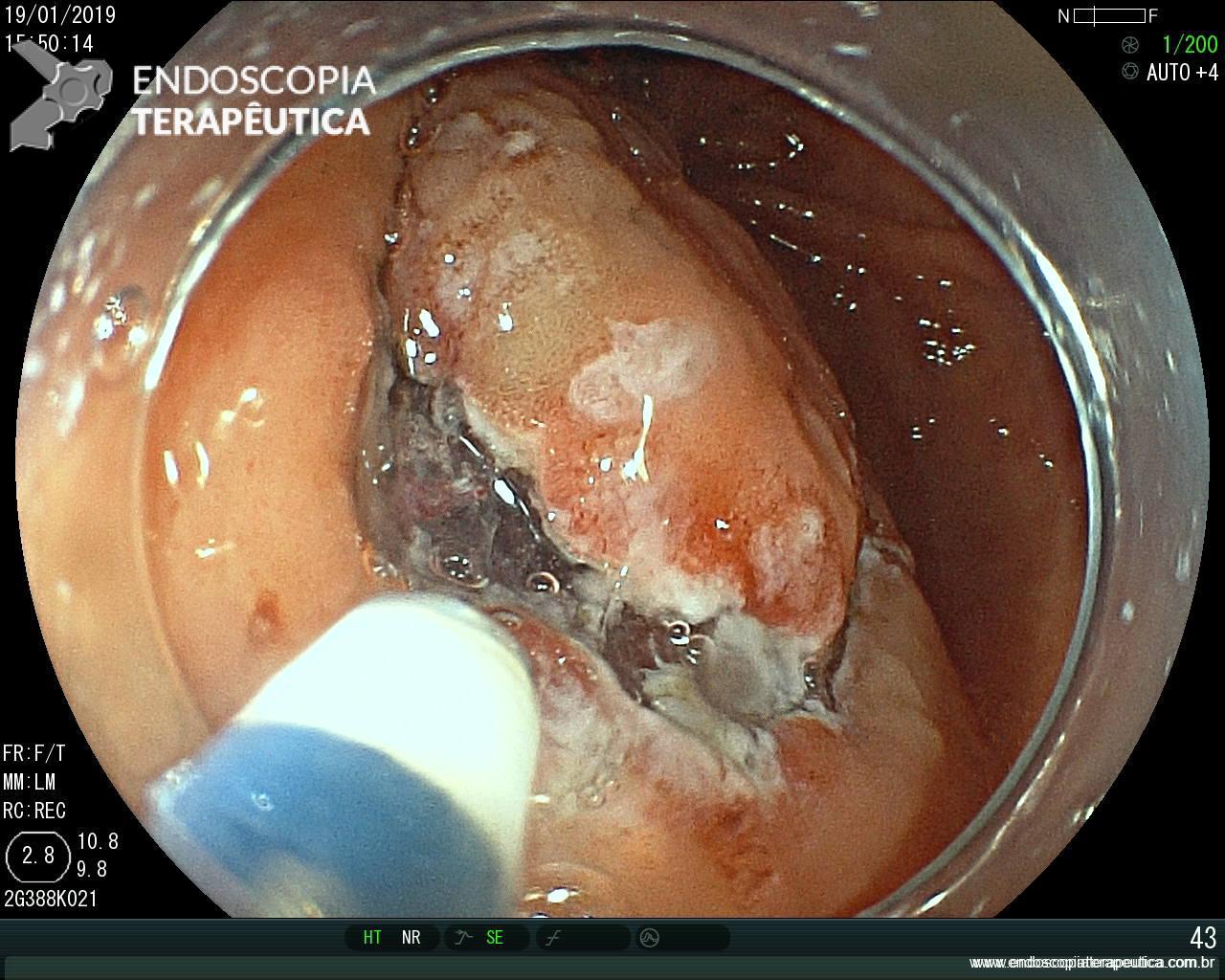
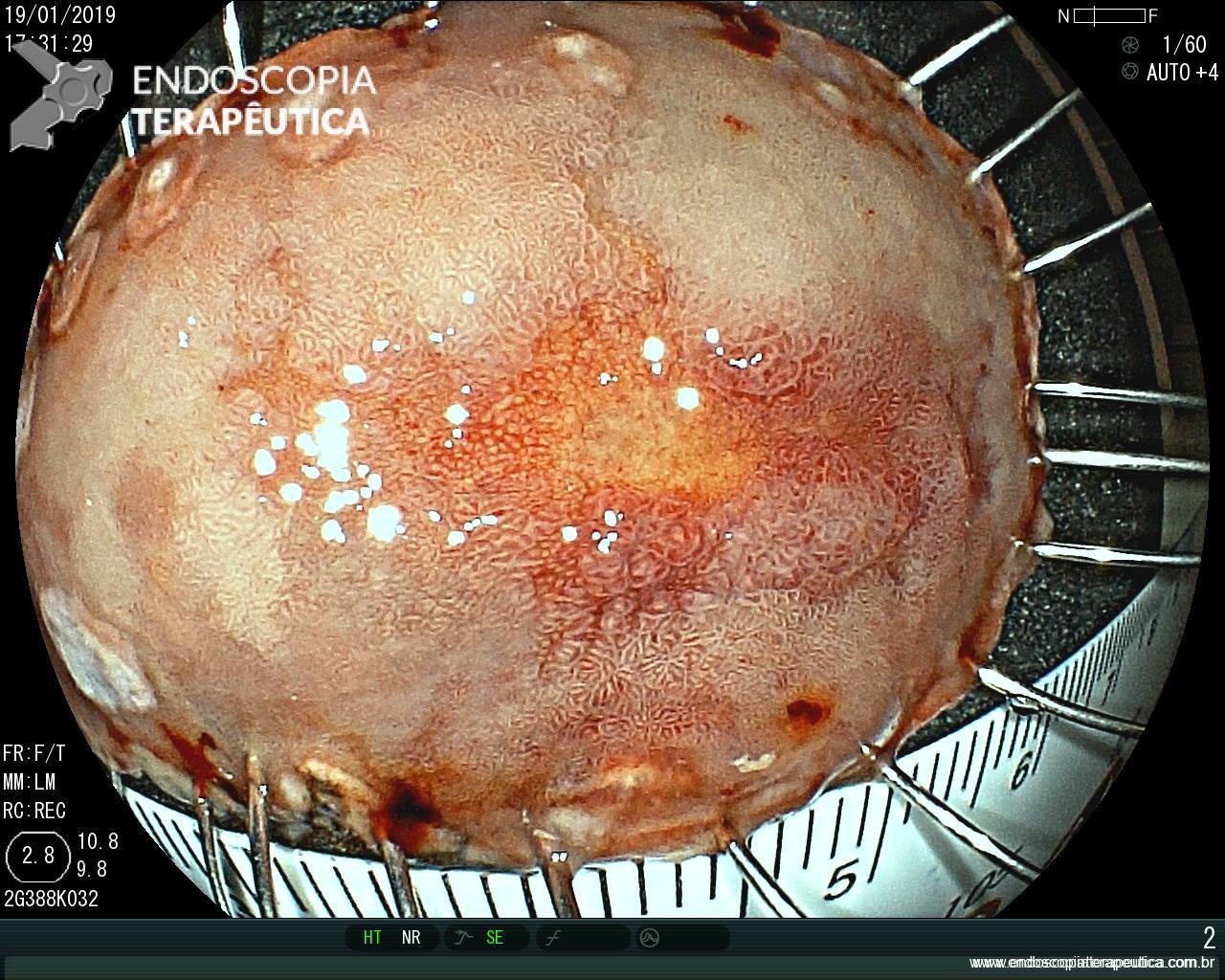
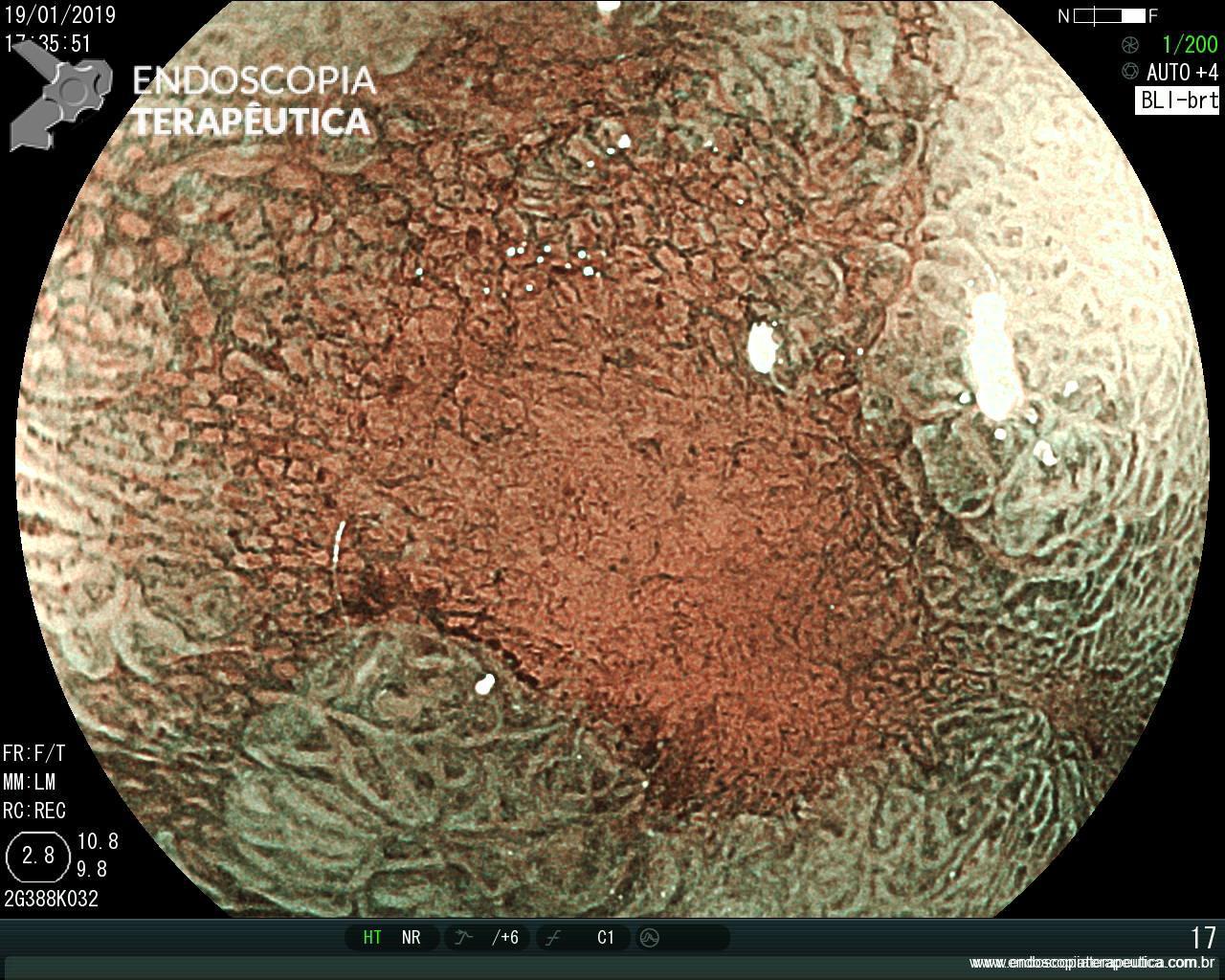
ARTIGO 3: Biópsias de LST colorretais aumentam fibrose e podem dificultar a ressecção
Estudo retrospectivo realizado no Hospital Universitário de Osaka comparou os achados de fibrose submucosa em lesões de crescimento lateral (LSTs) com biópsias prévias versus sem biópsias prévias.
A realização de biópsias previamente à ressecção dobrou o índice de fibrose submucosa severa (20% vs 10% – p=.03).
Não houve diferença entre os grupos com relação ao desfecho do tratamento, ou seja, ressecção completa em bloco e eventos adversos.
Comentários: a propedêutica endoscópica pré-operatória talvez seja um dos maiores desafios para o colonoscopista. Avaliar a lesão com uso de corantes, examinar detalhadamente sua superfície (de preferência com magnificação de imagens) e decidir a melhor estratégia de ressecção é tarefa que exige dedicação e experiência do endoscopista.
Não raramente recebemos pacientes cuja colonoscopia prévia foram feitas múltiplas biópsias! Sinceramente não vejo um bom motivo nem para fazer um único fragmento de biópsia, quanto mais múltiplas. O fato de vir adenocarcinoma no fragmento de anátomo não é contraindicação para ressecção endoscópica. Da mesma forma, o resultado de adenoma de baixo grau ou de alto grau não garante que em alguma outra região da lesão não possa se esconder um adenocarcinoma invasivo.
Não há nada de errado em estudar a lesão, documentar bem e não mexer na lesão num primeiro momento, deixando para decidir com calma posteriormente, conversando com paciente e familiares sobre a melhor estratégia terapêutica, seja por via endoscópica em caráter ambulatorial, ou internado no centro cirúrgico, ou mesmo decidir pela cirurgia.
Embora este estudo não tenha demonstrado impacto negativo nos resultados da ressecção pela fibrose, não podemos nos esquecer que se trata de um centro japonês avançado com alta expertise em ESD. Certamente esses resultados não podem ser extrapolados para centros ocidentais com baixo volume de terapêutica.
Fukunaga S, Nagami Y, Shiba M, et al. Impact of preoperative biopsy sampling on severe submucosal fibrosis on endoscopic submucosal dissection for colorectal laterally spreading tumors: a propensity score analysis. Gastrointest Endosc. 2019 Mar;89(3) (clique no link: https://doi.org/10.1016/j.gie.2018.07.032)