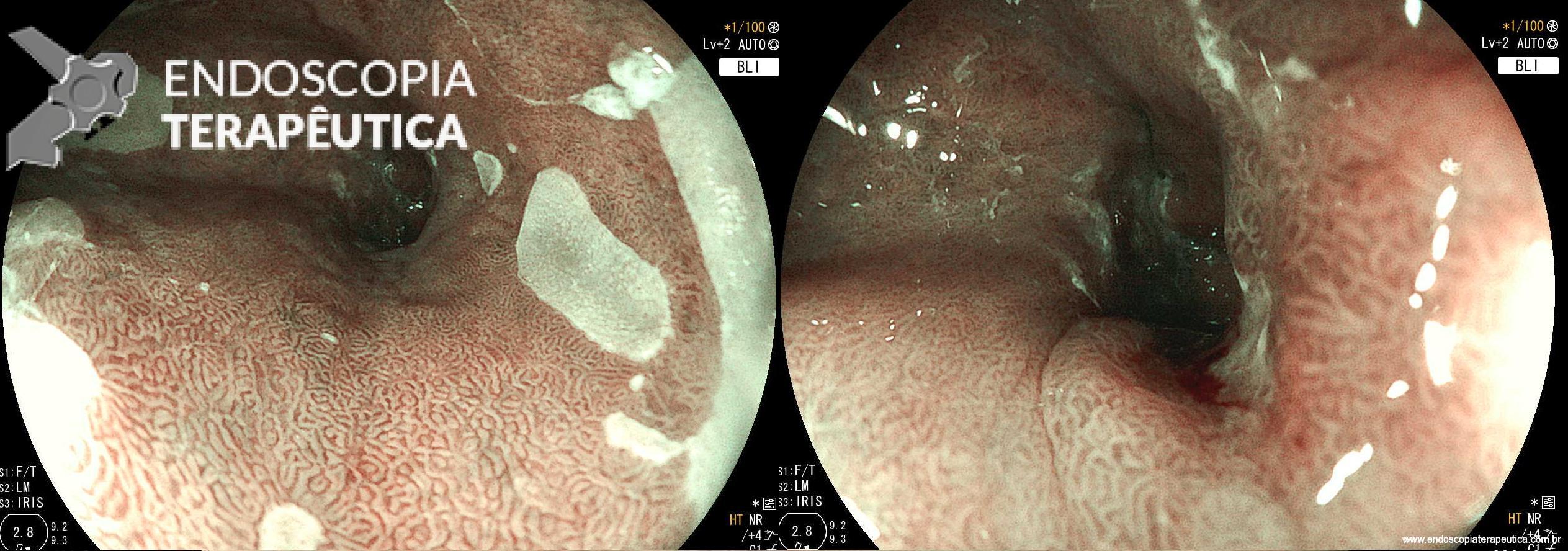
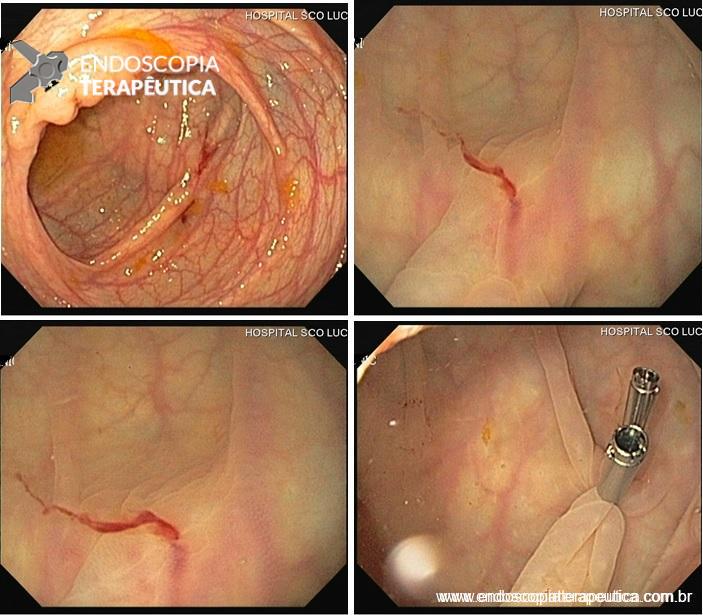
Manejo endoscópico de dumping após bypass gástrico em Y de Roux através de dispositivo de sutura (TORe)
O bypass gástrico em Y de Roux é uma técnica cirúrgica consagrada para o tratamento da obesidade com comprovada eficácia e segurança. Queixas de dumping são consideradas comuns principalmente no primeiro e segundo ano após a cirurgia, sendo habitualmente de leve intensidade e manejadas com orientação dietética.
A síndrome de dumping ocorre pelo trânsito acelerado de secreção digestiva e alimentar para o intestino proximal podendo estar relacionado a distensão de alças e hipersecreção com alteração da osmolaridade, estímulo vagal e hipoglicemia por hiperinsulinemia. As queixas podem ser precoces, quando ocorrem até 30 minutos após a alimentação, ou tardias, quando ocorrem entre 1-3h após a ingesta alimentar. Pacientes com dumping tardio também podem apresentar dumping precoce.
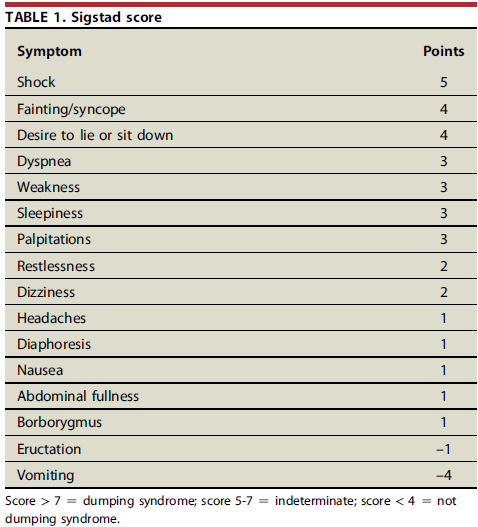
O escore de Sigstad é utilizado como uma maneira de identificar se a etiologia dos sintomas está relacionada ao dumping e mesmo estratificar sua gravidade e a resposta ao tratamento. Este escore é realizado através da ingestão de dieta rica em glicose e avaliação dos sintomas posteriormente atribuindo uma pontuação para cada um, estando descritos na tabela 1. Escores iguais ou superiores a 7 sugerem que a etiologia está relacionada a dumping e estimam a gravidade do quadro.
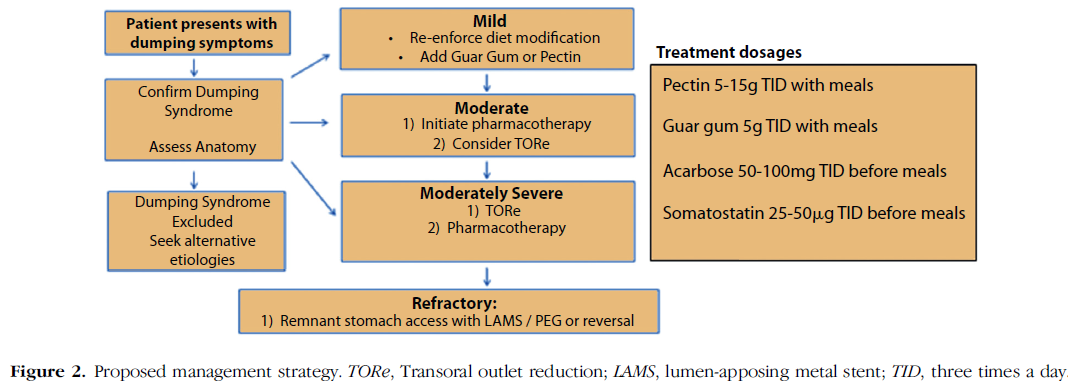
O manejo clínico envolve fracionamento da dieta com baixo volume (6 ou mais refeições por dia), restrição de ingesta de líquido durante as refeições (fazer ingesta 1h antes ou 1h depois), restrição de açúcar e carboidratos simples, aumento de ingesta de fibras e proteínas. O tratamento medicamentoso tem como objetivo retardar o trânsito alimentar e pode ser realizado com espessantes como goma guar e pectina porém a aderência ao tratamento é baixa devido ao paladar. Octreotide pode ser usado em casos de dumping precoce ou tardio, porém possui algumas desvantagens como administração subcutânea, custo elevado e tendência a formação de cálculos, sendo pouco utilizado. A medicação mais utilizada é a acarbose, um inibidor da alfa-glicosidase intestinal, que interfere na digestão de carboidratos reduzindo a resposta insulínica e hipoglicemia, com boa resposta para casos de dumping tardio.
Alguns pacientes apresentam quadros moderados a graves de difícil manejo, sendo refratários a modificação dos hábitos alimentares e ao tratamento medicamentoso. Em situações assim, acabamos nos deparando com uma encruzilhada entre o impacto negativo na qualidade de vida do paciente que consegue reduzir um pouco os sintomas do dumping, porém ainda possui queixas persistentes, enquanto o tratamento através de abordagem cirúrgica revisional possui sua própria morbidade e riscos.
Métodos:
Os autores realizaram um estudo prospectivo, em dois centros terciários (Estados Unidos e Alemanha), entre os anos de 2014 e 2018, envolvendo pacientes com queixa de dumping no pós operatório de bypass gástrico em Y de Roux, submetidos a tratamento endoscópico através de remodelamento da anastomose gastrojejunal (endoscopic transoral outlet reducion – TORe) com uso de sutura endoscópica e plasma de argônio.
Foram avaliados o peso e IMC em três momentos (antes da cirurgia, no momento da intervenção endoscópica e no seguimento com 3 meses), a intensidade das queixas de dumping através do escore de Sigstad e uso de medicação sintomática para dumping (antes e depois da intervenção).
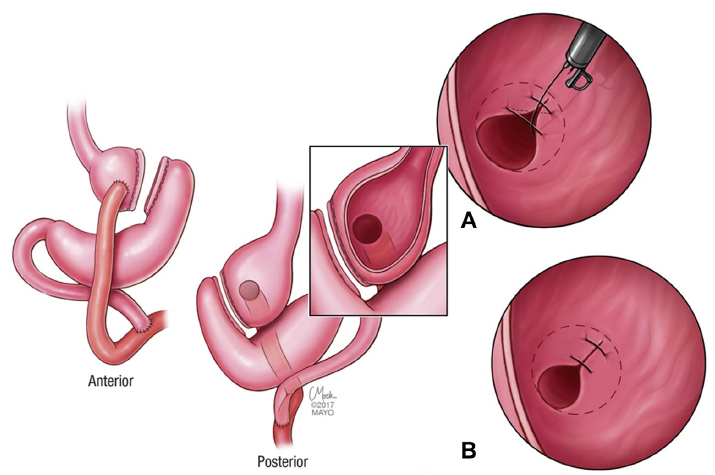
O procedimento foi realizado por apenas um médico especialista em cada centro, utilizando aparelho terapêutico (duplo canal). Inicialmente foi realizada aplicação de plasma de argônio no pouch gástrico com potência de 55W. Foi utilizado dispositivo de sutura de parede total modelo Overstich, iniciando a sutura na face jejunal utilizando fio de prolene, com pontos interrompidos em forma de oito ou separados, com objetivo final de reduzir a anastomose para 10mm. Os pacientes receberam prescrição de antieméticos, analgésicos e foram orientados a manter dieta específica por 2 semanas. Não há detalhamento sobre o tipo de dieta prescrita.
Foi definida como falha terapêutica a necessidade de repetir o procedimento (TORe), utilizar sondas alimentares ou necessitar de cirurgia de reversão do bypass.
Resultados:
O procedimento foi realizado em 115 pacientes, com idade média de 44,7 ± 9 anos, predominantemente sexo feminino (84%), em média 8,9 ± 1,1 anos após o bypass. A anastomose gastrojejunal possuia em média 39,8 ± 6,7mm antes do procedimento. A maior parte dos pacientes (87%, n=100) fazia uso de terapêutica medicamentosa com acarbose para controle do quadro de dumping. O escore de sigstad era de 17,02 ± 6,1 no momento da intervenção.
Foi obtido sucesso técnico em 100% dos casos, com tempo médio de 38,9 ± 17,3min para realização do procedimento, necessitando em média de 3 suturas (2-5).
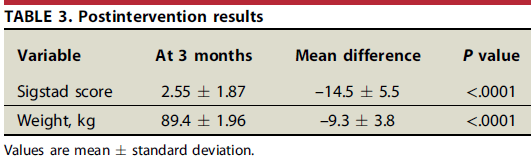
O procedimento teve sucesso em controlar o dumping após 3 meses em 97% dos casos (n=109), com interrupção do uso de medicação em todos pacientes nesse grupo.
Houve falha em 6 pacientes, dos quais três foram referenciados para tratamento cirúrgico e três foram submetidos a novo procedimento endoscópico por apresentarem anastomose gastrojejunal ampla durante exame de controle. Não há relato do índice de sucesso nesse grupo de três pacientes que foi submetido a novo procedimento (TORe).
Não houve eventos adversos graves como sangramento, perfuração, estenose ou óbito.
Os autores sugerem o seguinte fluxograma para manejo de dumping após bypass gástrico em Y de Roux.
Considerações
A publicação é muito interessante por apresentar uma alternativa eficaz, segura e minimamente invasiva para tratamento de casos refratários ou muito sintomáticos de dumping pós bypass gástrico em Y de Roux. Trata-se de estudo prospectivo, embora sem caso controle, com casuística bastante relevante, envolvendo 115 pacientes, majoritariamente com dumping moderado a severo (escore de 17) com resposta satisfatória na redução do escore para valores inferiores a 7 (não sugestivo de dumping) em 97% dos casos. Dos 6 casos de falha terapêutica, apenas três foram encaminhados para cirurgia. O artigo incluiu como falha três pacientes que foram submetidos a novo procedimento endoscópico através da técnica de TORe porém seria interessante que fosse relatada a resposta deste pequeno grupo ao procedimento.
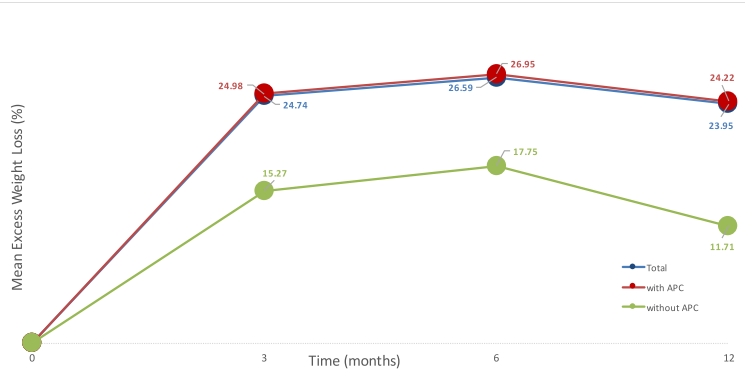
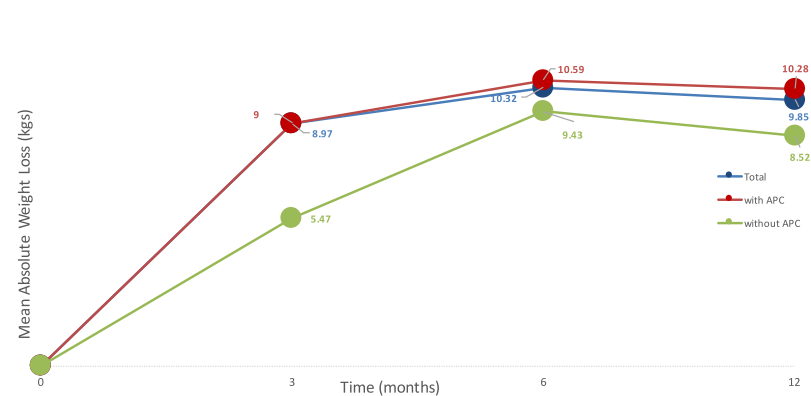
Embora o seguimento seja curto, de apenas 3 meses, temos outras publicações na literatura mostrando manutenção de perda de peso após TORe com seguimento mais longo, sendo razoável extrapolar esses resultados para o caso de dumping. Brunaldi publicou trabalho comparando sutura isoladamente e sutura associada a plasma de argônio para perda de peso sendo evidenciada de perda do excesso de peso após TORe de 24,98%, 26,95% e 24,22% em 3, 6 e 12 meses, respectivamente.
Uma importante limitação do procedimento está relacionada ao custo elevado que ainda está associado aos dispositivos de sutura endoscópica, além de quantidade restrita de endoscopistas com experiência em seu uso. Com o tempo, espera-se uma redução dos custos e popularização do método.
Para saber mais sobre este tema e outros relacionados, acesse o site Gastropedia clicando aqui!
Referências:
Artigo original: Vargas EJ, Abu Dayyeh BK, Storm AC, Bazerbachi F, Matar R, Vella A, et al. Endoscopic management of dumping syndrome after Roux-en-Y gastric bypass: a large international series and proposed management strategy. Gastrointest Endosc 2020;92(1):91–6.
Outras referências:
Brunaldi VO, Jirapinyo P, Turiani D, De Moura H, Okazaki O, Bernardo WM, et al. Endoscopic Treatment of Weight Regain Following Roux-en-Y Gastric Bypass: a Systematic Review and Meta-analysis. 2017;
Berg P, McCallum R. Dumping Syndrome: A Review of the Current Concepts of Pathophysiology, Diagnosis, and Treatment. Dig Dis Sci. 2016;61(1):11–8.
Moon RC, Teixeira AF, Neto MG, Zundel N, Sander BQ, Ramos FM, et al. Efficacy of Utilizing Argon Plasma Coagulation for Weight Regain in Roux-en-Y Gastric Bypass Patients: a Multi-center Study. Obes Surg. 2018;28(9):2737–44.
QUIZ! Magnificação endoscópica do estômago
Artigo comentado pelo autor: Peroral endoscopic pyloromyotomy for gastroparesis: a sistematic review and meta-analysis
Neste artigo, foi realizada uma revisão sistemática e metanalise sobre a eficácia do GPOEM em pacientes com gastroparesia.
A gastroparesia é uma doença crônica incapacitante, com fisiopatologia complexa, caracterizada por sintomas como náusea, vômito, saciedade precoce e dor abdominal.
As principais causas são idiopática, decorrente do diabetes mellitus ou pós-cirúrgica.
O diagnóstico é obtido através da suspeição clínica e exames demonstrando atraso do esvaziamento gástrico na cintilografia de 4h (GES) e endoscopia digestiva alta sem sinais de obstrução mecânica.
O tratamento de primeira linha inclui modificação da dieta (com baixo teor de gordura e pobre em fibras) e medicamentos como agentes antieméticos e procinéticos. Entretanto, a terapia medicamentosa deixa de fazer efeito em algum momento ou o seu uso precisa ser suspenso devido seus efeitos adversos. Além disso, a progressão da própria doença, faz opções terapêuticas se tornam necessárias.
Sabe-se que a disfunção pilórica pode desempenhar um papel na fisiopatologia da gastroparesia e portanto, algumas técnicas tem sido sugeridas com o objetivo de interromper a função da barreira pilórica e facilitar o esvaziamento gástrico. Injeções de botox, dilatação endoscópica com balão, piloroplastia, piloromiotomia (cirúrgica e endoscópica – G-POEM) e colocação de stent transpilórico têm sido empregadas com sucessos variados. O uso de toxina botulínica é controverso e não demonstrou benefício em estudos randomizados, não sendo, portanto, mais recomendado pelo American College of Gastroenterology.
Embora pareça haver um papel para a estimulação gástrica e a piloroplastia laparoscópica, ambas são técnicas invasivas com altas taxas de complicações e recorrência dos sintomas, fazendo da piloromiotomia endoscópica (G-POEM) uma técnica cada vez mais promissora e cada vez mais realizada em todo o mundo.
Métodos: Revisão sistemática e metanálise de estudos que analisaram o índice de sintomas cardinais da gastroparesia (GCSI) e a cintilografia de esvaziamento gástrico em fase sólida (GES) de 4 horas, antes e após o G-POEM, para verificar a sua eficácia, desde o início da sua descrição até janeiro 2019.
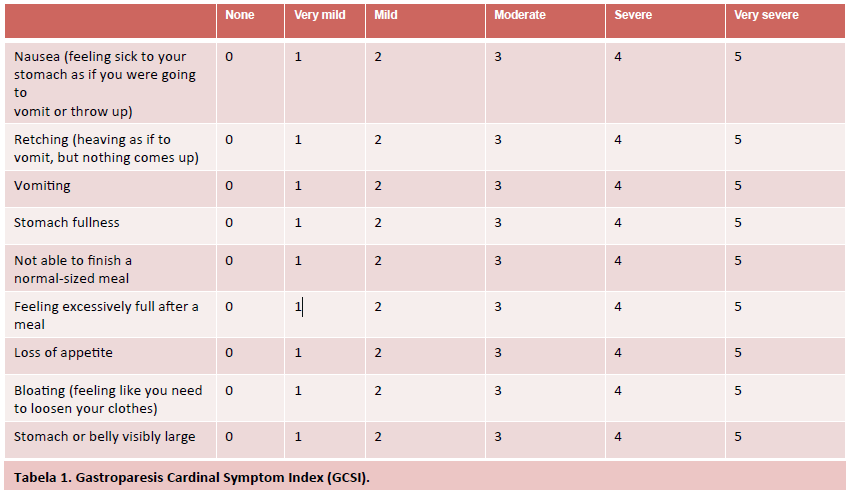
Segue uma tabela para melhor entendermos as pontuações GCSI que são calculadas usando uma escala Likert de 6 pontos e relatadas como subescores médios para as respostas dos pacientes à 9 perguntas que envolvem 3 principais grupos de sintomas: inchaço (2 perguntas), náusea/vômito (3 perguntas) e plenitude pós prandial (4 perguntas).
Resultados: Dez estudos com 281 pacientes foram incluídos nesta revisão sistemática. – A diferença média do GCSI após o procedimento foi de 1,76 (IC 95%: [1,43, 2,08], I2 = 72%)
– Análise do subgrupo do GCSI pelo tempo de acompanhamento (3, 6, 12 e 18 meses), mostrou uma diferença média de 1,84 (IC 95%: [1,57, 2,12], I2 = 71%).
– A diferença média do GES após o procedimento foi de 26,28 (IC95%: [19,74, 32,83], I2 = 87%), correspondendo a uma queda significativa nos valores percentuais da cintilografia de retenção gástrica em quatro horas.
Discussão:
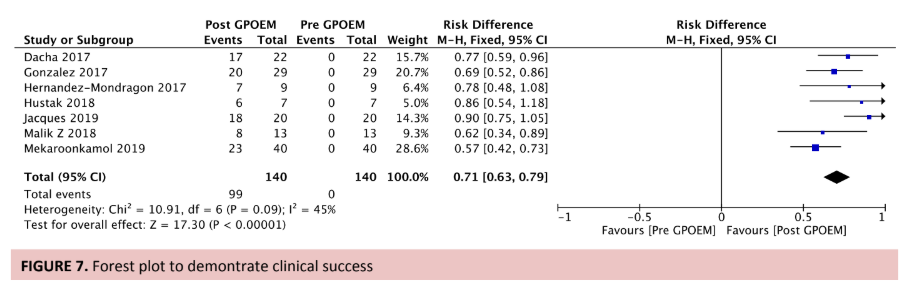
A taxa de sucesso clínico entre os trabalhos avaliados variou de 69% a 90%. Essa metanálise demonstrou melhora significativa dos sintomas, produzindo uma diferença média de sucesso clínico de 0,71 (IC 95%, [0,63, 0,79] I2 = 45%), conforme figura abaixo.
Apenas um estudo foi encontrado na literatura que comparava G-POEM com a piloroplastia laparoscópica (LP) e ambas as técnicas obtiveram melhora significativa nos índices GES e GCSI, sem diferenças desses resultados entre as intervenções. No entanto, o G-POEM parece ser superior à LP porque demonstrou menos morbidade perioperatória, incluindo tempo operatório, perda estimada de sangue e menor tempo de internação.
Quatro dos dez estudos analisaram as subclassificações do GCSI. Dois desses estudos mostraram melhora significativa em todas as subclassificações do GCSI (náusea/vômito, saciedade precoce e inchaço) aos 3 meses, enquanto a melhora sustentada até 12 meses, foi relatada em apenas no grupo de sintomas referentes à náusea/vômito e em um único estudo.
Diabetes e o sexo feminino foram associados a uma resposta ruim e falha terapêutica, enquanto as etiologias idiopática e pós-operatórias foram preditivas de sucesso.
A sonda de imagem luminal funcional endoscópica (Endo-FLIP) é um sistema que pode avaliar a disfunção pilórica em pacientes com gastroparesia. Foi utilizado em dois estudos, e observado que essa tecnologia pode desempenhar um papel quando realizada antes do G-POEM para definir quem se beneficiaria da intervenção pilórica, mas são necessários mais estudos para validar o seu uso.
Todos os estudos, exceto um, mostraram uma redução significativa do GCSI após o G-POEM. Isso se deve, provavelmente, ao fato dos valores basais do GCSI terem sido mais baixos nesse estudo. Pode-se observar, também, que pacientes com um GSCI inicial mais baixo e com sintomas menos graves apresentaram uma melhor resposta, sugerindo que a piloromiotomia deva ser realizada mais cedo no curso da doença para alcançar melhores resultados.
A melhora na cintilografia de 4h (GES) após o G-POEM foi significativa mas variável entre os estudos, e a sua normalização foi alcançada entre 70% e 100% dos casos. No entanto, o esvaziamento gástrico normal não parece ser necessário para se obter uma boa resposta clínica.
A cintilografia (GES), juntamente com o escore GSCI, foram os únicos dois parâmetros para medir o sucesso clínico na maioria dos estudos. Ainda não há consenso sobre como definir o sucesso terapêutico do tratamento da gastroparesia, foi proposto por um dos estudos que pacientes a serem submetidos ao G-POEM deveriam ter um GCSI basal de pelo menos 2.0 e uma taxa de retenção gástrica GES maior que 20% em 4 horas.
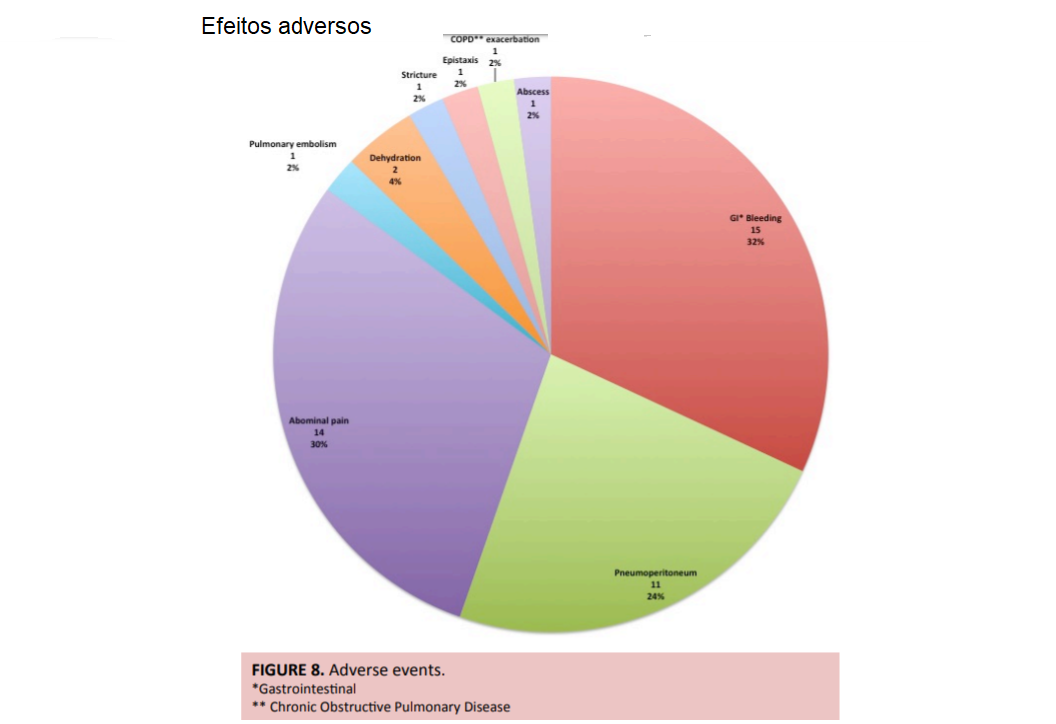
O sangramento gastrointestinal foi o evento adverso mais comum (32%), seguido de dor abdominal (30%) e pneumoperitônio (24%). Duas mortes foram relatadas, porém, relacionadas a eventos cardiovasculares. A figura abaixo se refere a todos os eventos adversos descritos.
Conclusão:
O G-POEM é eficaz, seguro, minimamente invasivo e mostra resultados promissores nos estudos. Esse procedimento deve estar no arsenal de opções de tratamento para gastroparesia refratária. Quando realizado por mãos experientes, mostra baixo risco de eventos adversos, contudo, estudos randomizados são necessários para prever quem responderá melhor a esse tratamento e estabelecer a eficácia a longo prazo dessa técnica.
Karime Lucas Uemura, Dalton Chaves, Wanderley M. Bernardo, Ricardo Sato Uemura, Diogo Turiani Hourneaux de Moura, Eduardo Guimarães Hourneaux de Moura. Peroral endoscopic pyloromyotomy for gastroparesis: a systematic review and meta-analysis. Endosc Int Open 2020; 08(07): E911-E923. DOI: 10.1055/a-1119-6616.
Você já se deparou com esse achado endoscópico na sua prática
Lesão de Dieulafoy: um desafio para o endoscopista
CASO 1
Paciente masculino de 65 anos em investigação de hepatopatia, apresentando episódios intermitentes de melena. Já realizou 2 endoscopias e uma colonoscopia não evidenciando o foco do sangramento. Hoje novo episódio de melena e queda significativa da hemoglobina. Indicada nova endoscopia.
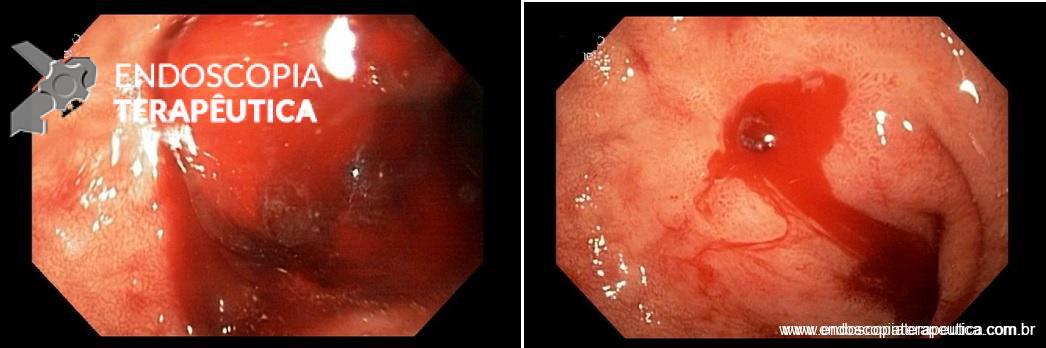
A endoscopia evidenciou um coágulo no ápice bulbar e após a sua remoção foi possível identificar um pequeno coto vascular com sangramento ativo. O coto foi tratado com injeção de solução de adrenalina seguida de aplicação de clipes. O paciente não apresentou novos sangramentos.
CASO 2
Menino de 6 anos com início há 3 dias com quadros de enterorragias volumosas intermitentes. Admitido no hospital com Hb de 6,0. Endoscopia digestiva alta normal. Indicada colonoscopia.
Após o preparo o cólon estava limpo e não apresentava mais resíduos hemáticos. No ceco foi identificado pequeno coágulo. Após a limpeza do ceco e avaliação detalhada underwater foi observado que o coágulo estava aderido a um coto vascular superficial com pequeno ponto de ruptura. Foi realizada a aplicação de clipes e a criança não apresentou mais episódios de sangramento.
Lesão de Dieulafoy
A lesão de Dieulafoy foi descrita pelo cirurgião francês Paul Georges Dieulafoy em 1898 e é uma causa pouco frequente de hemorragia gastrointestinal, mas de relevância, pois geralmente se apresenta com sangramentos volumosos. O grande desafio desta doença está no pequeno tamanho da lesão e na sua característica de sangramento intermitente com uma difícil localização endoscópica se o sangramento não estiver ativo. Isso leva à sua clássica apresentação de hematêmese e melena com significativa queda de hemoglobina e um exame de endoscopia normal ou com achados que não explicam o sangramento.
Ficou curioso? Clique aqui https://en.wikipedia.org/wiki/Paul_Georges_Dieulafoy
Patologia
As arteríolas normais da submucosa tem menos de 1 mm pois os vasos vão afilando progressivamente enquanto atravessam as camadas da parede do trato gastrointestinal. A lesão de Dieulafoy é um desses vasos, mas que não afilou após atravessar a muscular e chega à camada submucosa com um calilbre de 1-3 mm. Este vaso corre tortuosamente na submucosa e protrui através da mucosa para a luz gástrica através de um pequeno defeito na mucosa de 2 a 5 mm geralmente sem sinais inflamatórios mas podendo apresentar uma pequena área de fibrina adjacente.
O estômago é o local mais comum, geralmente na pequena curvatura alta. Até 1/3 das lesões são extra-gástricas sendo o duodeno e o cólon os locais mais frequentes. Já foram descritas lesões de Dieulafoy no esôfago, intestino delgado, reto, canal anal e nos brônquios.
Etiologia
A lesão provavelmente é de origem congênita. Patologicamente o vaso é normal, reduzindo a probabilidade de causa aneuristmática. Também fortalece a teoria congênita os casos descritos de lesões de Dieulafoy em recém-nascidos.
Uma grande proporção dos pacientes com ruptura deste vaso está internado sugerindo que a lesão por estresse está envolvida no sangramento. A hemorragia pode ocorrer em qualquer faixa etária mas é mais frequente acima dos 60 anos e duas vezes mais frequente em homens do que em mulheres. Comorbidades estão presentes em 90% dos pacientes sendo cardiopatias e insuficiência renal as mais comuns. Drogas como anti inflamatórios, aspirina e warfarina também podem estar relacionadas com o aumento da incidência do sangramento.
Embora a patogenia exata do que leva ao sangramento de um vaso previamente assintomático não é completamente compreendida mas o consenso é de que alguma forma de lesão mucosa por erosão ou injúria isquêmica expõe o vaso e predispõe ao sangramento.
Apresentação Clínica e Diagnóstico
A lesão de Dieulafoy tipicamente se apresenta agudamente com hemorragia maciça que geralmente é recorrente.
A endoscopia digestiva alta é efetiva no diagnóstico em até 70% dos pacientes. Porém, algumas vezes várias endoscopias podem ser necessárias para se fazer o diagnóstico. Até 6% dos pacientes necessitam 3 ou mais exames endoscópicos para encontrar a lesão. Entre os pacientes que o diagnóstico não foi feito na primeira endoscopia, 40% foi devido à presença de sangue acumulado impedindo a avaliação e 60% foi porque a lesão não pôde ser encontrada.
Existem relatos do uso de ecoendoscopia para identificar um vaso calibroso na submucosa mesmo na ausência de sangramento e também de seu uso para controle após tratamento endoscópico avaliando o desaparecimento do fluxo no vaso submucoso.
Características Endoscópicas da lesão de Dieulafoy
Os achados se dividem em 3 categorias:
- Sangramento ativo que pode ser em jato ou babação.
- Coágulo aderido que após a lavagem evidencia um mínimo defeito mucoso
- Vaso visível isolado com mucosa normal adjacente ou com pequena quantidade de fibrina, menor que 5 mm, não associado à úlcera.
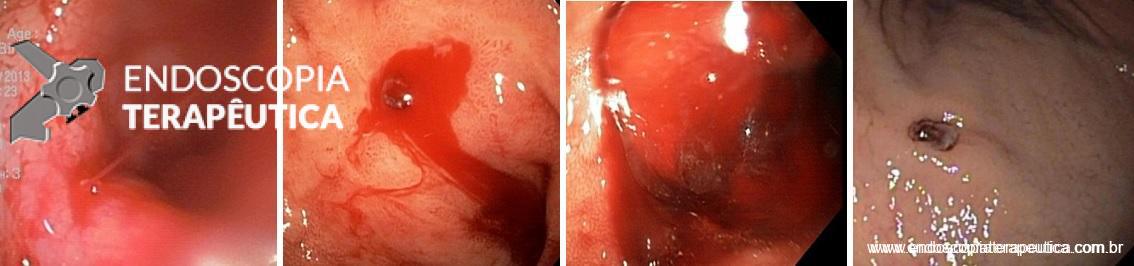
Da esquerda para a direita: Sangramento ativo em jato, sangramento ativo com vaso visível em babação, coágulo aderido, vaso visível com pequena quantidade de fibrina, menor que 5 mm.
Tratamento
O tratamento endoscópico é o método de escolha nas lesões acessíveis endoscopicamente. O sucesso é reportado acima de 90%. Podem ser utilizados métodos térmicos (heaterprobe, APC, coagrasper, eletrocoagulação com alça), injeção de agentes esclerosantes e terapias mecânicas (ligadura elástica e clipes). Cada técnica tem suas vantagens e desvantagens mas existe evidência na literatura de que as terapias mecânicas são mais efetivas. Terapias combinadas também apresentam menores taxas de ressangramento quando comparadas com a monoterapia.
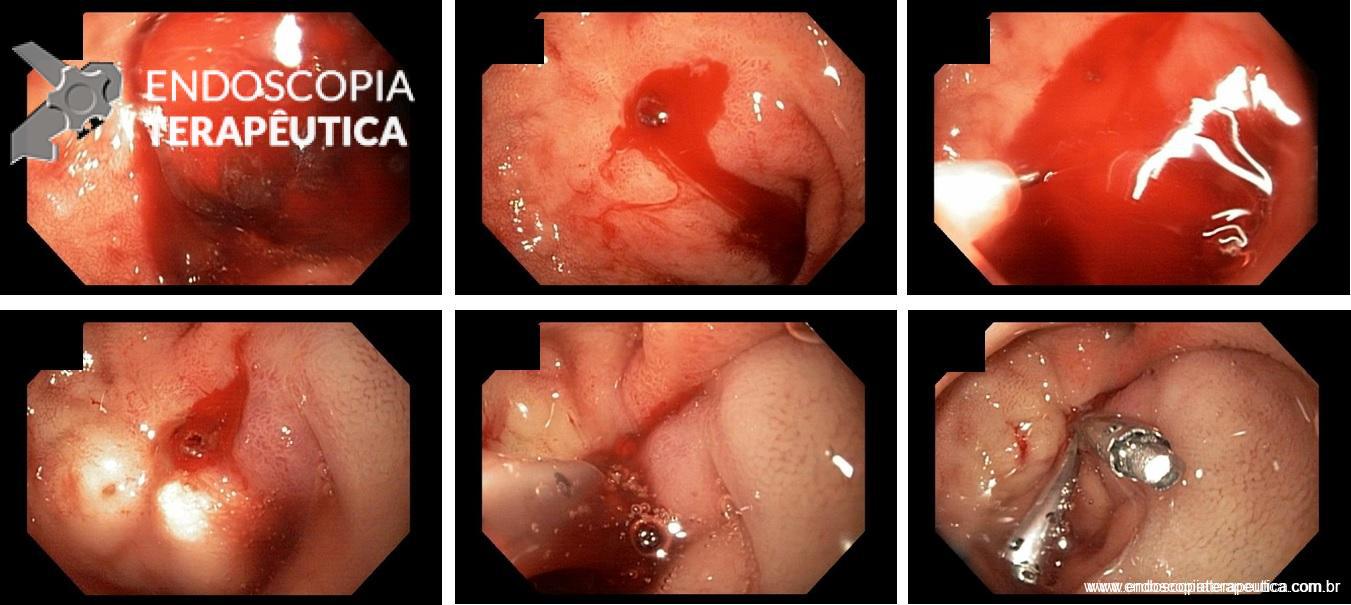
Tratamento endoscópico da lesão de Dieulafoy no duodeno. Superior da esquerda para a direita. a) coágulo aderido b)vaso visível com sangramento em babação após lavagem do coáugulo. c) escleroterapia com injeção de glicose e adrealina 1:10000. Inferior esquerda para a direita: d) aspecto após eslceroterapia. e)aplicação do primeiro clipe. e) aspecto após aplicação do segundo clipe.
A angiografia pode ser utilizada em casos que falham à terapia endoscópica. Nestes pacientes, a colocação de um clipe endoscópico próximo da lesão sangrante, quando possível, facilita bastante a localização da artéria a ser tratada. Esta técnica apresenta um risco considerável de isquemia na área da artéria obliterada que deve ser levado em conta no acompanhamento do paciente após o procedimento devido à possibilidade de perfuração tardia.
A angiografia é o método de escolha para lesões de Dieulafoy nos brônquios.
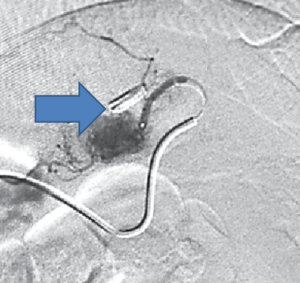
Angiografia demonstrando extravasamento de contraste em topografia gástrica. A seta demonstra a presença de um clipe endoscópico guiando o procedimento. Adaptado de Barbosa et. al 2016.
A cirurgia é reservada apenas para os casos onde existe falha endoscópica e angiográfica. O tratamento laparoscópico é possível e realizado através de ressecções em cunha ou gastrectomias parciais, mas depende da correta localização da lesão no intra-operatório. Por isso, nos pacientes que serão operados, a tatuagem endoscópica deve ser realizada para facilitar a identificação da área a ser ressecada.
Pontos importantes
A lesão de Dieulafoy é um desafio diagnóstico e terapêutico. Devemos sempre lembrar desta lesão nos casos de hemorragia obscura em todas as faixas etárias.
A repetição da endoscopia o mais precoce possível na recorrência da hemorragia permite a visualização do sangramento ativo facilitando muito a identificação da lesão.
O tratamento endoscópico é altamente efetivo e as terapias mecânicas são preferidas. Quando a posição da lesão não permitir a colocação de um clipe ou ligadura, terapias térmicas e injeção de agentes esclerosantes podem ser utilizados.
Referências
- Baxter M, Aly EH. Dieulafoy’s lesion: current trends in diagnosis and management. Ann R Coll Surg Engl. 2010;92(7):548‐554.
- Lee YT, Walmsley RS, Leong RW, Sung JJ. Dieulafoy’s lesion. Gastrointest Endosc. 2003;58:236–43.
- Clements J, Clements B, Loughrey M. Gastric Dieulafoy lesion: a rare cause of massive haematemesis in an elderly woman. Case Reports 2018;2018:bcr-2017-223615.
- Linda L. Manning-Dimmitt, Steven G. Dimmitt, and George R. Wilson, Am Fam Physician. 2005 Apr 1;71(7):1339-1346.
- Barosa, Rita et al. “Dieulafoy’s Lesion: The Role of Endoscopic Ultrasonography as a Roadmap.” GE – Portuguese Journal of Gastroenterology 24 (2016): 95 – 97.
- Ghazi Alshumrani, Angiographic findings and endovascular embolization in Dieulafoy disease: a case report and literature reviewDiagn Interv Radiol 2006; 12:151-154
Para saber mais:
Tratamento do Divertículo de Zenker por Z-POEM
Divertículo de Zenker (DZ) são protrusões saculiformes da mucosa e submucosa esofágica que ocorre na parede posterior da junção faringoesofágica, logo acima do músculo cricofaríngeo (MCF), com prevalência entre 0,01% e 0,1%.
O tratamento endoscópico ganhou espaço nas últimas décadas sobre o tratamento cirúrgico, visto ser um tratamento minimamente invasivo, com menor morbidade e eficaz.
Várias técnicas endoscópicas foram descritas como a diverticulotomia (link), uso de ultracision, plasma de argônio, etc. Os resultados das técnicas endoscópicas estão resumidos a seguir:
- Sucesso clínico entre 56% e 100%
- Eventos adversos média de 15%
- Recidiva clínica 10,5%
Essa recidiva relativamente alta é atribuída a dificuldade em se identificar com precisão o final do músculo cricofaríngeo, o que pode levar a septotomia incompleta. Por outro lado, a secção além do limite do músculo pode abrir comunicação com o mediastino e consequente risco infeccioso.
Neste cenário surgiu a possibilidade de aplicar uma nova técnica endoscópica, baseada na experiência prévia com o POEM (miotomia esofágica perioral) utilizada para tratamento da acalásia. Esse novo procedimento foi apelidado de Z-POEM ou D-POEM, ou seja, a miotomia do divertículo de Zenker com criação de um túnel submucoso.
As vantagens teóricas dessa técnica seriam:
- Melhor identificação e secção completa do músculo cricofaríngeo
- Possibilidade de fechar a mucosa com clipes, trazendo menos dor, possibilitando cicatrização mais rápida e minimizando riscos infecciosos.
Indicação
- Diverticulotomia do Zenker está indicada nos pacientes com DZ que apresentam disfagia, regurgitação, engasgos ou pneumonia de aspiração.
Avaliação pré-procedimento
- Deglutograma contrastado
- Endoscopia digestiva alta
- Pré-operatório para anestesia geral (ECG, RX tórax, exames laboratoriais com coagulograma)
Cuidados pré-operatórios:
- Recomendamos dieta líquida na véspera do procedimento e jejum de 12 horas para evitar presença de resíduos alimentares no interior do divertículo
- Antibióticos de amplo espectro na indução anestésica.
Sedação e posicionamento sugerido
- Anestesia geral
- Nossa preferência é pelo DLE, embora alguns autores realizem o procedimento na posição supina
Materiais necessários
- Agulha de esclerose
- Cap, de preferência o cap cônico.
- Faca de dissecção submucosa (Hybrid-knife Erbe)
- Bisturi elétrico Erbe com função endocut
- Pinça hemostática (coagrasper ou hot-biopsy Boston)
- Insuflador de CO2 (imprescindível). Recomendado baixo fluxo para evitar enfisema subcutâneo
Passos técnicos do procedimento
- Injeção e secção da mucosa 2 cm acima do septo do DZ
- Criação do túnel submucoso
- Identificação do septo (MCF)
- Dissecção meticulosa do septo na sua face anterior e posterior.
- Secção do septo
- Revisão da hemostasia
- Fechamento da mucosa com clips
Cuidados pós-operatórios
- Antibióticos. EV são mantidos por 24horas após o procedimento e na alta são substituídos por ATB via oral por 5-7 dias (solução líquida de amoxicilina ou amoxicilina + clavulanato).
- Aguá e chá frio podem ser iniciados 6 horas após o procedimento.
- Dieta líquida no primeiro PO, com progressão gradual para dieta pastosa e dieta leve conforme ausência de dor e boa aceitação via oral.
- IBP por 4 semanas.
- Controle endoscópico em 3 meses
Video do Procedimento
Procedimento realizado por Dr. Nelson Miyajima + Dr. Bruno Martins
Resultados
O maior estudo até então foi publicado este ano na GIE. [2]
- Estudo internacional multicêntrico envolvendo 10 instituições
- 75 pacientes, média idade 73 anos
- Sucesso técnico 97% (73/75)
- Eventos adversos em 6,7% (5/75)
- 1 sangramento leve tratado de forma conservadora
- 4 perfurações (1 grave e 3 moderadas)
- Tempo médio do procedimento 52 minutos
- Média de estadia hospitalar 1,8 dias
- Sucesso clínico 92% (69/75)
- Média de follow-up 291 dias
- Com 12 meses de follow-up, um paciente referiu recidiva dos sintomas
Conclusões:
O tratamento endoscópico do divertículo de Zenker utilizando a técnica do Z-POEM é promissora, eficaz e apresenta bons resultados.
Imagina-se que essa técnica possa oferecer uma resposta mais duradoura a longo prazo, visto possibilitar a secção completa do músculo cricofaríngeo com segurança, já que a mucosa pode ser fechada com clipes ao término do procedimento.
No entanto, estudos com follow-up a longo prazo ainda são necessário para nos certificarmos da resposta duradoura do procedimento.
Tampouco existem estudos comparando o Z-POEM com a técnica tradicional, embora existam estudos em andamento. Os resultados desses estudo são aguardados ansiosamente.
Referências:
- Li QL, Chen WF, Zhang XC, et al. Submucosal Tunneling Endoscopic Septum Division: A Novel Technique for Treating Zenker’s Diverticulum. Gastroenterology. 2016;151(6):1071‐1074. doi:10.1053/j.gastro.2016.08.064
- Yang J, Novak S, Ujiki M, et al. An international study on the use of peroral endoscopic myotomy in the management of Zenker’s diverticulum. Gastrointest Endosc. 2020;91(1):163‐168. doi:10.1016/j.gie.2019.04.249
- Maydeo A, Patil GK, Dalal A. Operative technical tricks and 12-month outcomes of diverticular peroral endoscopic myotomy (D-POEM) in patients with symptomatic esophageal diverticula. Endoscopy. 2019;51(12):1136‐1140. doi:10.1055/a-1015-0214
…………………………………………………………………………………………………….
Como citar esse artigo:
Martins, BC. Tratamento do Divertículo de Zenker por Z-POEM. Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/casosclinicos/tratamento-do-diverticulo-de-zenker-por-z-poem/
Algoritmo diagnóstico simples para detecção de câncer gástrico precoce através da magnificação endoscópica (MESDA-G)
O primeiro passo para o diagnóstico do câncer gástrico precoce (CGP) é identificar uma lesão suspeita usando a luz branca convencional. Nesse método, é importante prestar atenção nas mudanças sutis de cor e morfologia da mucosa. As pistas são: alteração da cor (eritema ou palidez), mudanças morfológicas na superfície (protrusão, elevação ou depressão), pregas afinadas ou interrompidas, sangramento espontâneo, alteração abrupta no padrão vascular ou mucoso, perda de brilho na mucosa. No caso de componente ulceroso, uma lesão suspeita pode ser detectada como alterações sutis na mucosa ao redor da úlcera.
Preparação adequada e uso de técnica apropriada são extremamente importantes para detecção de CGP.
Após identificar uma lesão que potencialmente é uma neoplasia, o segundo passo é procurar uma linha demarcatória entre a lesão e a mucosa adjacente. Devemos sempre olhar de fora para o centro da lesão, da mucosa normal à mucosa alterada. Se não houver demarcação nítida, trata-se de uma lesão benigna. O uso de corantes como índigo-carmim e/ou a magnificação endoscópica melhora a visualização das características da mucosa e facilita a diferenciação entre a lesão cancerosa e a mucosa ao redor.
O terceiro passo é procurar alterações nos padrões de microvascularização e microssuperfície DENTRO da linha demarcatória (Classificação VS). Caso uma das duas esteja presente, o diagnóstico de neoplasia gástrica precoce pode ser feito, conforme o algoritmo abaixo:
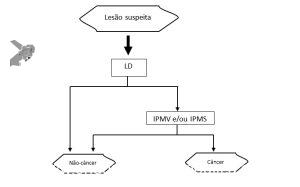
Algoritmo diagnóstico simples de Magnificação endoscópica para câncer gástrico (MESDA-G). LD: linha demarcatória; IPMV: irregularidade do padrão microvascular; IPMS: irregularidade do padrão de microssuperfície
MAGNIFICAÇÃO ENDOSCÓPICA DA MUCOSA GÁSTRICA NORMAL
Para detectar uma lesão suspeita, é de extrema importância entender os achados endoscópicos da mucosa gástrica normal. Com isso, podemos identificar os fatores de alto risco (infecção por H. pylori, atrofia e metaplasia), distinguir lesões neoplásicas de não neoplásicas e determinar as margens do tumor.
MUCOSA DE GLÂNDULAS FÚNDICAS NORMAL
A mucosa fúndica normal está presente no corpo gástrico sem nenhuma alteração patológica como por exemplo inflamação ou atrofia secundária à infecção por H. pylori.
Neste padrão, os capilares formam uma rede de vasos em forma de favo de mel em volta das criptas e desembocam nas vênulas coletoras.
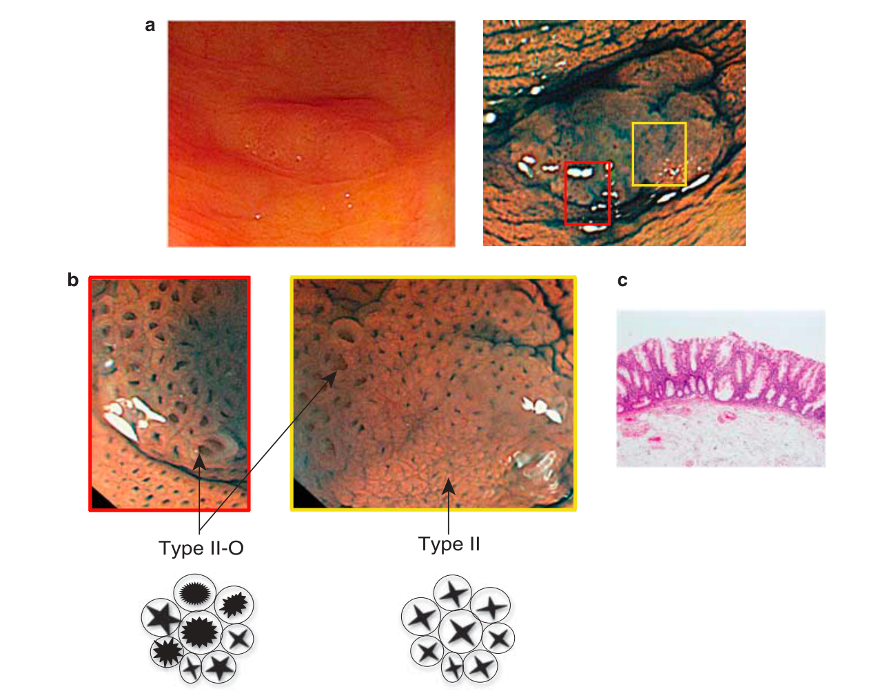
A cromoscopia com magnificação da mucosa fúndica normal é caracterizada por uma superfície epitelial onde a abertura das criptas é vista como oval ou redonda circundada por uma estrutura de coloração branca (epitélio marginal da cripta). As vênulas coletoras possuem distribuição regular (RAC, regular arrangement of collecting venules) e possuem coloração esverdeada (ciano), conforme demonstrado na figura 2
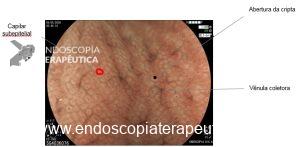
Figura 2: Magnificação endoscópica da mucosa do tipo fúndico.
MUCOSA DE GLÂNDULAS PILÓRICAS NORMAL
A mucosa pilórica normal está presente no antro gástrico sem nenhuma alteração patológica como por exemplo inflamação ou metaplasia secundária à infecção por H. pylori. Nesse caso, as glândulas desembocam obliquamente e não perpendicularmente como no padrão fúndico, dando um aspecto reticular com sulcos. Os capilares formam alças em espiral ou mola (figura 3).
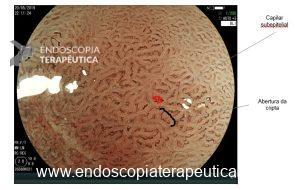
Figura 3: Magnificação endoscópica da mucosa do tipo pilórico.
MUCOSA DE GASTRITE CRÔNICA ASSOCIADA A PYLORI
A infecção persistente do H. pylori causa inflamação, atrofia e metaplasia intestinal na mucosa gástrica.
A magnificação endoscópica na mucosa fúndica associada à inflamação crônica mostra distribuição anômala das aberturas de criptas, assim como aberturas elípticas ou em forma de sulcos com coloração branca. Os capilares podem ou não ser observados ao redor das aberturas de criptas.
Os achados da magnificação na mucosa atrófica consistem em formas vilosas ou granulares dilatadas, com capilares em espiral. A metaplasia intestinal está frequentemente associada à atrofia e envolve a formação das cristas azul clara (Light blue crest), conforme demonstrado nas figuras 4 e 5.
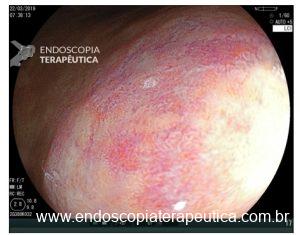
Figura 4: Magnificação de mucosa atrófica de corpo gástrico.
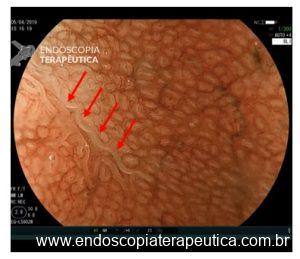
Figura 5: Light blue crest.
OBS: A distinção entre mucosa normal e gastrite crônica na mucosa pilórica ainda não está claramente elucidada.
METAPLASIA
A infecção crônica pelo H. pylori induz alterações biomoleculares na mucosa gástrica, fazendo com que ela se assemelhe ao fenótipo intestinal (metaplasia intestinal). A metaplasia intestinal é fator de risco para câncer gástrico.
Na endoscopia com luz branca, a metaplasia intestinal apresenta-se superficialmente elevada ou com áreas planas esbranquiçadas (figura 6). Também pode aparecer como placas da mesma cor da mucosa adjacente ou até áreas ligeiramente deprimidas e avermelhadas.
O NBI pode contrastar as diferenças de coloração entre a mucosa metaplásica e não-metaplásica. Com a magnificação, a estrutura da microssuperfície da mucosa gástrica normal tem o aspecto foveolar no corpo e reticular no antro, enquanto a microssuperfície da metaplasia intestinal geralmente apresenta um padrão viliforme ou em sulcos, mimetizando a mucosa antral normal ou mucosa intestinal (figura 7). Além disso, o epitélio da metaplasia intestinal é mais turvo quando comparado à mucosa não metaplásica
Uma fina linha de luz azul pode ser observada na crista ou giro da superfície epitelial, chamada de Light blue crest (LBC). O LBC é possivelmente originado pela reflexão da luz através da borda em escova presente na metaplasia intestinal (figura 5).
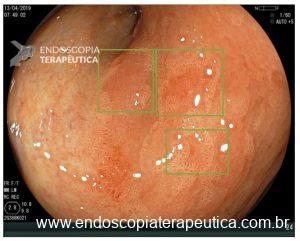
Figura 6: Metaplasia gástrica intestinal no antro: área esbranquiçada e ligeiramente elevada.
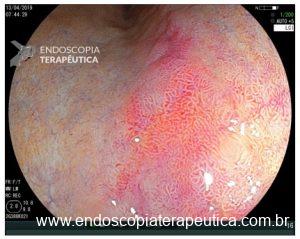
Figura 7: Magnificação endoscópica: a mucosa metaplásica apresenta um padrão de sulcos.
COMENTÁRIOS
O diagnóstico de câncer gástrico precoce é desafiador e requer conhecimento, prática e tempo. Este artigo propõe um algoritmo simplificado, de fácil aplicabilidade na prática clínica por endoscopistas não experientes.
O reconhecimento de uma lesão potencialmente maligna começa com a luz branca convencional. O foco deve ser nas alterações sutis da mucosa, como a cor e a superfície. Devemos sempre examinar de fora para o centro da lesão. Com o auxílio da cromoscopia e magnificação, pode-se avaliar as alterações do padrão microvascular e de microssuperfície. Para isso, é de extrema importância o conhecimento do aspecto endoscópico e anatômico da mucosa gástrica normal, das alterações inflamatórias secundárias à infecção pelo H. Pylori e das alterações precursoras (metaplasia intestinal, atrofia).
O critério simplificado proposto no MESDA-G classifica uma lesão como câncer quando a mesma é bem delimitada e com padrão irregular na cor (vascularização) e/ou superfície. A presença de uma linha demarcatória evidente entre a mucosa normal e a mucosa alterada está sempre presente nas lesões superficiais do estômago.
Nas lesões benignas (úlceras pépticas, gastrites erosivas), apesar de muitas vezes haver linha demarcatória, sua distribuição espacial é simétrica e a mucosa ao redor é regular.
REFERÊNCIA BIBLIOGRÁFICA
QUIZ ! Vamos ver se você acerta essa ?
Devemos incluir a manometria esofágica de alta resolução na avaliação do paciente com doença do refluxo gastroesofágico?
A Doença do Refluxo Gastroesofágico (DRGE) é de enorme importância na rotina do gastroenterologista e do endoscopista. Com uma prevalência de aproximadamente 31% da população (1), de acordo com recentes dados norte-americanos, ela é um dos principais motivos de consulta ao gastroenterologista. Destaca-se, ainda, que os portadores desta condição têm importante impacto em sua qualidade de vida, conforme estudos realizados em diferentes partes do mundo (2,3).
Notável também é o volume de recursos envolvidos na abordagem da DRGE. Estima-se que, só nos EUA, o gasto anual com a doença seja da ordem de 9 a 10 bilhões de dólares anuais (4), considerando-se exames diagnósticos e uso de medicamentos, particularmente os inibidores da bomba de prótons (IBP´s).
Estas drogas são as mais utilizadas no tratamento da doença, com ótimos resultados na maioria dos casos, porém as recentes preocupações com potenciais efeitos adversos com seu uso prolongado (5), amplamente divulgada pela mídia e já objeto de um outro post aqui no Endoscopia Terapêutica (clique nesse link para acessar), reforçam a necessidade de um diagnóstico mais preciso da DRGE, evitando-se, assim, uso desnecessário de medicamentos.
Neste contexto, uma publicação científica muito relevante é o Consenso de Lyon (6), que aborda o uso dos exames no moderno diagnóstico da DRGE.
O Consenso dá grande importância à manometria de alta resolução (MAR), com mais de 3 das 9 páginas da publicação referindo-se a ela.
Mas, devemos solicitar de rotina a manometria para pacientes com DRGE?
Em primeiro lugar, precisamos ressaltar os avanços representados pela nova tecnologia, a alta resolução, em comparação com a manometria convencional:
- Ela conta com um número muito maior de sensores (24 a 30), em geral espaçados a cada 1 ou 2 cm, em comparação com a tecnologia anterior.
- Isto permite uma avaliação muito mais detalhada da motilidade esofágica, inclusive com a introdução de novos parâmetros (métricas), que já são amplamente utilizados na literatura médica mundial.
- Destaca-se, ainda, uma interface gráfica mais amigável, com maior facilidade de aprendizado, maior acurácia diagnóstica para os distúrbios da motilidade esofágica e maior concordância inter-observadores (7).
- A única desvantagem potencial seria o custo mais elevado. Apesar disto, a alta resolução é tecnologia amplamente utilizada a nível mundial, suas métricas são as utilizadas nos mais recentes artigos publicados na literatura e, mesmo no Brasil, seu uso é crescente, contribuindo muito para isto a disponibilidade de equipamento de fabricação nacional, de ótima qualidade e com custo relativamente acessível.
Particularmente, na DRGE a MAR é fundamental para a localização do esfíncter esofágico inferior em pacientes que serão submetidos a pHmetria ou impedâncio-pHmetria, permitindo, assim, o adequado posicionamento dos sensores de pH. Ela possibilita também afastar diagnósticos alternativos, cujos sintomas podem se confundir com a DRGE, especialmente a acalasia.
Destaca-se ainda que a MAR permite a avaliação dos eventos essenciais na fisiopatologia da doença:
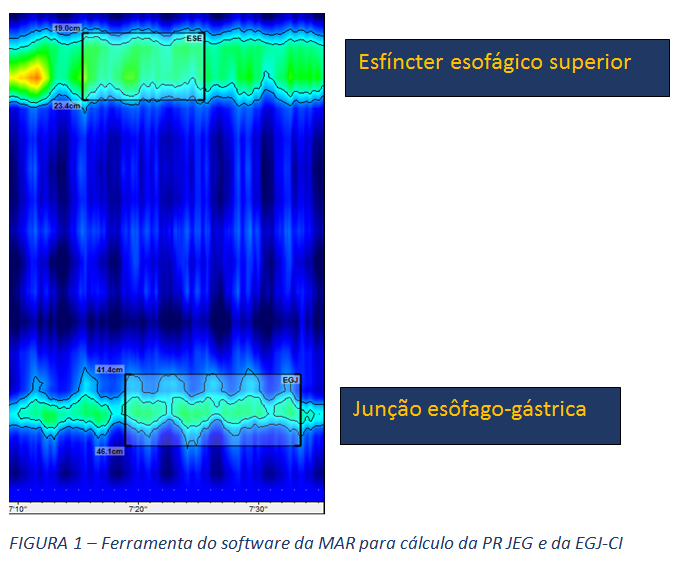
- Função de barreira da junção esôfago-gástrica (JEG)
- Peristalse do corpo esofágico.
1. FUNÇÃO DE BARREIRA DA JUNÇÃO ESÔFAGOGÁSTRICA
- Pressão da junção esofagogástrica (PR JEG) e integral de contratilidade da JEG (EGJ-CI): Estas são as duas métricas utilizadas para quantificar a função de barreira da JEG. A PR JEG é expressa em mmHg (8) e, mais recentemente, a integral de contratilidade da JEG (EGJ-CI), aferida em mmHg/cm (6) é considerada a medida mais promissora para avaliar a competência da junção, aferindo o seu vigor contrátil.
- Morfologia da JEG: A MAR permite, ainda, a avaliação da morfologia da JEG, através da análise da posição relativa do esfíncter esofágico inferior (EEI), propriamente dito, em relação à crura diafragmática. Assim, classifica-se esta morfologia em tipo I, quando o EEI e a crura estão em posição coincidente. Os tipos 2 e 3 representam ruptura anatômica da morfologia normal da JEG, como ocorre na hérnia hiatal, com separação entre os seus dois principais componentes, diferenciando-os a magnitude desta separação. O tipo 2 refere-se a uma separação menor que 3 cm, enquanto o tipo 3 descreve separação entre EEI e crura, maior ou igual a 3 cm.
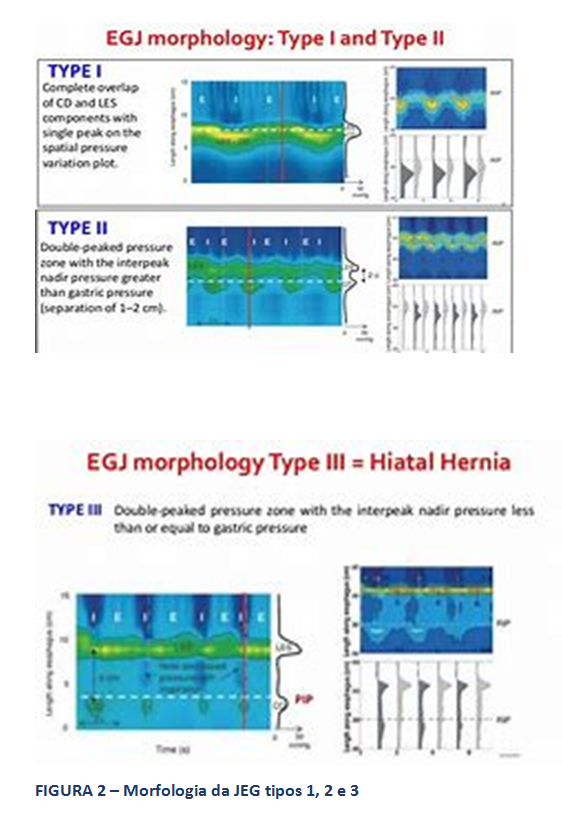
Type I: complete overlap of CD and LES components with single peak on the spatial pressure variation plot; Type II: double-peaked pressure zone with the interpeak nadir pressure grater than gastric pressure (separation of 1-2cm); Type III: double-peaked pressure zone with the interpeak nadir pressure less than or equal to gastric pressure
2. PERISTALSE DO CORPO ESOFÁGICO
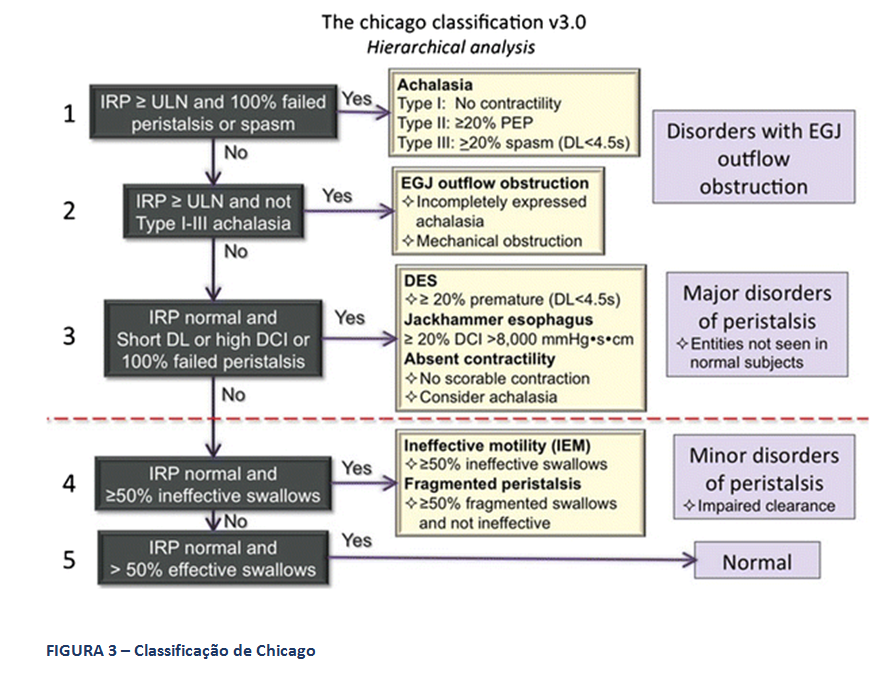
A peristalse normal do corpo esofágico é mecanismo fundamental ao adequado clearance de qualquer material que possa ser refluído para o esôfago, representando importante mecanismo anti-refluxo. A principal métrica que avalia a peristalse na MAR é a integral de contratilidade distal do corpo esofágico, designada pela sigla DCI. Ela expressa o vigor da contração esofágica em sua zona pós transicional e é aferida em mmHg.s.cm. Contrações normais tem valor de DCI acima de 450 mmHg.s.cm. Valores entre 100 e 450 designam contrações classificadas como fracas. Já valores abaixo de 100 mmHg.s.cm classificam a contração como falha.
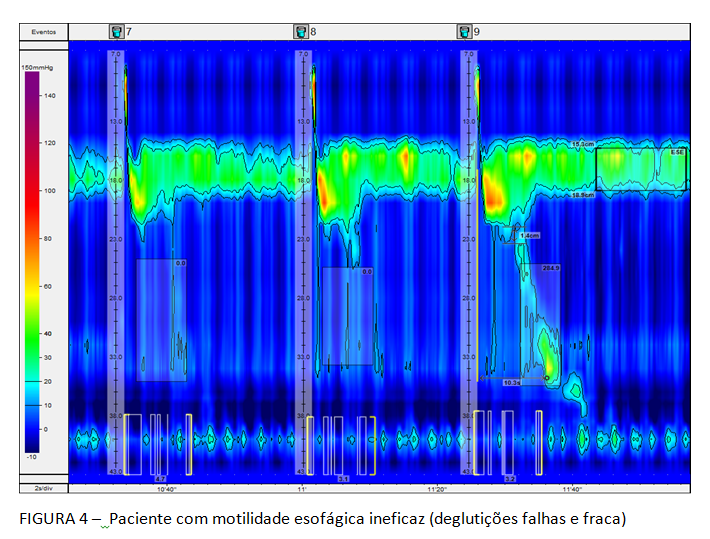
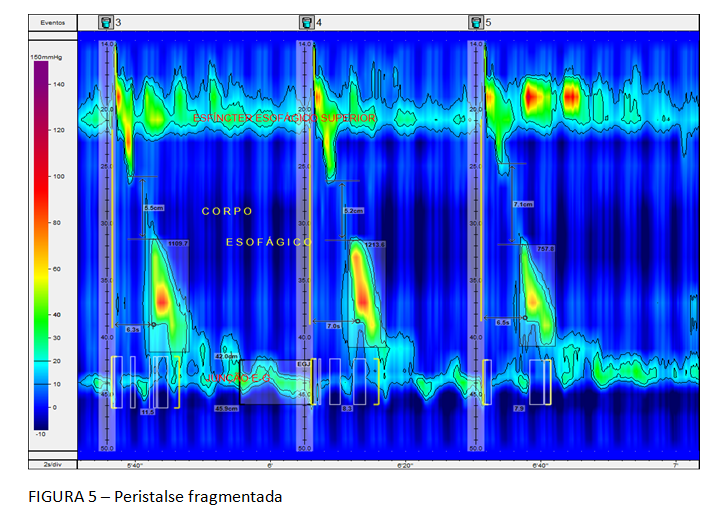
A Classificação hierarquizada de Chicago (figura 3), que rege a MAR, classifica como distúrbio maior da motilidade esofágica a ausência de peristalse, entre outros. Deve-se considerar a possibilidade de acalasia quando isto ocorre. Ela caracteriza, ainda, como distúrbio menor da peristalse, a motilidade esofágica ineficaz (MEI), quando se observa a presença de 50% ou mais de contrações falhas ou fracas, em qualquer proporção. Esta situação é frequente na DRGE (figura 4). Há na Classificação, também, a peristalse fragmentada, descrita quando ocorrem 50% ou mais de deglutições fragmentadas, com break maior que 5 cm (figura 5).
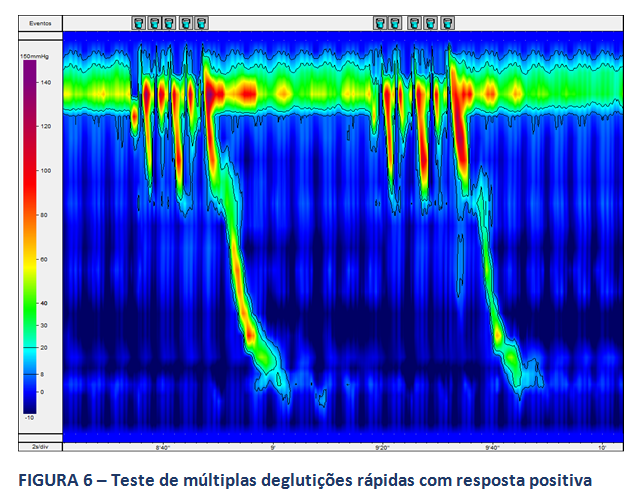
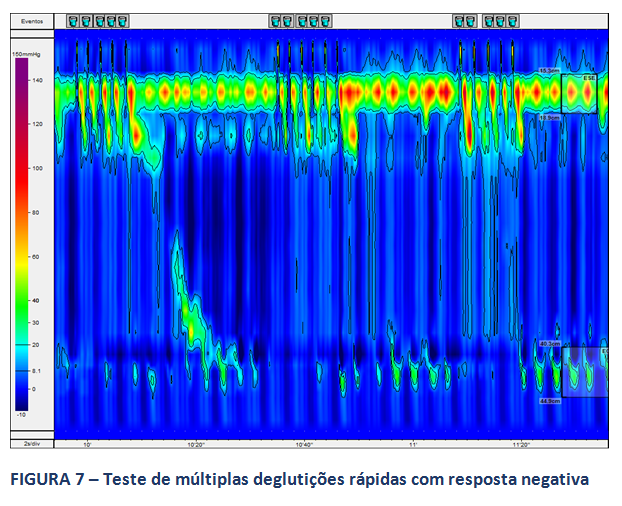
A MAR permite, ainda na avaliação da peristalse do corpo esofágico, a realização de testes provocativos, com o intuito de se avaliar a reserva peristáltica do corpo em pacientes com MEI ou peristalse ausente. O consenso de Lyon sugere a realização destes testes. Destaca-se, neste contexto, o teste de múltiplas deglutições rápidas (figuras 6 e 7), de mais fácil aplicação. A ausência de reserva peristáltica pode estar relacionada a maior incidência de disfagia no pós operatório em pacientes com DRGE (9).
Considerando ainda a avaliação da disfagia no pós-operatório de cirurgia anti-refluxo, estudos mostram que um outro parâmetro da MAR, a integral de relaxamento da JEG (IRP), fundamental no diagnóstico da acalasia, apresenta-se mais elevado em pacientes operados que apresentam disfagia prolongada (10,11,12) e a sua avaliação pode auxiliar a discriminar pacientes que podem beneficiar-se da dilatação endoscópica com balão. No paciente operado, a presença de duas zonas de alta pressão separadas ao nível da JEG é forte preditor da recorrência do refluxo gastro-esofágico (12). Ainda, há relação inversa entre a integral de contratilidade do corpo distal (DCI) no pré-operatório e o risco de disfagia após a cirurgia (10), considerando-se risco mais elevado para valores médios de DCI abaixo de 1000 mmHg.s.cm.
Diversos estudos mostram que há forte associação entre refluxo ácido à pHmetria e alterações nos parâmetros da MAR, como redução da pressão da JEG, redução da EGJ-CI, alteração na morfologia da JEG (tipos 2 e 3) e motilidade esofágica ineficaz (MEI) ou peristalse fragmentada.
Na nossa casuística, que será apresentada no próximo DDW e publicada como abstract no Gastroenterology, comparando-se pacientes com refluxo bem estabelecido à pHmetria, de acordo com o Consenso de Lyon (exposição ácida esofágica > 6%, n= 156) com pacientes sem refluxo ácido (exposição ácida < 4%, n= 162), observamos diferença estatisticamente significativa entre os dois grupos em relação à pressão da JEG e EGJ-CI (p<0,001), morfologia alterada da JEG (p=0,003) e diagnóstico de MEI (p=0,008). A análise de regressão logística mostrou que a PR JEG foi o melhor preditor independente de refluxo patológico (OR=3.078, 95%CI=1,894-5.004; p<0.001). Assim, concluímos que as métricas da MAR utilizadas para a avaliação da função de barreira da JEG, bem como aquelas que avaliam a peristalse do corpo esofágico são úteis para diferenciar pacientes com refluxo patológico dos indivíduos com refluxo apenas fisiológico.
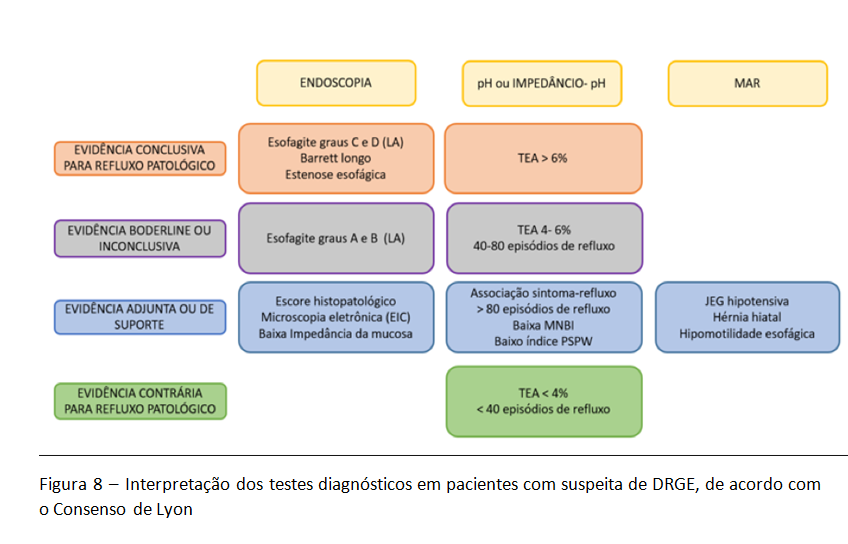
O consenso de Lyon estabelece um grupo de pacientes, classificado como indeterminado ou borderline para refluxo patológico. Utilizando-se os testes diagnósticos mais importantes, este grupo inclui pacientes com esofagite erosiva graus A e B na classificação de Los Angeles, além de pacientes com pHmetria indicando exposição esofágica ao ácido entre 4 e 6% do tempo (figura 8).
De acordo com o consenso, as alterações acima descritas na MAR podem ser usadas para ajudar na definição destes casos classificados como borderline. Os nossos dados reforçam o uso adjunto destas métricas neste grupo de pacientes.
Em conclusão, a MAR é ferramenta importante na avaliação da DRGE, embora ela não seja necessária em todos os pacientes. Ainda que ela não possibilite isoladamente o diagnóstico definitivo de refluxo ácido, ela permite excluir acalasia, auxiliar na adequação técnica da pHmetria, predizer risco aumentado de disfagia no pós operatório, avaliar sintomas no pós operatório e, também, auxiliar no diagnóstico de refluxo em pacientes classificados como borderline à pHmetria e/ou à endoscopia digestiva.
Referências:
- DELSHAD S D et al. Prevalence of Gastro-esophageal reflux disease and proton pump inhibitor refractory symptoms. Gastroenterology 2020; 158:1250–1261
- ELOUBEIDE M A, PROVENZALE D. Health-related quality of life and severity of symptoms in patients with Barrett’s esophagus and gastroesophageal reflux disease patients without Barrett’s esophagus. Am J gastroenterol 2000; 95(8):1881-7.
- MADISCH A et al. Impact of reflux disease on general and disease-related quality of life – evidence from a recent comparative methodological study in Germany. Z Gastorenterol 2003;41(12):1137-43
- SHAHEEN N J et al. The burden of gastrointestinal and liver diseases, 2006. Am J Gastroenterol 2006; 101:2128–38.
- VAEZI M. F. Complications of Proton Pump Inhibitor Therapy. Gastroenterology 2017; 153: 35–48
- GYAWALI CP et al – Modern diagnosis of GERD: The Lyon Consensus. Gut 2018; 67(7):1351-1362
- CARLSON D A et al – Diagnosis of esophageal motility disorders: esophageal pressure topographversus conventional line tracing. Am J Gastroenterol 2015; 110(7): 967-978
- JAIN M. Basal lower esophageal sphincter pressure in gastroesophageal reflux disease: Anignored metric in high–resolution esophageal manometry. Indian J Gastroenterol 2018; 37(5): 46-51
- STOIKES N et al. The value of multiple rapid swallows during preoperative esophageal manometry before laparoscopic antireflux surgery. Surg Endosc 2012; 26(12):3401-7.
- KAPADIA S et al. The role of preoperative high resolution manometry in predicting dysphagia after laparoscopic Nissen fundoplication. Surg Endosc. 2018; 32(5):2365-2372.
- MARJOUX S et al – Impaired postoperative EGJ relaxation as a determinant of post laparoscopic fundoplication dysphagia: a study with high–resolution manometry before and after surgery. Surg endosc 2012; 26(12):3642-9
- TATUM RP et al – High–resolution manometry in evaluation of factors responsible for fundoplication failure. Am Coll Surg. 2010; 210(5):611-7.
…………………………………………………………………………………………………….
Como citar esse artigo:
de Oliveira, RA. Devemos incluir a manometria esofágica de alta resolução na avaliação do paciente com doença do refluxo gastroesofágico? Endoscopia Terapêutica; 2020. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/devemos-incluir-manometria-esofagica-de-alta-resolucao-na-avaliacao-do-paciente-com-doenca-do-refluxo-gastro-esofagico/
Confira também: DRGE é fácil de ser diagnosticada?