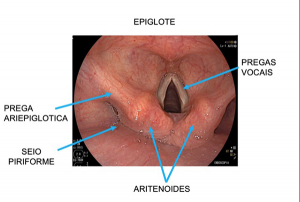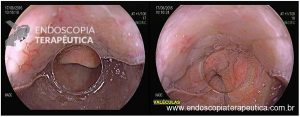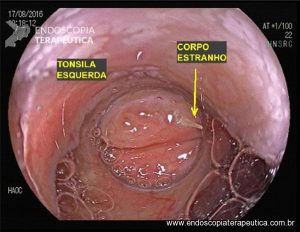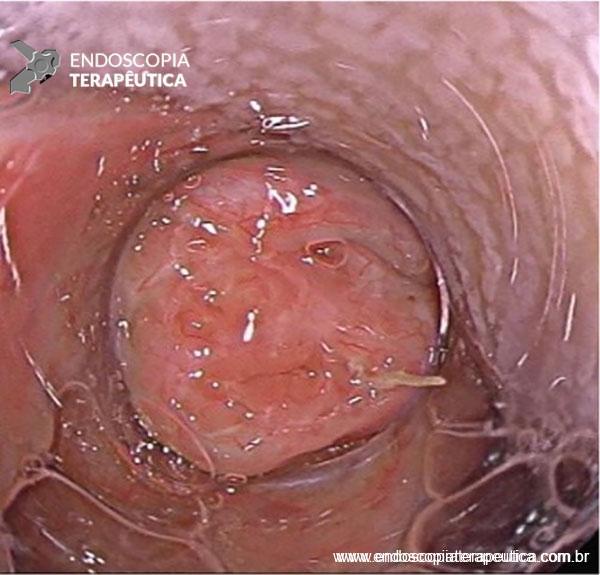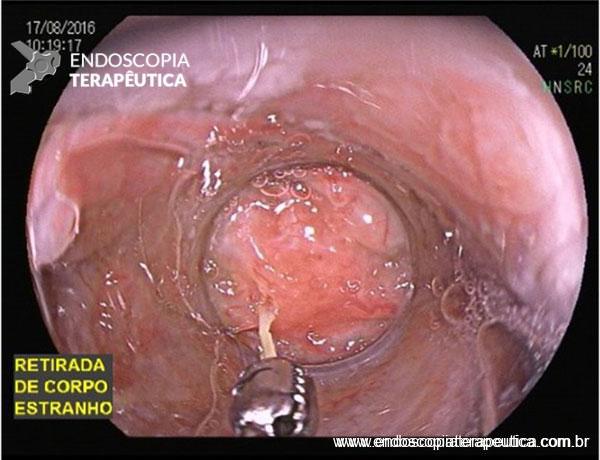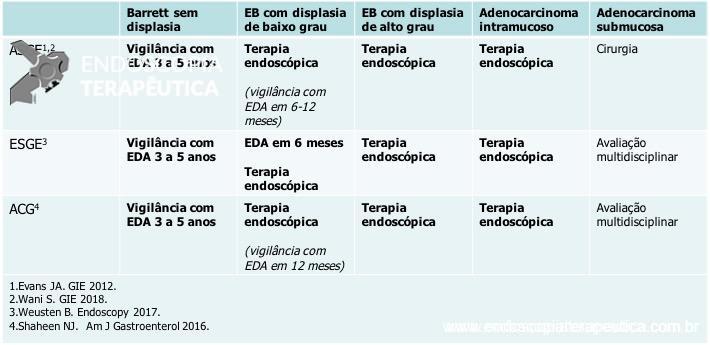
As doenças ocupacionais estão ligadas às mais variadas profissões, tendo evoluído ao longo dos anos e ocorrendo silenciosamente nos ambientes de trabalho.
Esse termo se originou a partir do grego ergon, que significa “trabalho”, e nomos, que quer dizer “leis ou normas”.
A escolha pela realização de uma revisão da literatura se fez necessária para comprovar a necessidade de se conhecer melhor a realidade do ambiente de trabalho do médico endoscopista devido ao aumento constante do volume e tempo dos procedimentos endoscópicos nos últimos anos.
Devido à escassez de estudos recentes sobre esse tema, foram escolhidos artigos publicados entre os anos 1994 a 2018, sendo encontrados 17 artigos específicos sobre o tema.
No Brasil, a norma regulamentadora NR-17, publicada em 1978 pelo Ministério de Trabalho e Emprego, dispõe sobre os “parâmetros que permitam a adaptação das condições de trabalho às características psicofisiológicas dos trabalhadores, de modo a proporcionar um máximo de conforto, segurança e desempenho eficiente” (Brasil, 1978).
As atividades ocupacionais desenvolvidas nos setores médico-hospitalares, clínicas e ambulatórios merecem maior atenção devido à importante demanda ergonômica.
Estudos recentes mostram que os médicos endoscopistas gastam pelo menos 43% do seu tempo realizando procedimentos endoscópicos, sendo a necessidade da avaliação ergonômica, primordial, devido às altas taxas de sintomas musculoesqueléticos e lesões por esforço repetitivo nesses profissionais.
Os artigos concordam em informar que as lesões e dores nos polegares, nas mãos, pescoço, costas, polegares (principalmente o esquerdo), ombro e punho são as mais comumente relatadas e, não surpreendentemente, os riscos parecem estar relacionados principalmente a fatores como: tempo de profissão, constante aumento do volume de exames e aumento da dificuldade para execução de novos procedimentos, que antigamente eram exclusivo de cirurgiões, postura e tempo prolongado do exame em que o profissional precisa se manter em pé, manipulação do aparelho e execução de força e torque com a mão direita.
Os estudos mostraram a prevalência de cerca de 37% a 89% de queixas musculoesqueléticas entre os endoscopistas, sendo que cerca de 67% desses profissionais trabalham em locais com péssima ergonomia e/ou possuem hábitos ergonômicos ruins.
Estudos mais recentes estimam que, após 10 anos de exposição ao trabalho, aproximadamente 10% dos endoscopistas teriam uma doença musculoesquelética, portanto, princípios ergonômicos claros e básicos deveriam ser incorporados à prática da endoscopia.
A aplicação de princípios ergonômicos básicos, como manter posturas neutras do punho, pescoço e ombros durante a endoscopia, não exagerar na força com as mãos e otimizar o design do aparelho usado, pode reduzir as queixas de dores e risco de lesões, além de tornar os procedimentos mais confortáveis para o médico.
Para que os endoscopistas consigam se manter em posturas neutras, o local de trabalho deve ser planejado para se adequar à maioria da população de endoscopista, de ambos os sexos, pois nem todos endoscopistas estão cientes dos riscos físicos aos quais estão expostos a cada dia como resultado do esforço repetitivo que aumenta o risco de sofrer lesões musculoesqueléticas agudas, podendo resultar em lesões permanentes e incapacidade.
O ambiente em que se trabalha e a rotina adquirida pode influenciar diretamente na saúde desses profissionais, como as superfícies do piso, macas, assentos, alturas de monitores de vídeo, qualidade dos aparelhos, falta de pausas entre longos procedimentos, entre outros.
Os sintomas podem variar desde dores leves até lombalgias mais graves, dormência, formigamento, atrofia e fraqueza e, inevitavelmente, a carreira profissional pode ser seriamente afetada por essas lesões permanentes decorrentes dos seus hábitos de trabalho.
Portanto, percebe-se que a maior parte dos médicos endoscopistas não está ciente dos perigos físicos a que estão expostos durante o trabalho e como preveni-los.
Principais lesões que acometem os endoscopistas
Síndromes do pescoço e do ombro
Com a introdução da videoendoscopia no lugar da fibroendoscopia, seria de esperar que as lesões no pescoço e ombros ocorressem com menos frequência, porém, as queixas de dores em pescoço e ombro foram umas das mais frequentes entre os endoscopistas, sendo necessário que a altura dos monitores seja ajustável ao nível dos olhos dos profissionais, evitando a hiperextensão cervical.
Lesões ulnar e radial
Alguns endoscopistas apresentaram parestesias em seu braço dominante, que emana de seus cotovelos e pode ser secundário ao aprisionamento do nervo ulnar ou radial.
Com o esforço repetitivo ocorrido durante os exames, ocorreu inflamação aumentando a compressão, comprimindo o nervo e produzindo parestesias e inibindo toda a amplitude de movimento.
Lombalgia e doenças da coluna lombar e sacral
A maior parte dos endoscopistas queixava-se de moderada ou forte dor nas costas após um dia de realização de procedimentos, pelo resultado de trauma contínuo ou repetitivo na coluna lombo-sacral, especialmente pelo longo período em pé.
A maioria dos endoscopistas contorce seus corpos e costas de acordo com as exigências de se levantar e trabalhar em posições inadequadas, sendo que em alguns exames, como a colangiopancreatografia retrógrada endoscópica, por exemplo, é obrigatório o uso de um pesado e desconfortável avental de chumbo.
Essas ações resultaram em algumas complicações, como a hérnia de disco em uma pequena porcentagem dos endoscopistas estudados.
Síndrome do polegar do endoscopista
A lesão conhecida como “polegar do endoscopista” – ou Síndrome de De Quervain (tenossinovite ou um espessamento inflamatório da bainha tendínea do extensor curto e abdutor longo do polegar) – foi relatada por muitos desses profissionais como uma das lesões mais comuns que os acometem, pois resulta do uso repetitivo do polegar esquerdo, que é essencial para girar as manoplas que controlam a angulação da ponta distal do endoscópio. É possível usar a técnica de duas mãos para evitar essa lesão, mas não é tão eficiente quanto a técnica de um polegar.
Ferimento do punho e mão
A lesão mais comum que afeta o punho ou a mão é a síndrome do túnel do carpo, a qual foi relatada por acometer médicos endoscopistas devido ao resultado de rotação repetitiva e torque do punho e da mão durante os procedimentos.
Lesões nos quadris, joelhos, pernas e pés
Devido ao longo tempo em pé gasto pelos endoscopistas durante os procedimentos, os mesmos relataram contorcer seus corpos, correndo o risco de ferir o sistema musculoesquelético de suporte.
Ao ferir as costas, os profissionais tentam mudar a posição para aliviar o desconforto e, ao fazê-lo, pode ocorrer inflamação, transferindo a lesão para quadris, joelhos, pernas e pés.
Dor nas pernas e nos pés
A maior parte das dores nas pernas apresentada pelos endoscopistas é transferida da dor nas costas ou quadris, sendo que a permanência por longos períodos em pé pode predispor à flebite e à fasceíte plantar.
O que fazer para evitar essas lesões?
Para otimizar a ergonomia na endoscopia, os artigos estudados recomendam:
- Os principais determinantes das posturas da parte superior do corpo são a localização do paciente, colocação do equipamento que vai ser utilizado e localização do monitor;
- Em todos exames endoscópicos, o posicionamento do monitor é um importante determinante da postura do tronco e cabeça. Os monitores devem ser colocados em frente ao endoscopista, para evitar rotação e flexão da coluna cervical e devem ser ajustáveis ao nível dos olhos. Com isto, percebeu que a colocação do monitor diretamente em frente ao endoscopista atinge uma postura neutra do pescoço e minimiza a rotação cervical;
O conjunto de endoscopia deve ser configurado com o monitor posicionado diretamente em frente ao endoscopista enquanto a endoscopia é realizada. A altura do monitor deve estar logo abaixo do nível dos olhos, com um ângulo de visão ideal de 15 a 25 graus abaixo do horizonte dos olhos, com uma distância de visualização de 52 cm a 182 cm, dependendo do tamanho do monitor e da preferência do endoscopista. Para acomodar o quinto percentil feminino à altura do 95º percentil do olho masculino, a altura do monitor deve ser ajustável de 93 cm a 162 cm.
Altura ideal do leito
A mesa de exame deve estar na altura do cotovelo ou abaixo dele (0-10 cm abaixo do cotovelo). Para acomodar o 5º percentil feminino ao percentil 95º da altura do cotovelo masculino, a altura da mesa de exame deve ser ajustável de 85 cm a 120 cm.
Os aparelhos utilizados pelos médicos endoscopistas devem ser feitos para facilitar o direcionamento e serem mais confortáveis para esses profissionais, devido a uma seção de controle mais leve, ao torque de angulação reduzido e ao melhor controle da ergonomia corporal. Devem integrar os avanços ergonômicos e tecnológicos de imagem para que os médicos tenham um melhor manuseio e operação por meio de um sistema completamente reprojetado, bem como uma tela de imagem para visualização de alta qualidade.
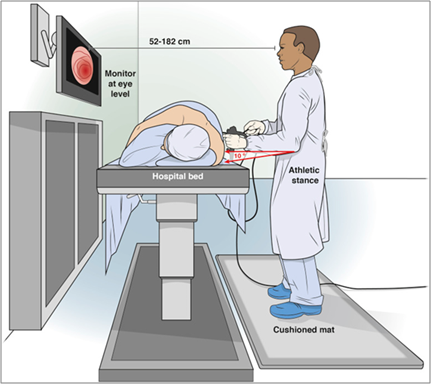
Sala ergonomicamente correta. Fonte: Singa et al., 2018
Medidas gerais
- Fazer pequenas pausas e alongamentos simples após término de procedimentos prolongados;
- Existem algumas técnicas para otimizar a ergonomia após e entre os exames endoscópicos, como: exercícios das mãos, punho, cotovelo, ombros, costas e pescoço com objetivo de prevenir lesões relacionadas a longos e/ou difíceis procedimentos;
- Usar sapatos confortáveis;
- Fazer exercícios físicos regularmente;
- Ter alimentação saudável;
- Se comportar como um “Endo atleta”, segundo o mais recente artigo sobre o tema (Singla M, Kwok RM, Deriban G, Young PE. Training the endo-athlete: an update in ergonomics in endoscopy. Clin Gastroenterol Hepatol. 2018;16(7):1003-6.).
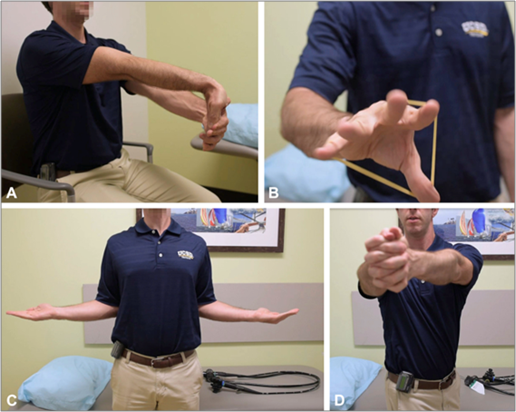
A: alongamento de pulso. B: exercícios de fortalecimento para os músculos extensores dos dedos. C: alongamento do ombro. D: alongamento de costas.Fonte: Chang et al., 2017
Embora tenha havido avanços substanciais na tecnologia de imagem endoscópica, o processo de rotação do endoscópio e a deflexão da ponta pouco mudaram desde o desenvolvimento da endoscopia flexível.
Numerosas pesquisas estão em processo sobre novos dispositivos projetados para examinar e administrar novos tratamentos ao trato digestivo. Esses dispositivos podem diminuir o risco de lesão em um endoscopista por meio do uso de melhores princípios ergonômicos.
Uma solução proposta é o uso de um sistema com plataforma de controle do tipo joystick, usando assistência eletromecânica – em oposição à força mecânica pura – para transmitir energia ao eixo do instrumento. Tais tecnologias têm o potencial de diminuir as lesões pela diminuição da carga. Embora interessante e potencialmente útil, nenhum dos produtos está atualmente disponível para uso, nem mesmo nos Estados Unidos.
O artigo mais recente, de 2018, informa que devemos tratar nossos corpos como os atletas profissionais fazem: manter boa forma, incentivar os colegas a observar e fornecer feedback sobre nossas ações, otimizar nossas instalações de prática e alongar nossos músculos.
No futuro, as inovações tecnológicas prometem reduzir os estresses físicos inerentes ao trabalho do médico endoscopista, podendo preservar nossa própria saúde e continuar a melhorar a saúde dos nossos pacientes.
Resumo das medidas essenciais para melhoria do local de trabalho do médico endoscopista e prevenção das lesões:
- O monitor de vídeo deve estar posicionado preferencialmente em frente ao endoscopista durante a realização do exame;
- A altura do monitor deve estar logo abaixo do nível do olho, com um ângulo de visão ideal de 15 a 25 graus abaixo do horizonte dos olhos, com uma distância de visão de 52 cm a 182 cm. Para acomodar o percentil feminino à altura do percentil do olho masculino, a altura do monitor deve ser ajustável entre 93 cm a 162 cm. A mesa de exame deve estar abaixo da altura do cotovelo;
- Durante o CPRE, um avental mais adequado deve ser usado para reduzir as cargas na parte superior das costas e na coluna cervical;
- O tempo de recuperação do profissional entre os exames é muito importante;
- Uma pausa na endoscopia, preferencialmente com alongamento, é muito importante, pois permite que os grupos musculares descansem durante um ciclo de trabalho de endoscopia.
É necessária a realização de novos estudos que proporcionem um ambiente seguro, tanto no projeto da estação de trabalho como na melhoria dos aparelhos endoscópicos com objetivo de minimizar e evitar dores e lesões ocupacionais, o que pode ter um efeito prejudicial à saúde, à produtividade e à carreira desses profissionais.
Portanto, para um médico endoscopista que espera trabalhar por muitos anos, a compreensão sobre ergonomia e a prevenção de lesões são essenciais e devem ser integradas nessa profissão desde a residência e praticadas diariamente.
Como citar este artigo:
Dragojevic PR. As principais lesões musculoesqueléticas que acometem os médicos endoscopistas e a importância da correta ergonomia em seu ambiente de trabalho. Endoscopia Terapêutica; 2021. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/as-principais-lesoes-musculoesqueleticas-que-acometem-os-medicos-endoscopistas-e-importancia-da-correta-ergonomia-em-seu-ambiente-de-trabalho/
Para saber mais:
- ASGE Technology Committee, Pedrosa MC, Farraye FA, Shergill AK, Banerjee S, Desilets D, Diehl DL, Kaul V, Kwon RS, Mamula P, Rodriguez SA, Varadarajulu S, Song LM, Tierney WM. Minimizing occupational hazards in endoscopy: personal protective equipment, radiation safety, and ergonomics. Gastrointest Endosc. 2010;72(2):227-35.
Acesse o Endoscopia Terapêutica para tomar contato com mais artigos comentados, assuntos gerais, casos clínicos, quizzes, classificações e mais!
*Post editado pelo Dr Gerson Brasil