Recanalização guiada por ecoendoscopia de estenose total de anastomose pancreaticojejunal pós duodenopancreatectomia
A duodenopancreatectomia é uma técnica cirúrgica que consiste da ressecção da cabeça pancreática, e, por questões anatômicas, ela necessariamente envolve também o colédoco distal e toda a topografia da segunda porção duodenal. Essa técnica é frequentemente utilizada para tratamento de lesões no território da cabeça pancreática, papila duodenal maior ou segunda porção duodenal. Ela requer uma reconstrução do coto do ducto pancreático principal remanescente (corpo e cauda pancreáticos), usualmente através de uma anastomose com o jejuno (anastomose pancreaticojejunal).
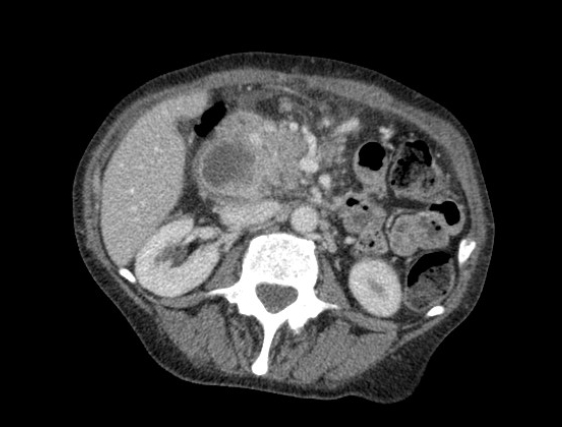
A cirurgia pode ter como efeito tardio uma estenose da anastomose pancreaticojejunal. A estenose é clinicamente significativa quando ela determina estase e/ou aumento da pressão intraductal pancreática, sendo estimada em até 2-10% dos casos[1] [2]. A estenose ductal pancreática pode resultar em alterações similares às observadas em pancreatite crônica, como dilatação ductal, formação de debris ou litíase ductal e alterações do parênquima pancreático. Clinicamente, ela pode manifestar-se com insuficiência pancreatica exócrina, surtos de pancreatite e dor abdominal crônica.
O tratamento da estenose ductal pós duodenopancreatectomia está indicado na presença de sintomas recorrentes ou refratários a tratamento clínico, e invariavelmente envolve descompressão ductal pancreática. Essa descompressão é tradicionalmente obtida por anastomose pancreatojejunal longitudinal por via cirúrgica por laparotomia. Alternativamente, a descompressão pode ser obtida através de técnicas minimamente invasivas envolvendo dilatação da estenose e/ou colocação de prótese pancreática, sendo essa possível por via radiológica, endoscópica, ou combinadas (rendez-vous).
Dentre essas técnicas, a endoscópica guiada por ecoendoscopia vem se destacando com diversas variações técnicas descritas[4] e sucesso técnico próximo de 70%[5] [6]. A vantagem em relação aos outros métodos minimamente invasivos é um acesso através de punção facilitado ao ducto pancreático (este usualmente dilatado) e com mínima interposição tecidual (interposição apenas da parede gástrica). As desvantagens seriam sua baixa disponibilidade e a necessidade de se criar um trajeto pancreato-gástrico. Os pontos controversos são seus resultados clínicos a longo prazo, comparados ou não à cirurgia, e manutenção do trajeto pancreatogástrico. Embora a taxa de sucesso clinico com o método tem sido descrito em torno de 80% (seguimento médio de 2 anos)6, esses dados são escassos na literatura, e tais questões serão difíceis de respondê-las devido à raridade dessa condição.
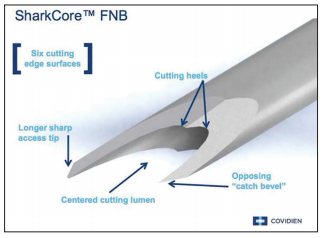
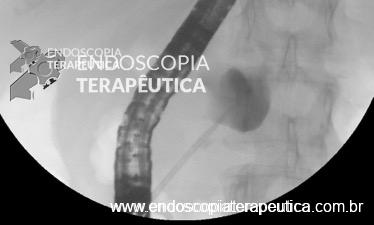
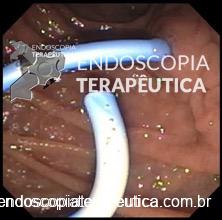
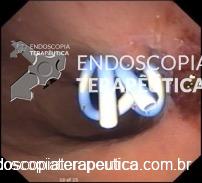
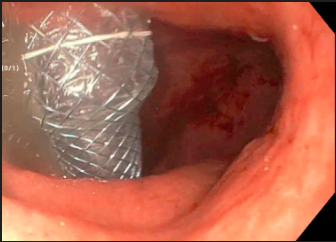
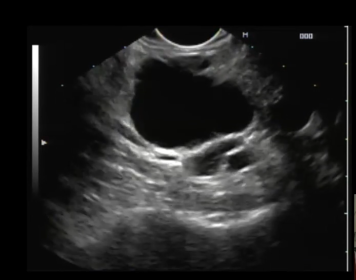
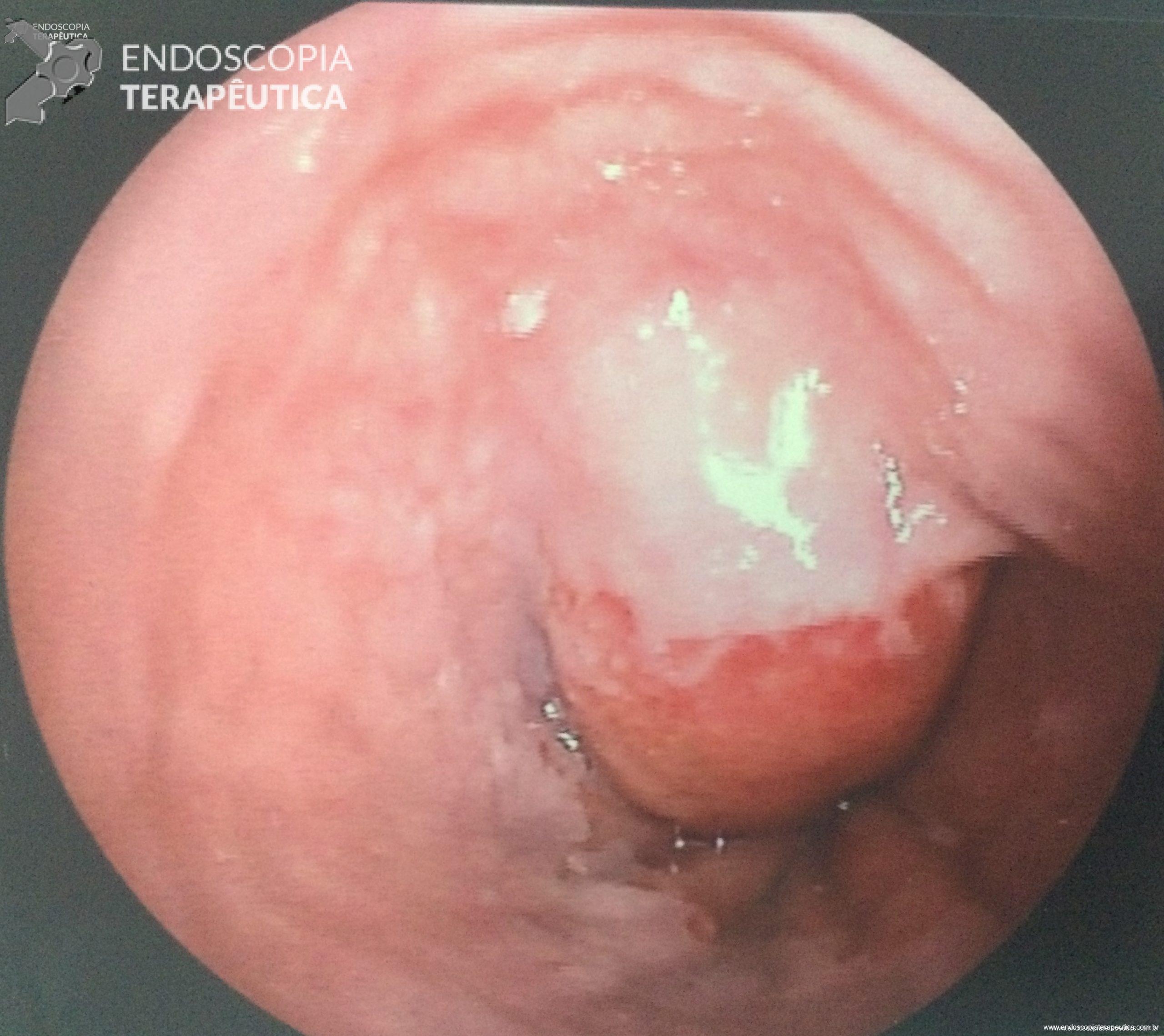
A técnica anterógrada transgástrica guiada por ecoendoscopia consiste de punção transgástrica, seguida de acesso, instrumentação e manipulação ductal pancreática guiada por ecoendoscopia e fluoroscopia. O ducto pancreático é identificado ao ultrassom e acessado em sua porção mais próxima à parede gástrica, usualmente ao nível do corpo pancreático junto à transição corpo-caudal. Durante a punção, a angulação da agulha deve ser obliqua a permitir injeção de contraste e passagem de um fio guia por via anterógrada em direção à anastomose pancreaticojejunal. Com o fio-guia, tenta-se atravessar a estenose e acessar a alça jejunal. Em seguida, dilata-se o local da punção – interface da parede gástrica-parênquima pancreático (trajeto pancreato-gástrico). Através do trajeto pancreato-gástrico obtido é possível instrumentação, resultando em dilatação da anastomose, remoção de cálculos e passagem de prótese pancreática para manutenção do trajeto pancreato-gástrico. Mesmo na vigência de uma estenose total da anastomose pancreaticojejunal, uma punção através da mesma por via anterógrada intraductal pode ser realizada, resultando em recanalização ductal pancreática e permitindo a passagem de fio guia e subsequentes manipulações.
CASO CLÍNICO:
REFERÊNCIAS
[1] Aram N Demirjian, Tara S Kent, Mark P Callery, Charles M Vollmer. The inconsistent nature of symptomatic pancreatico-jejunostomy anastomotic strictures. HPB (Oxford). 2010 Sep; 12(7): 482–487. doi: 10.1111/j.1477-2574.2010.00214.x
[2] Morgan KA, Fontenot BB, Harvey NR, Adams DB. Revision of anastomotic stenosis after pancreatic head resection for chronic pancreatitis: is it futile?
HPB (Oxford). 2010 Apr;12(3):211-6. doi: 10.1111/j.1477-2574.2009.00154.x.
[3] Kim EY, Hong TH. Laparoscopic Longitudinal Pancreaticojejunostomy Using Barbed Sutures: an Efficient and Secure Solution for Pancreatic Duct Obstructions in Patients with Chronic Pancreatitis. J Gastrointest Surg. 2016 Apr;20(4):861-6. doi: 10.1007/s11605-015-3053-3. Epub 2015 Dec 21.
[4] Ota Y, Kikuyama M, Suzuki S, Nakahodo J, Koide S. Percutaneous pancreatic-duct puncture with rendezvous technique can treat stenotic pancreaticojejunostomy. Dig Endosc. 2010 Jul;22(3):228-31. doi: 10.1111/j.1443-1661.2010.00990.x.
[5] Chapman CG, Waxman I, Siddiqui UD. Endoscopic Ultrasound (EUS)-Guided Pancreatic Duct Drainage: The Basics of When and How to Perform EUS-Guided Pancreatic Duct Interventions. Clin Endosc. 2016 Mar;49(2):161-7. doi: 10.5946/ce.2016.011. Epub 2016 Mar 25.
[6] Fujii LL, Topazian MD, Abu Dayyeh BK, Baron TH, Chari ST, Farnell MB, Gleeson FC, Gostout CJ, Kendrick ML, Pearson RK, Petersen BT, Truty MJ, Vege SS, Levy MJ. EUS-guided pancreatic duct intervention: outcomes of a single tertiary-care referral center experience. Gastrointest Endosc. 2013 Dec;78(6):854-864.e1. doi: 10.1016/j.gie.2013.05.016.