Introdução
A endometriose é uma doença ginecológica benigna definida pela presença de glândulas endometriais fora da cavidade uterina. É frequentemente diagnosticada na terceira década de vida, afetando 10 a 12% das mulheres em idade reprodutiva.
A sua etiologia ainda hoje é discutida, e a teoria mais popular é a da menstruação retrógrada. Durante a menstruação células endometriais migram através das trompas de Falópio para o peritônio e ali crescem sob a influência de fatores hormonais. Outras teorias consistem na transformação de células de outras topografias em células endometriais através de diferentes meios (metaplasia, células tronco).
A endometriose profunda é definida como a invasão subperitoneal com profundidade maior que 5 mm, sendo o intestino o órgão extragenital mais acometido, apresentando de 5 a 12% de prevalência nas mulheres com endometriose. A topografia é em 90% dos casos em cólon sigmoide e reto. Embora o envolvimento intestinal isolado possa ser observado, cerca de 50 % dos pacientes com doença no reto apresenta acometimento em outros locais. Curiosamente, em aproximadamente 30% dos casos com envolvimento de retossigmoide, o cólon direito também é acometido.
Sintomas
Os sintomas da endometriose intestinal podem ser inespecíficos como dismenorreia, dispareunia e dor pélvica crônica. Sintomas intestinais mais específicos, como diarreia, constipação, sangue nas fezes, distensão abdominal, disquezia e raramente obstrução intestinal, também podem ocorrer. No entanto, quaisquer sintomas pélvicos, especificamente de natureza cíclica, devem levantar a suspeita de endometriose.
Além disso, pacientes com endometriose frequentemente apresentam comorbidades psicopatológicas significativas, como ansiedade e depressão, que muitas vezes podem potencializar a gravidade da dor experimentada.
Diagnóstico
- Exame físico : através do toque pélvico bimanual é frequentemente útil no diagnóstico, especialmente se realizado no momento da menstruação, período em que as lesões podem estar mais inflamadas, sensíveis e palpáveis.
- Ultrassom transvaginal: exame de escolha como avaliação inicial, permite descrever tamanho, localização, distância da borda anal, profundidade e número de nódulos. Endometriomas se demonstram como imagens hipoecoicas que envolvem a parede intestinal a partir da serosa, podendo se estender para a muscular própria e a submucosa e raramente a mucosa (5% dos casos de endometriose intestinal). No entanto a limitação dessa técnica consiste em lesões no sigmoide, pois geralmente estão fora do campo de visão.
- Ultrassom retal: é considerado o teste de escolha para avaliar lesões que infiltram a parede intestinal com alta acurácia na determinação de profundidade, além da possibilidade de confirmação histológica através da punção. Outra importante função deste método é no diagnóstico diferencial de lesões subepiteliais. A endometriose quase sempre acomete mais de uma camada, especialmente a serosa e raramente acomete a camada mucosa. Demais lesões subepiteliais primárias da parede intestinal costumam ser restritas a apenas uma camada.
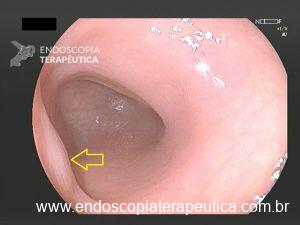
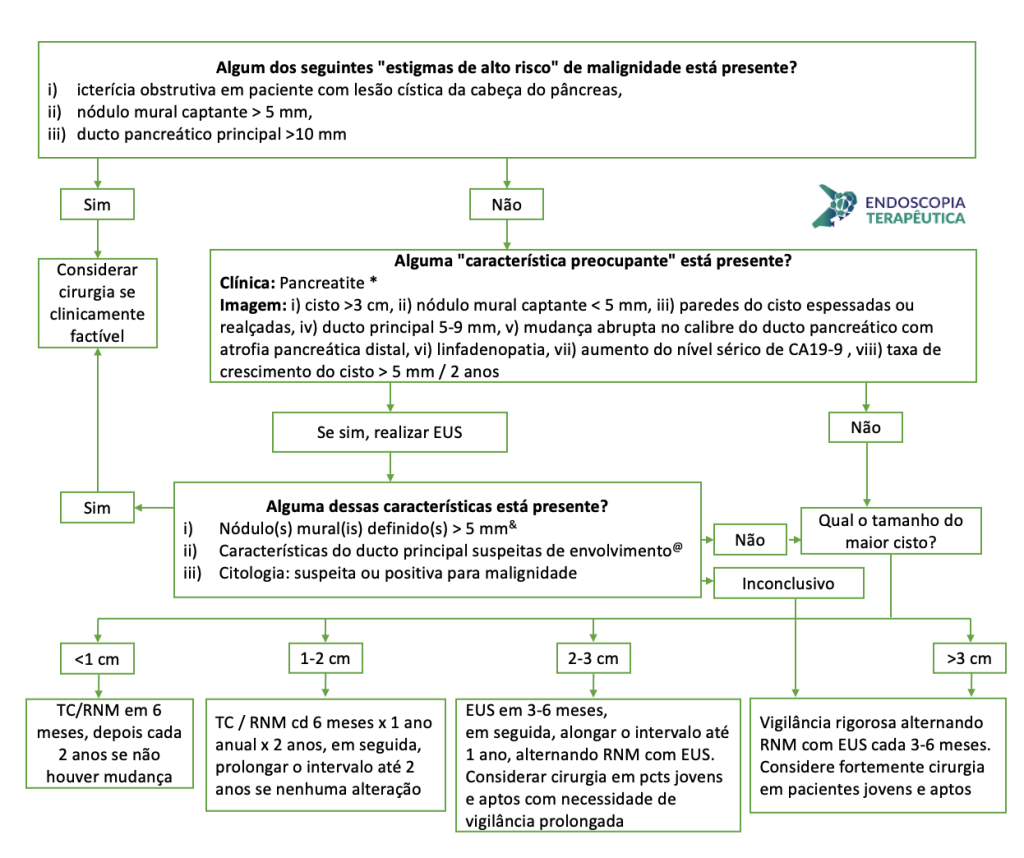
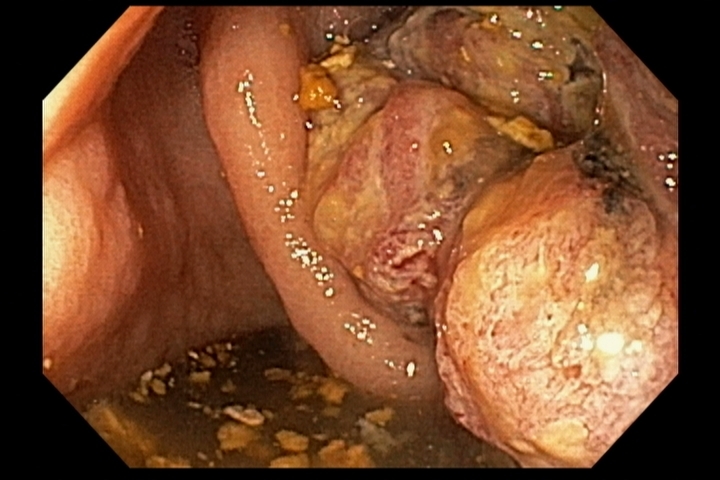
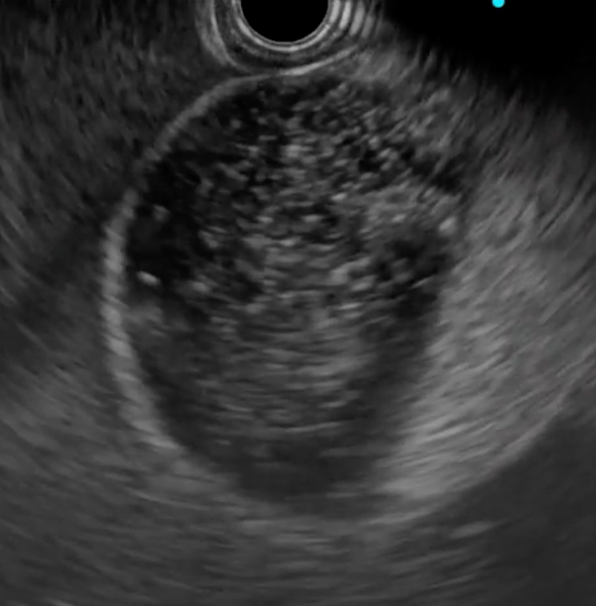
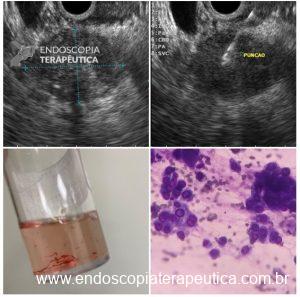
Figura 1: Paciente com endometriose e abaulamento submumoso em cólon sigmoide
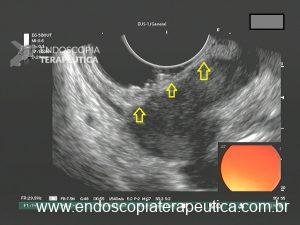
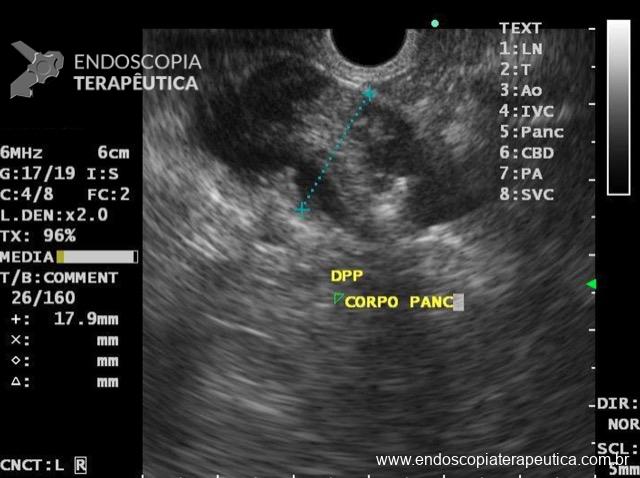
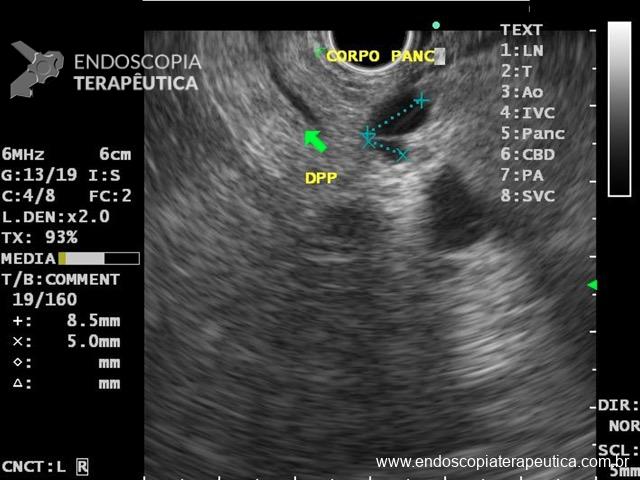
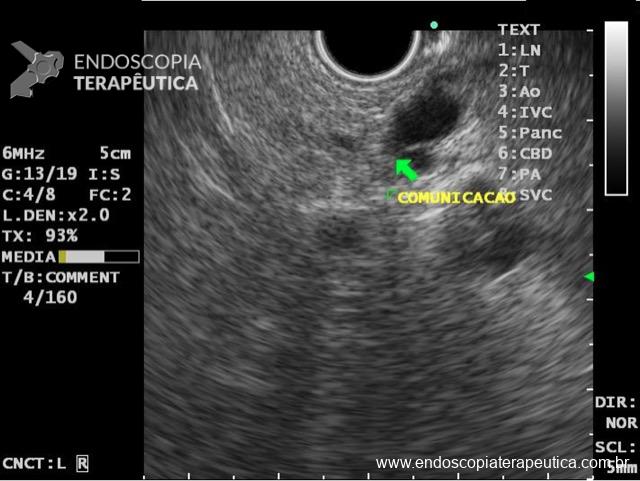
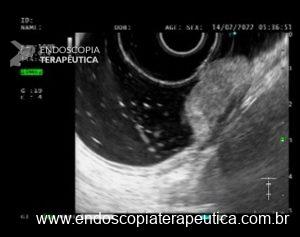
Figura 2: Ecoendoscopia demonstrando invasão maciça de imagem hipoecoica em submucosa de cólon
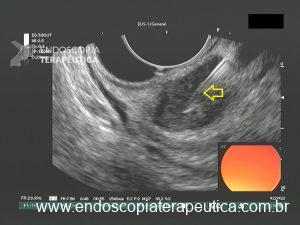
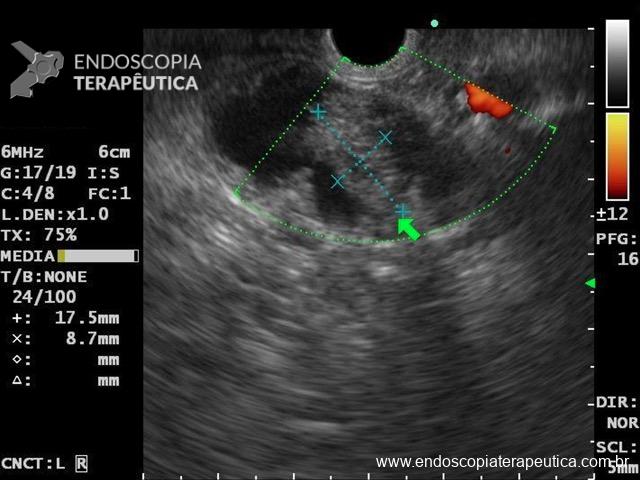
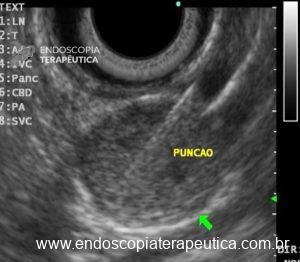
Figura 3: Punção ecoguiada de imagem hipoecoica
- Colonoscopia: fornece sinais específicos em apenas 4% dos casos de endometriose profunda, se demonstra como lesões subepiteliais e eventualmente com mucosa apresentando edema, enantema, friabilidade, irregularidade de superfície ou mesmos quadros de estenoses. Apesar baixa sensibilidade (7%) desse exame para o diagnóstico de endometriose, a colonoscopia possibilita investigação de outras doenças que podem levar a sintomas atribuídos a endometriose.
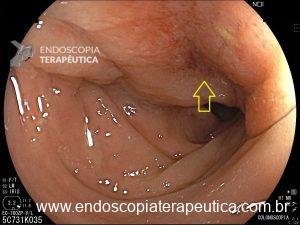
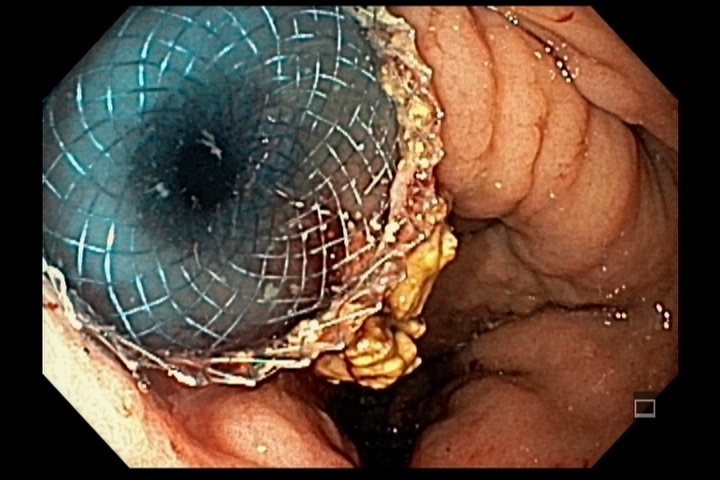
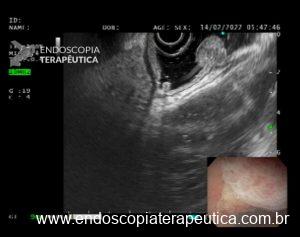
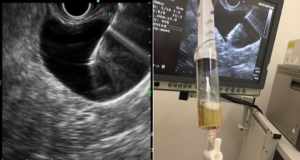
Figura 4: Endometriose profunda causando redução da luz em cólon sigmoide. Imagem cedida pela Dra Renata Nobre Moura.
- Ressonância: altamente eficiente e acurada, apresenta melhor resolução entre as estruturas e maior campo de visão. Esta técnica é cada vez mais utilizada nos casos em que o ultrassom apresenta dúvidas, na suspeita acometimento profundo da pelve ou quando há programação cirúrgica.
Tratamento
Como tratamento medicamentoso de primeira linha estão as combinações estroprogestogênicas, progestogênios isolados e análogos do hormônio liberador de gonadotrofina, sendo muito úteis também na prevenção de recorrência pós-operatória da doença. Em um estudo de pacientes utilizando o tratamento medicamentoso, foi observada uma diminuição de 53% dos sintomas gastrointestinais. Entretanto após 12 meses, 33% optaram pelo tratamento cirúrgico devido aos sintomas persistentes.
O exame padrão ouro no diagnóstico da endometriose é a laparoscopia, sendo também o método de escolha para o tratamento cirúrgico da endometriose pélvica sintomática. Dessa forma uma avaliação pré-operatória com os exames citados acima, é crucial para o manejo da doença, sendo que na presença de lesões intestinais ou no sistema urinário, um cirurgião especialista é altamente recomendado.
O tratamento cirúrgico é indicado nos pacientes que não respondem ao tratamento medicamentoso, e deve-se ser realizado preferencialmente de forma conservadora, com exceção dos casos estenose intestinal, uretral ou massas de características duvidosas, onde a remoção radical deve ser indicada.
Pontos chave Endometriose Intestinal
– 10 a 12% das mulheres (faixa etária 30 anos)
– patogênese: teoria da menstruação
– 5 a 12% acometimento intestinal
– 90% cólon e reto
– assintomática, inespecífico ou sintomas cíclicos
– exame físico: toque bimanual
– ultrassom transvaginal: exame inicial, limitação para cólon sigmoide
– ultrassom retal: confirmação de acometimento intestinal e diagnóstico diferencial de lesões subepiteliais
– ressonância: avaliação geral de endometriose profunda
– colonoscopia: lesões subepitelais e investigação sintomas paralelos
– tratamento medicamentoso: primeira escolha
– tratamento cirúrgico: laparoscopia, conservador quando possível
Referências
Nezhat C, Li A, Falik R, Copeland D, Razavi G, Shakib A, Mihailide C, Bamford H, DiFrancesco L, Tazuke S, Ghanouni P, Rivas H, Nezhat A, Nezhat C, Nezhat F. Bowel endometriosis: diagnosis and management. Am J Obstet Gynecol. 2018 Jun;218(6):549-562. doi: 10.1016/j.ajog.2017.09.023. Epub 2017 Oct 13. PMID: 29032051.
Habib N, Centini G, Lazzeri L, Amoruso N, El Khoury L, Zupi E, Afors K. Bowel Endometriosis: Current Perspectives on Diagnosis and Treatment. Int J Womens Health. 2020 Jan 29;12:35-47. doi: 10.2147/IJWH.S190326. PMID: 32099483; PMCID: PMC6996110.
Rossini LG, Ribeiro PA, Rodrigues FC, Filippi SS, Zago Rde R, Schneider NC, Okawa L, Klug WA. Transrectal ultrasound – Techniques and outcomes in the management of intestinal endometriosis. Endosc Ultrasound. 2012 Apr;1(1):23-35. doi: 10.7178/eus.01.005. PMID: 24949332; PMCID: PMC4062201.
Bourgioti C, Preza O, Panourgias E, Chatoupis K, Antoniou A, Nikolaidou ME, Moulopoulos LA. MR imaging of endometriosis: Spectrum of disease. Diagn Interv Imaging. 2017 Nov;98(11):751-767. doi: 10.1016/j.diii.2017.05.009. Epub 2017 Jun 23. PMID: 28652096.
Colaiacovo R, Carbonari A, Ganc R, de Paulo G, Ferrari A. Bowel endometriosis mimicking gastrointestinal stromal tumor and diagnosed by endoscopic ultrasound. Endoscopy. 2014;46 Suppl 1 UCTN:E433-4. doi: 10.1055/s-0034-1377429. Epub 2014 Oct 14. PMID: 25314180.
Nácul, Andrea Prestes e Spritzer, Poli MaraAspectos atuais do diagnóstico e tratamento da endometriose. Revista Brasileira de Ginecologia e Obstetrícia [online]. 2010, v. 32, n. 6 [Acessado 3 Abril 2022] , pp. 298-307. Disponível em: <https://doi.org/10.1590/S0100-72032010000600008>. Epub 28 Set 2010. ISSN 1806-9339. https://doi.org/10.1590/S0100-72032010000600008.
Milone, M., Mollo, A., Musella, M., Maietta, P., Sosa Fernandez, L. M., Shatalova, O., Conforti, A., Barone, G., De Placido, G., & Milone, F. (2015). Role of colonoscopy in the diagnostic work-up of bowel endometriosis. World journal of gastroenterology, 21(16), 4997–5001. https://doi.org/10.3748/wjg.v21.i16.4997