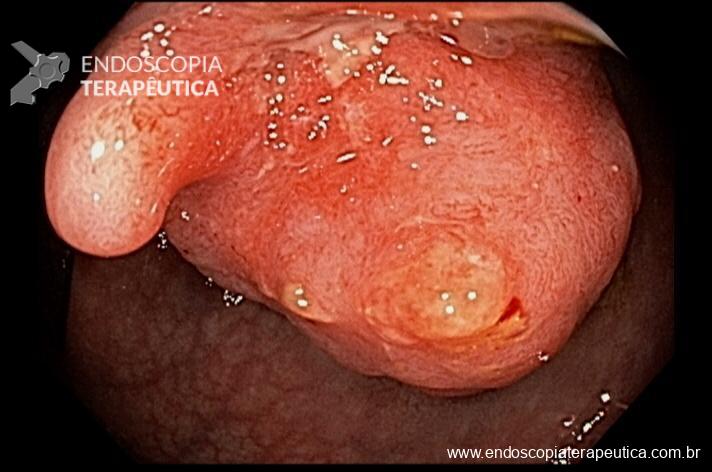
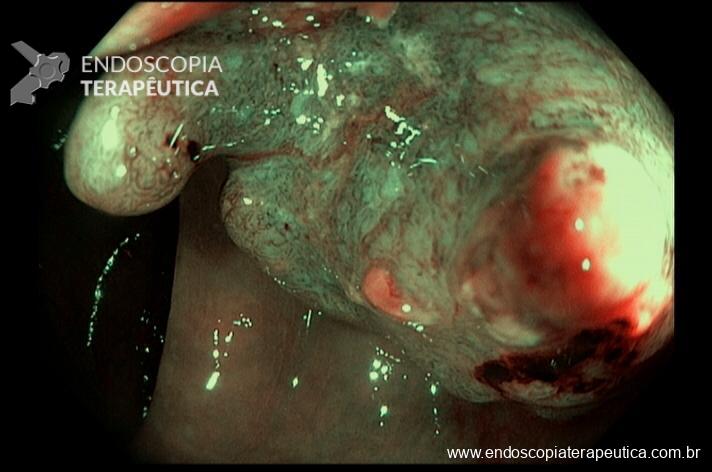
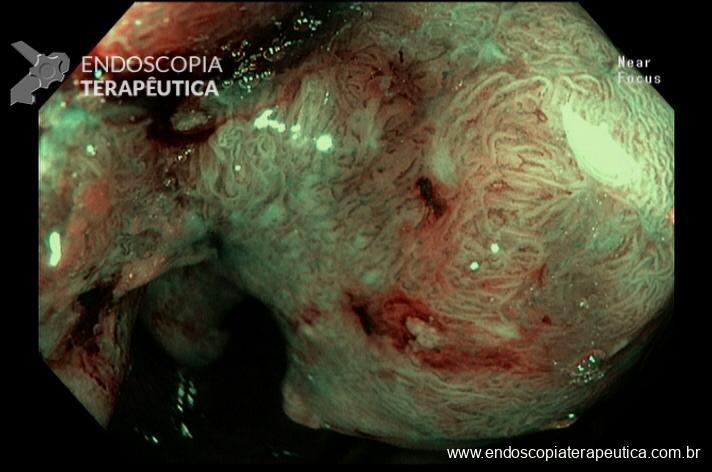
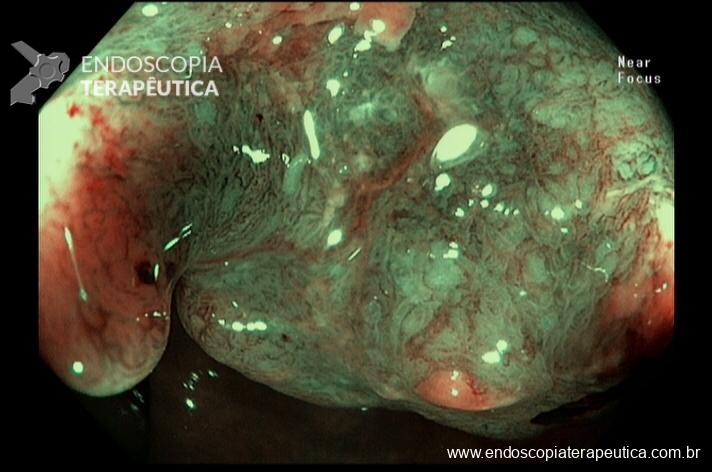
A ADR (taxa de detecção de adenoma) é um dos principais indicadores de qualidade em colonoscopia pois está inversamente correlacionada ao risco de desenvolvimento de câncer colorretal de intervalo. Muitos artigos e esforços têm tentado encontrar caminhos para aumentar a frequência com que encontramos essas lesões. De fato, é difícil imaginar que fatores não ligados diretamente à execução do exame, não interfiram de alguma forma no yield do procedimento.
Já são conhecidos fatores ligados ao paciente (qualidade do preparo, gênero), ao examinador (experiência, conhecimento, técnica e tempo de retirada, fadiga) e ao equipamento (alta resolução, campo de visão), como interferentes na ADR. Alguns autores estão ampliando o olhar para outros elementos que possam interferir no indicador.
Pensando assim, pesquisadores do Massachusetts General Hospital e da Columbia University avaliaram o efeito das dimensões do monitor na visibilização da mucosa e, como consequência, na ADR, com a hipótese de que monitores maiores poderiam melhorar o indicador.
O estudo foi feito em um único centro, com inclusão de todos os pacientes atendidos ambulatorialmente durante o período do estudo, num total de 1795 pacientes. Caso o paciente tivesse mais de um exame, apenas o primeiro foi levado em conta. A maior parte dos pacientes faziam exame de screening (57%), e tinham boas/excelentes condições de preparo (93%, escala de Aronchick modificada) Todos os dias, os médicos eram aleatoriamente encaminhados a duas salas de exame. Em uma das salas era usado um monitor padrão de 19 polegadas (1280×1024) e na outra um monitor de 32 polegadas (1920×1080). Além das dimensões dos monitores, não houve qualquer mudança na rotina dos procedimentos e a distância entre a tela e o examinador era de 1,20 m. A tabela 1 traz mais detalhes sobre os monitores.
Foi definida como desfecho primário a comparação entre as ADRs obtidas nos dois grupos. Como desfechos secundários, foram observadas as ADRs específicas de cada médico, bem como as taxa de detecção de pólipos global e individuais (PDR).
Tabela 1 – Especificações dos monitores usados no estudo.
| Size |
Model |
Technology |
Resolution |
Pixel pitch |
Viewing angle |
Contrast ratio |
| 19-inch |
SC-SX19- A1A11 |
active matrix with in-plane switching |
1280x 1024 |
.294 mm |
178- degree |
600:1 |
| 32-inch |
SC-WU32-A1A11 |
active matrix thin-film-transistor screen with lightemitting diode backlight |
1920×1080 |
.364 mm |
178-degree |
3000:1 |
Como vemos, embora fosse, até certo ponto, intuitivo imaginar que uma maior amplitude da imagem pudesse favorecer a detecção de lesões, isso não foi demonstrado no estudo. A única exceção parece ser que o uso de um monitor maior foi associado estatisticamente ao aumento na detecção de pólipos por endoscopistas com menor PDR basal (PDR < 35%, P=.04).
A tabela 2 sumariza os achados do estudo.
Tabela 2 – Achados e estatística dos resultados.
|
19”
(n-905) |
32”
(n=890) |
P |
| Qualquer lesão polipoide |
297 (32.8) |
306 (34.4) |
.50 |
| Adenoma |
248 (27.4) |
248 (27.9) |
.80 |
| Polipos hiperplásicos |
80 (8.8) |
83 (9.3) |
.60 |
| Outras benignas |
52 (5.8) |
39 (4.4) |
.26 |
| Câncer colorretal |
8 (.9) |
8 (.9) |
.98 |
Os autores comentam que não foram consideradas outras variáveis como tempo de retirada e ponderam que as maiores dimensões do monitor possam trazer outros benefícios que não o aumento da ADR.
Ok, parece que trocar de monitor não vai ajudar muito. E se a gente caprichasse na sedação e deixasse o paciente sempre quietinho, sem interferir na paz do exame?
Existem evidências de que o exame com sedação moderada não é superior em ADR e PDR quando comparado a exames sem sedação. Será que o mesmo ocorre ao se comparar sedação com benzodiazepínicos e opióides versus sedação profunda com propofol?
Com essa pergunta e de olho no uso crescente de propofol em exames de screening, um grupo da Universidade do Missouri comparou retrospectivamente estes indicadores em colonoscopias índice conduzidas com os dois modelos de sedação, em períodos não coincidentes. No total, foram 338 pacientes no grupo de sedação moderada e 247 receberam sedação profunda. Nenhuma diferença estatística foi observada entre os grupos, quanto à ADR ou PDR, independente do gênero ou em avaliações de subgrupos. No passado, outros estudos falharam em demonstrar benefícios da sedação profunda na detecção de lesões, mas incluíam pacientes de perfil heterogêneo, o que poderia ter comprometido os resultados. Este estudo do Missouri seria o primeiro a considerar apenas colonoscopias índice e em pacientes ASA 1 e 2.
Ambos os trabalhos que eu trouxe aqui têm limitações de desenho, mas apontam para conclusões que reforçam a importância de um exame cuidadoso e atento, independente dos recursos tecnológicos que estejam ao dispor.
Referências
Impact of moderate versus deep sedation on adenoma detection rate in index average-risk screening colonoscopies.
Gastrointest Endosc. 2019 Sep;90(3):502-505. doi: 10.1016/j.gie.2019.05.011. Epub 2019 May 15.
PMID: 31102644 DOI: 10.1016/j.gie.2019.05.011
Effect of video monitor size on polyp detection: a prospective, randomized, controlled trial.
Gastrointest Endosc. 2019 Aug;90(2):254-258.e2. doi: 10.1016/j.gie.2019.03.1172. Epub 2019 Apr 12.
PMID: 30986402 DOI: 10.1016/j.gie.2019.03.1172