Pseudopólipos nas doenças inflamatórias intestinais
Definições e subtipos:
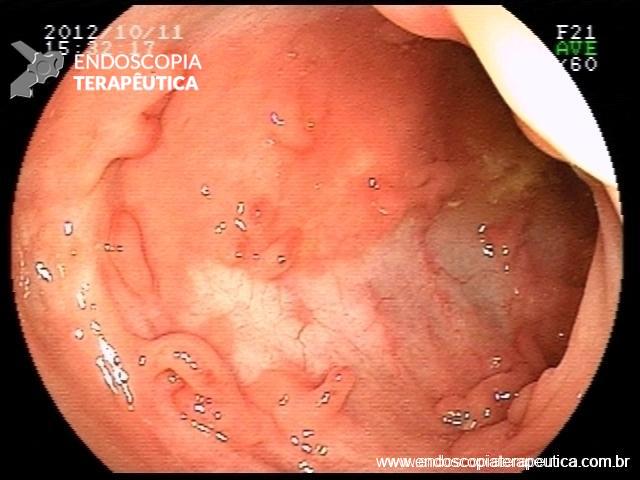
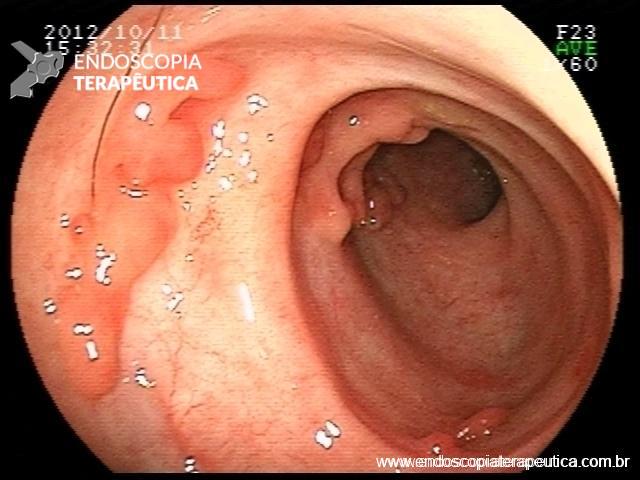
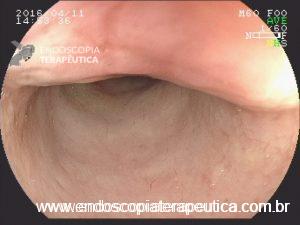
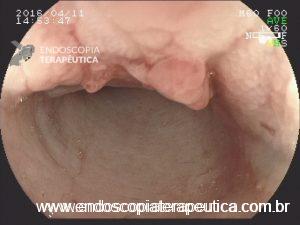
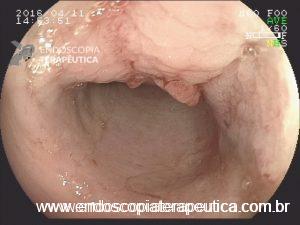
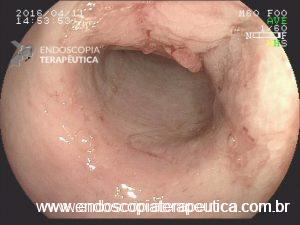
Os pseudopólipos são uma entidade bem descrita na evolução das doenças inflamatórias intestinais. Apesar de sua formação ainda não completamente entendida, são consideradas lesões não neoplasicas, originadas na mucosa em consequência de ciclos de inflamação e regeneração de epitélio ulcerado. Na literatura é possível distinguir três tipos principais:
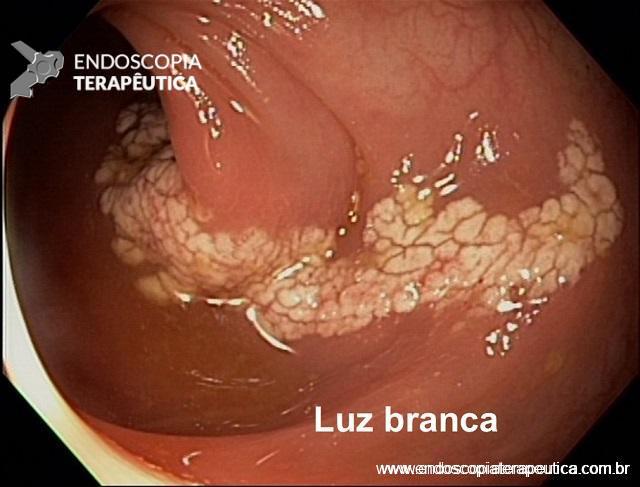
- Pseudopólipos: áreas de mucosa normal que entremeia área de inflamação grave
- Pólipos inflamatórios : devido inflamação da submucosa há maior infiltração da muscular da mucosa por células inflamatórias gerando tecido de granulação e subsequente pólipo
- Pólipos pós-inflamatórios : excessiva regeneração e reepitelização da área lesada (o que leva a formação do pólipo) associada a tração mecânica dessa região exercida pela passagem as fezes.
Morfologia :
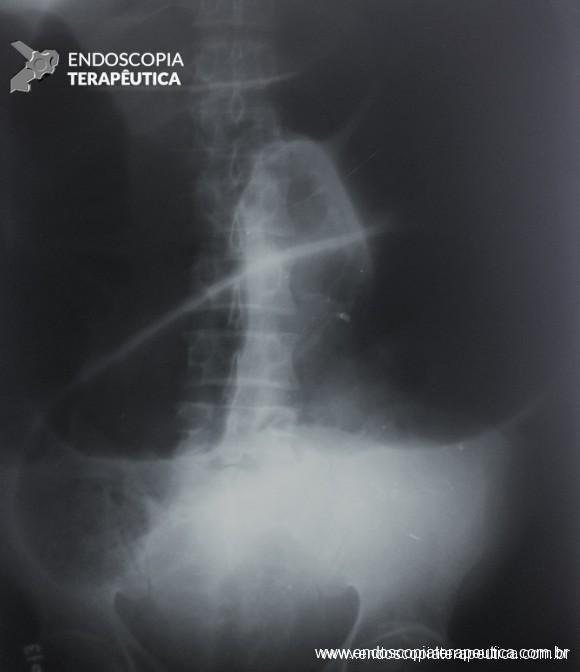
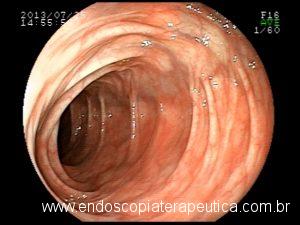
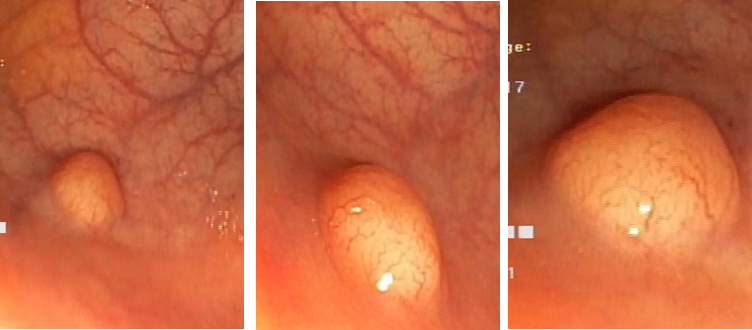
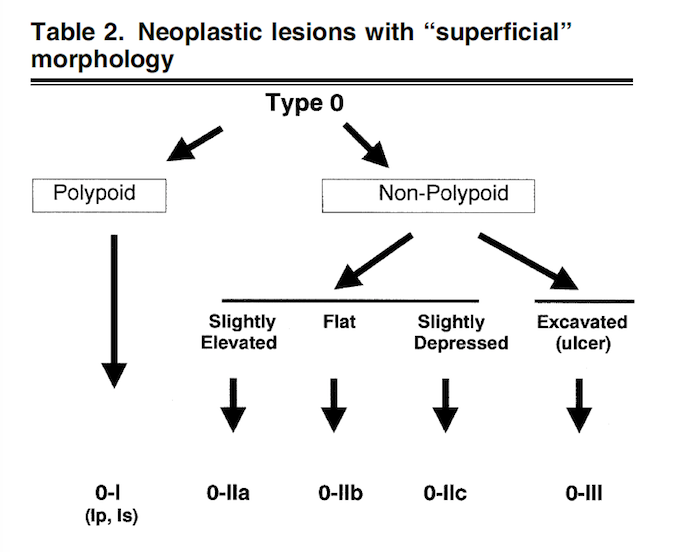
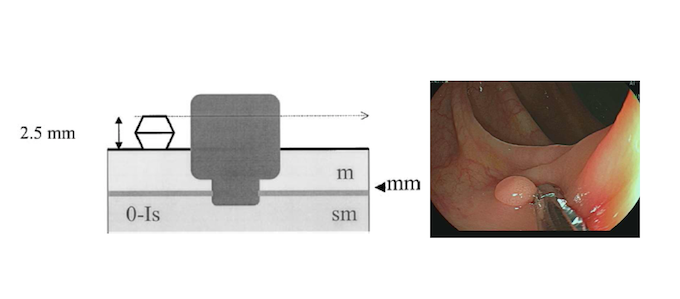
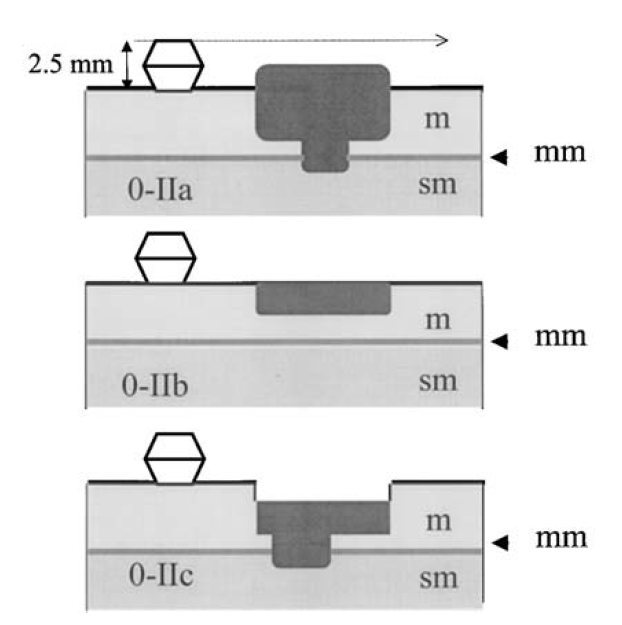
Apesar de processos de formação diferentes, tais entidades são compreendidas como uma só, e a nomenclatura é intercambiável na literatura. O formato dos pólipos pode variar (séssil ou pediculado), podendo ocorrer em vários tamanhos e números. Quando maior que 15 mm é chamado de pólipo gigante.
Há um formato em especial descrito como vermiforme ou filiforme onde se nota um alongamento sem uma “cabeça” como em um pólipo pediculado tradicional.
Localização e prevalência :
A prevalência não pode ser avaliada com exatidão, porém tem uma incidência estimada de 10 a 20% dos casos, mais comumente em pacientes com Retocolite Ulcerativa que em Doença de Crohn, sendo mais afetado o cólon transverso e esquerdo. Não há diferença entre os sexos, e o pico de idade é entre 30 e 40 anos. Há relatos de sítios extracolônicos, porém, são incomuns. Deve ser mencionada a possível presença desses pólipos no íleo terminal de paciente com retocolite ulcerativa, muito provavelmente pelo fenômeno de “ileite de refluxo”.
A presença dos pseudopólipos é um marcador de episódios anteriores de infamação importante, porém, não há como prever sua formação.
Risco de câncer e manejo :
A presença de pseudopólipos é considerado um fator de risco intermediário para o câncer colorretal, sendo indicada a vigilância endoscópica a cada três anos. Porém, a transformação de pseudopólipos para neoplasia é considerada evento raro, sendo que a possível explicação para o maior risco de neoplasia seja o fato de os pseudopólipos ocorrerem em paciente com episódios de colite intensa e extensa, esse, um fator já conhecido para neoplasia de cólon, associado também ao fato, de que a presença de inúmeros pseudopólipos podem dificultar a identificação dos verdadeiros adenomas.
Por fim, a conduta na presença dos pseudopólipos ainda não é consenso devido a falta de estudos sobre o assunto.
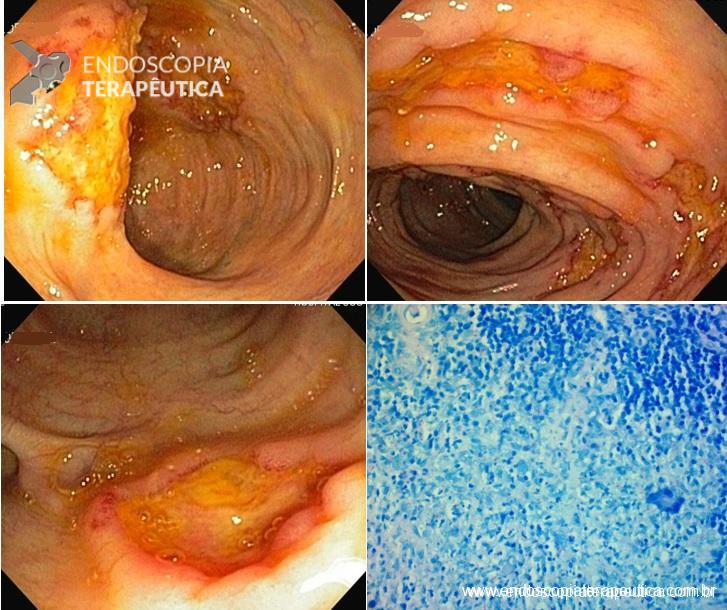
A principal preocupação frente ao achado de psudopólipos é a diferenciação desta com lesões displásicas (antigamente denominadas DALM). Tal diferenciação pode ser realizada com endoscópio de boa qualidade e endoscopista treinado:
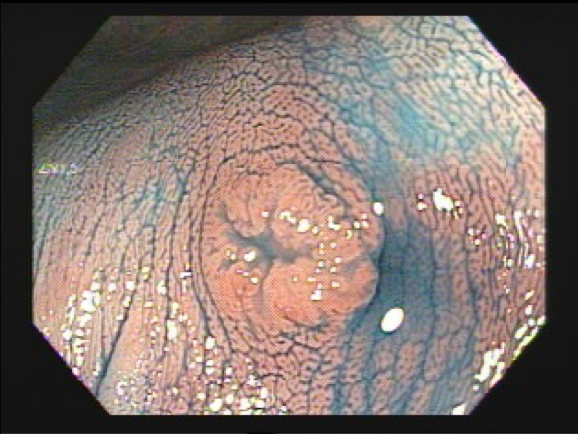
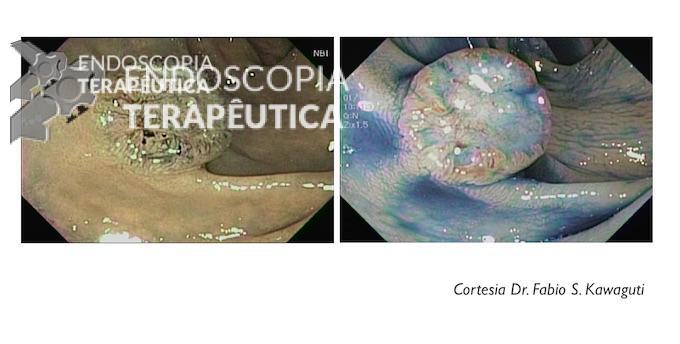
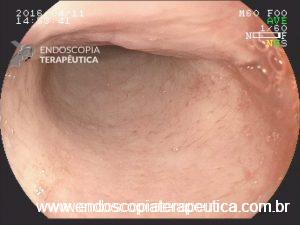
- os psedudopólipos em geral são numerosos, localizados dentro de áreas de colite, superficie lisa e pálida, podendo conter exsudato e bordas definidas;
- as áreas de displasia podem ser múltiplas, mas em geral são únicas, podendo estar dentro ou fora da área de colite, normalmente têm bordas definidas e podem ser sésseis ou pediculadas.
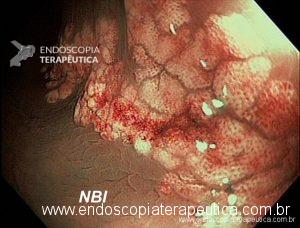
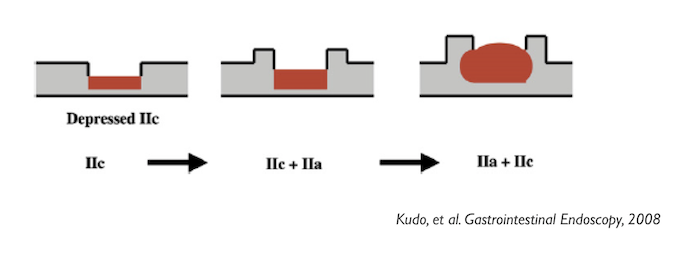
Não é necessária a remoção ou biópsias dos pseudopólipos quando bem caracterizados à endoscopia. A cromoendoscopia pode ajudar, pois os pseudólipos, por serem não neoplásicos, apresentam padrão de criptas Kudo tipo II. Nos casos de dúvida dignóstica, pólipos gigantes, dificuldade de avaliação devido à grande quantidade de pseudopólipos, a remoção está indicada, assim como biópsias das áreas adjacentes.
Bibliografia (textos abertos – free : clique para o texto completo )
Politis DS, Katsanos KH, Tsianos EV, Christodoulou DK. Pseudopolyps in inflammatory bowel diseases: Have we learned enough? World J Gastroenterol. 2017 Mar 7;23(9):1541-1551. doi: 10.3748/wjg.v23.i9.1541