Dica Rápida e Simples que Salva Vidas: Identifique Precocemente o Carcinoma de Células Escamosas (CEC) no Esôfago
Os endoscopistas ocidentais falham em diagnosticar 12% das neoplasias do trado digestivo superior.(1) Isso também te procupa? Saber que falhamos em diagnosticar uma fatia significativa de doenças letais deixa qualquer endoscopista apreensivo. Para o CEC de esôfago, um pequeno ajuste na sistematização de seu exame pode dobrar sua capacidade diagnóstica sem aumentar o tempo de seu exame. Salve vidas lendo o rápido texto abaixo↓↓.
Introdução
O CEC precoce de esôfago se apresenta como lesões sutis da mucosa que são dificilmente percebidas na endoscopia de rotina. A sensibilidade diagnóstica da luz branca é de preocupantes 50%.(2) Isso mesmo, deixamos de identificar metade dos casos de uma doença altamente letal em uma fase facilmente curável.
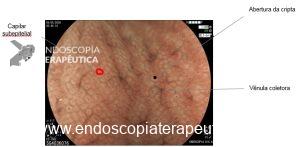
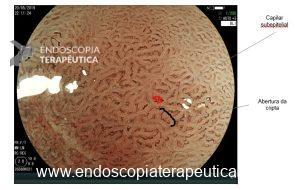
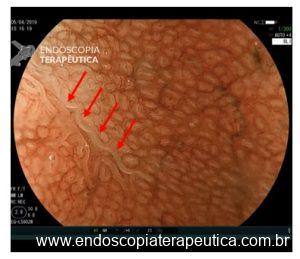
A displasia escamosa e o carcinoma intramucoso possuem alterações mínimas de relevo. O aspecto endoscópico consiste principalmente na deformação progressiva do padrão microvascular da mucosa: os “intra papilar capillary loops” (IPCLs). Usando um endoscópio de alta definição, vemos os IPCLs como pontos vermelhos à luz branca. Em um exame mais detalhado, usando magnificação, podemos ver a alça capilar adjacente à membrana basal. Por ser tão superficial, os IPCLs refletem precocemente as alterações epiteliais e se observados atentamente, permitem um diagnóstico precoce do CEC.(3)
A observação destas alterações é um desafio já que há um contraste pobre entre a mucosa subjacente de coloração rósea e a cor vermelha do IPCL. Como veremos mais adiante, a cromoscopia óptica ou digital apresenta um papel fundamental ao realçar o contraste dos vasos transformando em chamativas alterações discretas.(3)

Rastreio:
No rastreio para CEC, a cromoscopia com lugol sempre foi um método chave nos pacientes de alto risco. Sua sensibilidade chega a 90% permitindo um diagnóstico eficaz. Contudo, o lugol apresenta uma baixa especificidade além de necessitar da disponibilidade de seu antídoto (tiosulfato ou hipossulfito). Outras complicações como hiperssensibilidade ao iodo, laringite, pneumonite e dor retrosternal também estão associadas ao procedimento.(2)

Com o surgimento das tecnologias de cromoscopia integradas aos sistemas de endoscopias, foi possível solucionar vários dos incovenientes do Lugol. Tecnologias patenteadas por seus respectivos fabricantes como o NBI, o BLI e o i-Scan proporcionaram a capacidade de executar a cromoscopia com apenas um toque no aparelho, não havendo qualquer necessidade de acessório. O NBI é a ferramenta com maior nível de evidência e será abordado mais diretamente neste texto.
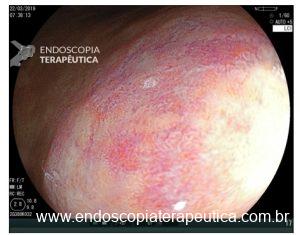
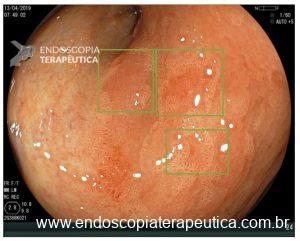
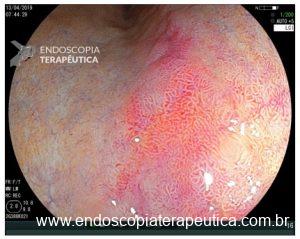
O NBI subtrai alguns espectros da luz branca, deixando a vasculatura mais contrastada. Quando há alterações dos IPCLs uma mancha amarronzada fica bastante evidente ao lado da mucosa normal com tom esverdeado. Mesmo sem magnificação este aspecto endoscópico dobra a sensibilidade diagnóstica do exame.(4)

E agora, a dica !
Com apenas um clique o endoscopista multiplica sua sensibilidade diagnóstica para o CEC de esôfago. Um salto de 50% para 90% de diagnósticos identificados! Sistematize da seguinte forma seu exame: Lavagem e aspiração do esôfago; Introdução do aparelho com luz branca; ao encerrar o procedimento, retire o aparelho com NBI ou similar ligado, inspecionando detalhadamente o esôfago na retirada. Tal é simples e certamente vai te ajudar a salvar vidas!

Referencias
1. Menon S, Trudgill N. How commonly is upper gastrointestinal cancer missed at endoscopy? A meta-analysis. Endosc Int Open. 2014;02(02):E46–50.
2. Morita FHA, Bernardo WM, Ide E, Rocha RSP, Aquino JCM, Minata MK, et al. Narrow band imaging versus lugol chromoendoscopy to diagnose squamous cell carcinoma of the esophagus: A systematic review and meta-analysis. BMC Cancer [Internet]. 2017;17(1):1–14. Available from: http://dx.doi.org/10.1186/s12885-016-3011-9
3. Inoue H, Kaga M, Ikeda H, Sato C, Sato H, Minami H, et al. Magnification endoscopy in esophageal squamous cell carcinoma: A review of the intrapapillary capillary loop classification. Ann Gastroenterol. 2015;28(1):41–8.
4. Ide E, Maluf-Filho F, Chaves DM, Matuguma SE, Sakai P. Narrow-band imaging without magnifcation for detecting early esophageal squamous cell carcinoma. World J Gastroenterol. 2011;17(39):4408–13.
Como citar este artigo
Pontual JP, Dica Rápida e Simples que Salva Vidas: Identifique Precocemente o Carcinoma de Células Escamosas (CEC) no Esôfago, Endoscopia Terapeutica; 2022. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/dica-rapida-e-simples-que-salva-vidas-identifique-precocemente-o-carcinoma-de-celulas-escamosas-cec-no-esofago/