Profilaxia de pancreatite aguda pós-CPRE: quando utilizar prótese pancreática?
A pancreatite aguda pós-CPRE (PEP, do inglês “post-ERCP pancreatitis“) é uma das complicações mais temidas associadas à colangiopancreatografia retrógrada endoscópica (CPRE). Sua incidência varia entre 3,5% e 9,7%, sendo que de 0,3% a 0,8% evoluem com pancreatite aguda grave, associada a disfunção orgânica persistente. Como não há tratamento endoscópico para PEP, é fundamental que os endoscopistas adotem medidas profiláticas eficazes para diminuir o risco, principalmente de casos graves. Em seu guideline de 2023, a American Society for Gastrointestinal Endoscopy (ASGE) destaca três medidas principais para a profilaxia da PEP: uso de anti-inflamatórios não esteroidais (AINEs) via retal, hidratação intravenosa agressiva e a colocação de prótese pancreática (1). Neste artigo, analisaremos o estudo publicado em 2024 na Lancet por Elmunzer et al., que comparou o uso de AINE via retal com e sem a colocação de prótese pancreática em pacientes de alto risco para PEP, intitulado “Indomethacin with or without prophylactic pancreatic stent placement to prevent pancreatitis after ERCP: a randomised non-inferiority trial” (2).
Métodos
Trata-se de ensaio clínico randomizado (ECR) de não-inferioridade conduzido em 20 centros de referência nos Estados Unidos e Canadá entre 2015 e 2023. O estudo avaliou a eficácia da indometacina via retal em comparação com indometacina via retal associada à colocação de prótese pancreática profilática (PPP) em pacientes com alto risco de PEP.
A) Critérios de Inclusão
Os critérios de inclusão foram baseados nos principais fatores de risco para PEP, divididos em critérios maiores e menores.
Critérios Maiores (≥1):
- História pessoal de PEP
- Canulação difícil (≥6 min ou ≥6 tentativas)
- Pré-corte
- Esfincterotomia pancreática
- Dilatação balonada da papila sem esfincterotomia
- Suspeita de disfunção do esfíncter de Oddi
Critérios Menores (≥2):
- Mulher com menos de 50 anos
- Pancreatite aguda recorrente (2 ou mais episódios)
- Injeção de contraste no ducto pancreático principal
Critérios de Exclusão:
- Indicação de ampulectomia
- Indicação de prótese pancreática terapêutica
- Alergia a AINEs
- Pancreatite aguda há menos de 1 semana
- Baixo risco de PEP (ex.: esfincterotomia prévia)
B) Procedimentos
Os pacientes randomizados para o grupo de indometacina isolada (grupo IN) receberam 100 mg de indometacina via retal imediatamente antes do procedimento. No grupo da indometacina mais prótese pancreática (grupo PP) a mesma dose de indometacina foi administrada e o endoscopista tentou ativamente a canulação do ducto pancreático principal (DPP) para a passagem da PPP, sem padronização de tempo ou técnica.
C) Desfechos
- Primário: Incidência de PEP, definida como dor nova ou crescente no abdômen superior e elevação das enzimas >3x até 24h pós-CPRE.
- Secundário: Casos de PEP moderada ou grave.
D) Cálculo Amostral
O cálculo amostral foi realizado com uma margem de não-inferioridade de 5% entre os grupos, considerando uma taxa esperada de PEP de 9,7% e um poder de 85%, resultando em um total de 1950 pacientes.
Resultados
O estudo incluiu 1950 pacientes, com 975 em cada braço e apenas uma perda em cada grupo. O “crossover” no grupo PP – ou seja, pacientes nos quais foi tentado, porém não houve sucesso, na passagem da prótese pancreática – foi de quase 20%, enquanto no grupo IN foi de apenas 1,6% – pacientes que não deveriam ter recebido PPP pelo grupo de randomização, porém o endoscopista optou pela passagem da PPP.
Na análise por intenção de tratamento, foram observados 110 casos (11,3%) de PEP no grupo PP, sendo 58 (6%) PEP moderada ou grave, em comparação com 145 casos (14,9%) no grupo IN, dos quais 78 (8%) foram moderados ou graves. Três óbitos (0,3%) foram reportados, todos no grupo IN. A diferença de risco para PEP entre os grupos foi estatisticamente significativa (3,6% – IC95% 0,6-6,6) a favor do grupo PP (tabela 1).
| Intenção de tratamento | Por protocolo | |||||
| Resultado | Indometacina + PPP (n=975) | Indometacina isolada (n=975) | Diferença de risco (IC 95%) | Indometacina + PPP (n=777) | Indometacina isolada (n=951) | Diferença de risco (IC 95%) |
| Desfecho primário | ||||||
| Pancreatite aguda pós-CPRE | 110 (11,3%) | 145 (14,9%) | 3,6% (0,6 a 6,6) |
90 (11,6%) |
137 (14,4%) | 2,8% (−0,3 a 6,0) |
| Desfechos secundários e de segurança | ||||||
| Pancreatite moderada ou grave pós-CPRE | 58 (6,0%) | 78 (8,0%) | 2,1% (−0,2 a 4,3) |
45 (5,8%) | 74 (7,8%) | 2,0% (−0,4 a 4,4) |
| Pancreatite grave | 14 (1,4%) | 20 (2,1%) | 0,6% (−0,5 a 1,8) |
12 (1,5%) | 19 (2,0%) |
0,5% (−0,8 a 1,7) |
| Óbito relacionado à pancreatite | 0 |
3 (0,3%) | 0,3% (0,0 a 0,7) |
0 |
3 (0,3%) | 0,3% (0,0 a 0,7) |
| Evento adverso grave | 352 (36,1%) | 355 (36,4%) | −0,3% (−4,6 a 4,0) |
282 (36,3%) | 345 (36,3%) | 0,0% (−4,5 a 4,6) |
| Admissão na UTI | 39 (4,0%) | 29 (3,0%) |
−1,0% (−2,9 a 0,9) |
27 (3,5%) |
32 (3,4%) | −0,1% (−2,2 a 2,0) |
Dos 188 pacientes que foi tentada passagem de PPP sem sucesso, 19 (10,1%) tiveram PEP.
Realizando testes estatísticos “post-hoc” – ou seja, após a obtenção e análise dos dados e, portanto, sujeitos a mais vieses – os autores identificaram que o grupo IN foi inferior na profilaxia de PEP e teve um risco 32% maior de PEP do que o grupo PP.
Na análise de subgrupos avaliando múltiplas variáveis, os fatores que mais impactaram a diferença entre os grupos favorecendo o grupo PP foram: técnica do duplo-fio guia, esfincterotomia pancreática e não realização de esfincterotomia biliar (tabela 2).
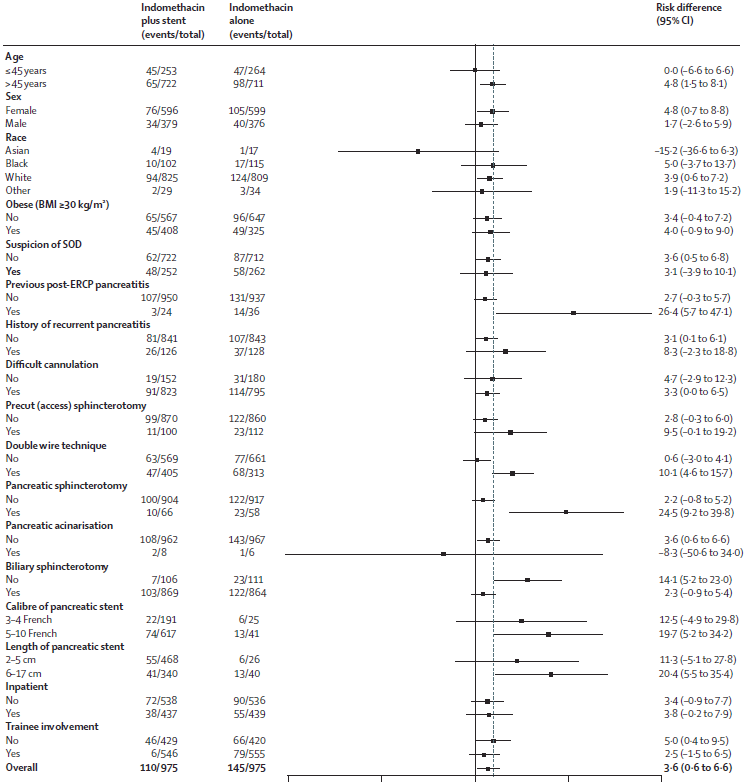
Ainda foi observado que quantos mais fatores de risco o paciente apresentava, maior proteção a PPP ofereceu, partindo de um número necessário para tratar (NNT) de 44 para os pacientes que tinham apenas 1 fator de risco e chegando a um NNT=7 para pacientes com 3 ou mais fatores.
Conclusão do estudo
Os autores concluem que a combinação de indometacina e prótese pancreática foi superior à indometacina isolada na prevenção de PEP em pacientes de alto risco, especialmente em pacientes com múltiplos fatores de risco. Ainda sugerem maior treinamento na passagem de próteses pancreáticas durante a especialização em CPRE, porém alertam para o cuidado em relação à técnica e ao tempo de tentativa, que não foram padronizados no estudo.
Análise Crítica
Embora o estudo seja um ECR robusto, seus resultados e conclusões devem ser interpretadas com cautela. É fundamental considerar que o estudo foi desenhado como um ECR de não-inferioridade, o que pode gerar inconsistências nas inferências de superioridade. Testes estatísticos “post-hoc” são importantes para aproveitar ao máximo os dados do estudo e levantar novas hipóteses, porém não devem ser a base para conclusões.
A concepção das intervenções nos grupos talvez seja a principal causa dos possíveis equívocos observados nos resultados, os quais levaram a conclusões imprecisas. A profilaxia com prótese pancreática é recomendada pelas principais sociedades de endoscopia dos Estados Unidos e da Europa – ASGE e ESGE – para pacientes de alto risco nos quais o DPP foi canulado de forma inadvertida (1,3). Portanto, esses pacientes deveriam ter recebido a PPP, mesmo quando randomizados para o grupo sem PPP (grupo IN) – o que não ocorreu na maioria dos casos.
Embora o estudo não apresente explicitamente o número de pacientes do grupo IN que sofreram canulação inadvertida do DPP, a Tabela 2 revela parte dessa informação: nesse grupo, houve 68 casos com uso da técnica de duplo fio-guia, 23 esfincterotomias pancreáticas e 1 injeção com acinarização pancreática – totalizando, no mínimo, 92 pacientes com indicação formal para PPP. Considerando que apenas 16 pacientes do grupo IN foram submetidos ao “crossover” para o grupo que recebeu a prótese, pelo menos 76 pacientes elegíveis deixaram de receber a PPP – provavelmente um número ainda maior.
Esse viés é reforçado pelo fato de que os subgrupos que mais contribuíram para a diferença entre as abordagens foram justamente aqueles nos quais ocorreu canulação inadvertida do DPP – como os que realizaram técnica do duplo fio-guia e esfincterotomia pancreática (provavelmente associada à técnica de acesso transpancreático).
Uma concepção metodológica mais adequada teria sido randomizar os pacientes entre dois grupos: um com tentativa ativa de canulação do DPP para passagem de PPP e outro sem essa tentativa. Dessa forma, todos os pacientes com canulação inadvertida do DPP receberiam PPP, independentemente do grupo para o qual foram inicialmente alocados.
É importante contextualizar que o estudo foi iniciado em 2015, quando as recomendações sobre o uso da PPP em casos de canulação inadvertida ainda não eram tão enfáticas quanto são atualmente. Assim, a concepção adotada pode ter sido considerada aceitável à época. Entretanto, como foi publicado em 2024, os autores deveriam ter considerado essas limitações, trazendo a conclusão de que na estratégia desenhada não foi demonstrada a não-inferioridade das abordagens, sugerindo estudos para avaliar se vale a pena ou não tentar ativamente cateterizar o DPP para passagem de PPP, ao invés de estimular essa abordagem – que pode ser perigosa e até aumentar o risco de PEP.
Mensagem Final
A pancreatite aguda pós-CPRE é uma complicação crítica que requer cuidados técnicos e medidas profiláticas. As principais estratégias incluem:
- Uso de AINEs via retal antes do procedimento em pacientes sem contraindicação
- Hidratação intravenosa agressiva em pacientes sem contraindicação
- Colocação de prótese pancreática profilática em pacientes de alto risco com canulação inadvertida do DPP
Embora o estudo de Elmunzer et al. sugira a possibilidade de tentativa ativa de canulação do DPP para passagem de PPP em pacientes de alto risco para PEP, essa abordagem deve ser considerada com cautela, dadas suas implicações potencialmente prejudiciais, e não deve ser praticada de rotina. Trabalhos futuros devem estudar adequadamente essa abordagem antes de novas recomendações serem adotadas.
Veja mais sobre o assunto: Estratégias de prevenção de pancreatite pós CPRE: quais as recomendações mais atuais? • Endoscopia Terapeutica.
Referências
- Buxbaum JL, Freeman M, Amateau SK, et al. American Society for Gastrointestinal Endoscopy guideline on post-ERCP pancreatitis prevention strategies: summary and recommendations. Gastrointest Endosc. 2023;97(2):153-162. doi:10.1016/j.gie.2022.10.005
- Elmunzer BJ, Foster LD, Serrano J, et al. Indomethacin with or without prophylactic pancreatic stent placement to prevent pancreatitis after ERCP: a randomised non-inferiority trial. Lancet. 2024;403(10425):450-458. doi:10.1016/S0140-6736(23)02356-5
- Dumonceau JM, Kapral C, Aabakken L, et al. ERCP-related adverse events: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2020;52(2):127-149. doi:10.1055/a-1075-4080
Como citar este artigo
Proença IM. Profilaxia de pancreatite aguda pós-CPRE: quando utilizar prótese pancreática? Endoscopia Terapeutica, 2025 Vol II. Dispnível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/profilaxia-de-pancreatite-aguda-pos-cpre-quando-utilizar-protese-pancreatica/