Lesões Subepiteliais: do Diagnóstico a Abordagem
As lesões subepiteliais são conceitualmente definidas por lesões originadas das camadas muscular da mucosa, submucosa ou muscular própria, as quais podem ocorrer em qualquer órgão do trato gastrointestinal1. O termo lesões submucosas foi antigamente empregado para essas condições, mas não deve ser mais utilizado, pois essa antiga nomenclatura remete a injúrias restritas a camadas abaixo da submucosa2.
O diagnóstico histopatológico definitivo das lesões subepiteliais é de grande importância, pois possibilita a definição do prognóstico, o risco de degeneração neoplásica e definição de conduta entre expectante, vigilância, ressecções endoscópicas ou tratamento cirúrgico. Isso se deve ao fato de existir uma ampla variedade de diagnósticos diferenciais possíveis, cuja evolução, quadro clínico, risco de complicações e taxa de degeneração neoplásica variam consideravelmente.
Epidemiologia
Apesar das lesões subepiteliais poderem ser encontradas em qualquer órgão do trato gastrointestinal, o principal sítio de localização consiste no estômago. Além disso, as exatas taxas de incidência e prevalência dessas condições são desconhecidas devido a carência de estudos epidemiológicos de condições cujo diagnóstico na maioria dos casos é incidental, dificultando o estudo na população geral. Entretanto, alguns dados na literatura já tentaram estimar essa informação, demonstrando uma prevalência de detecção de lesões subepiteliais em 1,9% das endoscopias digestivas altas realizadas na Coreia, sendo que 64,1% foi identificada no estômago.16,19 Outros estudos estimam uma incidência de cerca de 0,36% de lesões subepiteliais diagnosticas por endoscopias digestivas altas de rotina.20-23 Com relação ao prognóstico, a maioria das lesões subepiteliais são benignas ao diagnóstico, sendo estimadas lesões malignas em menos de 15% dos casos.16,18
Quadro Clínico
A grande maioria dos casos apresenta-se assintomático, principalmente lesões inferiores a 2 cm15. Dentre os casos sintomáticos, o quadro clínico é variável conforme localização, etiologia e tamanho das lesões.
Os sintomas mais frequentes são dor abdominal e hemorragia digestiva. Entretanto, podem ocorrer raramente sintomas de suboclusão do trato gastrointestinal, sendo esse quadro mais frequentemente associado a lesões no intestino delgado.
Com relação ao tamanho das lesões, a manifestação de sintomas será variável a depender do órgão acometido. Afinal, lesões menores no esôfago podem se manifestar com disfagia e no reto com alteração de hábito intestinal. A manifestação de sintomas suboclusivos no estômago dependerá da existência de lesões maiores diante do maior volume da câmara gástrica em relação aos demais segmentos do aparelho digestivo.
Apresentações Endoscópicas e Ecoendoscópicas das Lesões Subepiteliais
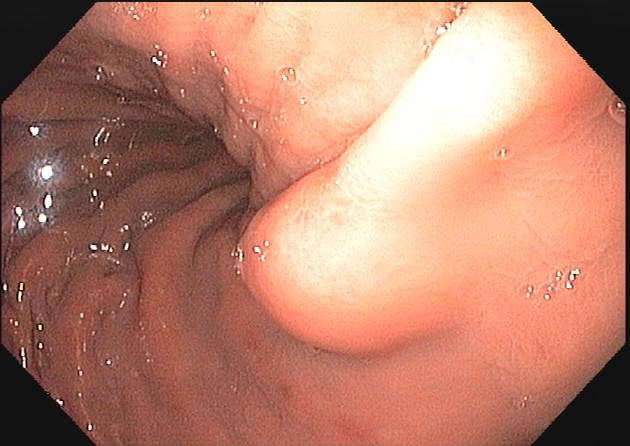
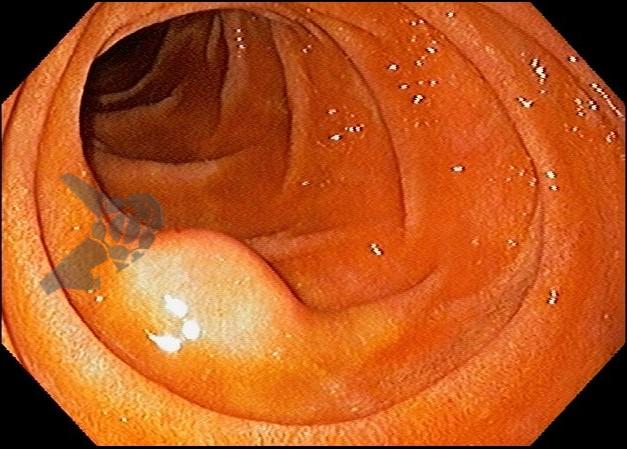
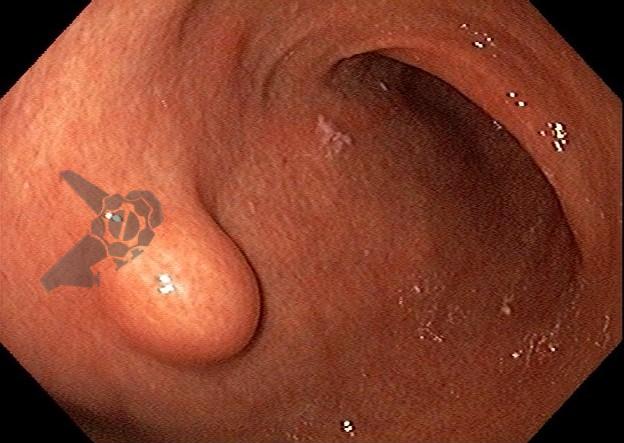
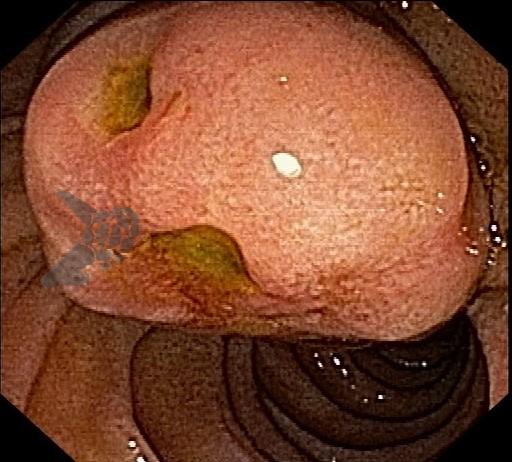
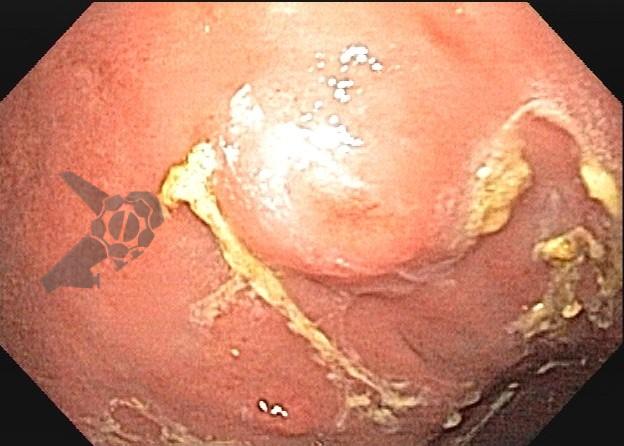
As lesões subepiteliais apresentam-se à visão endoscópica como um abaulamento ou protuberância de mucosa com tamanho variável. Em geral, a mucosa sobreposta a lesão é íntegra, mas dependendo da etiologia, é possível haver enantema, erosão ou ulceração devido efeito de pressão da lesão ou, mais raramente, degeneração maligna. Outros parâmetros endoscópicos podem ser avaliados e podem permitir uma impressão diagnóstica sobre a lesão, como: coloração, superfície, mobilidade e consistência da lesão.
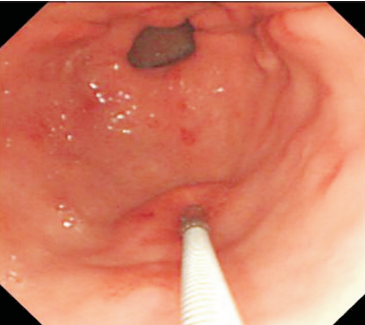
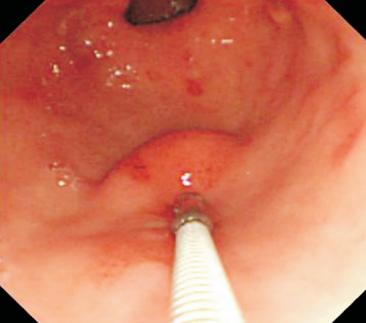
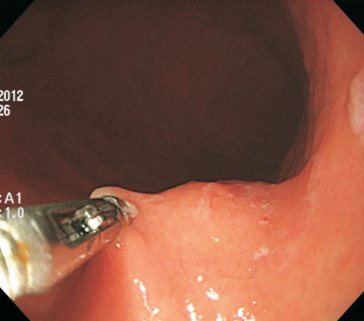
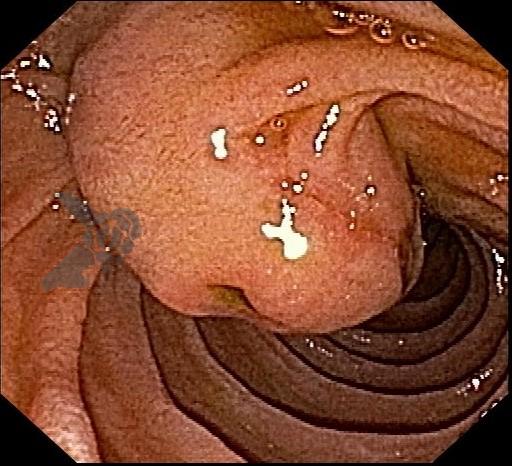
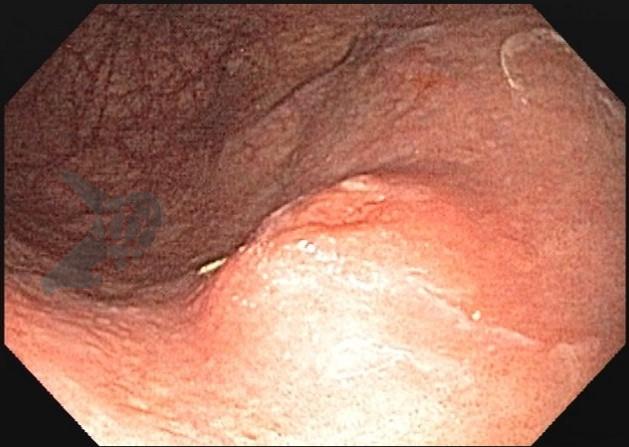
Algumas manobras simples ao exame endoscópico podem garantir também maior segurança para estabelecer uma impressão de diagnóstico etiológico das lesões subepiteliais, podendo em alguns casos definir conduta expectante para essas lesões. As principais manobras consistem: sinal do travesseiro ou almofada (pillow sign), sinal do rolamento (rolling sign) e sinal da tenda (tenting sign) (figuras 1, 2 e 3).
O sinal do travesseiro consiste em manipular a lesão com a pinça de biópsia, empurrando a mesma. Caso a lesão seja compressível ao toque da pinça e haja retorno a morfologia habitual da lesão após a retirada do instrumento, a lesão é sugestiva de lipoma (98% de especificidade e 40% de sensibilidade)4.
O sinal do rolamento quando presente sugere que a lesão se encontra na muscular própria ou abaixo da mesma. É realizado sob auxílio de pinça de biópsia fechada, deslizando a mesma sobre a lesão, permitindo com que a lesão seja facilmente mobilizada.16
O sinal da tenda apresenta a mesma implicância clínica do sinal do rolamento.16 Sob auxílio de pinça de biópsia, realiza-se apreensão superficial da mucosa sobrejacente a lesão, permitindo com que a mucosa e submucosa se destaquem facilmente da lesão.
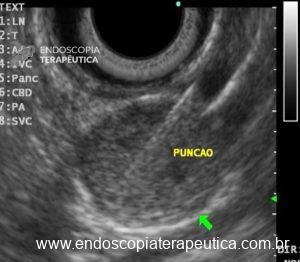
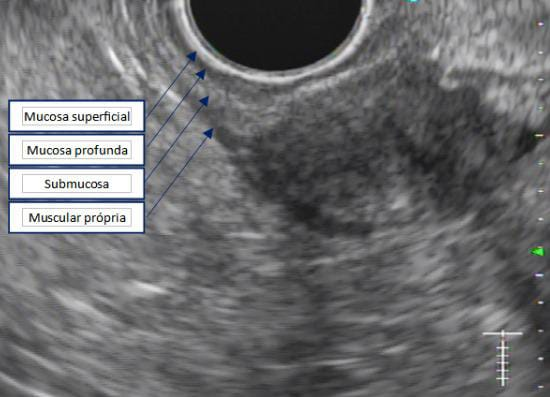
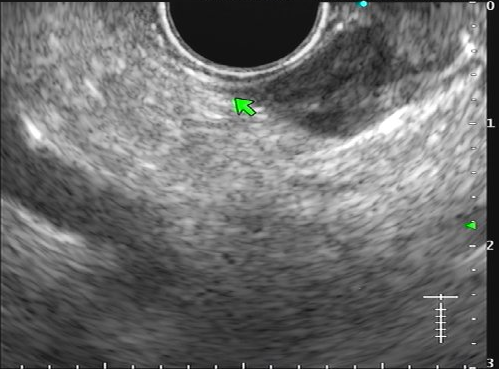
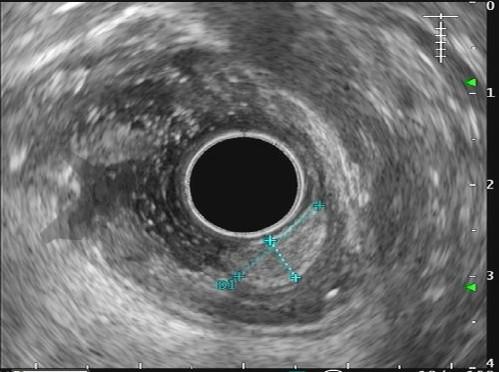
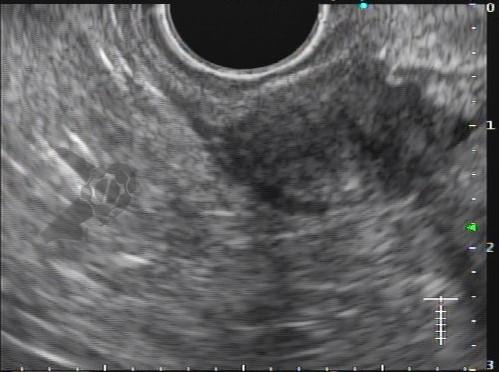
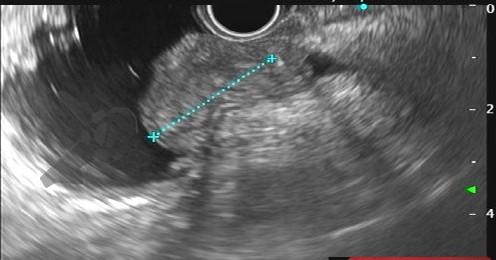
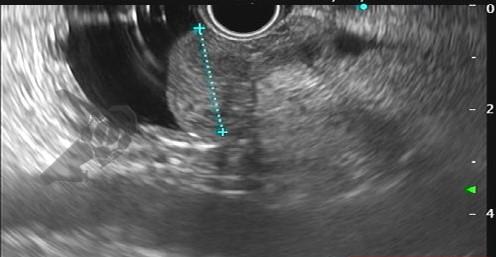
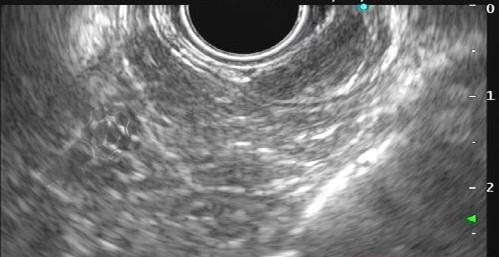
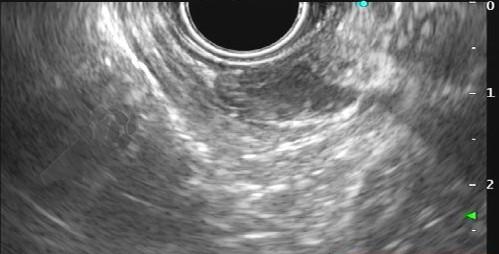
Com relação à ecoendoscopia, o método permite avaliar com muita precisão as camadas e interfaces do trato gastrointestinal, sendo o melhor método de imagem para avaliar e caracterizar as lesões subepiteliais. Com uma frequência de varredura entre 5 a 12 MHz, o ultrassom endoscópico permite distinguir as paredes do TGI em 5 camadas: mucosa superficial (1ª camada ou interface fluído luminal e mucosa), mucosa profunda (2ª camada ou muscular da mucosa), submucosa (3ª camada), muscular própria (4ª camada) e serosa (5ª camada) (figura 4)15,24-26.
A tabela 1 demonstra resumidamente os achados endoscópicos e ecoendoscópicos das principais lesões do trato gastrointestinal. E as imagens de 1 a 14 demonstram exemplos de casos de lesões com suas respectivas imagens endoscópicas e ecoendoscópicas.
| Lesão Subepitelial | Camada de Origem | Sítios Principais | Ecoendoscopia | Endoscopia |
|---|---|---|---|---|
| Cisto de duplicação | 1ª, 2ª, 3ª, 4ª ou extramural | – Esôfago – Mediastino |
– Anecoico – Arredondado ou oval – Sem vascularização |
– Normocorado ou ligeiramente translúcido – Superfície regular – Compressível à manipulação |
| GIST | 4ª (principal) 2ª (infrequente) |
– Estômato (65%) – Delgado (25%) |
– Hipoecoico – Heterogêneo – Com ou sem vascularização |
– Normocorado – Superfície regular, com erosão ou ulceração – Consistência endurecida |
| Leiomioma | 2ª (principal) 4ª (infrequente) |
– Esôfago | – Hipoecoica – Homogênea – Calcificações no interior |
– Normocorada – Superfície regular – Consistência endurecida |
| Linfangioma | 3ª | – Intestino delgado | – Anecoico – Septos internos – Sem vascularização |
– Massa protuberante semelhante a um cisto – Consistência amolecida |
| Linfoma | 2ª, 3ª ou 4ª | – Estômago – Intestino delgado |
– Hipoecoico | – Sem características específicas |
| Lipoma | 3ª | – Cólon | – Hiperecoico – Homogêneo – Ovalado |
– Amarelado – Superfície regular – Consistência amolecida – Sinal do travesseiro positivo |
| Metástase | 1ª, 2ª, 3ª, 4ª | – Qualquer sítio | – Hipoecoica – Heterogênea |
– Sem características específicas |
| Pâncreas ectópico | 2ª, 3ª ou 4ª | – Estômago | – Hipoecoica ou mista – Estruturas ductais no interior |
– Normocorado – Umbilicação central (90%) – Consistência endurecida |
| Pólipo fibroide inflamatório | 2ª ou 3ª | – Estômago | – Hipoecoico – Homogêneo – Margens não definida |
– Pólipo séssil – Superfície regular ou com ulceração |
| Schwannoma, neuroma e neurofibroma | 3ª ou 4ª | – Estômago | – Hipoecoico – Homogênea |
– Normocorado – Superfície regular – Consistência endurecida |
| Tumor de células granulares | 2ª ou 3ª | – Esôfago | – Hipoecoico – Heterogênea |
– Amarelado ou branco-amarelado – Superfície regular – Consistência endurecida |
| Tumor glômico | 4ª ou 3ª (menos frequente) | – Qualquer sítio | – Hipoecoico – Heterogeneo – Calcificações no interior – Com vascularização |
– Normocorada – Superfície regular – Consistência endurecida |
| Tumor neuroendócrino | 2ª ou 3ª | – Estômago – Duodeno – Reto |
– Isoecoico ou ligeiramente hipoecoico – Homogêneo – Ovalado ou redondo |
– Normocorado, amarelado ou avermelhado – Superfície com erosão – Consistência endurecida |
| Varizes | 3ª | – Esôfago | – Anecoica – Serpinginoso – Com vascularização |
– Azulada – Superfície regular – Consistência compressível |
Adaptado de: ESGE1, ASGE27, ACG14, AGA11, Kim GH16
Abordagem Diagnóstica e Aquisição Tecidual
Como mencionado, a identificação de uma lesão subepitelial é na grande maioria das vezes incidental em uma endoscopia digestiva alta. Os achados endoscópicos somados a propedêutica em muitos casos não irão permitir o estabelecimento de uma conduta definitiva sem o diagnóstico histopatológico. Além disso, as biópsias convencionas de mucosa possuem um rendimento histopatológico extremamente baixo no diagnóstico de lesões subepiteliais, afinal as lesões em sua maioria são revestidas por mucosa íntegra. A realização de biópsias sobre biópsias também não apresenta rendimento significativo (55 a 65% para lesões da terceira camada e 40% para lesões da quarta camada)6,7, não sendo um método de abordagem recomendado.
A Sociedade Europeia de Endoscopia Gastrointestinal (ESGE) recomenda aquisição tecidual de lesões subtepiteliais quando: há suspeita de tumor estromal gastrointestinal (GIST), lesões superiores a 20 mm, lesões com estigmas de alto risco ou necessidade de tratamento cirúrgico ou oncológico. Em caso de lesões assintomáticas compatíveis com lipoma, varizes ou pâncreas ectópico, não há indicação de aquisição tecidual.
Os métodos que permitem aquisição tecidual consistem nos seguintes: biópsia assistida por incisão de mucosa (mucosal incision-assisted biopsy, MIAB), punções ecoendoscópicas com agulha FNA (fine needle aspiration, EUS-FNA) ou com agulha FNB (fine needle biopsy, EUS-FNB).
Em lesões superiores a 20 mm, a ESGE recomenda igualmente como primeira escolha MIAB ou EUS-FNB. Entretanto, lesões inferiores a 20 mm, a ESGE recomenda como primeira linha o MIAB, sendo a EUS-FNB segunda escolha (tabela 2). Afinal, nessas lesões, há menor rendimento diagnóstico com punções ecoguiadas diante de maior dificuldade técnica para aquisição de amostras significativas. Para uma discussão mais aprofundada sobre MIAB, confira esse outro artigo: Biópsia Assistida por Incisão da Mucosa: Quando e Como Fazer?. Com relação às agulhas FNA, estudos prospectivos e retrospectivos vêm demonstrando que FNB possui melhor aquisição tecidual em relação a agulhas FNA quando comparadas a calibres (gauges) semelhantes, apresentando perfis de segurança semelhante e com precisão diagnóstica variando entre 75 a 100%.8-11 Portanto, o III Consenso Brasileiro de Ecoendoscopia recomenda o uso de FNB em relação ao uso de FNA para o diagnóstico de lesões subepiteliais maiores de 20 mm, sendo concordante com o guideline da ESGE13.
| Tamanho | Método de Escolha |
|---|---|
| LSE > 20 mm | 1ª escolha: EUS-FNB ou MIAB |
| LSE < 20 mm | 1ª escolha: MIAB 2ª escolha: EUS-FNB |
Vigilância
A vigilância consiste no seguimento das lesões subepiteliais, podendo ser realizado por EDA e/ou ecoendoscopia a depender do tamanho da lesão. A ESGE sugere vigilância em lesões subepiteliais esofágicas e gástrica, desde que sejam assintomática e não tenham diagnóstico histopatológico definitivo. Recomenda-se realização de EDA em 3 a 6 meses como primeiro exame de vigilância, sendo seguida de EDA a cada 2 a 3 anos para lesões inferiores a 10 mm, e EDA a cada 1 a 2 anos para lesões entre 10 a 20 mm. Além disso, como alternativa a vigilância de lesões gástricas inferiores a 20 mm e sem diagnóstico definitivo, a ESGE sugere ressecção endoscópica para esses casos.
Em caso de lesões superiores a 20 mm, assintomática e que não tenham sido ressecadas, a ESGE recomenda vigilância com EDA e ecoendoscopia necessariamente, sendo o primeiro controle em 6 meses, sendo seguido de intervalos de 6 a 12 meses.
Além disso, nas seguintes situações, opta-se por conduta expectante, não sendo recomendado vigilância pela ESGE, desde que o paciente seja assintomático e o diagnóstico histopatológico seja definitivo: leiomiomas, lipomas, pâncreas ectópico, tumores de células granulares, schawannomas e tumores glômicos.
Veja Figuras sobre achados endoscópicos e suas correlações ecoendoscópicas a seguir:
Referências
- Deprez PH, Moons LMG, OʼToole D, Gincul R, Seicean A, Pimentel-Nunes P, Fernández-Esparrach G, Polkowski M, Vieth M, Borbath I, Moreels TG, Nieveen van Dijkum E, Blay JY, van Hooft JE.
Endoscopic management of subepithelial lesions including neuroendocrine neoplasms: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2022 Apr;54(4):412-429. doi: 10.1055/a-1751-5742. Epub 2022 Feb 18. PMID: 35180797. - Pal S, Hodgar D. Gastrointestinal Subepithelial Lesions: A Review. J Digest Endosc 2023;14:99–105.
- Papanikolaou IS, Triantafyllou K, Kourikou A, Rösch T. Endoscopic ultrasonography for gastric submucosal lesions. World J Gastrointest Endosc 2011;3(05):86–94
- Hwang JH, Saunders MD, Rulyak SJ, Shaw S, Nietsch H, Kimmey MB. A prospective study comparing endoscopy and EUS in the evaluation of GI subepithelial masses. Gastrointest Endosc 2005; 62(02):202–208
- Yokohata N, Tamegai Y, Tokuhara M, et al. 3 case of gastric SMT (submucal tumor) which was diagnoced before operation: open biopsy with ESD (endoscopic submucal dissection) for interstind SMT. Prog Dig Endosc 2007;70:82–83.
- Ji JS, Lee BI, Choi KY, et al. Diagnostic yield of tissue sampling using a bite-on-bite technique for incidental subepithelial lesions. Korean J Intern Med (Korean Assoc Intern Med) 2009;24(02): 101–105
- Buscaglia JM, Nagula S, Jayaraman V, et al. Diagnostic yield and safety of jumbo biopsy forceps in patients with subepithelial lesions of the upper and lower GI tract. Gastrointest Endosc 2012; 75(06):1147–1152
- El Chafic AH, et al. Comparison of FNA and fine-needle biopsy for EUS-guided sampling of suspected GI stromal tumors. Gastrointest Endosc 2017;86:510–515.
- Kim GH, et al. Comparison of 22-gauge aspiration needle with 22-gauge biopsy needle in endoscopic ultrasonography-guided subepithelial tumor sampling. Scand J Gastroenterol 2014; 49:347–354.
- de Moura DTH, et al. EUS-guided fine-needle biopsy sampling versus FNA in the diagnosis of subepithelial lesions: a large multicenter study. Gastrointest Endosc 2020;92:108–119.e3.
- Sharzehi K, Sethi A, Savides T. AGA Clinical Practice Update on Management of Subepithelial Lesions Encountered During Routine Endoscopy: Expert Review. Clin Gastroenterol Hepatol. 2022 Nov;20(11):2435-2443.e4. doi: 10.1016/j.cgh.2022.05.054. Epub 2022 Jul 13. PMID: 35842117.
- Wani S, Muthusamy VR, Komanduri S. EUS-guided tissue acquisition: an evidence-based approach (with videos). Gastrointest Endosc 2014;80:939–959.e7.
- Pessoa RRP, Bestetti AM, Oliveira VL, Araujo WC, Guaraldi S, Rodrigues Silva RR, Oliveira FAA, Ribeiro MSI, Carneiro FOAA, D’Assunção MA, Medrado BFOA, Retes FA, Paulo GA, Schneider NC, Rossini LGB, Vallinoto L, Ardengh JC, Coelho Neto DE, Ide E, Silva MCB, Franco MC, Matuguma SE, Moura DTH, Arantes VN, Nahoum R, Brunaldi VO, Santos MELD, Chaves DM, Micelli-Neto O, Salomao BC, Maluf-Filho F, Luz GO. III BRAZILIAN CONSENSUS STATEMENT ON ENDOSCOPIC ULTRASOUND. Arq Gastroenterol. 2024 Oct 21;61:e24062. doi: 10.1590/S0004-2803.24612024-062. PMID: 39442127.
- Jacobson BC, Bhatt A, Greer KB, Lee LS, Park WG, Sauer BG, Shami VM. ACG Clinical Guideline: Diagnosis and Management of Gastrointestinal Subepithelial Lesions. Am J Gastroenterol. 2023 Jan 1;118(1):46-58. doi: 10.14309/ajg.0000000000002100. Epub 2022 Sep 6. PMID: 36602835.
- Landazábal B G. Lesões subepiteliais. In: Artifon ELA, Castaño R, eds. Endoscopia Digestiva Oncológica Diagnóstica-Terapêutica. 1ª ed. Rio de Janeiro: Revinter; 2015. p. 123-131.
- Kim GH. Systematic Endoscopic Approach for Diagnosing Gastric Subepithelial Tumors.
Gut Liver. 2022 Jan 15;16(1):19-27. doi: 10.5009/gnl20296. PMID: 33707348; PMCID: PMC8761929. - Miyajima NT, Toyonaga T. Dissecção Submucosa Endoscópica. In: Ferrari A, Maruta L, Averbach M, eds. Endoscopia Digestiva Terapêutica. Rio de Janeiro: Revinter; 2012. p. 115-134.
- Polkowski M. Endoscopic ultrasound and endoscopic ultrasound-guided fine-needle biopsy for the diagnosis of malignant submucosal tumors. Endoscopy 2005;37:635-645.
- Choe Y, Cho YK, Kim GH, et al. The prevalence, natural course, and clinical practice of upper gastrointestinal subepithelial tumors in Korea. Gastrointest Endosc 2020;91(6 Suppl):AB321.
- Hedenbro JL, Ekelund M, Wetterberg P. Endoscopic diagnosis of submucosal gastric lesions. The results after routine endoscopy. Surg Endosc 1991; 5: 20-23
- Polkowski M. Endoscopic ultrasound and endoscopic ultrasound-guided fine-needle biopsy for the diagnosis of malignant submucosal tumors. Endoscopy 2005; 37: 635-645
- Rösch T, Lorenz R, Dancygier H, von Wickert A, Classen M. Endosonographic diagnosis of submucosal upper gastrointestinal tract tumors. Scand J Gastroenterol 1992; 27: 1-8
- Papanikolaou IS, Triantafyllou K, Kourikou A, Rösch T. Endoscopic ultrasonography for gastric submucosal lesions. World J Gastrointest Endosc 2011;3(05):86–94
- Humphris JL, Jones DB. Subepithelial mass lesions in the upper gastrointestinal tract. J Gastroenterol Hepatol 2008;23:556-66.
- Hwang JH, Rulyak SD, Kimmey MB. American Gastroenterological Association Institute technical review on the management of gastric subepithelial masses. Gastroenterology 2006;130:2217-28.
- Forero EA, Maluf-Filho F. Ultrasonido endoscópico en lesiones subepiteliales gastrointestinales. In: Forero EA, Maluf-Filho F. (Eds.). Tratado de ultrasonido endoscópico. São Paulo: Atheneu 2008. р. 87-110.
- Standards of Practice Committee; Faulx AL, Kothari S, Acosta RD, Agrawal D, Bruining DH, Chandrasekhara V, Eloubeidi MA, Fanelli RD, Gurudu SR, Khashab MA, Lightdale JR, Muthusamy VR, Shaukat A, Qumseya BJ, Wang A, Wani SB, Yang J, DeWitt JM. The role of endoscopy in subepithelial lesions of the GI tract.
Gastrointest Endosc. 2017 Jun;85(6):1117-1132. doi: 10.1016/j.gie.2017.02.022. Epub 2017 Apr 3. PMID: 28385194.
Como citar este artigo
Balbinot RS, Martins B. Lesões Subepiteliais: do Diagnóstico a Abordagem Endoscopia Terapeutica 2025 Vol II. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/lesoes-subepiteliais-do-diagnostico-a-abordagem/